Автоматический посев и идентификация микроорганизмов с помощью времяпролетной масс спектрометрии
Обновлено: 05.10.2024
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Использование метода времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (Maldi-ToF MS) для индикации и идентификации возбудителей I-II групп патогенности
1. РАЗРАБОТАНЫ Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.В.Демина, Н.В.Шеенков); ФКУЗ "Российский научно-исследовательский противочумный институт "Микроб" (В.Е.Куклев, Н.А.Осина, А.В.Осин, И.Н.Шарова, С.А.Портенко, А.Н.Спицын, Д.В.Уткин, Н.С.Червякова, А.С.Абдрашитова, С.А.Щербакова); ФКУЗ "Ростовский-на-Дону научно-исследовательский противочумный институт" (С.В.Титова, О.С.Чемисова, B.В.Агафонова, С.О.Чайка, И.А.Чайка, О.А.Рыковская, И.А.Молдаван, Н.В.Павлович, М.В.Цимбалистова); ФКУЗ "Иркутский научно-исследовательский противочумный институт Сибири и Дальнего Востока" (С.В.Балахонов, М.В.Чеснокова, М.В.Афанасьев, Л.В.Миронова, C.А.Татарников, Е.Г.Токмакова, Г.В.Вдовиченко, А.С.Остяк, М.Б.Ярыгина, Е.А.Басов); ФБУН "Государственный научный центр прикладной микробиологии и биотехнологии" (И.А.Дятлов, Е.А.Тюрин, Л.В.Чекан, К.В.Детушев, А.Е.Хомяков); ФКУЗ "Волгоградский научно-исследовательский противочумный институт" (В.А.Антонов, Г.А.Ткаченко, С.С.Савченко, В.В.Алексеева, О.В.Зинченко, И.М.Шпак, М.А.Гришина, Н.В.Вьючнова, О.С.Ульянова, Д.В.Викторов).
2. УТВЕРЖДЕНЫ руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю.Поповой 24 апреля 2014 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
Настоящие методические рекомендации предназначены для специалистов лабораторий, осуществляющих диагностические, мониторинговые и научные исследования с возбудителями опасных инфекционных болезней.
Методические рекомендации по использованию метода масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией для идентификации возбудителей чумы, холеры и туляремии включают описание применения масс-спектрометрии для видовой идентификации микроорганизмов - возбудителей опасных инфекционных заболеваний. Описание охватывает такие разделы, как культивирование исследуемых штаммов, получение из них белковых препаратов, снятие спектров, дополнение базы данных референсных спектров, проведение идентификации с использованием расширенной базы данных, интерпретацию полученных результатов, приводится список используемых реактивов и расходных материалов.
2. Общие положения
Масс-спектрометрический анализ (МС-анализ) является аналитической процедурой, физическим методом исследования, в процессе которого осуществляется измерение отношения массы заряженных частиц материи (ионов) к их заряду. Полученный результат - спектральный сигнал - представляет собой рассортировку заряженных частиц по значению отношения молекулярной массы иона к его заряду.
Первоначально, с момента разработки, МС-анализ применялся в основном в аналитической и биологической химии и физике для изучения химического и изотопного состава веществ, в том числе и многокомпонентных, сложных биополимеров, их структуры и химических модификаций.
Для исследования применяется прибор - масс-спектрометр. Несмотря на большое количество различных моделей инструментов для МС-анализа любой прибор включает три компонента: источник ионов (ионизатор), систему разделения ионов и систему детекции ионов. Ионизатор переводит исследуемый образец в ионизированную форму. Существует большое количество систем ионизации, ее выбор зависит от типа исследуемых молекул, агрегатного состояния образца (твердого, жидкого, газообразного). Далее ионизированные компоненты образца оказываются в системе разделения ионов, которая, используя различные физические механизмы, ранжирует их по значению отношения массы иона к заряду. Детектор регистрирует образовавшиеся и рассортированные ионы, позволяя генерировать визуальный спектр, на котором в виде пиков различной интенсивности представлены отношения массы иона к заряду всех ионизированных компонентов исследуемого образца.
Последнее десятилетие ознаменовалось активным внедрением одного из видов МС-анализа, метода матрично-активированной лазерной десорбции/ионизации (англ. Matrix Assisted Laser Desorption/Ionization, MALDI) с времяпролетным разделением (англ. Time of Flight, ToF) ионов (MALDI-ToF-MS), в клиническую микробиологию для идентификации микроорганизмов. MALDI - метод мягкой ионизации, позволяющий ионизировать биологические макромолекулы (пептиды, белки, ДНК, олигонуклеотиды, липополисахариды и сахара) в присутствии особого вещества, "матрицы", под воздействием лазера. Полученные ионы, преимущественно однозарядные, ранжируются во времяпролетной системе разделения за счет разной скорости перемещения, обратно пропорциональной массе иона. Зная длину пути перемещения иона от ионизатора до детектора, а также время этого перемещения, можно вычислить скорость движения иона и на основании ее значения рассчитать массу частицы.
Использование в качестве исследуемого образца чистой культуры микроорганизма или его экстрактов позволяет получить спектр, характеризующий качественный молекулярный состав исследуемого объекта. Получаемый спектральный паттерн является уникальной видо-, а в некоторых случаях и штаммоспецифичной характеристикой, позволяющей однозначно идентифицировать микроорганизм до вида, а в некоторых случаях осуществить и внутривидовую дифференциацию или определить дополнительные свойства микроорганизма, в том числе и клинически значимые.
Собранные в процессе анализа спектры исследуемых микроорганизмов могут сравниваться с референсными спектрами, присутствующими в базе данных, поставляемых производителями вместе с оборудованием для MALDI-ToF MS. При определенном проценте совпадений выводится результат о таксономической принадлежности исследуемого объекта.
3. Требования к организации работ
Работу в микробиологической лаборатории с пробами материалов, содержащих возбудителей опасных инфекционных болезней бактериальной природы, на MALDI-ToF масс-спектрометре выполняют в соответствии с действующими нормативными и методическими документами.
Пробы, содержащие или подозрительные на содержание возбудителей опасных инфекционных болезней, подготавливают и обеззараживают в "заразной" зоне в боксах биологической безопасности II класса. Работу с подготовленными пробами осуществляют после их выноса из микробиологического бокса или из "заразной" зоны, в зависимости от того где установлен MALDI-ToF масс-спектрометр. Средства индивидуальной защиты и тип дезинфицирующего раствора определяются конкретным видом возбудителя, с которым проводятся работы, в соответствии с действующими нормативными и методическими документами.
Каждое структурное подразделение (лаборатория), проводящее работы по индикации возбудителей опасных инфекционных болезней на MALDI-ToF масс-спектрометре, должно иметь санитарно-эпидемиологическое заключение о соответствии санитарно-эпидемиологическим правилам и нормативам при проведении работ с возбудителями опасных инфекционных болезней.
Исследования методом MALDI-ToF масс-спектрометрии проводят в организациях, имеющих лицензию на деятельность, связанную с возбудителями инфекционных болезней, в лабораториях, имеющих санитарно-эпидемиологическое заключение о возможности проведения данных работ, выданных в установленном порядке.
4. Культивирование микроорганизмов
Стандартная среда культивирования бактерий для MALDI-ToF MS анализа - кровяной агар (прилож.1), содержащий 5% овечьей крови.
Допускается исследование культур, полученных на других питательных средах, а также с различных фаз роста или выращенных при разных температурах. Следует помнить, что наилучшие результаты получаются при использовании условий (среда, фаза роста, температура), идентичных тем, что были использованы для культивирования образцов, использованных для создания референсных единиц базы данных.
Для масс-спектрометрического анализа необходимо использовать только чистые культуры или изолированные колонии микроорганизмов, выращенных с соблюдением условий, специфических для каждого патогена. В случае работы с медленнорастущими микроорганизмами допускается использование культур, выращиваемых более суток. Если в исследуемом образце содержатся микроорганизмы более чем одного вида, то идентификация пройдет некорректно.
Все манипуляции с живыми ПБА I-II групп проводятся в боксах биологической безопасности II В класса, с ПБА III-IV групп - в боксах биологической безопасности II А класса.
При выполнении работ необходимо руководствоваться действующими нормативными правовыми и методическими документами, регламентирующими требования биологической безопасности при проведении работ с возбудителями инфекционных заболеваний, а также иными документами и внутренними инструкциями, разработанными и согласованными с органом по контролю соблюдения требований биологической безопасности учреждения, утвержденными руководителем, регламентирующими работу с возбудителями I-IV группы патогенности.
4.1. Культивирование возбудителя чумы
Для исследования используют чистые культуры суточного роста. Исследуемые штаммы Y. pestis выращивают на питательном агаре для культивирования микроорганизмов общего назначения, рН 7,2 (прилож.1) в течение 24 ч при температуре 28°С. Полученные суточные культуры используют для приготовления образцов для масс-спектрометрии. Культуры возбудителя чумы подвергают предварительной экстракции белка перед нанесением на чип (мишень).
4.2. Культивирование возбудителя холеры
4.3. Культивирование возбудителя туляремии
Культивирование проводят на чашках с FT-агаром (прилож.1) в течение 72 ч при температуре 37°С. Культуры возбудителя для масс-спектрометрического исследования подвергают предварительной экстракции белка перед нанесением на чип (мишень).
4.4. Культивирование возбудителя сибирской язвы
Культивирование проводят на чашках с агаром Хоттингера (рН 7,2) в течение 24 ч при температуре 37°С (прилож.1). Культуры возбудителя для масс-спектрометрического исследования подвергают предварительной экстракции белка перед нанесением на чип (мишень).
5. Подготовка проб для масс-спектрометрии
5.1. Экстракция белков с использованием муравьиной кислоты
Данный метод применяют для возбудителей I-II групп патогенности (за исключением спорообразующих микроорганизмов, дрожжей, грибов) - возбудителей чумы, туляремии и холеры, агглютинирующих с одной из указанных серогруппоспецифических сывороток.
1. Готовят и маркируют необходимое число микропробирок, соответствующее числу исследуемых штаммов.
2. В каждую пробирку вносят 300 мкл деионизованной воды.
3. Микробиологической петлей диаметром 1 мм в пробирку вносят одну изолированную колонию возбудителя и плавными движениями суспендируют.
4. К суспензии добавляют 900 мкл 96%-го этилового спирта.
5. Полученную смесь тщательно перемешивают на микроцентрифуге-вортексе.
6. После перемешивания пробирки помещают в центрифугу (необходимо сохранять ориентацию пробирок после помещения их в ротор) и центрифугируют в течение 2 мин при 13 тыс. об./мин.
7. Полученный супернатант аккуратно, не задевая осадка, отбирают одноразовым наконечником и сливают в емкость с дезинфицирующим раствором.
8. Этапы 6 и 7 повторяют для удаления остатков раствора этанола.
9. К осадку добавляют 25 мкл 70%-го водного раствора муравьиной кислоты, полученную смесь тщательно перемешивают пипетированием или на микроцентрифуге-вортексе (объем муравьиной кислоты зависит от первоначального количества культуры, взятой в исследование, и может варьировать от 1 до 80 мкл).
10. К суспензии добавляют равный объем ацетонитрила и смесь повторно тщательно перемешивают.
11. После перемешивания пробирки помещают в центрифугу (необходимо сохранять ориентацию пробирок, после помещения их в ротор) и центрифугируют в течение 2 мин при 13 тыс. об./мин.
12. В лунку MSP-чипа вносят 1 мкл полученного супернатанта. Для каждой исследуемой единицы (колония, штамм) используют 5 лунок для получения достоверного результата.
13. Сразу после высыхания нанесенной на чип капли супернатанта сверху наносят 1 мкл матрицы (прилож.3, 5).
14. В лунку Н12 MSP-чипа вносят 1 мкл калибровочного стандарта для масс-спектрометрии, на который также после высыхания наносят 1 мкл матрицы. Необходимо дождаться высыхания раствора матрицы, после чего можно приступать к масс-спектрометрическим исследованиям.
15. После проведения мероприятий по заключительной дезинфекции рабочей зоны бокса 70%-м спиртом чип с нанесенными на него образцами может быть перенесен в "чистую" зону для дальнейшего анализа.
аспират мягких тканей, глубокие раны или абсцессы, мазок из влагалища, мазок из уретры, мазок из цервикального канала, мазок раневой поверхности, мазок с шейки матки, неглубокие поверхностные раны (гнойные, ожоги), экссудат подкожной и мягких тканей, язвы, узелки (узелковые утолщения), эякулят
Описание
Посев отделяемого (в т.ч. анаэробы) на микрофлору с определением чувствительности к основному спектру антибиотиков и антимикотиков — бактериологическое исследование, с помощью которого определяется количественный и качественный состав микрофлоры и её чувствительность к противомикробным и противогрибковым препаратам.
Суть метода заключается в посеве исследуемого материала на питательные среды, и с целью выявления и идентификации чистой культуры возбудителя. Культивирование происходит в кислородных и бескислородных условиях.
Микрофлора — совокупность микроорганизмов, обитающих на определённых участках среды. В организме человека существует постоянная и транзиторная микрофлора. Транзиторная микрофлора не может существовать в организме длительно. Постоянная микрофлора состоит из микроорганизмов, которые постоянно находятся в нём и она подразделяется на облигатную и факультативную микрофлору. Облигатная флора представлена лактобактериями, бифидобактериями, пептострептококками и кишечными бактериями, её количественный состав преобладает над факультативной. Факультативная флора это стафилококки, стрептококки, клебсиеллы, клостридии, некоторые грибы. В организме человека микроорганизмы нормальной микрофлоры заключены в полисахаридную биологическую плёнку, устойчивую к различным воздействиям.
- фактор неспецифической резистентности;
- защитная функция по отношению к патогенной и гнилостной микрофлоре;
- участие в водно-солевом обмене;
- участие в рециркуляции стероидных гормонов, желчных солей;
- участие в формировании и поддержании иммунитета;
- хранилище и источник хромосомных и плазмидных генов, в частности генов лекарственной устойчивости к антибиотикам.
Микрофлора мочеполового тракта
Слизистая оболочка передней уретры в норме может содержать стафилококки, непатогенные нейсерии, коринеморфные бактерии и др.
Нормальная микрофлора влагалища включает лактобактерии, бифидобактерии, бактероиды, пропионибактерии, порфиромонады, превотеллы, пептострептококки, коринеформные бактерии др., в ней преобладают анаэробы. В норме соотношение анаэробы/аэробы равно 10/1. В репродуктивный период жизни преобладают грамположительные бактерии, в период менопаузы — грамотрицательные. Примерно у 5–60% здоровых женщин выявляются Gardenerella vaginalis, у 15–30% — Mycoplasma hominis, у 5% — бактерии рода Mobilunculus.
Качественный и количественный состав микрофлоры зависит от фазы менструального цикла, беременности и др. Эстрогены способствуют накоплению гликогена, который расщепляется лактобактериями с образованием молочной кислоты. В результате pH составляет 4–4,6. Подкисленный вагинальный секрет, наличие перекиси водорода и наличие бактериоцинов, подавляют рост посторонней микрофлоры.
Цервикальный канал, полость матки, почки, мочеточник, мочевой пузырь в норме стерильны.
Микрофлора кожи
На коже и в протоках сальных и потовых желёз, волосяных мешочках, анаэробов в 2–10 раз больше чем аэробов. Кожу колонизируют грамположительные бактерии, дрожжеподобные грибы рода Malassezia, реже встречается транзиторная флора Staphylococcus aureus, Streptococcus pyogenes. При ослаблении организма на коже возрастает количество грамотрицательных бактерий.
Инфекционные заболевания
Инфекционные заболевания вызывают патогенные и условно-патогенные микроорганизмы. К условно-патогенным относят представителей нормальной микрофлоры человека, так как эволюционно они сохрани способность к паразитическому образу жизни. В отличие от патогенных микроорганизмов, они проявляют свои свойства при условии снижения сопротивляемости организма.
Бактериологический посев, в т.ч анаэробов, позволяет выделить: бактероиды, вейлонеллы, эубактерии, пептострептококки, актиномицеты, фузобактерии, клостридии, превотеллы, гемеллы, бифидобактерии, порфиромонас, пропионобактерии.
Определение чувствительности к антибиотикам проводится при выявлении роста 10 2 и более КОЕ/мл.
Определение дрожжеподобных грибов рода Candida и постановка чувствительности к антимикотическим средствам входит в данный анализ. Спектр антибиотиков и антимикотиков подбираются в зависимости от локализации воспалительного процесса.
Показания
Выявление возбудителей инфекции при газовой гангрене, абсцессов различных локализаций, инфицировании кишечника, язв, раневых поверхностей, воспалительных заболеваниях подкожно-жировой клетчатки, холециститах (при подозрении на инфицирование клостридиями). Контроль проведенного лечения.
Подготовка
Исследование проводят до начала приёма противомикробных препаратов и иммуномодуляторов, а также спустя 14–21 день после окончания их приёма.
- сдача мазка не допускается в дни менструации. За трое суток до взятия необходимо отказаться от применения вагинальных свечей, тампонов, спермицидов, за сутки исключить половые контакты. Нельзя спринцеваться накануне проведения обследования. После УЗИ-исследования с применением вагинального датчика, кольпоскопии, биопсии должно пройти не менее 48 часов.
- за 1–2 суток до взятия мазка, необходимо исключить половые контакты. Нельзя мочиться в течение 1,5–2 часов до процедуры.
На бланке результата указывается наличие или отсутствие роста; степень бактериурии, выраженная в КОЕ/мл, наименование возбудителя; степень бактериурии, выраженная в КОЕ/мл; чувствительность к антимикробным препаратам.
В норме — рост микробной флоры отсутствует. При выделении ассоциации бактерий 10 5 КОЕ/мл и более — является критическим. Повышение уровня говорит с большей вероятностью о развитии гнойной инфекции или генерализации процесса. При обсемененности менее 10 5 КОЕ/мл, раны заживают без явлений нагноения.
Подготовка
Моча:
- Используется средняя порция утренней мочи.
- Перед сбором мочи проводится тщательный туалет наружных половых органов без использования антибактериального мыла и антисептиков.
- Исследование проводится до начала антибактериальной терапии.
- Контроль излеченности - не ранее чем через 2 недели после окончания лечения.
Уретра:
- Накануне исследования не применять местные лекарственные препараты и процедуры, исключить половой акт.
- При взятии соскоба из уретры не мочиться в течение 1,5-2 часов до процедуры.
- Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.

Основа метода MALDI-TOF берет свое начало из аналитической химии, а впервые этот метод был предложен Хилленкампом и Карасом в 1988 году для анализа белков (5). Масс-спектрометрия представляет собой метод химического анализа, который используют для измерения массы неизвестных молекул путем ионизации, разделения и обнаружения ионов в соответствии с их отношением массы к заряду (разделяя их на положительные и отрицательные ионы). А данные регистрируют в виде масс-спектров.
В этой статье рассматривается технология MALDI-TOF, а также описываются преимущества и недостатки системы.
Методы идентификации микроорганизмов
Цель идентификации микроорганизмов состоит в том, чтобы дифференцировать одного микробного изолята от другого, а затем определить семейство и вид этого изолят (что является наилучшим результатом, которого можно достичь на уровне фенотипической идентификации) или даже конкретный штамм (посредством генотипической идентификации).
Во многих лабораториях в основном распространены фенотипические методы благодаря их относительно низкой стоимости. Однако следует признать, что проявление фенотипических признаков микроорганизма, таких как размер и форма клетки, споруляция, клеточный состав, антигенность, биохимическая активность, чувствительность к антимикробным средствам и так далее, часто зависит от используемых питательных сред и условий культивирования. Фенотипические реакции обычно включают реакции на различные химические вещества или различные биохимические маркеры. Они основываются на более субъективных определениях. Использование биохимических реакций и способов ассимиляции углерода имеет некоторые недостатки в плане достижения стабильной (повторяемой и воспроизводимой) идентификации. Поэтому с целью улучшения классических методов биохимической идентификации в последние годы были сделаны и усовершенствованы некоторые новые разработки. В совокупности эти методы рассматривают как современные методы биохимической идентификации (7).
MALDI-TOF
Как единая система, этот метод позволяет анализировать биомолекулы (такие как ДНК, белки, пептиды и сахара) и крупные органические молекулы (такие как полимеры, дендримеры и другие макромолекулы). Эти молекулы, как правило, хрупкие и фрагментируются при ионизации более традиционными методами ионизации. После ионизации, вызванной лазерным лучом, система выполняет сканирование на наличие микробных белков, которые в основном попадают в диапазон от 4000 до 20000 Дальтон (от 60 до 70 % от сухой массы клетки бактерии) (11). Оптимальная воспроизводимость в идентификации микроорганизмов с помощью MALDI-TOF MS основывается на оценке рибосомальных белков, которые обычно присутствуют в клетке в большом количестве.
На основании этих принципов система является быстрым и высоконадежным аналитическим инструментом для определения характеристик разнообразных коллекций микроорганизмов, обнаруживаемых на фармацевтических и медицинских объектах (12).
Через некоторое время метод был коммерциализирован для анализа белкового состава микробной клетки. При этом сравнительные исследования показали, что MALDI-TOF MS является сравнительно эффективным методом идентификации, поскольку это утверждение основывается на его воспроизводимости, скорости и чувствительности анализа (13). Одним из важных преимуществ MALDI-TOF MS по сравнению с другими методами идентификации является время получения результата. При использовании MALDI-TOF результаты, как правило, получают в течение нескольких минут, что обеспечивается относительно быстрым проведением испытания и подготовкой пробы, которая готовится также достаточно быстро и просто.
На рынке производителей MALDI-TOF MS решений существует два основных поставщика:
Метод
На основе этого метода существует два подхода в зависимости от тест-микроорганизма. Обычно истинные колонии выращивают в чашке на подходящей агаровой среде. Как и в большинстве других методов идентификации, колонии должны быть выращены в течение ночи и быть не старее 24 часов перед использованием. Однако в отличие от большинства других методов рекомендуется, чтобы до момента испытания чашки не хранились при температуре 2—8 °C, поскольку холодильное хранение может повлиять на качество спектров. В качестве альтернативы в клинических условиях наряду со специальным набором для экстракции могут быть использованы клинические образцы, например, материал гемокультуры.
Процесс использования MALDI-TOF MS был обобщен Пателем (Patel) и его можно разбить на пять этапов (14, 15):

Рисунок 1: упрощенная схема метода MALDI-TOF MS (источник: Matt F. Traxler)
При использовании метода рекомендуется использовать положительный и отрицательный контроль. Контроли могут быть использованы либо для ежедневной калибровки, либо включены в каждое испытание. Положительный контроль — это микроорганизмы, имеющие отношение к лаборатории (обнаруживаемые в ней). Отрицательный контроль — это холостая проба, которая показывает, что целевая чашка чистая.
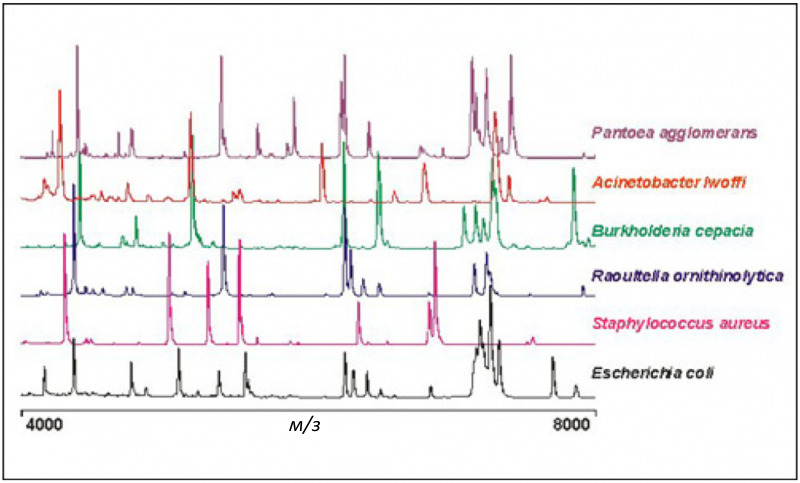
Рисунок 2: пример спектров, относящихся к различным типам бактерий (источник: Anagnostec GmbH)
Сильные и слабые стороны MALDI-TOF
Как и любая из имеющихся в продаже систем идентификации микроорганизмов MALDI-TOF MS имеет свои преимущества и недостатки. Рассмотрим их далее.
Сильные стороны
Разные пользователи систем MALDI-TOF, прежде всего из клинических учреждений, отмечают следующие преимущества системы: (17, 18, 19):
- Система позволяет идентифицировать широкий спектр бактерий, включая грамположительные кокки и палочки, а также ферментирующие и неферментирующие грамотрицательные палочки.
- Система хорошо подходит для определения дрожжей. Система имеет значительные ограничения в отношении идентификации грибов, однако такие как Aspergillus, Fusarium и Penicillium можно точно идентифицировать до видового уровня.
- Система хорошо подходит для анаэробных бактерий.
- В большинстве случаев для испытания достаточно одиночной колонии (большие количества микробной культуры необходимы для дрожжей или мукоидных колоний).
- Система позволяет успешно идентифицировать бактерии, которые считаются сложными для культивирования. Одним из таких примеров являются микобактерии.
- Система также может с некоторым успехом применяться для идентификации вирусов (20).
- Она имеет низкий риск с точки зрения лабораторной безопасности. Это связано с тем, что перед использованием образцы инактивируют путем экстракции.
- Для испытания требуется минимальное количество расходных материалов. Покупка самой системы сопряжена с относительно высокими затратами, однако эксплуатационные расходы низкие.
- При необходимости система может быть расширена.
- Результаты, как правило, воспроизводимы.
Слабые стороны
Основные слабые стороны этой системы были выявлены Агентством здравоохранения Великобритании, органом общественного здравоохранения Англии и другими организациями (21). Они включают:
Верификация метода
Очень важно, чтобы при внедрении для практического использования в лаборатории любой метод микробиологической идентификации был верифицирован (квалифицирован). Для начала работы с автоматизированным прибором необходимо выполнить следующие этапы:
- квалификация монтажа: это документальное подтверждение того, что оборудование и связанные с ним системы, такие как программное обеспечение, аппаратное обеспечение и вспомогательные средства, надлежащим образом установлены, а соответствующая документация проверена. Документация может включать руководства по эксплуатации, сертификаты, методики и протоколы калибровки.
- квалификация функционирования: в ходе неё проверяют и подтверждают, что система или подсистема работает как и ожидается в рамках всех предполагаемых рабочих диапазонов, а также документируют необходимую информацию.
- квалификация эксплуатации: в ходе неё подтверждают, что система работает стабильно, как и предусмотрено при нормальной эксплуатации, а также соответствует нормативным требованиям и ожиданиям или требованиям пользователей. Эффективная эксплуатация автоматизированной системы микробиологической идентификации очень сложна и времязатратна вследствие множества факторов, таких как выбор изолятов, вариабельность со стороны оператора и воспроизводимость самой системы.
В последующем для демонстрации пригодности самой методики требуется валидация или верификация, в случае неавтоматизированных систем. Проверка обычно включает (28):
- Параллельные испытания с использованием существующей системы и примерно 50 микробных изолятов.
- Испытание от 12 до 15 репрезентативных исходных культур часто выделяемых видов (необходимо убедиться, что они имеют достаточно широкий диапазон для охвата большей части испытательного массива приборов). В идеале следует использовать типовые штаммы.
- Подтверждение того, что от 20 до 50 микробных идентификаций, включая от 15 до 20 различных видов, согласуются с результатами контрольных лабораторных испытаний разделенного образца.
Ключевыми оцениваемыми критериями являются (29):
- Правильность, которую выражают в процентах путем деления количества правильных результатов на количество полученных результатов и умножения на 100.
- Воспроизводимость, которую аналогично выражают в процентах. Для этого количество правильных согласующихся результатов делят на общее количество результатов и умножают на 100.
Резюме
В этой статье описано, как масс-спектрометрия может быть задействована для идентификации и классификации микроорганизмов с использованием маркерных белков (характерных паттернов экспрессии белка, которые сохраняются и используются в качестве специфических биомаркерных белков для перекрестного сравнения).
Как описано в статье, при идентификации бактерий с помощью такого устройства, как прибор матрично-активированой лазерной десорбции/ионизации времяпролетной масс-спектрометрии (MALDI-TOF), отдельную изолированную колонию или простой клеточный экстракт помещают на целевую чашку из нержавеющей стали и покрывают поглощающим ультрафиолет веществом. Целевую чашку помещают в прибор MALDI-TOF. Затем обрабатывают образец с помощью азотного импульсного лазера для ионизации белков. После чего их разделяют на основании их отношения масса/заряд. Полученные спектр маркерных белков (которые находятся в диапазоне 2000—20000 Дальтон) сравниваются по базе данных известных спектров.
Этот метод, несмотря на описанные ограничения, является быстрым, эффективным и подходит для лабораторий, которым требуется обрабатывать большой объем образцов и которых устраивают получаемыми результаты на основе фенотипических проявлений.
Литература
Похожие записи:
Микробиологические испытания и нормы для оценки эффективности очистки

Подборка международных нормативных документов и полезных статей по асептическому производству

Понимание природы, предотвращение появления и уничтожение плесневых грибов в чистых помещениях

Некоторые аспекты проектирования и планирования современной микробиологической лаборатории контроля качества

Преимущества и риски использования УФ-ламп в боксах биологической безопасности

Об идентификации

К вопросу о контроле температуры

Шесть составляющих эффективного обучения GMP в лаборатории
Читайте также:

