Азотные удобрения в аквариуме
Обновлено: 04.10.2024
Азот относится к макроэлементам и является одним из основных питательных веществ для растений, в том числе и для аквариумных. При его недостатке в начальной стадии замедляется рост растений, на молодых листьях может проявиться хлороз, стебель растения истончается, молодые листья мельчают. Своеобразно разрушаются старые листья, так как растение, стремясь восполнить недостаток азота, перемещает его из нижних листьев в точки роста и в молодые листья. В отличие от признаков недостатка калия (разрушение ткани старых листьев между жилками и появление дырок в листьях), при недостатке азота старые листья сначала желтеют (светлеют) от периферии к центральной жилке, в дальнейшем происходит разрушение ткани листа. У некоторых растений отмирание начинается с центральной жилки. В любом случае на листе, пожелтевшем от недостатка азота, не бывает зеленых жилок. При выраженном недостатке азота растение останавливается в росте, может погибнуть ростковая почка (зона роста). Этот признак следует дифференцировать с недостатком микроэлементов, например с недостатком бора, при котором наблюдается почернение ростковой почки и сильное кущение растений.
Источником азота для высших растений являются неорганические соединения - аммиак/аммоний, нитриты, нитраты. В литературе также встречаются данные о том, что растения могут усваивать низкомолекулярные органические соединения азота (карбамид, некоторые аминокислоты). В ряде работ показано, что аммиачный и нитратный азот являются равнозначными источниками азота для растений.
Усвоенный растениями нитрат не участвует напрямую в реакциях биосинтеза. Он подвергается восстановлению до нитритов и далее до аммиака при участии ферментов. Активность этих ферментов зависит от многих факторов. При низкой освещенности скорость восстановления низка, что может вызывать накопление свободных ионов NO3-. Усвоенный извне или восстановленный из нитратов аммиак подвергается аминированию и амидированию. Ведущую роль в этом процессе занимают реакции синтеза глутаминовой кислоты и глутамина. Эти соединения представляют собой депо азота в растении для дальнейших реакций биосинтеза.
В аквариуме после азотного голодания скорость потребления соединений азота и, в частности, нитратов, может быть очень высокой, до 6 - 10 мг/л в сутки. Но, по мере пополнения запасов азота в тканях растений, скорость его потребления заметно снижается. Быстрорастущим растениям таких запасов хватает на несколько дней.
В растительном аквариуме с мощным светом, СО2 и умеренной плотностью посадки рыб часто возникает дефицит соединений азота в воде. Это можно выявить аквариумными тестами на нитрат-ион (NO3-). При нулевом уровне нитратов растения перестают усваивать фосфаты, это тоже хорошо заметно при тестировании воды. В своих аквариумах я стараюсь поддерживать постоянную концентрацию нитратов на уровне 5-10 мг/л, иногда до 20 мг/л внесением удобрений, содержащих азот.
Калиевая селитра (нитрат калия - KNO3)
Безопасное азотсодержащее удобрение для аквариумных растений. Содержание элементов питания: Калий - 38,7%, Нитрат - 61,3%. При внесении 1 грамма калиевой селитры на 100 литров воды концентрация нитрат-ионов возрастает на 6 мг/л. Это должно подтверждаться аквариумным тестом (при необходимости таким способом можно проверить работоспособность теста).
Однако при длительном внесении этого удобрения выяснилось, что калий, входящий в состав селитры, вносится в избытке. Растениям он нужен в меньшем количестве и не успевает усваиваться в полном объеме. В моем аквариуме расчетный уровень калия на фоне применение калиевой селитры составил 40-50 мг/литр (в природной воде уровень калия обычно не превышает 10 мг/литр). При этом другие удобрения, содержащие калий в значимых концентрациях, не вносились. В литературе по минеральному питанию растений есть данные о том, что избыток калия блокирует усвоение азота. Избежать такого накопления калия можно применением массивных подмен воды (50% и более в неделю - метод Барра) или использованием бескалиевых азотсодержащих удобрений.
Натриевая селитра (нитрат натрия - NaNO3)
Нитрат - 72,9%, натрий - 27,1%. В качестве основного источника азота нельзя использовать длительное время, так как может привести к накоплению ионов натрия в воде. Неплохие результаты получаются при использовании вместе с калиевой селитрой.
Карбамид (мочевина)
Карбамид - CO(NH2)2 - содержит не менее 46% азота. Получается синтезом из аммиака и углекислого газа при высоком давлении и температуре. Белый мелкокристаллический порошок, хорошо растворимый в воде. Гигроскопичность при температуре до 20°С сравнительно небольшая. Особенно хорошими физическими свойствами обладает гранулированная мочевина. Во время грануляции мочевины образуется токсичный биурет (CONH2)2NH. Однако содержание его в гранулированном удобрении не превышает 1% и практически безвредно для растений и рыб. В воде постепенно распадается с образованием аммиака. Из-за этого процесса представляет потенциальную опасность для рыб.
Карбамид я использовал недолго. Вносил по 2-3 мг/литр в сутки. Вспышки водорослей из-за аммиачного азота не было, но некоторая активация роста зеленых водорослей имела место.
Аммиачная селитра (нитрат аммония – NH4NO3)
В этом удобрении содержится максимальное относительное количество азота (N) – 35% (NO3 – 77,5%, NH4 – 22,5%). Не содержит ионов металлов и других балластных веществ. Аммиачный азот либо сразу усваивается растениями, либо окисляется в процессе нитрификации до нитрата.
Из раствора NH4N03 растения быстрее поглощают катион NH4+, чем анион NO3-. Из-за положительно заряда ион аммония быстро связывается с органическим субстратом грунта (илом) и дальше окисляется до нитрата в процессе нитрификации. Поэтому токсического действия на рыб при внесении аммиачной селитры в дозе до 5 мг/литр не наблюдается.
Следует соблюдать осторожность при внесении в грунт под корни растений. Если грунт не обладает буферными свойствами (не содержит карбонат кальция), то образуется азотная кислота (HNO3). Подкисление носит временный характер, так как исчезает по мере потребления нитратного азота растениями. В первое же время, особенно при внесении большой дозы в грунте могут создаваться очаги с высокой кислотностью.
Влияние на водоросли такое же, как у карбамида.
Сульфат аммония (сернокислый аммоний)
Сульфат аммония (сернокислый аммоний) (NH4)2SО4 - содержит 20,8 - 21% азота и до 24% серы. Применение в аквариуме считаю нецелесообразным, так как азот в этом удобрении присутствует в аммиачной форме, а сера обычно вносится в достаточном количестве с другими удобрениями (сульфатом калия, магния и т.п.).
Кальциевая селитра (нитрат кальция)
Кальциевая селитра (кристаллогидрат нитрата кальция, азотнокислый кальций)— Ca(NO3)2*4H2O. Как калиевая и натриевая селитры, содержит азот в нитратной форме. Возможно применение, если есть необходимость поднять общую жесткость за счет ионов кальция. При этом желательно следить за gH или точно рассчитывать дозу удобрения. (1 dGH содержит 7,5 мг Ca++).
Магниевая селитра (нитрат магния)
Кристаллогидрат нитрата магния - Mg(NO3)2*6H2O. Длительное время использовать нельзя из-за подъема общей жесткости (gH) ионами магния. С другой стороны, магниевая селитра представляет перспективный метод внесения магния без балластного сульфат-иона.
Нитрат магния можно получить самостоятельно из нитрата кальция и сульфата магния. При этом сульфат кальция (гипс) выпадет в осадок, нитрат магния останется в растворе.
Полное уравнение реакции:
MgSO4 + Ca(NO3)2 = CaSO4(в осадок) + Mg(NO3)2
По массе сульфат магния и кальциевую селитру следует брать в соотношении 1:2.
Азотная кислота (HNO3)
Считаю ее перспективным источником нитратов для аквариумных растений. Азотная кислота не содержит балластных катионов. При ее использовании уменьшается щелочность воды (кН), которая постоянно растет при интенсивной подаче углекислого газа. При использовании в течение месяца в дозе 2 мг/литр в сутки отмечено снижение кН с 6 до 4 градусов.
Эта кислота естественна для аквариума, она является конечным продуктом нитрификации и приводит к закисанию воды в перенаселенных аквариумах. Итоговое упрощенное уравнение нитрификации выглядит так:
NH3 + 2O2 → NO3- + H+ + H2O.
При внесении в аквариум азотная кислота реагирует с гидрокарбонатами:
HNO3 + HCO3- = NO3- + H2O + CO2
Поэтому, при использовании азотной кислоты, следует следить за кН (щелочностью) и поддерживать её выше 3-4 dkH.
Из-за работы карбонатного буфера заметного снижения рН не происходит. Аквариумные рыбы никак не реагируют на однократное внесение азотной кислоты в дозе до 1 г на 100 литров.
Для корневых подкормок применять нельзя, так как азотная кислота вызовет выраженное локальное подкисление грунта в зоне внесения.

Макро удобрения для аквариума
Данная статья является логическим продолжением наших предыдущих статей про питательные вещества в аквариуме, необходимых пропорциях и роли отдельных элементов и способах их внесения.
Здесь мы рассмотрим практическую часть и попытаемся осветить, как рассчитать необходимое количество того или иного удобрения и как можно сделать удобрение самостоятельно.
Для того чтобы понять сколько вносить макроэлементов (азот и фосфор) в аквариум нам для начала надо определить сколько их уже содержится и сколько растения в аквариуме их потребляют (обычно считают в расчете на неделю).
Тестами на нитраты (NO3) и фосфаты (PO4) определяем содержание соответственно азота в виде нитратов и фосфора в виде фосфатов. Если у вас аквариум с установившимся балансом (с точки зрения азотного цикла), то измерять содержание аммиака (NH3)/аммония (NH4) и нитритов(NO2) нет смысла, т.к. их концентрации должны стремиться к нулю, но если даже они и присутствуют, то в гораздо меньших количествах, чем NO3, хотя и являются источниками азота для растений, влиянием их на общее содержание можно пренебречь.
Уже на этом этапе может оказаться, что содержание NO3 и PO4 вполне достаточно (а то и зашкаливает) и внесение дополнительных макроэлементов не требуется. О рекомендуемых концентрациях и соотношении NO3:PO4 мы уже говорили в статье параметры воды для идеального травника. Как известно излишки этих элементов берутся в первую очередь из корма для рыбок, а так же могут попадать из водопроводной воды при подменах ее в аквариуме.
Дальше действуем исходя из полученных результатов.
Если содержание и пропорция NO3 и PO4 в допустимых пределах – ничего не делаем, в дальнейшем периодически (например, раз в неделю) делаем контрольные замеры.
Если пропорция NO3 и PO4 нарушена (часто бывает завышенное содержание PO4 относительно NO3, т.к. фосфаты постепенно накапливаются в грунте аквариума), но их концентрация в допустимых пределах – корректируем добавляя фосфатное или нитратное удобрение. Про сами удобрения мы поговорим ниже.
Например. При первом замере у нас получилась концентрация NO3 – 10мг/л, далее внесли 10мл нитратного удобрения и у нас поднялось содержание NO3 до 20мг/л. Замер через 2 дня показал концентрацию NO3 в 15мг/л. Значит за 2 дня у нас употребилось 5 мг/л NO3 или 2,5 мг/л за день или 17,5 мг/л за неделю. Мы знаем так же, что 10мл. удобрения у нас подняли концентрацию NO3 на 10мг/л, значит для компенсации 17,5 мг/л (недельная доза) нам необходимо вносить 17,5 мл удобрения в неделю.
Вносить удобрения можно раз в неделю, но это не лучший вариант, как мы уже писали в предыдущих статьях, т.к. лишние неиспользованные удобрения являются хорошим источником питания для водорослей. Поэтому эту дозу лучше разделить на 7 и вносить удобрение каждый день по (17,5/7)=2,5 мл.
Точно такие же измерения и расчет делаем для фосфатов, да и для железа тоже (о нем поговорим ниже).
Какие макроудобрения использовать? Кто его производит большой роли не играет. Но лучше использовать по отдельности нитратное и фосфатное удобрение. Конечно, удобнее использовать комплексное удобрение (NPK), но при этом у нас уменьшается возможность корректировки пропорции NO3:PO4. Правда многие производители заранее учитывают эти пропорции и делают составы, которые оптимально работают в среднестатистическом аквариуме с учетом регулярных подмен воды, которые сглаживают возможные перекосы в соотношениях веществ.
Самомомес нитрата и фосфата для аквариума

Макро удобрения для аквариума
Если же у вас есть желание, то есть смысл изготавливать удобрения самостоятельно (особенно макро). Они несложны по составу и не требуют особо точного оборудования для изготовления.
В качестве азотного (нитратного) удобрения обычно используют нитрат калия (KNO3). Другие его названия – калий азотнокислый, калиевая селитра. KNO3 хорош тем, что он является одновременно поставщиком нитратов и калия. В сельском хозяйстве часто поставщиком азота является натриевая селитра (NaNO3) и аммиачная селитра (NH4NO3), но для аквариума они не годятся, т.к. первая содержит натрий, который не желателен в аквариуме, а вторая – аммоний, который ядовит для обитателей.
В качестве фосфатного удобрения используют монофосфат калия (KH2PO4) или калий фосфорнокислый однозамещенный. Так же хорош тем, что в своем составе имеет только фосфат и тот же калий и, ничего лишнего.
Готовить удобрения желательно на очищенной воде. Лучшим вариантом будет дистиллированная вода (купить можно в авто- или хозяйственных магазинах), неплохой вариант – осмос. Если по каким-то причинам нет возможности применить такую воду - можно использовать кипяченную воду. Но кипятить желательно не менее получаса. Это гарантирует уничтожение различных бактерий и грибков, а так же несколько снижает жесткость воды.

Макро удобрения для аквариума
Для приготовления нитратного удобрения взвешиваем 8 грамм KNO3 (нитрат калия или калиевая селитра) и растворяем в 100 мл горячей воды. Для большей точности лучше растворить 80 грамм KNO3 в 1 литре воды. Если вы применяете калиевую селитру из садового магазина раствор может получиться мутным из-за примесей и его надо будет отстоять и слить с осадка.
В полученном нами удобрении будет содержаться нитратов (NO3) – 50 г/л и калия (К) – 30 г/л. Соответственно, если мы добавим 1 мл удобрения на 10 л аквариумной воды у нас содержание нитратов в аквариуме поднимется на 5 мг/л. При этом следует учитывать, что и содержание калия поднимется на 3 мг/л.
Фосфатное удобрение делаем подобным образом. 7,5 грамм KH2PO4 (монофосфат калия) растворяем в 1 литре воды. Отвесить 7,5 грамм на кухонных весах уже не так просто, поэтому если Вы решили самостоятельно делать удобрения – купите соответствующие весы. На Алиэкспресс имеется большой выбор по совсем гуманным ценам. Так же после растворения соли может появиться взвесь (в случае применения садового монофосфата калия), в этом случае потребуется отстоять раствор.
В полученном нами фосфатном удобрении будет содержаться 5 г/л фосфатов и 2 г/л калия. Соответственно при добавлении 1 мл удобрения на 10 л аквариумной воды у нас поднимется концентрация фосфатов на 0,5 мг/л и калия на 0,2 мг/л.
Примечание: Дозировки можно удвоить. Это повлияет только на количество "пшиков" удобрения в аквариум. Если у вас небольшой аквариум, рекомендуем стандартные пропорции, если аквариум большой - от 200л., пропорции лучше удвоить, что уменьшить "пшики" =)
Калиевое удобрение для аквариума

В изготовленных нами нитратном и фосфатном удобрениях содержится калий (мы его выделяли отдельно), однако его количество обычно недостаточно для поддержания калия на нужном уровне и приходится добавлять его дополнительно.
Для изготовления калиевого удобрения используется сульфат калия (K2SO4) или калий сернокислый. Эта соль не содержит нитратов и фосфатов, поэтому не придется беспокоиться о превышении концентрации их при внесении именно калиевого удобрения. Изготавливается калиевое удобрение так же, как нитратное и фосфатное.
Растворяем 110 г K2SO4 в 1 л воды. В полученном удобрении будет содержаться 50 г/л калия. Соответственно при добавлении 1 мл удобрения на 10 л аквариумной воды концентрация калия поднимется на 5 мг/л.
Как видим сделать самостоятельно макроудобрения совсем несложно. В микроудобрениях принцип тот же, но составляющих гораздо больше. Об этом мы поговорим в следующей статье.
Автор Игорь Лакин
ПАРУ ЛАЙФХАКОВ ДЛЯ ВСЕХ, КТО ПРОЧЕЛ СТАТЬЮ И РЕШИЛСЯ САМОСТОЯТЕЛЬНО ДЕЛАТЬ АКВАРИУМНЫЕ УДОБРЕНИЯ.
1. Приготовив самомес у нас возникает проблема, как его хранить? Удобрение – хорошая питательная среда для микроорганизмов, в частности для водорослей. Если не хранить литрушку УДО в холодильники, то часто на стенках тары могут образовываться всякие обрастания, само удобрение портится.
Чтобы бы этого не допустить, записывайте фишечку, диктую =) Берете ~ 20 мл. любого альгицида (глутарового альдегида), например, от Медосы.
Вливаете эти 20 мл. в приготовленный 1 литровый раствор удобрения и вуаля, его можно хранить при комнатной температуре и он не скиснет.
Для всех, кто беспокоится о влиянии глутарового альдегида на свой травник, спешим успокоить, что такая мала доза ни как не повлияет на состояние травника. Даже наоборот, улучшит его. Ибо глутаровый альдегид в малых дозах полезен растениям, поскольку является источником углерода – С.
В свою очередь, находясь в растворе удобрения, альгицид будет играть роль консерванта, не давая всякой бяке развиваться.
2. И на последок, еще один совет. Понято, что для приготовления удобрения нам понадобятся точные весы, которые измеряют вес в граммах. Такие весы можно купить, на АлиЭксперссе, скажем, вот такие + пригодятся на кухне.

Но есть специализированные электронные мерные ложечки. Ими весьма удобно отмерять даже самые небольшие порции удобрений. Если вы решите приобрести такую ложечку, рекомендуем брать профессиональные вещи, типа Ista Digital Spoon Scale – специальная, можно сказать аквариумная ложка, которая обеспечат точное дозирование любого химического вещества или добавки до 300 грамм с шагом 0,1 г.
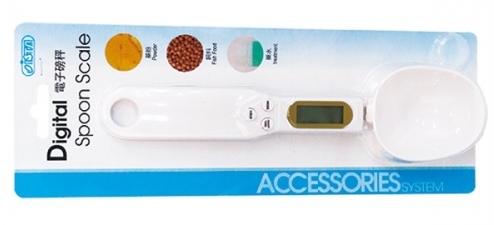
Мы не рекомендуем, брать похожие ложки на Али (как минимум тщательно читайте отзывы) ибо были печальные прецеденты с их точностью. Как проверить точность? Вес 10 рублевой монеты = 5,65 грамм. Кладете и проверяете =)
Крутые ролики о растениях и травнике от ФанФишки
Подписывайтесь на наш You Tube-канал, чтобы ничего не пропустить

Данная статья является логическим продолжением наших предыдущих статей про питательные вещества в аквариуме, необходимых пропорциях и роли отдельных элементов и способах их внесения.
Здесь мы рассмотрим практическую часть и попытаемся осветить, как рассчитать необходимое количество того или иного удобрения и как можно сделать удобрение самостоятельно.
Для того чтобы понять сколько вносить макроэлементов (азот и фосфор) в аквариум нам для начала надо определить сколько их уже содержится и сколько растения в аквариуме их потребляют (обычно считают в расчете на неделю).
Тестами на нитраты (NO3) и фосфаты (PO4) определяем содержание соответственно азота в виде нитратов и фосфора в виде фосфатов. Если у вас аквариум с установившимся балансом (с точки зрения азотного цикла), то измерять содержание аммиака (NH3)/аммония (NH4) и нитритов(NO2) нет смысла, т.к. их концентрации должны стремиться к нулю, но если даже они и присутствуют, то в гораздо меньших количествах, чем NO3, хотя и являются источниками азота для растений, влиянием их на общее содержание можно пренебречь.
Уже на этом этапе может оказаться, что содержание NO3 и PO4 вполне достаточно (а то и зашкаливает) и внесение дополнительных макроэлементов не требуется. О рекомендуемых концентрациях и соотношении NO3:PO4 мы уже говорили в статье параметры воды для идеального травника. Как известно излишки этих элементов берутся в первую очередь из корма для рыбок, а так же могут попадать из водопроводной воды при подменах ее в аквариуме.
Дальше действуем исходя из полученных результатов.
Если содержание и пропорция NO3 и PO4 в допустимых пределах – ничего не делаем, в дальнейшем периодически (например, раз в неделю) делаем контрольные замеры.
Если пропорция NO3 и PO4 нарушена (часто бывает завышенное содержание PO4 относительно NO3, т.к. фосфаты постепенно накапливаются в грунте аквариума), но их концентрация в допустимых пределах – корректируем добавляя фосфатное или нитратное удобрение. Про сами удобрения мы поговорим ниже.
Например. При первом замере у нас получилась концентрация NO3 – 10мг/л, далее внесли 10мл нитратного удобрения и у нас поднялось содержание NO3 до 20мг/л. Замер через 2 дня показал концентрацию NO3 в 15мг/л. Значит за 2 дня у нас употребилось 5 мг/л NO3 или 2,5 мг/л за день или 17,5 мг/л за неделю. Мы знаем так же, что 10мл. удобрения у нас подняли концентрацию NO3 на 10мг/л, значит для компенсации 17,5 мг/л (недельная доза) нам необходимо вносить 17,5 мл удобрения в неделю.
Вносить удобрения можно раз в неделю, но это не лучший вариант, как мы уже писали в предыдущих статьях, т.к. лишние неиспользованные удобрения являются хорошим источником питания для водорослей. Поэтому эту дозу лучше разделить на 7 и вносить удобрение каждый день по (17,5/7)=2,5 мл.
Точно такие же измерения и расчет делаем для фосфатов, да и для железа тоже (о нем поговорим ниже).
Какие макроудобрения использовать? Кто его производит большой роли не играет. Но лучше использовать по отдельности нитратное и фосфатное удобрение. Конечно, удобнее использовать комплексное удобрение (NPK), но при этом у нас уменьшается возможность корректировки пропорции NO3:PO4. Правда многие производители заранее учитывают эти пропорции и делают составы, которые оптимально работают в среднестатистическом аквариуме с учетом регулярных подмен воды, которые сглаживают возможные перекосы в соотношениях веществ.
Самомомес нитрата и фосфата для аквариума

Если же у вас есть желание, то есть смысл изготавливать удобрения самостоятельно (особенно макро). Они несложны по составу и не требуют особо точного оборудования для изготовления.
В качестве азотного (нитратного) удобрения обычно используют нитрат калия (KNO3). Другие его названия – калий азотнокислый, калиевая селитра. KNO3 хорош тем, что он является одновременно поставщиком нитратов и калия. В сельском хозяйстве часто поставщиком азота является натриевая селитра (NaNO3) и аммиачная селитра (NH4NO3), но для аквариума они не годятся, т.к. первая содержит натрий, который не желателен в аквариуме, а вторая – аммоний, который ядовит для обитателей.
В качестве фосфатного удобрения используют монофосфат калия (KH2PO4) или калий фосфорнокислый однозамещенный. Так же хорош тем, что в своем составе имеет только фосфат и тот же калий и, ничего лишнего.
Готовить удобрения желательно на очищенной воде. Лучшим вариантом будет дистиллированная вода (купить можно в авто- или хозяйственных магазинах), неплохой вариант – осмос. Если по каким-то причинам нет возможности применить такую воду - можно использовать кипяченную воду. Но кипятить желательно не менее получаса. Это гарантирует уничтожение различных бактерий и грибков, а так же несколько снижает жесткость воды.

Для приготовления нитратного удобрения взвешиваем 8 грамм KNO3 (нитрат калия или калиевая селитра) и растворяем в 100 мл горячей воды. Для большей точности лучше растворить 80 грамм KNO3 в 1 литре воды. Если вы применяете калиевую селитру из садового магазина раствор может получиться мутным из-за примесей и его надо будет отстоять и слить с осадка.
В полученном нами удобрении будет содержаться нитратов (NO3) – 50 г/л и калия (К) – 30 г/л. Соответственно, если мы добавим 1 мл удобрения на 10 л аквариумной воды у нас содержание нитратов в аквариуме поднимется на 5 мг/л. При этом следует учитывать, что и содержание калия поднимется на 3 мг/л.
Фосфатное удобрение делаем подобным образом. 7,5 грамм KH2PO4 (монофосфат калия) растворяем в 1 литре воды. Отвесить 7,5 грамм на кухонных весах уже не так просто, поэтому если Вы решили самостоятельно делать удобрения – купите соответствующие весы. На Алиэкспресс имеется большой выбор по совсем гуманным ценам. Так же после растворения соли может появиться взвесь (в случае применения садового монофосфата калия), в этом случае потребуется отстоять раствор.
В полученном нами фосфатном удобрении будет содержаться 5 г/л фосфатов и 2 г/л калия. Соответственно при добавлении 1 мл удобрения на 10 л аквариумной воды у нас поднимется концентрация фосфатов на 0,5 мг/л и калия на 0,2 мг/л.
Калиевое удобрение для аквариума

В изготовленных нами нитратном и фосфатном удобрениях содержится калий (мы его выделяли отдельно), однако его количество обычно недостаточно для поддержания калия на нужном уровне и приходится добавлять его дополнительно.
Для изготовления калиевого удобрения используется сульфат калия (K2SO4) или калий сернокислый. Эта соль не содержит нитратов и фосфатов, поэтому не придется беспокоиться о превышении концентрации их при внесении именно калиевого удобрения. Изготавливается калиевое удобрение так же, как нитратное и фосфатное.
Растворяем 110 г K2SO4 в 1 л воды. В полученном удобрении будет содержаться 50 г/л калия. Соответственно при добавлении 1 мл удобрения на 10 л аквариумной воды концентрация калия поднимется на 5 мг/л.
Как видим сделать самостоятельно макроудобрения совсем несложно. В микроудобрениях принцип тот же, но составляющих гораздо больше. Об этом мы поговорим в следующей статье.
Азот (N), фосфор (P) и калий (К) – это те макроэлементы, которые мы вносим в аквариум в форме жидких удобрений, если хотим добиться высокого качества растений.
Зачастую просто подобрать нужную дозировку, ориентируясь на рекомендации инструкции написанной на упаковке, недостаточно. Что-то идёт не так и приходится какой-либо из этих элементов вносить дополнительно.
Например, Вам удалось установить хорошее освещение аквариума, наладить подачу углекислоты, установив рН в нейтральном диапазоне (6,5-7,5), а водоросли всё равно растут. В этом случае в первую очередь надо разбираться с количеством азота (N) и фосфора (P).

Без тестов нам не разобраться. Придётся покупать и измерять параметры воды. А именно, сначала убедиться, что рН в нейтральном диапазоне. Иначе дальше двигаться нет смысла: будет питательных элементов достаточно, а насколько эффективно они усваиваются неизвестно. Следующим шагом, после коррекции рН на нужный уровень будет измерение азота (N) и фосфора (P). Для оптимального роста растений и избавления от водорослей нам не нужен ни недостаток, ни избыток.
Оба эти элемента взаимосвязаны. Один без другого не усваивается. Но если временный недостаток фосфора (Р) растение может перенести (оно его накапливает и затем использует из своих запасов), то недостаток азота ( N ) фатален. Без него растение с трудом усваивает углерод (С) и, соответственно, задыхаясь, не может потребить и остальные элементы. Растения, не получив своё, испытывают стресс и начинают отдавать в воду кроме всего прочего принятый ранее фосфор (P) с азотом (N) и аммоний (NH4+), провоцируя ещё больший рост водорослей. Аммоний (NH4+), кстати, тот ещё провокатор. Он тоже одна из основных причин появления водорослей.
О количестве рыб
Баланс азота (N) и фосфора (P)
К широко используемым в удобрениях макроэлементам относятся азот (N), фосфор (P) и калий (K). Так удобрения и маркируются – NPK. По относительному составу элементов. Например, популярное сельскохозяйственное удобрение, так называемая нитроаммофоска, бывает с характеристиками N:P:K = 8:24:24 и N:P:K = 16:16:16
Но у нас не навоз-колхоз. На почве важен только рост растений, а нам нужно ещё учитывать излишки элементов, которые достаются водорослям. В наших условиях необходимое соотношение N:P:K = 10:1:11. Цифры тут реальные. Означают миллиграммы на литр воды, точнее, атомарное соотношение по массе. Причём решающим соотношением для избавления от водорослей является нитрат:фосфат. Нитрата (NO3) всегда должно быть в 10 раз больше чем фосфата (PO4). Одно без другого просто не усваивается, а излишки остаются на радость водорослям.
Минимальное количество еженедельно вносимых нитратов и фосфатов 10:1 годится для аквариумов без подачи углекислоты; 30:3 норма для благополучного аквариума с быстрорастущими растениями; а 50:5 максимально допустимое значение, которое переносят рыбы. Т.е. при еженедельной подмене воды добиваемся, контролируя тестами, этих значений так чтобы питания хватило на неделю. Если не лень, разбиваем это количество на несколько порций и добавляем в течение недели.
Через неделю, когда наступает время очередной замены воды, снова делаем тесты, чтобы увидеть, в каких пропорциях поглощались питательные вещества. И снова корректируем количество вносимых удобрений. На первых этапах придётся сделать промежуточные тесты среди недели между подменами воды. Так будет ясна полная картина потребления удобрений.
О важности азота (N) в формуле N-P-K
Недостаток одного элемента всегда лимитирует потребление остальных. Из трёх основных макроэлементов азота (N), фосфора (P) и калия (K) допустимо, чтобы лимитирующим фактором был только фосфор (P).
Азот (N) входит в состав аммония (NH4+), нитрита (NO2) и нитрата (NO3). В силу ничтожно малых количеств аммония (NH4+) и нитрита (NO2) в здоровом аквариуме, мы будем учитывать только нитрат (NO3).
При отсутствии азота (N) энзим активирующий потребление СО2 не срабатывает и углерод растениями резко перестаёт усваиваться. Прекращается фотосинтез, рост и потребление всех питательных веществ. По этой причине недостаток азота (N) намного хуже, чем нехватка фосфора (P). При нехватке фосфатов (PO4) водоросли появляются не сразу и постепенно. При нехватке нитратов (NO3) мы получим вспышку водорослей. Поэтому гораздо проще, когда лимитирующим фактором роста растений становиться не азот (N), а фосфор (P). В таком случае отклонение от пропорции N:P = 10:1 лучше сделать в сторону нитрата (NO3) N:P = 15:1. Хотя фосфором (P) тоже не стоит ограничивать рост растений. Лучше делать это сокращением интенсивности или продолжительности освещения. Питательных элементов всегда должно хватать. Речь идёт о том, кратковременный дефицит какого элемента нам принесёт больше проблем.
Пока в воде присутствуют оба элемента и азот и фосфор, не важно, в какой они пропорции. Правило N-P-K вступает в силу в ситуации, когда рост растения лимитирован по одному из элементов. Мы рассчитываем дозировки с запасом до следующей подмены воды. А так как растениям азот важнее, можно перестраховаться и сделать соотношение с запасом прочности N:P = 20-25:1 Такое соотношение особенно актуально, если не используется питательный грунт и растениям приходится полагаться только на питание из воды.
Пропорция Редфилда (Redfield ratio, RR-ratio)
Alfred C. Redfield (1890-1983), американский учёный, исследовал зоопланктон и морские водоросли. В 1934 году он выяснил что атомарное соотношение углерод-азот-фосфор в составе зоопланктона соответствует С:N:P = 106:16:1 во всех океанах с небольшими отклонениями.
С:N:P = 106:16:1 это атомарное соотношение. Нам же интересно атомарное соотношение по массе в веществах нитрат (NO3) и фосфат (PO4). Если перевести атомарный Redfield ratio N:P = 16:1 в соотношение N:P по массе, получим N:P = 7,2:1. А в переводе PO4:NO3 по массе получится как раз та пропорция, которую мы используем 1:10 (если точно, 1:10.4). Допустимый диапазон атомарного Redfield Ratio (RRatomic) равен 1:15-30. Что соответствует по массе PO4:NO3 = 1:~10-20.
Эти соотношения были исследованы далее и привели к выводам, что при избытке азота по отношению к фосфору, будут расти зелёные водоросли, а при избытке фосфора по отношению к азоту – сине-зелёные водоросли.
Фосфат (PO4) в аквариуме
Основные естественные источники фосфата в аквариуме: корм, выделения рыб и отмирающие растения.
Фосфат не усваивается растениями в нерастворённом виде. Это не является большой помехой, т.к. он способен быстро растворяться из разлагающейся органики в воду. Он также быстро усваивается растениями. Внесённая доза 5 мг/л довольно быстро усваивается про запас, оставляя концентрацию в воде около 0,1 мг/л или того меньше, и затем может использоваться растением из своих источников при непродолжительном отсутствии фосфата (PO4) в воде. Это не значит, что надо вносить большие дозировки или добавлять фосфат между подменами воды. Это означает, что всё сделано верно: растениям обеспечены условия для хорошего роста. Так не остаётся шансов водорослям.
Растения не потребляют органически связанный фосфат (PO4) пока он не будет переработан бактериями. Этот процесс происходит несколько медленно для того, чтобы успеть удовлетворить потребность в питании быстрорастущих растений в благополучном аквариуме. Поэтому фосфат необходимо вносить дополнительно.
В качестве источника фосфата используют монофосфат калия (KH2PO4). Его можно купить в садовых магазинах. Состав монофосфата калия (KH2PO4) входит PO4=69.8%, P=22.8%, K=28.7%
Признаки недостатка фосфата (PO4): скручивание побегов и листьев, потемнение молодых листьев, на старых листьях появляются красновато-бурые или бурые пятна.
Азот (N) в аквариуме
Возможно это самый важный элемент в питании растений. Азот (N) является стимулятором потребления углекислоты (СО2). Без наличия азота (N) в воде рост растений прекращается, провоцируется вспышка водорослей. Есть смысл делать дозировку азота (N) при добавлении удобрений с запасом во избежание ситуации, когда этот элемент иссякнет.
Признаки недостатка азота (N): замедление скорости роста, пожелтение листьев начинается с краёв и кончиков, отмирание старых листьев, почернение участков листьев папоротников.
Доступные источники азота (N): нитрат калия (KNO3), нитрат аммония (NH4NO3), сульфат аммония (NH4SO4) и амидный азот (NH2).
Нитрат калия (KNO3), он же калиевая селитра, калийная селитра, азотнокислый калий, индийская селитра и др., самый доступный и самый дешёвый вариант. Не вызывает рост водорослей.
Нитрат аммония (NH4NO3), он же аммиачная селитра, лучше использовать при рН>6,5. Дело в том, что в этом случае растения легче усваивают азот из аммония (NH4+), а не из нитрата (NO3). Не очень удобный вариант, т.к. аммоний (NH4+) – основной стимулятор роста водорослей. В состав нитрата аммония (NH4NO3), входят NO3 77,5%, NH4 22,5%. Азота (N) содержится в нём 33%. Если внести его в расчёте по нитрату 20 мг/л, концентрация аммония будет 4,5 мг/л т.е. близка к токсичному порогу (5 мг/л). Выходит, нитрат аммония (NH4NO3) нужно применять в аквариуме без рыб, или почти без рыб. И ещё один подводный камень. Чего будет больше после обработки бактериями, аммиака или аммония зависит от жёсткости воды. При GH >12 аммиак вносить нельзя. Он будет в токсичном количестве. При такой жёсткости воды лучше использовать сульфат аммония (NH4SO4).
Ещё один удачный источник азота – амидный азот (NH2). Он не провоцирует водоросли и легко усваивается растениями.
Амидный азот (NH2)
Вместо аммония (NH4+) в качестве источника азота (N) лучше использовать амидный азот (NH2). Его неоспоримое преимущество в том, что в отличие от аммония (NH4+), избыток которого является одной из частых причин возникновения водорослей, азот (N) в этой форме для водорослей недоступен.
Амидный азот (NH2) входит в состав многих соединений, в том числе и аминокислот: глутамат, аспарин, аргинин, аланин, гистидин и др. Эти вещества содержат готовые к употреблению растениями азотные соединения NO3, NH4, NH3, NH2, что облегчает их потребление.
Амидный азот (NH2) довольно популярен, широко используется в сельскохозяйственных удобрениях и удобрениях для гидропоники.
Некоторые аквариумные удобрения тоже делают с амидным азотом (NH2). Так компания ADA использует способность растений извлекать амидный азот (NH2) из аминокислот и включает их в состав ADA Green Gain и ADA Efficient Complex Acid.
Аммоний (NH4+)
Аммоний (NH4+) играет важную роль в метаболизме растений. Он ускоряет потребление азота (N) из нитрата (NO3). Но вносить в аквариум дополнительно его нужно очень осторожно. Концентрация, превышающая всего лишь 0.02мг/л способна остановить потребление нитрата (NO3). На практике он не вноситься. Разве что в аквариум без рыб. Источником аммония (NH4+) в аквариуме являются органические разложения, корм и экскременты рыб.
При использовании питательного грунта, такого как ADA, или внесении в аквариум дополнительной дозировки аммония (NH4+) важно использовать внешний фильтр для эффективной обработки аммония (NH4+) бактериями в случае случайной передозировки.
Эффективность биофильтрации снижается при заиливании фильтрующих элементов. При возникновении водорослей, если все параметры в норме, означает, что нужно чистить фильтр.
Также должно быть достаточно много растений и они должны быть обеспечены хорошим светом, СО2 и питанием всеми микро- и макроэлементами. И всё должно быть в таком балансе, установить который получается с опытом.
Ещё при внесении аммония (NH4+) нужно учесть, что он, так же как и аммиак, может быть в водопроводной воде.
Проще еженедельно вносить в качестве источника азота (N) нитрат калия (KNO3) 10-30мг/л и не заморачиваться на аммоний (NH4+).
Калий (К) в аквариуме
Калий (К) обязательно должен быть в аквариумной воде, недельная норма которого 10-20 мг/л. Без него не происходит фотосинтеза.
Он есть в кормах. Корм для рыб, как отмечалось выше, основной источник макроэлементов. При создании растениям оптимальных условий для роста, на одном корме далеко не уедешь. Калия будет недостаточно.
Дополнительно вносится обычно в качестве сульфата калия (K2SO4), он же сернокислый калий.
Если калий (К) добавлять в состве солей нитрата калия (KNO3) и фосфата калия (KH2PO4), то надо учитывать количество нитратов (NO3) с фосфатами (PO4).
Так если азот (N) и фосфор (P) добавлять в аквариум в составе нитрата калия (KNO3) и фосфата калия (KH2PO4), калий (K) дополнительно не добавляется. Его и так будет достаточно.
На практике калий (К) нет необходимости измерять тестами и вносить его точное количество. Тем более в продаже и тестов для измерения калия (К) в пресной воде нет. Достаточно корректировать еженедельные дозировки, ориентируясь по состоянию растений.
Признаки недостатка калия (К): появление маленьких дырочек на листьях, медленный рост растений и, как следствие, появление проблем с водорослями.
Эти проблемы могут возникнуть даже при внесении калия (К) в достаточном количестве. Дело в том, что его антагонистом является натрий (Na), который есть в водопроводной воде. Натрий (Na) блокирует потребление калия (К). Ничего страшного в этом нет. Просто его всегда должно быть больше чем натрия (Na). Нужно увеличить дозировку калия (К), тогда он будет доступен растениям.
В водопроводной воде концентрация натрия (Na) обычно колеблется в диапазоне от 5 до 50 мг/л. Запросто может и больше, ведь предельно допустимая концентрация – 200 мг/л.
Часто дырки на листьях появляются во время запуска аквариума, когда растения ещё не прижились. В это время, особенно в первые две недели, никакие удобрения вносить нельзя, а калий (К), при появлении признаков его недостатка – желательно.
Не стоит увлекаться простотой применения калия (К). Его передозировка, в свою очередь, блокирует потребление азота (N) и кальция (Ca).
Признаки нехватки кальция (Ca): радикулит (искривление и уменьшение в размерах каждого нового листа), побеление молодых листьев и дальнейшее их отмирание.

Самодельный Мелафикс
Средство на основе эфирного масла от внешних бактериальных инфекций легко сделать в домашних условиях. Довольно эффективное. Помогает даже при заживлении язв.

Проверь себя
Небольшой экзамен. Подборка вопросов с краткими ответами на них и ссылками на страницы с подробными яснениями.

Заходи к нам в
АКВАРИУМНЫЕ УСЛУГИ
Наша основная деятельность – услуги по обслуживанию аквариумов. Оформление и обслуживание аквариума в Москве.
Цены на оформление аквариума начинаются с 17000 руб. за аквариумы не более 200 литров, оформленные искусственными растениями. В цену входит, грубо говоря, всё, кроме самого аквариума и аквариумного оборудования: декоративное наполнение и аквариумные рыбки, комплект по уходу за аквариумом, а так же месяц гарантийного ухода, в течение которого произойдёт запуск аквариума. Подробнее можно посмотреть на странице Прайс-лист.
Конечно, это не полный список аквариумных услуг, которые мы делаем. Для своих клиентов мы выполняем любые аквариумные пожелания.
Читайте также:

