Бактериофаги поражают клетки растений
Обновлено: 19.09.2024
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Государственной премии РФ (1999). Автор и соавтор более 300 научных работ и 20 патентов.
Вера Витальевна Морозова — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор более 30 научных работ и 6 патентов.
Игорь Викторович Бабкин — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 58 научных работ и 2 патентов.
Нина Викторовна Тикунова — доктор биологических наук, заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 120 научных работ и 21 патента.
Когда в 1930-х гг. группа ученых занялась проблемами функционирования живых систем, то в поиске простейших моделей они обратили внимание на бактериофаги — вирусы бактерий. Ведь среди биологических объектов нет ничего проще, чем бактериофаги, к тому же их можно легко и быстро выращивать и анализировать, а вирусные генетические программы невелики.
Фаг — это минимального размера природная структура, содержащая плотно упакованную генетическую программу (ДНК или РНК), в которой нет ничего лишнего. Эта программа заключена в белковую оболочку, снабженную минимальным набором устройств для ее доставки внутрь бактериальной клетки. Бактериофаги не могут размножаться сами по себе, и в этом смысле их нельзя считать полноценными живыми объектами. Их гены начинают работать только в бактерии, используя имеющиеся в бактериальной клетке биосинтетические системы и запасы молекул, необходимых для синтеза. Однако генетические программы этих вирусов принципиально не отличаются от программ более сложных организмов, поэтому эксперименты с бактериофагами позволили установить основополагающие принципы устройства и работы генома.
В дальнейшем эти знания и разработанные в ходе исследований методы стали фундаментом для развития биологической и медицинской науки, а также широкого спектра биотехнологических приложений.
Бактериофаги — наши друзья, когда речь идет о бактериях, патогенных для человека. Однако есть и другие, дружественные нам бактерии, которые используются в современных биотехнологических производствах, а также в традиционных производствах пищевой промышленности, таких как сыроварение и т. п. В этих случаях фаги могут приносить большой вред, поскольку в больших популяциях микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения фагов, что приводит к лизису производственных бактериальных культур. При производстве сыра проблема не столь серьезна, так как при этом обычно применяют закваски, состоящие из многих культур, часть которых выдержит фаговую атаку и продолжит процесс молочнокислого брожения. Серьезные неприятности возникают, если весь процесс основан на применении одного конкретного бактериального штамма, как, например, при производстве антибиотиков или терапевтических белков.
Борцы с патогенами
Первые попытки использовать бактериофаги для лечения инфекционных заболеваний были предприняты практически сразу после их открытия, однако недостаток знаний и несовершенные биотехнологии того времени не позволили достичь полного успеха. Тем не менее дальнейшая клиническая практика показала принципиальную возможность успешного применения бактериофагов при инфекционных заболеваниях желудочно-кишечного тракта, мочеполовой системы, при острых гнойно-септических состояниях больных, для лечения хирургических инфекций и т. д.
По сравнению с антибиотиками бактериофаги имеют ряд преимуществ: они не вызывают побочных эффектов, к тому же строго специфичны для определенных видов бактерий, поэтому при их использовании не нарушается нормальный микробиом человека. Однако такая высокая избирательность создает и проблемы: чтобы успешно лечить пациента, нужно точно знать инфекционный агент и подбирать бактериофаг индивидуально.
Бактериофагами лечат инфекционные болезни не только людей, но и домашних и сельскохозяйственных животных: мастит у коров, колибактериоз и эшерихиоз у телят и свиней, сальмонеллез у кур. Особенно удобно применять фаговые препараты в случае аквакультуры — для лечения промышленно выращиваемых рыб и креветок, так как в воде они долго сохраняются. Бактериофаги помогают защитить и растения, хотя применение фаговых технологий в этом случае затруднено из-за воздействия природных факторов, таких как солнечный свет и дождь, губительных для вирусов.
Фаги могут сыграть большую роль в поддержании микробиологической безопасности продуктов питания, так как применение антибиотиков и химических агентов в пищевой отрасли не решает эту проблему, одновременно снижая уровень экологической чистоты продукции. О серьезности самой проблемы говорят статистические данные: например, в США и России ежегодно регистрируется до 40 тыс. заболевших сальмонеллезом, из которых 1% умирает. Распространение этой инфекции в значительной степени связано с выращиванием, переработкой и потреблением различных видов птицы, и попытки применить для борьбы с ней бактериофаги дали многообещающие результаты.
Так, американская компания Intralytix производит фаговые препараты для борьбы с листериозом, сальмонеллезом и бактериальным загрязнением кишечной палочкой. Они разрешены к применению как добавки, предотвращающие размножение бактерий на продуктах питания — их распыляют на продукты из мяса и домашней птицы, а также на овощи и фрукты. Эксперименты показали, что коктейль из бактериофагов может быть успешно применен и при транспортировке и реализации живой прудовой рыбы для снижения бактериального загрязнения не только воды, но и самой рыбы.
Очевидным применением бактериофагов является дезинфекция, то есть уничтожение бактерий в тех местах, где их не должно быть: в больницах, на пищевых производствах и т. п. Для этой цели британская компания Fixed-Phage разработала метод фиксации фаговых препаратов на поверхностях, обеспечивающий сохранение биологической активности фагов до трех лет.
Эксперимент американских исследователей А. Херши и М. Чейза с использованием бактериофагов, меченных изотопами серы и фосфора, доказали роль ДНК как основного носителя генетической информации
В качестве объектов для своих исследований М. Дельбрюк и его сотрудники использовали мутантные бактериофаги так называемой Т-серии, поражающие кишечную палочку
Семь дней творения
Современные методы синтетической биологии позволяют не только вносить различные модификации в фаговые геномы, но и создавать полностью искусственные активные фаги. Технологически это несложно, нужно только синтезировать фаговый геном и ввести его в бактериальную клетку, а там он уже сам запустит все процессы, необходимые для синтеза белков и сборки новых фаговых частиц. В современных лабораториях на эту работу уйдет всего несколько дней.
Генетические модификации применяют, чтобы изменить специфичность фагов и повысить эффективность их терапевтического действия. Для этого наиболее агрессивные фаги снабжают узнающими структурами, связывающими их с целевыми бактериями. Также в вирусные геномы дополнительно встраивают гены, кодирующие токсические для бактерий белки, нарушающие метаболизм, — такие фаги более смертоносны для бактерий.
Универсальный способ защиты бактерий от всех внешних воздействий — так называемые биофильмы, пленки из ДНК, полисахаридов и белков, которые бактерии создают совместными усилиями и куда не проникают ни антибиотики, ни терапевтические белки. Такие биопленки — головная боль врачей, так как они способствуют разрушению зубной эмали, образуются на поверхности имплантов, катетеров, искусственных суставов, а также в дыхательных путях, на поверхности кожи и т. п. Для борьбы с биофильмами были сконструированы особые бактериофаги, содержащие ген, кодирующий специальный литический фермент, разрушающий бактериальные полимеры.
Большое число ферментов, сегодня широко использующихся в молекулярной биологии и генетической инженерии, были открыты в результате исследований бактериофагов.
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Фаговый дисплей
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 10 6 –10 14 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
Принципиальная схема процедуры биопеннинга — отбора высокоспецифичных рекомбинантных антител к конкретной мишени-антигену из комбинаторной библиотеки фагового дисплея на основе нитчатых бактериофагов. По: (Тикунова, Морозова, 2009)
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
Так как вирус представляет собой достаточно жесткую конструкцию с определенным соотношением размерностей, это обстоятельство позволяет использовать его для получения пористых наноструктур с известной площадью поверхности и нужным распределением пор в структуре. Как известно, именно площадь поверхности катализатора является критическим параметром, определяющим его эффективность. А существующие на сегодня технологии формирования на поверхности бактериофагов тончайшего слоя металлов и их оксидов позволяют получать катализаторы с чрезвычайно развитой регулярной поверхностью заданной размерности. (Lee et al., 2012).
Нитчатый бактериофаг М13, размножающийся в обычной кишечной палочке (а), может нести на своей поверхности рекомбинантные чужеродные белки, такие как антитела (б) либо пептиды (в). Он также может служить шаблоном для создания наноустройств и наноматериалов, таких как нанокристаллический катализатор с известной площадью поверхности и нужным распределением пор (г)
Путем покрытия нитчатых фагов золотом и двуокисью индия были получены электрохромные материалы — пористые нанопленки, меняющие цвет при изменении электрического поля, способные реагировать на изменение электрического поля в полтора раза быстрее известных аналогов. Подобного рода материалы перспективны для создания энергосберегающих ультратонких экранных устройств (Nam et al., 2012).
На основе комплексов бактериофага М13, двуокиси титана и одностенных углеродных нанотрубок были также созданы материалы для солнечных батарей (Dang et al., 2011).
Последние годы ознаменовались широкими исследованиями бактериофагов, которые находят себе все новые применения не только в терапии, но и в био- и нанотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Литература
1. Бактериофаги: биология и применение / Ред.: Э. Каттер, А. Сулаквелидзе. М.: Научный мир. 2012.
2. Стент Г., Кэлиндар Р. Молекулярная генетика. М.: Мир. 1974. 614 с.
3. Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acta Naturae. 2009. № 3. C. 6–15.
4. Mc Grath S., van Sinderen D. Bacteriophage: Genetics and Molecular Biology. Horizon Scientific Press, 2007.

Бактериофаг – вирус, избирательно поражающий бактериальные клетки [1] .
Содержание:
Состояние вопроса
В ходе длительных исследований достоверно установлено, что антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в клетку бактерии с последующим его размножением внутри ее и лизисом инфицированной клетки. После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления [3] [1] .
Бактериофаги отличаются высокой специфичностью действия в отношении штаммов-хозяев, отсутствием токсичности, не способностью вызывать аллергические реакции и дисбактериоз. Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами [3] [1] .
Несмотря на масштабы накопленного научного материала многие вопросы, касающиеся биологических свойств бактериофагов, требуют дополнительных исследований. В частности не выяснена функция многих продуктов, синтезируемых фагами, нет единой схемы таксономии и морфологической классификации, нет стандартных наборов бактериофагов многих возбудителей, схем и регламента их применения [3] [1] .

Развитие бактериофага в культуре бактерий рода Xanthomonas

Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами. Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками [1] .
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2 [1] .
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры. Все структуры отростка имеют белковую природу. Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм. Длина хвоста, как правило, в 2–4 разабольше диаметра головки [2] [1] .
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид [1] .
Хвост представляет собой белковую полую трубку окруженную чехлом, содержащим сократительные белки. Чехол является продолжением белковой оболочки головки. В основании хвоста находится АТФ-аза, регенерирующая энергию для инъекции генетического материала (сокращения чехла отростка бактериофага). У некоторых вирусов чехол сокращается, обнажая часть стержня. На конце хвоста у многих фагов присутствует базальная пластинка с тонкими длинными нитями, способствующими прикреплению его к бактерии. Кроме того в области базальной пластинки присутствует фермент – бактериофаговый лизоцим, способный разрушать муреин клеточной стенки бактерии [2] [1] .
Морфологические типы
Описание структуры и морфологии бактериофагов приведенное выше соответствует наиболее изученным Т-фагам (типовым фагам). Они составляют группу коли-дизентерийных фагов, включающую 7 представителей: 4 нечетных Т1, ТЗ, Т5 и Т7 и 3 четных Т2, Т4, Т6 [1] .
По форме вирусных частиц фаги делятся на шесть основных морфологических типов:
Содержание:
Состояние вопроса
В ходе длительных исследований достоверно установлено, что антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в клетку бактерии с последующим его размножением внутри ее и лизисом инфицированной клетки. После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления.
Бактериофаги отличаются высокой специфичностью действия в отношении штаммов-хозяев, отсутствием токсичности, не способностью вызывать аллергические реакции и дисбактериоз. Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами.
Несмотря на масштабы накопленного научного материала многие вопросы, касающиеся биологических свойств бактериофагов, требуют дополнительных исследований. В частности не выяснена функция многих продуктов, синтезируемых фагами, нет единой схемы таксономии и морфологической классификации, нет стандартных наборов бактериофагов многих возбудителей, схем и регламента их применения.
Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами. Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками.
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2.
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры.Все структуры отростка имеют белковую природу.Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм.Длина хвоста, как правило,в 2–4 разабольше диаметра головки.
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид.
Хвост представляет собой белковую полую трубку окруженную чехлом, содержащим сократительные белки. Чехол является продолжением белковой оболочки головки. В основании хвоста находится АТФ-аза, регенерирующая энергию для инъекции генетического материала(сокращения чехла отростка бактериофага). У некоторых вирусов чехол сокращается, обнажая часть стержня. На конце хвоста у многих фагов присутствует базальная пластинка с тонкими длинными нитями, способствующими прикреплению его к бактерии. Кроме того в области базальной пластинки присутствует фермент – бактериофаговый лизоцим, способный разрушать муреин клеточной стенки бактерии.
Морфологические типы
Описание структуры и морфологии бактериофагов приведенное выше соответствует наиболее изученным Т-фагам (типовым фагам). Они составляют группу коли-дизентерийных фагов, включающую 7 представителей: 4нечетных Т1, ТЗ, Т5 и Т7 и 3 четных Т2, Т4, Т6.
По форме вирусных частиц фаги делятся на шесть основных морфологических типов:
- Палочковидные или нитевидные.
- Головка без отростка.
- Головка и несколько небольших выступов (отростков).
- Головка и один небольшой короткий отросток.
- Головка и длинный отросток, чехол которого не сокращается.
- Головка и длинный отросток, чехол которого сокращается.
Геномы
Геномы бактериофагов характеризуются большим разнообразием. Объемы геномов варьируют от 20 до 700 kb. Длина большинства фаговых геномов составляет около 50 kb
Длина самого крупного бактериофага (G) равна 670 kb. Это самый крупный из всех вирусных геномов. Его размер в четыре раза превышает самый маленький бактериальный геном.
Встречаются фаги, геном которых сегментирован, но в основном геномы представлены целыми линейными или кольцевыми молекулами нуклеиновых кислот. Большинство изученных бактериофагов имеют двухцепочечную ДНК. Однако обнаружены группы с одноцепочечной ДНК, двухцепочечной и одноцепочечной РНК.
Химический состав
Бактериофаги состоят из нуклеиновой кислоты и белка. Общее количество белка – 50–60%, нуклеиновых кислот – 40–50 %. В составе некоторых фагов имеются ДНК с азотистыми основаниями. Вместо цитозина может присутствовать5-оксиметилцитозин. Внутри головки фага Т2 обнаружен белок с полиамидами в составе. Он способствует суперспирализации ДНК и способствует размещению достаточно длинной ДНК в головке небольшого размера. В частицах многих фагов под чехлом присутствует фермент лизоцим.
Классификация бактериофагов
Современная классификация бактериофагов основана на строении фаговой частицы и характеристике нуклеиновой кислоты. Прежде всего фаги, как и все остальные вирусы, делятся на РНК-содержащие и ДНК-содержащие. В соответствии с Международной классификацией и номенклатурой вирусов в настоящее время из наиболее исследованных бактериофагов выделяют 13 семейств, в том числе: Myoviridae (частица без оболочки с сократительным хвостом, двухцепочечная ДНК линейная),Rudiviridae (частица без оболочки, палочкообразная, двухцепочечная ДНК линейная),Bicaudaviridae (частица без оболочки, лимонообразна, двухцепочечная ДНК кольцевая).
Отдельные семейства объединены в два порядка. Для большинства порядки не определены.
Жизненный цикл
Как указывалось выше, бактериофаги характеризуются специфичностью к определенным видам бактерий. Однако, взаимоотношение между фагами и бактериями сложны и не всегда завершаются лизисом чувствительной к нему клетки и размножением фага.
В зависимости от специфичности различают:
- моновалентные бактериофаги – лизируют культуры бактерий определенного вида;
- типовые бактериофаги – лизируют отдельные штаммы внутри вида;
- поливалентные бактериофаги – вызывают лизис группы родственных видов микробов.
Инфекцию клетки, заканчивающуюся ее гибелью и размножением в ней фага, называют продуктивной.
Главная особенность бактериофагов: размножение происходит только в живых клетках, находящихся в состоянии развития и роста. В мертвых клетках и в продуктах клеточного обмена размножение фагов не происходит.
По характеру взаимодействия с бактериальными клетками различают две группы:
- Вирулентные бактериофаги – всегда лизируют зараженные бактерии и имеют только один путь развития – литический цикл.
- Умеренные бактериофаги – ведут себя двояко: после проникновения в клетку нуклеиновая кислота вируса может быть вовлечена в литический цикл или вступает с клеткой-хозяином в своеобразные симбиотические отношения. Она встраивается в хромосому бактерии и превращается в профаг, передаваясь всему потомству клетки (лизогенный путь). При этом бактерии, содержащие профаг, называют лизогенными бактеиями.
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый путь развития. Период с момента инфицирования клетки до ее лизиса называется латентным периодом. Первая половина латентного периода, когда фаг не удается обнаружить в клетке, называют скрытым периодом. Каждая система бактериофаг – бактерия характеризуются конкретными величинами латентного и скрытого периода. Продолжительность этих периодов зависит от температуры, состава среды и многих других факторов. Продолжительность латентного периода варьирует от 15 минут до 5 часов и более. При низкой температуре она увеличивается.
Реакция на химические и физические факторы
Распространение
Бактериофаги – наиболее многочисленная и широко распространенная в биосфере и скорее всего наиболее эволюционно древняя группа вирусов. Приблизительный размер популяции фагов насчитывает более 10 фаговых частиц. Считается, что на одну бактерию приходится 10 фаговых частиц.
Бактериофаги обнаруживаются в воде, почве, сточных водах, организме человека и животных, в культурах бактерий.Фаги обнаруживаются в тех местах, где распространены чувствительные к ним бактерии.
(c) Справочник AgroXXI
30 до 10 32 фаговых частиц в биосфере, — и играют ключевую роль в поддержании баланса всех исследованных экосистем. Бактериофаги являются естественными регуляторами и борцами с бактериями и обеспечивают динамическое равновесие в природе, сохраняя относительное постоянство микробного пейзажа в природе и ограничивая рост популяции бактерий. Бактериофаги присутствуют даже в нашей пище — ежедневное поедание бактериофагов с пищей, в которой они присутствуют естественным образом, регулирует микробный баланс в организме человека.
Знаменитый ученый Д, Эрелль представил миру бактериофаги как естественные антибактериальные агенты и предложил использовать их для терапии — еще до открытия антибиотиков.
Бактериофаги в препаратах
Возможность исследования фагов в качестве антимикробных агентов в клинике привлекает внимание мирового врачебного и научного сообщества. Быстрое распространение мультирезистентных к антибиотикам штаммов мутантов вредоносных бактерий разожгло интерес научного сообщества к этому методу с почти 100-летней историей.
Современные биотехнологии позволяют использовать бактериофаговую терапию против большинства бактериальных инфекций. На сегодняшний день созданы лекарственные препараты на основе бактериофагов. История массового применения этих препаратов уходит корнями в трагические времена Великой Отечественной Войны (в 1940 году был создан коктейль из нескольких видов бактериофагов, борющихся с бактериями, вызывающими тяжелые раневые инфекции).
Эти препараты спасли жизни тысячам раненных солдат. Подобный опыт позволил сохранить и развить биофармацевтическое производство бактериофагов в России — сегодня наша страна мировой лидер в производстве этих лекарственных антибактериальных препаратов.
Наука и бактериофаги
В 50-90-е годы их использовали просто как очень удобный объект для исследований: многие фундаментальные открытия в молекулярной биологии, такие как генетический код, рекомбинация, репликация нуклеиновой кислоты, были сделаны на примере бактериофагов, потому что их легко культивировать и они продуцируют большое количество нуклеиновой кислоты.
Бактериофаги и фармацевтическая промышленность Запада
В тридцатых годах прошлого века крупный американский концерн основал даже клинику, где начали лечить фагами. Пропагандисты нового метода сулили исцеление от всех болезней. Однако действительность оставляла желать лучшего: научные основы такой терапии были ещё так скудны, что новое средство применяли практически вслепую. Считалось, что все фаги одинаковы и побеждают любую бактерию. Одним и тем же бактериофагом начинали лечить разные заболевания, а болезнь всё не уходила — так метод был серьёзно скомпрометирован. Мнение о малой эффективности фагов задержалось в кругах медиков на многие годы, живёт оно ещё и сегодня.
Недавно появились публикации исследователей из Рокфеллеровского университета в Нью-Йорке об успехах терапии с помощью фагов.
Кому подходят препараты бактериофагов
Препараты бактериофагов подходят для людей различных возрастных категорий, нуждающихся в профилактике и лечении бактериальных инфекций. Бактериофаги показаны даже беременным, кормящим матерям и детям с 0 лет. Ведь применение бактериофагов абсолютно физиологично.
Какие проблемы решают препараты бактериофагов
Эффективная борьба с бактериальными инфекциями
Усиление действия антибиотиков
Уничтожают только вредоносные бактерии
Эффективная замена антибиотикам
Минимум противопоказаний
Бактериофаги могут применяться как внутрь, так и использоваться для наружного применения
Что такое бактериофаги?
Из чего состоит бактериофаг
Преимущества бактериофагов
Бактериофаги – антибактериальные агенты и природные антисептики
Безопасны и не токсичны, побочные эффекты редки, применяются у новорождённых детей, беременных и кормящих женщин
Действие бактериофагов не затрагивает полезную микрофлору организма, в отличие от антибиотиков
Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность
Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри
Бактериофаги выводятся из организма естественным путем
Применение бактериофагов
Сразу после открытия бактериофагов, препараты на их основе стали использовать для борьбы с инфекционными болезнями человека. Однако в результате изобретения антибиотиков и недостатка знаний о бактериофагах их лечебный потенциал не был реализован.
Фаги нашли применение в разных сферах человеческой деятельности, включая био- и нанотехнологии. Например, как простые системы для наработки белков с заданными свойствами или как основа для создания материалов с заданной архитектурой в каталитической химии.
Но все-таки медицина, как и столетие назад, остается главной областью применения этих врагов бактерий. С ростом лекарственной устойчивости бактерий к химическим антибиотикам возросло значение фаготерапии для профилактики и лечения инфекционных болезней человека.
Вирусы (от лат. вирус — яд) – представляют собой мельчайшие неклеточные формы жизни. Вирусы имеют размеры 2-5*10 -7 см, что значительно меньше, чем бактериальная клетка (от 0,2 до 10 мкм). Рассмотреть вирусы возможно только с помощью электронного микроскопа, увеличивающий в 100 тысяч и более раз. Вирусы относятся к отдельному царству.
Вирусология – наука изучающая вирусы. Становление вирусологии как науки начинается с 30-х годов 20 века.
История открытия вирусов
Впервые вирус табачной мозаики (рис.1) был открыт русским ученым Д.И.Ивановским (1892г.) (рис.2).

Рис.1 Листья табака (слева) пораженные вирусом табачной мозаики (справа)
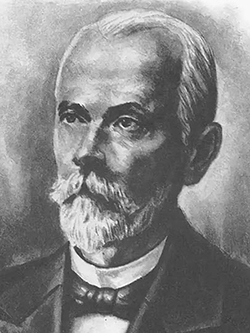
Рис.2 Д.И.Ивановский — первооткрыватель вирусов
Первый вирус животных (вирус ящура) был описан в 1897 году Лёффером и Фрошем. В 1901 году вирус желтой лихорадки был открыт англичанами У. Ридом и Д. Кэрроллом.
В 1917 году Ф.д’Эррелем был открыт бактериофаг – вирус, поражающий бактерии.
Удивительно то, что первая вакцина от оспы была предложена за 100 лет до открытия вирусов, в 1796 году английским врачом Э.Дженнером. Второй по открытию стала – антирабическая вакцина, представленная французским ученым микробиологом Л.Пастером в 1885 году.
Строение и формы вирусов
Вирусы — неклеточные частицы, состоящие из белковой оболочки (капсид) и собственного генетического материала в виде нуклеиновой кислоты (ДНК или РНК) (рис.3).
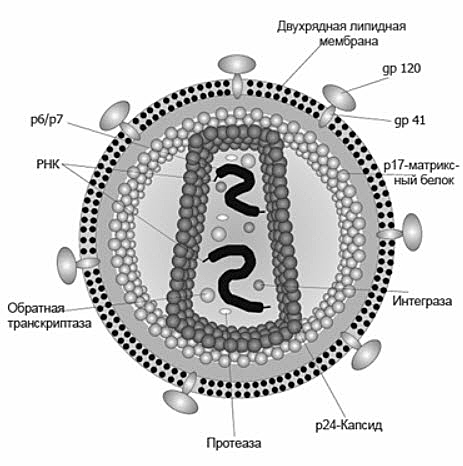
Рис.3 Строение вируса иммунодефицита человека (ВИЧ)
Вирусы могут обладать разнообразными формами: шаровидные, овальные, палочковидные, нитевидные, цилиндры, тетраэдры, октаэдры и др.(рис.4).
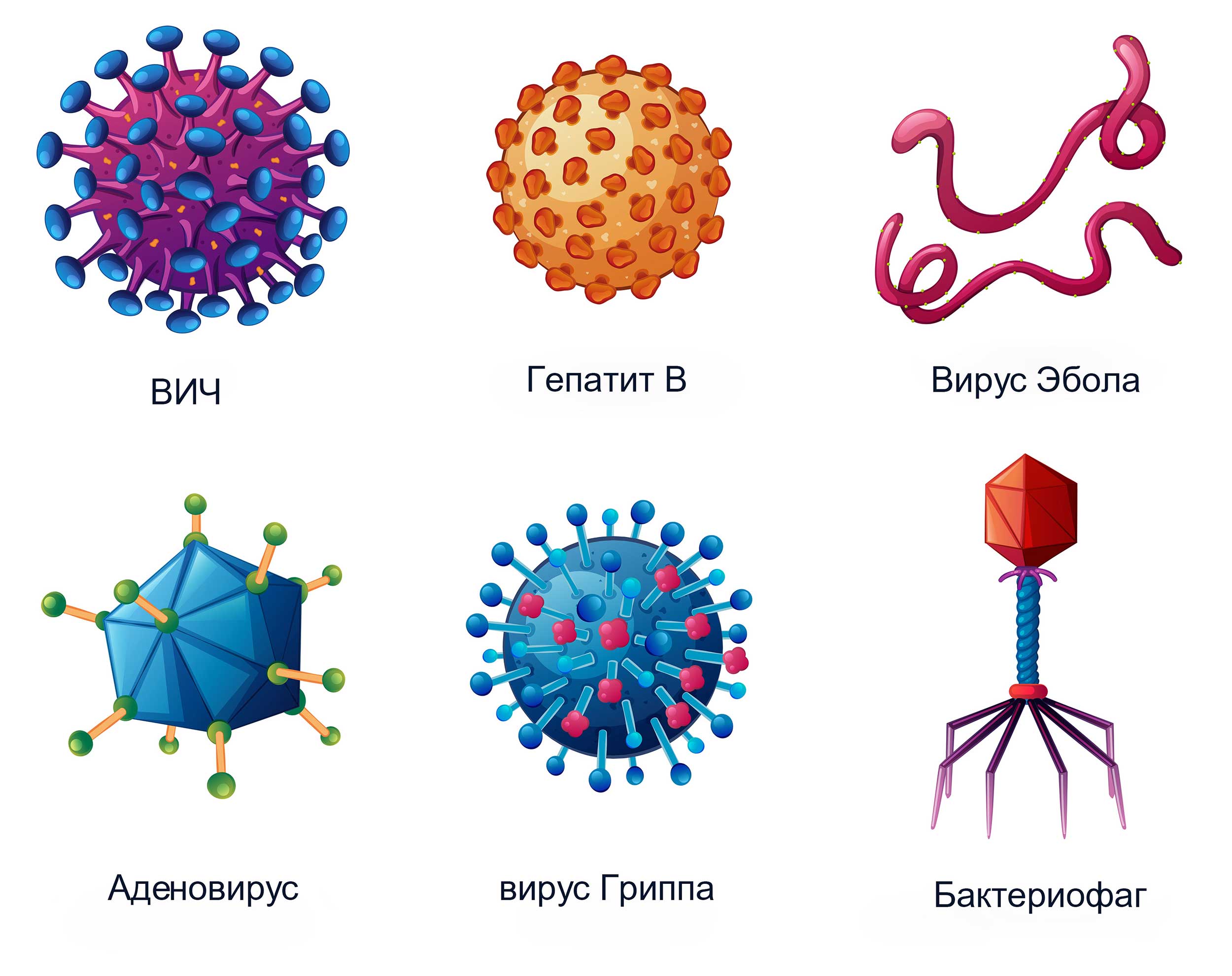
Рис.4 Разнообразные формы и виды вирусов
Более сложные вирусы имеют в своем составе дополнительные белковые или липопротеидные оболочки. Вирусы гриппа и герпеса кроме белковой оболочки могут содержать и углеводы.
| ДНК-содержащие вирусы | РНК-содержащие вирусы |
|---|---|
| оспы | бешенства |
| герпеса | кори |
| бактериофаги Т-группы | СПИДа и лейкоза |
| гепатита В | гепатита А |
| паповавирусы | гриппа |
| аденовирусы | полимиелита |
| цитомегаловирус | ОРЗ |
| Эпштейн-Бара | желтой лихорадки |
| и др. | краснухи и др. |
Геном вирусов может быть представлен однонитчатыми и двунитчатыми молекулами ДНК (вирус оспы человека, овец, свиней, аденовирус человека) и РНК (матрица для вирусов насекомых и других животных). Вирусы с однонитчатой молекулой РНК (энцефалит, краснуха, корь, бешенство, грипп и др.).
Вне живой клетки вирус не питается, не передвигается, не растет, не размножается и не проявляет других свойств живого.
Размножение вирусов
Вирусы способны размножаться только внутри живой клетки. Вирус проникает внутрь клетки путем связывания его с особым протеином – рецептором, расположенным на поверхности клетки. На поверхности чувствительной клетки происходит связывание с рецептором, после чего присоединившейся участок погружается в цитоплазму и превращается в вакуоль. Стенки вакуоли, состоящей из цитоплазматической мембраны способны сливаться с другими вакуолями или даже ядром. В результате вирус достигает любой участок клетки.
Основные этапы заражения вирусом:
Данный процесс до конца не изучен, и возможно именно он мог бы решить вопрос возникновения онкологических заболеваний.
Быстрая способность адаптироваться и видоизменяться, подстраиваясь к геному клетки, делает некоторые вирусные заболевания практически неизлечимыми. Таким образом, вирусы представляют паразитизм на генетическом уровне (рис.5).
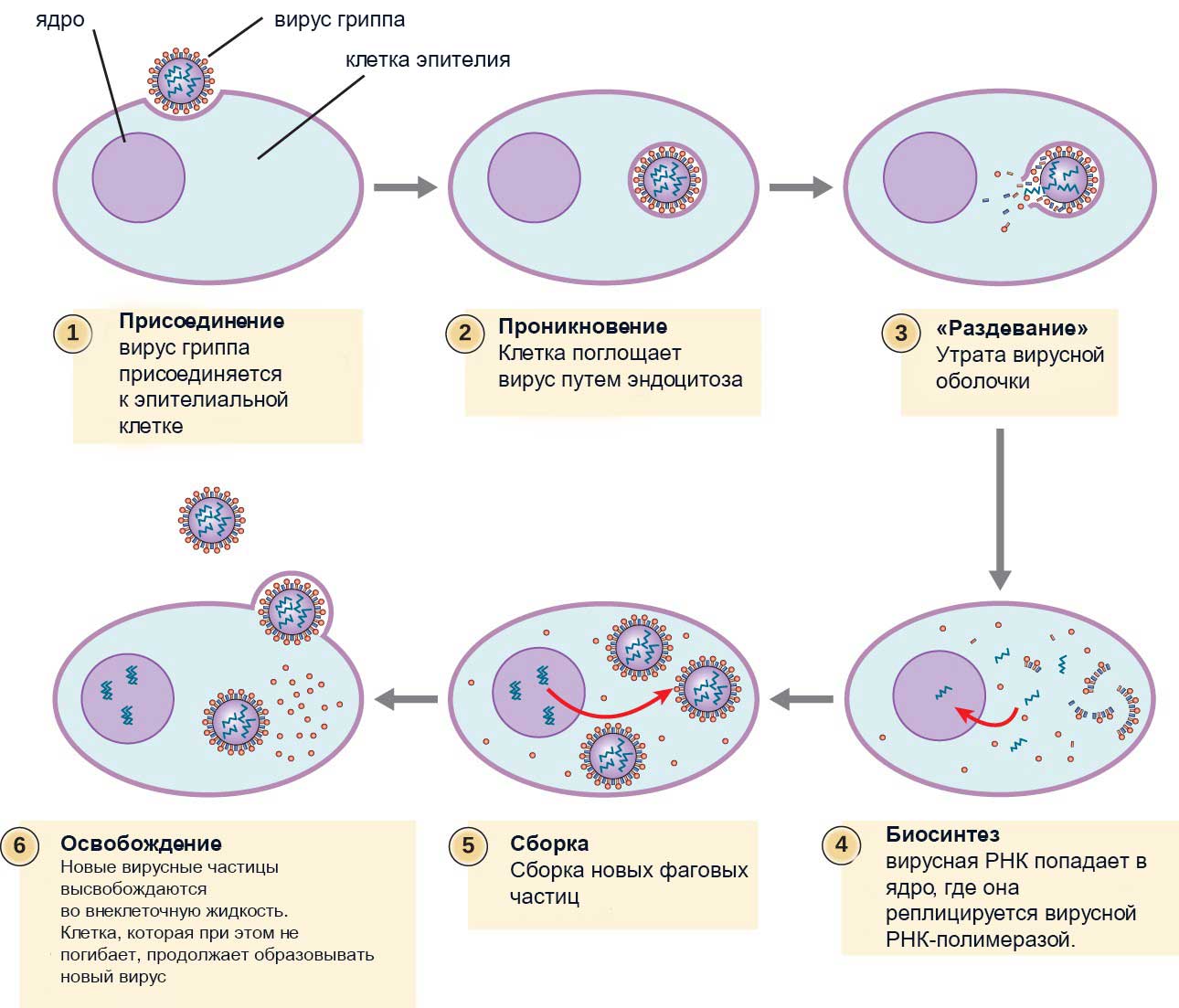
Рис.5 Размножение вируса гриппа
Бактериофаги
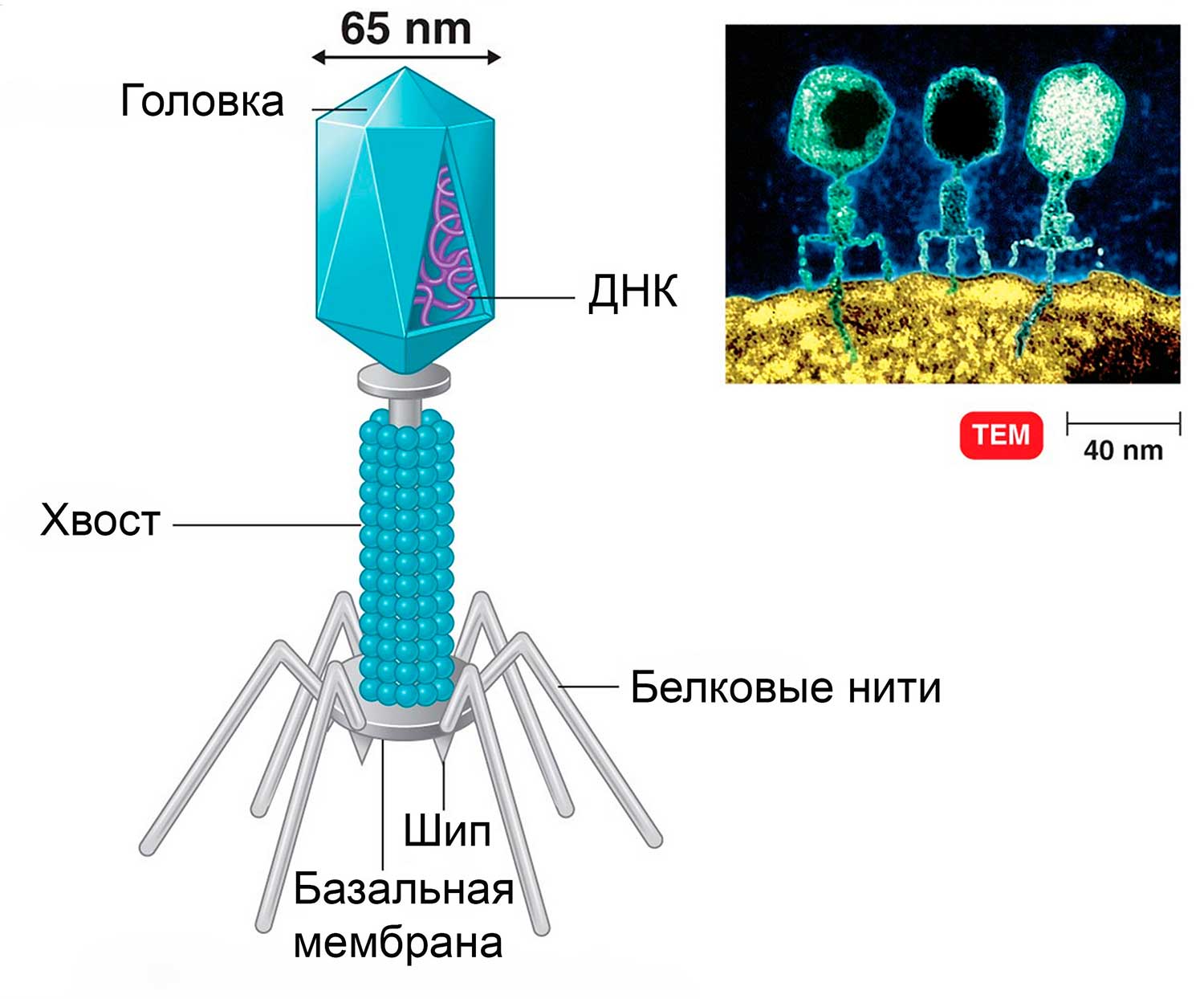
Рис.6 Строение бактериофага
Бактериофаг состоит из головки, хвостика и нескольких хвостовых отростков (белковых нитей). Наружная часть головки покрыта белковой оболочкой. Во внутренней части головки расположена ДНК, а внутри хвоста проходит центральный канал. Из-за толстых клеточных стенок бактерий белок-рецептор бактериофага не может погрузиться в цитоплазму.
Удерживаясь на поверхности клетки за счет шипов, расположенных под базальной мембраной, бактериофаг пронзает стенку бактерии и вводит внутрь полый стержень. По этому стержню в цитоплазму поступает ДНК (или РНК). Геном бактериофага проникает внутрь клетки, а оболочка остается снаружи. Спустя время, сформировавшиеся зрелые фаговые частицы разрушают бактерию изнутри и выходят наружу (рис.7).
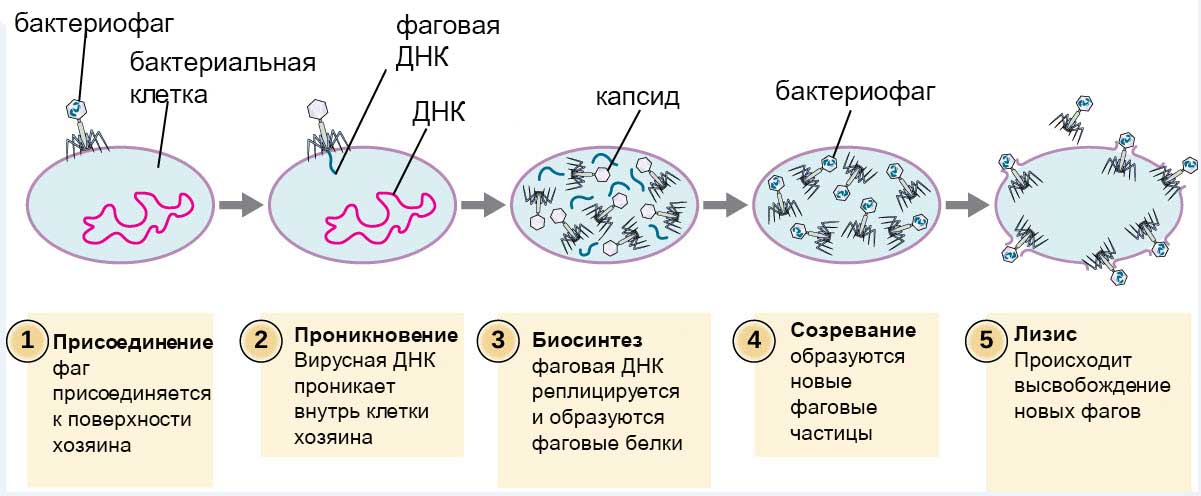
Рис.7 Размножение бактериофага
Обладая способностью полного уничтожения бактериальной клетки, бактериофаги могут быть использованы для лечения разнообразных бактериальных заболеваний (холеры, дизентерии, брюшного тифа и др.).
Отмечено, что отделение от вирусной частицы нуклеиновой кислоты приводит к потере инфекционной способности к репродукции. Это говорит о том, что нуклеиновая кислота играет важную роль в размножении вируса.
При благоприятных условиях вирус очень быстро размножается. Так, за 30 минут в одной клетке появляются сотни новых вирусов.
Вирусы могут продолжительно сохраняться в почве, воде и другим средах. Некоторые представители устойчивы к высоким температурам (свыше +100С) и высушиванию.
Виды вирусных заболеваний
В настоящее время известно около 400 видов вирусов растений и около 500 видов вирусов животных.Вирусы растений вызывают поражение листьев и других органов, вызывая появление разноцветных или бесцветных пятен и полосок. Вирусы вызывают замедление роста растений, изменяет их форму и снижает урожайность.
Наиболее опасными для человека являются вирусы гепатита – А, В, С. Вирус способен сильно повреждать ткани печени, вызвав необратимые последствия.
ВИЧ.СПИД
Более опасную для человечества форму представляет вирус иммунодефицита человека или сокращенно ВИЧ (HIV). Попав в кровь, ВИЧ, поражает иммунную систему человека, приводя к развитию болезни под названием СПИД (синдром приобретенного иммунодефицита человека). РНК-содержащий ВИЧ атакует белые кровяные клетки – лимфоциты, отвечающие за иммунитет, делая человека уязвимым для других болезней.
Внедренный в лимфоциты РНК вирус начинает синтезировать фермент – ревертазу. Этот фермент служит матрицей для последующего синтеза молекулы ДНК. Синтезированная вирусная ДНК встраивается в хромосому лимфоцита. После чего вирус долгое время может не проявлять себя. Это может длиться от 1 до 2 лет, а иногда и более. Спустя время вирусная ДНК начинает проявлять себя, синтезируя сотни тысяч вирусов, что в итоге приводит к разрушению лимфоцита.
Вероятность заражения ВИЧ увеличивается при прямом контакте с кровью больного человека. Распространенные пути передачи вируса; незащищенный половой контакт с инфицированным человеком, инъекции шприцом, переливание крови. ВИЧ не передается воздушно-капельным путем, через укусы насекомых, посуду, при рукопожатиях и пользовании общественными местами (туалеты, бассейны, бани и т.п.).
В настоящее время вакцины против СПИДа нет, но существуют медицинские препараты на основе азотимидина и ингибиторов протеаз, способные подавить синтез вирусной ДНК. Это облегчает течение болезни и значительно удлиняет жизнь человека.
Симптомами СПИДа является температура, постоянный озноб, легкая простужаемость, резкое похудение.
Чтобы предупредить СПИД необходимо соблюдать следующие правила;
— избегать прямого контакта с кровью неизвестного человека (зараженными так же могут быть лимфа, сперма, влагалищные выделения, грудное молоко и др.);
— избегать случайные половые связи;
— использовать презервативы;
— пользоваться одноразовыми шприцами;
— пользоваться личными бритвенными приборами, при этом не разрешать пользоваться своими.
Природным очагом СПИДа по мнению ученых считается Центральная Африка, а носителем вируса являются зеленые мартышки.
Грипп
Всем известный вирус гриппа не менее опасный, наряду с корью, гепатитом и полиомиелитом.
Читайте также:

