Для определения фаготипа культуры стафилококка делают посев
Обновлено: 05.10.2024
Питание является одним из важнейших факторов, определяющих здоровье населения. Правильное питание способствует профилактике заболеваний, повышению работоспособности, создает условия для адекватной адаптации к окружающей среде. Одним из важнейших показателей, характеризующих качество и безопасность продовольственного сырья и продуктов питания, является контаминация их микроорганизмами. Учитывая особую значимость продуктов питания в возникновении острых кишечных инфекционных заболеваний и бактериальных пищевых отравлений, уделяется пристальное внимание мониторингу за микробиологической чистотой продовольственного сырья и пищевых продуктов. Ведущее место в санитарно-бактериологических исследованиях является выполнение исследований продовольственного сырья и пищевых продуктов. Стафилококки – одна из ведущих причин микробных пищевых отравлений. Стафилококки вызывают множество инфекций в организме человека, в том числе поверхностные и глубокие гнойные инфекции, интоксикации, инфекции мочевых путей. Важнейшим патогенным стафилококком является Золотистый стафилококк – Staphylococcus aureus – стойкий, высоковирулентный, легко приобретающий устойчивость к антимикробным препаратам возбудитель инфекции. Staphylococcus aureus является одним из важнейших возбудителей инфекций человека и вызывает более 100 нозологических форм заболеваний. Золотистый стафилококк может размножаться в продуктах питания. Чаще всего, в кондитерских изделиях и молочных продуктах, в мясных изделиях (полуфабрикаты и колбасы), в рыбе (слабосоленая, консервы). Сам микроорганизм не представляет угрозы для человека. Он быстро погибает в желудке под воздействием соляной кислоты. Но в процессе жизнедеятельности золотистый стафилококк выделяет энтеротоксин, который накапливается в продуктах питания. Попадая в желудочно-кишечный тракт, этот токсин вызывает симптомы пищевого отравления.

1. Билетова Н.В., Корнелаева Р.П., Кострикина Л.Г. и др. Под ред. Любашенко и С.Я. Санитарная микробиология. - М.: Пищевая промышленность, 2010 г.
2. Корнелаева Р.П., Степаненко П.П., Павлова Е.В., Санитарная микробиология сырья и продуктов животного происхождения. - М.: 2012 г.
4. ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus.
5. Онищенко Г.Г., Абаев И.В., Дятлов И.А., Скрябин Ю.П. и соавт. Молекулярно- генетическая идентификация штамма Staphylococcus aureus — возбудителя пищевой токсикоинфекции при вспышке в Санкт-Петербурге в 2013 г. // Актуальные вопросы микробиологии. – 2014, № 9-10. – С. 33-34.
6. Пруссова В.Н., Кива М.С., Клименко В.В. Микробиологический мониторинг за пищевыми продуктами по обоснованию сроков годности и условий хранения // Здоровье. Медицинская экология. Наука. 2013. №2-3(52). С. 94-97.
7. Пруссова В.Н., Кива М.С. Микробиологический мониторинг за пищевыми продуктами // Здоровье. Медицинская экология. Наука. 2015. №4(62). С. 142-146.
Основными источниками обсеменения стафилококками пищевых продуктов являются люди и животные с гнойно-воспалительными процессами (абсцессы, фурункулы, гнойные раны и др.), а также носители этих микроорганизмов. Перенос стафилококков от людей на пищевые продукты может происходить воздушно-капельным путем, при непосредственном контакте людей с продуктами, оборудованием, в процессе убоя скота и разделки туш.
Чаще всего причиной стафилококковых токсикозов является употребление молока, мяса и мясных изделий, кондитерских изделий с заварным кремом и др., контаминированных патогенными стафилококками. Органолептические свойства продуктов, в которых размножаются стафилококки и накапливаются энтеротоксины, не изменяются [2].
Энтеротоксигенные стафилококки размножаются в пищевых продуктах даже при содержании в них около 40% влаги. Они могут развиваться в продуктах, содержащих от 7% до 12% хлорида натрия. Сахар угнетает развитие стафилококков при концентрациях 30–40%. Некоторые микроорганизмы (В. сеreus, дрожжи из рода Саndidа и др.) оказывают на стафилококки стимулирующий эффект (они усиливают образование энтеротоксина).
Энтеротоксин стафилококков обладает высокой термоустойчивостью. Инактивирование (разрушение) токсина происходит только через 2,5–3 часа кипячения. При автоклавировании (120°С) токсин разрушается через 20 мин. При благоприятных температурных условиях энтеропатогенные стафилококки быстро размножаются в продуктах и продуцируют токсин. Пищевые токсикозы, вызванные энтеропатогенными стафилококками, протекают в форме острого гастроэнтерита, сопровождающегося рвотой, реже диареей, головной болью. Инкубационный период очень короткий – от 30 мин до 6 ч. Длится заболевание один, реже – два, три дня [1].
Выявление и определение количества этих микроорганизмов в пищевых продуктах проводят в соответствии с ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus.
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды [4].
Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus.
При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам.
Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду [6].
Перед посевом анаэробные условия в среде создают кипячением при (100±1) °С в течение 15 мин, наслоением агара или парафина в каждую пробирку после посева, а также с помощью альтернативной процедуры - инкубирования пробирок в емкости или инкубаторе в анаэробных условиях.
Пробирки с посевами инкубируют при температуре 37 °С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков на Жиолитти-Кантони бульоне определяется по редукции теллурита калия, а на глюкозном или солевом бульоне - по помутнению среды [3].
Поверхность одной из агаризованных селективно-диагностических сред (Байрд-Паркер агара, молочно-солевого, яично-желточно-азидного, яично-желточно-солевого агара, агара с кроличьей плазмой и бычьим фибриногеном), инокулируют из предположительно положительных пробирок после 24 ч и все оставшееся пробирки после 48 ч.
Чашки Петри с посевами инкубируют при температуре 37°С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков определяется по редукции теллурита калия и яично-желточной реакции (лецитиназной активности) [7].
На агаре с кроличьей плазмой и бычьим фибриногеном после инкубирования присутствие коагулазоположительных стафилококков определяется по типичным колониям, показавшим специфичную реакцию (бычий фибриноген/кроличья плазма).
Подтверждение принадлежности типичных и (или) атипичных колоний к коагулазоположительным стафилококкам проводят по изучению отношения выявленных микроорганизмов к окраске по Граму, определению присутствия у них каталазы и коагулазы.
Подтверждение принадлежности коагулазоположительных стафилококков к S. aureus проводят по определению образования ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. Результаты выявления коагулазоположительных стафилококков и S. aureus выражают: "обнаружены" или "не обнаружены"[5].
Метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus. Навески продукта и (или) серию разведений навески продукта вносят в жидкую селективную питательную среду. Наиболее вероятное число коагулазоположительных стафилококков и S. aureus в 1 см или в 1 г продукта определяют для подтвержденных посевов, пользуясь НВЧ-таблицей по ГОСТ 26670.
Методы определения количества коагулазоположительных стафилококков и S. aureus посевом на (в) агаризованные селективно-диагностические среды основаны на высеве навески продукта и/или разведения навески продукта на (в) агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных и (или) атипичных колоний, подтверждении по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus [4].
Проводят посев определенного количества жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции на (в) агаризованную селективно-диагностическую питательную среду на две параллельные чашки Петри. Аналогично проводят посев десятикратных разведений испытуемого продукта. Посевы в чашках Петри инкубируют при температуре 37 °С в течение 24-48 ч.
При посеве в (на) агаризованную среду с кроличьей плазмой и бычьим фибриногеном определяют только типичные колонии и без подтверждения по биохимическим признакам их относят к коагулазоположительным стафилококкам.
При выявлении коагулазоположительных стафилококков в определенной навеске исследуемого продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред [6,7].
Перед использованием Жиолитти-Кантони бульон прогревают кипячением при (100±1) °С в течение 15 мин для удаления воздуха. Охлаждают до 44 °С - 47 °С и с соблюдением правил асептики прибавляют раствор теллурита калия.
Соотношение между количеством высеваемого продукта или его разведением и питательной средой нормальной концентрации 1:10. При использовании среды двойной концентрации соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:1 [3].
Если при последующем подтверждении принадлежности коагулазоположительных стафилококков к S. aureus не определяют наличие термостабильной нуклеазы и гемолитической активности, то допускается проводить посев в Жиолитти-Кантони бульон без прогрева перед посевом и без наслаивания голодного агара или парафина после посева.
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Если появилось почернение или черный осадок в Жиолитти-Кантони бульоне или помутнение в солевом или сахарном бульоне, то проводят подтверждение принадлежности выросших микроорганизмов к коагулазоположительным стафилококкам. Если почернения, черного осадка или помутнения нет, то посевы инкубируют еще (24±2) ч [2].
Для получения изолированных колоний стерильной петлей делают пересевы культур из каждого посева на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркер агара, Байрд-Паркер агара с кроличьей плазмой и бычьим фибриногеном, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Пересевы проводят также из пробирок, в которых нет видимых признаков роста.
Чашки Петри с пересевами инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч или (48±2) ч. После 24 ч инкубирования чашек Петри по отмечают на дне чашек присутствие типичных и атипичных для коагулазоположительных стафилококков колоний [1].
На Байрд-Паркер агаре после инкубирования в течение 24 ч коагулазоположительные стафилококки образуют типичные колонии черного или серого цвета, блестящие и выпуклые, окруженные прозрачной зоной, диаметр колоний около 1,0-1,5 мм и до 1,5-2,5 мм после инкубирования в течение 48 ч. После инкубирования в течение 24 ч непосредственно около колонии в прозрачной зоне может появиться опалесцирующее кольцо, окружающее колонию.
Принадлежность выявленных коагулазоположительных стафилококков к S. aureus проводят по определению их способности образовывать ацетоин и ферментировать мальтозу в аэробных условиях [5].
Определение образования ацетоина (реакция Фогес-Проскауера). Культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. После инкубирования посевов к 1 см отобранной культуральной жидкости прибавляют 0,6 см раствора - нафтола и 0,2 см раствора гидроокиси калия. Появление розового окрашивания через 15-60 мин указывает на положительную реакцию. S. aureus образует ацетоин.
Определение ферментации мальтозы в аэробных условиях. Способность ферментации мальтозы в аэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus. Для определения ферментации мальтозы в аэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. При ферментации мальтозы в аэробных условиях с образованием кислоты цвет среды Гисса изменяется. S. aureus ферментирует мальтозу в аэробных условиях [4].
Оценка результатов посевов в жидкие среды. При определении НВЧ коагулазоположительных стафилококков или S. aureus или при их выявлении в определенной навеске продукта посевы считают положительными (то есть коагулазоположительные стафилококки или S. aureus выявлены в испытуемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении типичных и (или) атипичных колоний, выросших на этих средах, хотя бы в одной колонии будут обнаружены коагулазоположительные стафилококки или S. aureus [6].
Результаты выявления коагулазоположительных стафилококков или S. aureus записывают: обнаружены (не обнаружены) в 1 г (см3) продукта; масса или объем продукта, в котором выявляли коагулазоположительные стафилококки или S. aureus.
Определение фаготипа проводится с помощью специальных наборов типовых фагов и является одним из методов внутривидовой дифференциации бактерий.
1. Помощь эпидемиологу в выявлении источников и путей циркуляции инфекции при внутрибольничном заражении;
2. Для идентификации микроба.
Определение фаготипа стафилококка проводят при помощи фагов, разведенных до тест- разведения, обозначенного на этикетке. Каплю 4-х часовой бульонной культуры распределяют на поверхности подсушенного агара в чашке Петри. Дно чашки расчерчивают на 22 квадрата по числу фагов, затем капают фаги по одному в каждый квадрат. Посев инкубируют в термостате 18 часов при температуре 37 о С. На 2-й день проводят учёт результатов; фаготип культуры соответствует тому фагу, который в тест-разведении вызывает её полный лизис. В зависимости от чувствительности культуры к фагу наблюдается разная степень лизиса:
+ + + - сливной лизис с вторичным ростом
+ + - более 50 негативных колоний (стерильных пятен)
+ - единичные негативные колонии (стерильные пятна)
Также проводится фаготипирование брюшнотифозных (44 типа) и паратифозных бактерий (15 типов), энтеропатогенных эшерихий (24 типа).
Реакция фаголизиса.
Реакция фаголизиса ставится для идентификации возбудителя дизентерии.
1) чистая культура шигелл на скошенном агаре;
3) дизентерийный бактериофаг
1) Проверка культуры шигелл на чистоту (окраска по Граму);
2) Посев в 2 пробирки с МПБ
Иммуноферментный анализ (ИФА)
1. Полистироловый планшет;
2. Антитела к HbsAg;
3. Конъюгат – мышиные моноклониальные антитела, меченые пероксидазой;
4. Контрольные сыворотки;
5. Фосфатно-солевой буфер;
6. Ортофенилдиамин (ОФД).
Реакция протекает в две фазы. HbsAg связывается с гомологичными антителами, меченными пероксидазой. Затем ставят цветную реакцию с использованием ОФД, происходит желтое окрашивание.
Учет ИФА – по оптической плотности с помощью фотометра, при этом степень оптической плотности будет обратно пропорциональна концентрации HbsAg антигена вируса гепатита В.
Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция имитирует естественную репликацию ДНК и позволяет обнаружить единственную молекулу ДНК в присутствии других молекул.
Суть метода заключается в размножении в пробирке определенных участков ДНК в процессе повторяющихся температурных циклов. На каждом цикле вновь синтезированные молекулы копируются ДНК-полимеразой. Благодаря этому происходит многократное удвоение специфических фрагментов ДНК. Термостабильная ДНК-полимераза, полученная из термофильных бактерий, служит катализатором ПЦР.
В ПЦР участвуют праймеры – две искусственно синтезированные молекулы ДНК, которые комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента. Синтез протекает только между праймерами, и количество копий фрагмента удваивается.
Этапы цикла амплификации:
1. Денатурация ДНК при t=95 о С 1 мин.
2. Отжиг (присоединение) праймеров, t=50-65 о С 1-2 мин.
3. Синтез фрагмента ДНК, t=72 о С 1-3 мин.
Продукты синтеза первого цикла амплификации служат матрицей для второго цикла, а продукты синтеза второго цикла – матрицей для третьего цикла амплификации. Цикл амплификации проводится в термо-циклере или амплификаторе. За 30 циклов амплификации образуется 10 копий специфического фрагмента.
1) высокая чувствительность и специфичность;
3) возможность диагностики внутриклеточных паразитов и персистирующих микроорганизмов;
4) использование клинического материала, взятого от больного.
Реакция иммунофлюоресценции (РИФ)
Использование при диагностике гриппа
Реакция относится к серологическим реакциям с участием меченых антигенов или антител.
Проводится прямым и непрямым методами.
При прямом методе обнаруживают антиген в материале от больного. Используется диагностическая флюоресцирующая сыворотка, которая содержит иммуноглобулины, выделенные из иммунных сывороток и меченные флюорохромами.
Специфический антиген обнаруживается в виде ярко-зеленых люминесцирующих конгломератов, а фон препарата окрашивается в оранжево-красный цвет.
Компоненты реакции прямой иммунофлюоресценции:
Для поиска антигена при экспресс-диагностике:
1) исследуемый материал;
2) специфическая люминесцентная сыворотка;
3) люминесцентный микроскоп.
При диагностике гриппа проводят дифференциацию от возбудителей парагриппа и аденовирусной инфекции. Носоглоточный мазок обрабатывают флюоресцирующей гриппозной сывороткой или гриппозным иммуноглобулином.
Компоненты реакции непрямой иммунофлюоресценции
Для поиска антигена при экспресс-диагностике:
1) исследуемый материал (антиген);
2) специфическая сыворотка;
3) антиглобулиновая люминесцентная сыворотка
4) люминесцентный микроскоп.
I фаза специфическая
Сывороточные антитела адсорбируются на антигене.
II фаза неспецифическая
Используется антиглобулиновая сыворотка с антителами, меченными флюорохромами. Образуется комплекс антиген+антитело (I) + антиглобулиновая сыворотка (II), который светится.
32. РПГА для определения напряженности противодифтерийного поствакцинального иммунитета
Антитоксический противодифтерийный иммунитет проверяют с помощью РПГА с дифтерийным эритроцитарным диагностикумом (анатоксином).
Неимунными считаются лица с титром антитоксина менее 0,03 МЕ/мг
1. Испытуемая сыворотка, адсорбированная бараньими эритроцитами;
2. Эритроцтарный диагностикум;
3. Физиологический раствор;
4. Противодифтерийная контрольная сыворотка активностью 10 МЕ.
1) Сыворотку разводят физиологическим раствором в 12 лунках от 1:10 до 1:20480 (1:40-1:5120)
2) В каждую лунку добавляют по 1 капле диагностикума;
3) Противодифтерийную контрольную сыворотку разводят также от 1:10 до 1:20480 и вносят по 1 капле диагностикума;
4) Оставляют на 3 часа при комнатной температуре.
Расчет активности: Х=-----------, где
Х – активность испытуемой сыворотки;
10 – титр контрольной сыворотки;
А – максимальное разведение испытуемой сыворотки с положительным результатом;
В – максимальное разведение контрольной сыворотки с положительным результатом.
Реакция флокуляции
Протекает in vitro (в пробирке) при эквивалентном соотношении антигена и антитела. Сопровождается помутнением и выпадением осадка. Феномен флокуляции используют:
- для определения флоккулирующей активности токсинов;
- для титрования антитоксических сывороток.
Например, при дифтерии используется реакция флокуляции с дифтерийным анатоксином. В пробирке, где количество сыворотки и анатоксина эквивалентно, выпадают нежные хлопья. Количество анатоксина, дающее в смеси 1 АЕ сыворотки инициальную флокуляцию, называется 1 иммуногенной единицей анатоксина (1 ИЕ).
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Автор: Трубачева Е.С., врач – клинический фармаколог
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
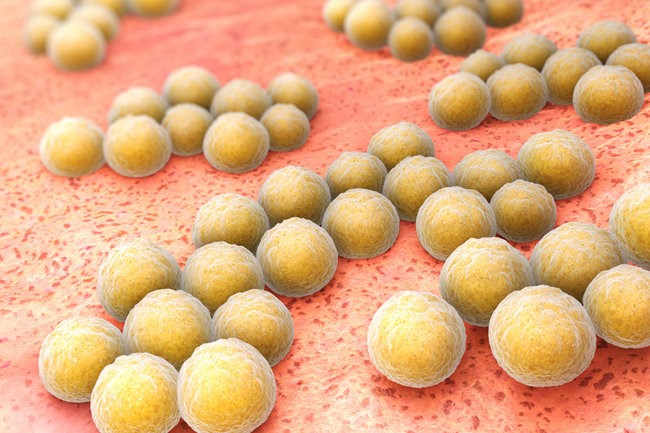
Сначала повторим общеизвестные факты: S.aureus относится к грамположительным коккам и являются чуть ли не основной причиной большого количества инфекций кожи и мягких тканей, а так же ведущей причиной послеоперационных раневых инфекций.
Выделяют следующие разновидности золотистого стафилококка:
- Дикий S.aureus
- MSSA – метициллин-чувствительные стафилококки
- MRSA – метициллин-резистентные, которые обладают устойчивостью ко всему бета-лактамному ряду, сохраняя клинически важную чувствительность к ванкомицину, линезолиду и тигециклину
- VRSA и VISA – ванкомицин-устойчивые штаммы, к счастью, крайне редко встречающиеся и в основном наблюдающиеся в отделениях онкогематологии научно-исследовательских центров у пациентов, проходящих курс полихимиотерапии с последующей трансплантацией костного мозга
И сейчас обсудим первые три более подробно, так как именно они являются той причиной, ради которой повторно поднята данная тема, в том числе и по просьбам читателей (за что выражаем отдельную признательность).
Первое, что необходимо не просто запомнить, а буквально зазубрить наизусть – золотистый стафилококк, он же S.aureus, является нормальным жителем на неповрежденной коже и слизистых оболочках. Еще раз – нормальным, но только на неповрежденной коже и вне зависимости от антибиотикочувствительности пойманных экземпляров. Если кожа по тем или иным причинам поражается (например, сахарным диабетом) или повреждается, стафилококк тут же из милого соседа превращается в злейшего врага. Все как у людей – стоит дать слабину, и ближайшие соседи начнут добивать с ласковой улыбкой.
Таким образом, когда вы получаете результат микробиологического исследования образца, взятого с кожи (или из носоглотки), и видите там золотистого стафа, то должны понимать, кто перед вами, и насколько этот кто-то имеет отношение к текущему процессу.
Второе: если клиника отсутствует, а стафилококк посеялся, надо сделать что? Правильно, повторить посев еще раз. Золотистый стафилококк – это один из немногих микробов, чье наличие в отделяемом материале надо проверять дважды. Единственное исключение – это кровь, взятая непосредственно из сосудистого русла, чаще всего из вены. Наличие стафилококка в крови является поводом к немедленному назначению антибактериальной терапии, так как прямо указывает на наличие инфекции кровотока, а уж какого она генеза, спонтанного или ятрогенного, разбираться будете позже. Во всех остальных ситуациях проводится пересев с тщательным соблюдением техники забора материала (со стенок раны, а не гной, состоящий из дохлых нейтрофилов и нападавших сверху стафилококков) и правил асептики и антисептики, чтобы собственными стафилококками с кожи вновь забранный материал не контаминировать.
Чтобы понять, друг перед нами или враг, познакомимся со стафилококками более подробно.
- Дикий S.aureus, не видавший ни одного антибиотика, выглядит так
.jpg)
.jpg)
И нет, автор не сошла с ума – резистентность к ванкомицину у природных диких золотистых стафилококков – совершенно нормальное явление. Более того, попытка лечить такого возбудителя ванкомицином считается грубейшей ошибкой и закончится полным провалом в силу природной устойчивости к данному препарату. Это третье, о чем помнить необходимо.
Где мы встречаем таких S.aureus чаще всего? В носоглотках грудных младенцев или в их же кале, если придумали посеять. Почему? Потому что это представитель нормальной микрофлоры кожи, и ребенок сглатывает то, что живет в его носоглотке или слизывает с кожи матери. Надо лечить? В данной ситуации – ни в коем случае, иначе побьете нормальную микрофлору кожи и слизистых, и если очень повезет, то для ребенка это пройдет без последствий, но, скорее всего, получим стафилококка, вооруженного пенициллиназами, или MSSA. Повторимся еще раз – только в случае отсутствия клинической картины можно принимать такого рода решения. Во всех иных случаях необходима антибактериальная терапия, причем на длительный (до 28 суток) период времени.
.jpg)
.jpg)
При каких состояниях мы можем увидеть подобных возбудителей?
- Практически при всех инфекциях кожи и мягких тканей
- При внутрибольничных раневых инфекциях
- При диабетической стопе
- У внутривенных наркоманов
Типичным для клинической картины будет довольно агрессивное течение заболевания с яркими клиническими проявлениями ввиду того, что именно такой вид стафилококка обладает определенным набором ферментов, очень быстро расплавляющим окружающие ткани с образованием полостей и большим количеством гнойного отделяемого.
на антибиотикограмме будет выглядеть приблизительно так, оксациллин-резистентный, но ванкомицин-чувствительный (хотя при таком значении МПК уже возможны варианты)
.jpg)
Когда встречается? Все многообразие ятрогенных ВБИ к вашим услугам – почти все раневые инфекции и послеоперационные гнойные осложнения вне зависимости от их локализации. Повторимся в очередной раз – руки надо мыть, и мыть правильно. А еще закрывать маской не только рот, но и нос всем, кто хоть как-то касается открытых ран вне зависимости от причин их образования, так как стоит ране появиться, как стафилококк мгновенно превращается в зверя, осложняющего течение любого послеоперационного периода, особенно после операций, связанных с установками импланта. Более подробно о лечении предлагаем почитать в первой статье.
- В последнем пункте автор, по идее, должна была бы предложить испугаться самыми страшными ванкомицин-резистентными стафилококками и предложить схватиться за голову, но глядя на следующий набор антибиотикограмм, мы предлагаем посмотреть на то, что обычно сваливается с рук медицинского персонала в раны пациентов или контаминирует их биологический материал, который собран или хранится неправильно. Слава микробиологии, что подобные возбудители для пациентов, которые сохранили хоть какие-то остатки неспецифического иммунитета, не опасны, так как проходя эволюционные пути борьбы с ванкомицином, они почти полностью теряют факторы вирулентности. Но так как такие находки – это будни любой микробиологической лаборатории, то и вы о них тоже должны иметь представление. Уточним еще раз – это результаты посевов при полном отсутствии клинической картины бактериальной инфекции.
.jpg)
.jpg)
.jpg)
.jpg)
А теперь, тихо-тихо прошепчем, что иногда так может выглядеть приболевший микробиологический анализатор, который все, что в него не поставят, может определять как подобную страшную зверюгу. Хотя у вашего анализатора может быть какая-то своя болячка, и эти болячки лучше все-таки знать. Именно такого рода антибиотикограммы, как ничто другое наглядно показывают необходимость развития клинического мышления для умения отличать истинного возбудителя от контаминанта или нормального жителя человеческого организма, а также необходимости понимания, как работают методы микробиологической диагностики и варианты их ограничения.
Подведем краткие итоги нынешнего разговора:
- Стафилококк на неповрежденной коже и в носоглотке является нормальным представителем микромира, и лечить его не надо, более того, это может наносить прямой вред (как минимум кошельку)
- Существует целый перечень профессий, где носительство стафилококка строго нежелательно, и именно для этого проводятся контролирующие посевы среди медицинского персонала и работников пищевой отрасли
- Необходимо уверенно различать не только дикие и внутрибольничные штаммы, но и градацию по MRSA и MSSA, так как это прямо влияет на решение о применении конкретных препаратов при проведении эрадикационной терапии
- Антибиотикотерапия стафилококковых инфекций должна быть длительной, а не прерываться через 7-10 дней, даже если пациент демонстрирует положительную динамику. Недобитые золотистые стафилококки умеют метастазировать. Более подробно смотрим предыдущую статью
- Так как S.aureus занимает одно из ведущих мест в структуре внутрибольничных инфекций, особенно связанных с установкой имплантов, правила асептики и антисептики при работе с оными должны соблюдаться максимально жестко, иначе можно повторить дело Хабаровского кардиоцентра
Диагностика и санация стафилококковых бактерионосителей
Главный государственный санитарный врач Российской Федерации - Первый заместитель Министра здравоохранения Российской Федерации Г.Г.Онищенко 6 апреля 2001 г.
В методических рекомендациях представлена принципиально новая схема лабораторной диагностики стафилококковых бактерионосителей: цитоскопический метод выявления бактерионосителей стафилококков; питательная среда, позволяющая выделять стафилококки с персистентными свойствами; способ дифференциации стафилококковой микрофлоры, основанный на определении у штаммов, выделенных от бактерионосителей, факторов персистенции; предложены новые средства санации: масляный раствор витамина А, микроклимат спелеошахты, препарат электролизного водного раствора гипохлорита натрия.
Методические рекомендации предназначены для бактериологов, эпидемиологов, инфекционистов и врачей других специальностей.
Рекомендации разработаны сотрудниками Оренбургской государственной медицинской академии и Оренбургского института клеточного и внутриклеточного симбиоза УрО РАН (член-корреспондент РАН и РАМН, профессор О.В.Бухарин; профессор Б.Я.Усвяцов, доктор биологических наук О.Л.Карташова, кандидат биологических наук С.Б.Киргизова, кандидат медицинских наук Л.И.Паршута).
Введение
Настоящие методические рекомендации посвящены проблеме профилактики стафилококкового бактерионосительства.
В этиологической структуре внутрибольничных инфекций, возникающих в акушерских и хирургических стационарах, большая роль принадлежит стафилококкам. Основным источником гнойной стафилококковой инфекции являются бактерионосители.
Работами сотрудников Оренбургской медицинской академии и Института клеточного и внутриклеточного симбиоза УрО РАН (1989-1997) установлено, что факторы персистенции стафилококков (антилизоцимная, антиинтерфероновая, антикомплементарная активности), направленные на инактивацию защитных механизмов хозяина, обеспечивают длительное переживание бактерий и создают основу резидентного бактерионосительства.
В представленных методических рекомендациях предлагаются новые подходы к профилактике стафилококковых инфекций, включающие: цитоскопический метод выявления бактерионосителей; питательную среду, позволяющую избирательно выделять стафилококки с персистентными свойствами; способ дифференциации резидентной и транзиторной стафилококковой микрофлоры, основанный на определении факторов персистенции у штаммов, выделенных от бактерионосителей.
Учитывая то обстоятельство, что подавление персистирующих свойств возбудителя затрудняет его паразитирование и тем самым повышает эффективность лекарственных воздействий, разработаны эффективные способы санации через снижение персистентных характеристик стафилококка.
Апробация предлагаемых методик в лечебно-профилактических учреждениях города показала их преимущество по сравнению с классическими методами профилактики.
Приоритетность способов диагностики и санации стафилококковых бактерионосителей подтверждена 2 авторскими свидетельствами и 4 патентами РФ на изобретения.
Диагностика стафилококковых бактерионосителей
Предлагаемый метод диагностики стафилококкового бактерионосительства отличается от существующих принципиально новой схемой исследования, включающей в себя: цитоскопический метод выявления бактерионосителей стафилококков; посев на питательную среду, позволяющую избирательно выделять стафилококки с персистентными свойствами (патент РФ N 2088668 "Питательная среда для выделения стафилококков с персистентными характеристиками"); способ дифференциации резидентной и транзиторной стафилококковой микрофлоры, основанный на определении факторов персистенции у штаммов, выделенных от бактерионосителей.
Цитоскопический метод
1. Реактивы, приборы, стекло
1.1. Среда-199 - официнальная среда для сохранения культуры клеток, производится в Свердловском НИИ вирусных инфекций.
1.2. Пробирки, ГОСТ 10515*, диаметр 15 мм, высота 145-150 мм
* На территории Российской Федерации документ не действует. Действует ГОСТ 25336-82, здесь и далее по тексту. - Примечание изготовителя базы данных.
1.4. Пастеровские пипетки
1.5. Предметное стекло
1.7. Ватный тампон, укрепленный на проволоке
2. Метод заключается в следующем:
2.1. Исследуемый материал (клетки эпителия слизистой оболочки переднего отдела носа) забирают с помощью стерильных ватных тампонов, смоченных в физиологическом растворе.
2.2. Тампон погружают в стерильную пробирку с 1,0 мл среды-199, встряхивают в течение 15 минут, тампон отжимают о стенки пробирки и удаляют.
2.3. Содержимое пробирки инкубируют в течение 1-2 часов при 37 °С в термостате (для сохранения жизнеспособности эпителиальных клеток и размножения в них стафилококков).
2.4. Верхний слой жидкости удаляют при помощи пастеровской пипетки, из осадка делают мазок на чистое, хорошо обезжиренное стекло (стекла обезжиривают при помощи смеси Никифорова).
2.5. После подсыхания мазок фиксируют метанолом в течение 5 минут и окрашивают одним из принятых методов (синькой Мансона, по Романовскому-Гимзе и др.).
2.6. При микроскопии мазков просматривают не менее 30 эпителиальных клеток (учитывают клетки с хорошо видимым ядром). В том случае, если обнаруживают 5 и более клеток, содержащих микроколонии стафилококков (группа из 4 и более кокков), то делают заключение о резидентном бактерионосительстве.
2.7. Для уточнения видовой характеристики стафилококков проводят бактериологическое исследование.
Бактериологический метод
А. Выделение чистой культуры стафилококка с персистентными свойствами путем посева на элективную питательную среду с фузидином
1. Реактивы, приборы, стекло
* На территории Российской Федерации документ не действует. Действует ГОСТ 25336-82, здесь и далее по тексту. - Примечание изготовителя базы данных.
1.2. Натрий хлористый, ГОСТ 4233-77 (Михайловский завод химреактивов)
1.3. Куриное яйцо
1.4. Фузидин-натрий-натриевая соль фузидиевой кислоты (Пензенский комбинат медицинских препаратов "Биосинтез")
1.5. Питательный агар для культивирования микроорганизмов, сухой, код ОКП 93 8511 0197 ФС 42-188 ВС-88 (НПО "Питательные среды", Махачкала)
1.6. Физиологический раствор (9 г NaCl на 1 л воды)
1.7. Ватный тампон, укрепленный на проволоке
2. Элективная питательная среда (приготовление и посев)
2.1. Приготовление элективной среды: к 850 мл расплавленного мясо-пептонного агара добавляют 85 мл NaCl, затем среду стерилизуют, остужают до 50 градусов и добавляют 150 г желточной взвеси (желток асептически извлекают из яйца, взбалтывают с 200 мл изотонического раствора хлорида натрия). Перед заливкой чашек Петри во флаконы вносят 0,0002 г/л антибиотика фузидина. Все тщательно перемешивают, готовую среду разливают в стерильные чашки, подсушивают в термостате при 37 °С в течение 10 минут.
2.2. На поверхность среды засевают исследуемый материал (клетки эпителия слизистой оболочки носа), который забирают с помощью стерильных ватных тампонов, смоченных в физиологическом растворе, и учитывают результаты через 24 часа инкубации в термостате при 37 °С.
2.3. Рост колоний на данной среде позволяет отнести бактерионосителя к резидентному типу, т.к. имеет место преимущественный рост стафилококка с персистентными свойствами.
Б. Идентификация чистой культуры; определение резидентной стафилококковой микрофлоры
При дифференциации резидентной стафилококковой микрофлоры от транзиторной, кроме учета микробной обсемененности, рекомендуется определять у выделенных штаммов чувствительность к фузидину, а также персистентные свойства (антилизоцимная, антиинтерфероновая, антикомплементарная активности), как наиболее информативные биологические характеристики (А.с. СССР N 1449587 "Способ выявления возбудителя при гнойно-воспалительных процессах"; патент РФ N 2010860 "Способ определения антикомплементарной активности микроорганизмов").
1. Реактивы, приборы, стекло
1.2. Питательный агар для культивирования микроорганизмов, сухой, код ОКП 93 8511 0197 ФС 42-188 ВС-88 (НПО "Питательные среды", Махачкала)
1.3. Физиологический раствор (9 г NaCl г на 1 л воды)
1.4. Официнальные диски с фузидином (Минмедпром РФ объединение "Мосмедпрепарат" им. А.Я.Карпова)
1.5. Яичный лизоцим, регистрационный номер 76/506/6 (Фармацевтическое акционерное общество "Ферейн", Москва)
1.6. Культура Micrococcus luteus (N 211001 по каталогу ГИСК им. Л.А.Тарасевича)
1.7. Препарат человеческого лейкоцитарного интерферона (ПО "Иммунопрепарат", Уфа)
Читайте также:

