Эмболизация септальных ветвей коронарных артерий метод лечения
Обновлено: 05.10.2024
Транскоронарная септальная спиртовая абляция – малоинвазивная процедура, целью которой является уменьшение обструкции выносящего тракта левого желудочка за счет уменьшения толщины межжелудочковой перегородки. Данная процедура не требует вскрытия грудной клетки и предсердия, необходимости в общем наркозе также нет. [1]
Название протокола: Транскоронарная септальная спиртовая абляция при обструктивной гипертрофической кардиомиопатии.
Код протокола:
Код(ы) МКБ-10:
I 42.1 – Обструктивная гипертрофическая кардиомиопатия.
Сокращения, используемые в протоколе:
| АЛТ – аланинаминотрансфераза АСТ – аспартатаминотрансфераза АЧТВ – активированное частичное тромбопластиновое время ВОЛЖ – выходной отдел левого желудочка ГКМП – гипертрофическая Кардиомиопатия ЛКА – левая коронарная артерия ПНА – передняя нисходящяя артерия ПТИ – протромбиновый индекс ЭКГ – электрокардиограмма ЭФГДС – эзофагофиброгастродуоденоскопия |
Дата разработки протокола: 2015 год.
Категория пациентов: взрослые.
Пользователи протокола: кардиологи, терапевты, врачи общей практики, интервенционные кардиологи, рентгенэндоваскулярные хирурги.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация: [2]
Транскоронарная септальная спиртовая абляция при следующих гемодинамических вариантах обструктивной гипертрофической кардиомиопатии:
· с субаортальной обструкцией в покое (базальной);
· с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины.
Диагностика
Цель проведения процедуры/вмешательства:
· уменьшение градиента давления в ВОЛЖ;
· улучшить качество жизни пациентов в ближайший и отдаленный периоды;
· профилактика внезапной сердечной смерти.
Показания и противопоказания к процедуре/ вмешательству: [3]
Показания к процедуре/ вмешательству:
· неэффективность медикаментозной терапии;
· недостаточность кровообращения III–IV ФК по NYHA;
· II ФК по NYHA — при наличии синкопальных состояний;
· гемодинамические показания – градиент давления в ВОЛЖ > 30 мм рт. ст. в покое и > 50 мм рт. ст. при физической нагрузке.
Противопоказания к процедуре/вмешательству:
Абсолютные противопоказания:
· гемодинамические нарушения на митральном клапане (митральная недостаточность III);
· гемодинамические нарушения на аортальном клапане;
· концентрический тип обструкции.
Относительные противопоказания:
· недавно перенесенный инсульт (в течение последнего месяца);
· прогрессирующая почечная недостаточность;
· острое желудочно-кишечное кровотечение;
· подъем температуры тела, который может быть обусловлен инфекцией;
· общая инфекция;
· неблагоприятный прогноз вследствие других заболеваний; рак или цирроз печени;
· выраженная анемия;
· выраженные электролитные нарушения;
· тяжелые системные или психические заболевания, при которых прогноз сомнителен;
· очень большой физиологический (не хронологический) возраст;
· отказ пациента от проведения операции;
· интоксикация сердечными гликозидами;
· документированная анафилаксия к ангиографическим контрастным веществам.
Перечень основных и дополнительных диагностических мероприятий.
Перечень основных диагностических мероприятий:
Лабораторные исследования:
· общий анализ крови;
· биохимический анализ крови: (определение глюкозы, определение мочевины, определение креатинина, определение тропонина, определение АЛТ, определение АСТ, количественное определение С-реактивного белка, общий белок и фракции )
· определение АЧТВ;
· aHCV total (антитела к антигенам вируса гепатита C);
· ИФА – HbsAg (Обнаружение поверхностного антигена (HBsAg) гепатита В в сыворотке крови);
· определение группы крови;
· резус-фактора;
· определение ПТИ;
· определение фибриногена;
· определение общего холестерина;
· определение липопротеиды низкой плотности (ЛПНП);
· определение липопротеиды высокой плотности (ЛПВП);
· определение триглицеридов;
· определение калия/натрия;
· общий анализ мочи.
Инструментальные исследования:
· ЭКГ;
· мониторирование ЭКГ;
· эхокардиография;
· коронарография;
· рентгенография органов грудной клетки.
Перечень дополнительных диагностических мероприятий:
· определение гликозилированного гемоглобина;
· тест на толерантность к глюкозе;
· ИФА: натрийуретический пептид;
· определение Д-димера;
· исследование кислотно-основного состояния;
· определение миоглобина;
· эзофагогастродуоденоскопия диагностическая взрослым;
· определение щелочной фосфатазы;
· агрегация тромбоцитов;
· определение магния;
· ЭКГ тест с физической нагрузкой (ВЭМ, тредмил-тест);
· определение МВ-КФК.
Техническое оснащение:
· ангиографический комплекс;
· интродьюсер 6Fr-7Fr;
· диагностический проводник 0,35 дюймов;
· контрастное вещество неионное (йопромид, йогексол, йодиксанол) – 100-200 мл;
· проводниковые катетеры 6Fr-7Fr, например: JL(Judkins left), AL(Amplatzer left), XB(extra backup), XBLAD(extra backup for LAD);
· проводник коронарный 0,014 дюймов;
· временный ЭКС;
· баллон – катетеры типа OTW (Over-the-Wire);
· спирт 96% – 2-4мл.
Требование к подготовке пациента:
· письменное информированное согласие пациента на проведение процедуры;
· подготовка места предполагаемого доступа (брить паховую область);
· исключение пищи и воды за 6 часов до процедуры.
· Седация Диазепам 10 мг – 2,0 мл в/м за 30 минут до процедуры.
Лечение
Методика проведения процедуры/вмешательства:
Описание медицинского вмешательства.
Сосудистый доступ.
Под местной анестезией (раствор новокаина 0,5%) пунктируется по Сельдингеру бедренная артерия, устанавливается интродьюсер 6F.
После установки интродьюсера по нему вводится 100–150 ЕД/кг гепарина для повышения ACT >250 сек.
Далее, через бедренную или подключичную вену устанавливается временный электрод в правый желудочек, к электроду подсоединяется водитель ритма.
Тензиометрия. Для измерения градиента давления в ВОЛЖ одновременно записывается давление с проводникового катетера, расположенного в восходящем отделе аорты и специального 5F катетера Pigtail с отверстиями только в дистальной части, расположенного в верхушке левого желудочка. Градиент в ВОЛЖ измеряется в покое и в течение провокационных проб, таких, как проба Вальсальвы, или после экстрасистолы.
Ангиография. Диагностический катетер типа JL устанавливается в устье ЛКА (левая коронарная артерия), выполняется коронарография ЛКА в левой или правой кассой проекции с краниальным отклонением.

Подготовка септальной артерии. Для предотвращения тромбоэмболических осложнений вводится гепарин из расчета на массу тела (1 мкг на 1 кг массы тела). После коронарографии и определения крупной септальной ветви, кровоснабжающей гипертрофированную межжелудочковую перегородку, участвующую в обструкции, диагностический катетер сменяется на проводниковый (JL, AL, XB, XBLAD, XBC). В выбранную септальную ветвь проводится коронарный проводник 0,014–inch. После этого проводится короткий (
Препараты (действующие вещества), применяющиеся при лечении
| Гепарин натрия (Heparin sodium) |
| Прокаин (Procaine) |
| Этанол (Ethanol) |
Информация
Источники и литература
Информация
Список разработчиков протокола:
Конфликт интересов: отсутствует.
Условия пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
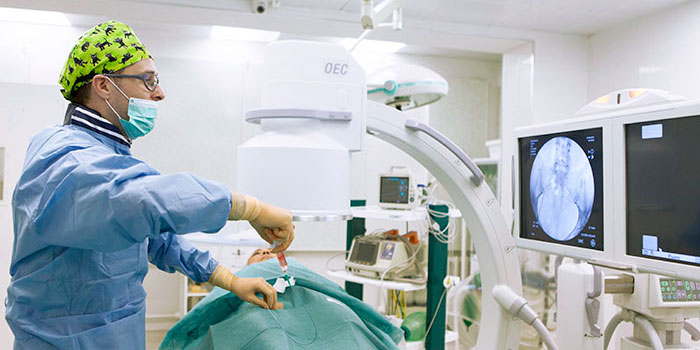
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
Эмболизация артерий в онкологии
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация – эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.
Ключевые слова
Для цитирования:
For citation:
Введение
Гипертрофическая кардиомиопатия (ГКМП) — генетическая патология, выражающаяся структурной и функциональной аномалией миокарда левого желудочка, проявляющаяся утолщением стенок по данным ЭхоКГ, КТ или МРТ. У части пациентов гипертрофия миокарда может приводить к обструкции выходного тракта левого желудочка (ВТЛЖ), что обуславливает высокий риск неблагоприятных сердечно-сосудистых исходов. Критерием обструкции ВТЛЖ является максимальный градиент давления (ГДmax) в ВТЛЖ > 25 мм рт. ст. по данным ЭхоКГ. При ГДmax > 50 мм рт. ст. рассматривается вопрос о выполнении коррекции ВТЛЖ 3. Показания к коррекции ВТЛЖ определяются высокими цифрами градиента давления, недостаточностью кровообращения 3-4-го функционального класса по NYHA, наличием синкопальных состояний и неэффективностью медикаментозной терапии [1].
В настоящее время устранение субаортальной обструкции выполняется двумя способами: миоэктомии на открытом сердце и эндоваскулярным способом. В нашей статье мы хотели описать вариант лечения обструктивной формы ГКМП с помощью транскатетерного метода [4].
Впервые септальная абляция у больных с обструктивной формой ГКМП была осуществлена в 1994 г. F. Gietzen и его коллегами [5]. Они использовали технику чрескожной транслюминальной ангиопластики с последующим введением 96 % этанола в перфорантную септальную ветвь, что приводило к локализованному инфаркту и уменьшению толщины МЖП с последующим снижением субаортальной обструкции.

Рисунок 1. Передняя межжелудочковая артерия отдает множественные мелкие септальные ветви. Случай, не подходящий для септальной абляции
Figure 1. Anterior interventricular artery with multiple small septal branches. Septal ablation contraindicated

Рисунок 2. Передняя межжелудочковая артерия отдает крупную септальную ветвь
Figure 2. Anterior interventricular artery with a large septal branch
Техническая возможность выполнения септальной абляции определяется наличием перфорантных внутриперегородочных ветвей более 1 мм и отсутствием их участия в кровоснабжении папиллярных мышц. Оценка строения септальных ветвей выполняется при коронарографии.
В связи с тем что расположение септальных артерий в миокарде индивидуально, информация об участке миокарда, который нужно разрушить инъекцией спирта, крайне необходима перед выполнением абляции, чтобы исключить повреждение гемодинамически значимых структур миокарда, таких как папиллярные мышцы.
Оценка зоны кровоснабжения септальной ветви выполняется методом селективной контрастной трансторакальной эхокардиографии. Выполняется следующими образом: в септальную ветвь в приустьевом отделе over the wire (OTW) баллонным катетером через просвет OTW-баллонного катетера вводится ультразвуковое контрастное средство, распределяющееся в зоне кровоснабжения септальной ветви. В течение времени, необходимого для выполнения эхокардиографического определения зоны распределения контрастного вещества, баллонный катетер должен оставаться достаточно раздутым, препятствуя смыванию ультразвукового контраста (рис. 3) [6, 7].

Рисунок 3. Определяется контрастное вещество в пределах базального сегмента межжелудочковой перегородки
Figure 3. Contrast agent in basal segment of interventricular septum
Материалы и методы
Собственный клинический случай
Также в анамнезе у пациентки отмечалась диагностированная кавернозная ангиома головного мозга. Состояние при поступлении средней тяжести. Сознание ясное. Кожные покровы физиологической окраски. Дыхание жесткое, хрипов нет. ЧД 17 в минуту. Сердечные тоны усилены, расщепление 2 тона и систолический шум на аортальном клапане типа crescendo-decrescendo. Пульс 65 ударов в минуту. АД 120/90 мм рт. ст. Отечность нижних конечностей до середины голеней.
Учитывая высокую степень субаортальной обструкции, клиническое состояние пациентки, отсутствие эффективности медикаментозной терапии и наличие высокого риска осложнений при открытой миоэктомии, было решено провести спиртовую септальную абляцию.
На коронарографии определись интактные коронарные артерии, выраженная первая септальная ветвь (СВ1) передней межжелудочковой артерии (ПМЖА), мышечный мост в среднем сегменте ПМЖА с систолической компрессией до 40 % (видео 1).
Видео 1. Селективное контрастирование левой коронарной артерии
Video 1. Selective contrast enhancement of left coronary artery
Правая коронарная артерия была интактна (видео 2).
Видео 2. Селективное контрастирование правой коронарной артерии
Video 2. Selective contrast enhancement of right coronary artery
Премедикация в операционной — диазепам 10 мг, промедол 20 мг.
Ход операции. Электрод временного электрокардиостимулятора (ЭКС) установлен в правый желудочек, контроль положения электрода пробным навязыванием ритма. Инвазивное измерение градиента давления в ВТЛЖ, ГД в покое 105 мм рт. ст., при пробе Вальсальвы 125 мм рт. ст.
Устье ЛКА канюлировано проводниковым катетером. По коронарному проводнику в септальную ветвь проведен OTW-баллонный катетер, проводник удален (видео 3). Раздутием баллона окклюзирована септальная ветвь, в септальную ветвь введено ультразвуковое контрастное вещество серы гексафторид (соновью) 2,0 мл (видео 4). На ЭхоКГ контрастное вещество распределилось в пределах базального сегмента межжелудочковой перегородки (видео 5 и 6). После чего в септальную ветвь введено 2,0 мл 96 % раствора этилового спирта с экспозицией 20 минут (видео 7 и 8). Баллон сдут и удален. На контрольной коронарографии первая септальная ветвь не контрастируется, контрастирование передней межжелудочковой артерии не изменено (видео 9). Интраоперационно по данным ЭхоКГ ГД в ВТЛЖ снизился до 53-60 мм рт. ст.
Видео 3. В первую септальную ветвь проведен коронарный проводник
Video 3. Coronary guidewire in first septal branch
Видео 4. Баллонный катетер раздут в первой септальной ветви
Video 4. Balloon catheter inflated in first septal branch
Видео 5. Контрастная эхокардиография в апикальной четырехкамерной позиции
Video 5. Contrast enhanced echocardiography, apical four-chamber view
Видео 6. Контрастная эхокардиография в апикальной двухкамерной позиции
Video 6. Contrast enhanced echocardiography, apical two-chamber view
Видео 7. Введение 96 % спирта с добавлением контраста
Video 7. Injection of 96% alcohol with added contrast agent
Видео 8. 10-минутная экспозиция 96 % спирта
Video 8. 10 minutes exposure to 96% alcohol
Видео 9. Контрольная коронарография
Video 9. Control coronary angiography. No contrast visualisation of first septal branch
В раннем послеоперационном периоде суточное наблюдение в условиях отделения реанимации и интенсивной терапии (ОРИТ). Двукратное срабатывание ЭКС. Тропониновый тест положительный. Электрод ЭКС удален на 2-е сутки.
На 3-е сутки по данным ЭхоКГ отмечалась локальная редукция толщины базальной части МЖП до 1,3 см с гипокинезом на небольшом участке с сохранением общей сократительной способности левого желудочка (ФВ 60 % Sim), ГД на выходном тракте ЛЖ составлял 65 мм рт. ст., наблюдалось уменьшение степени регургитации на митральном клапане и снижение СДПЖ до 45 мм рт. ст.
Через 2 мес. при проведении контрольной ЭхоКГ было зафиксировано увеличение ГД до 85 мм рт. ст. У пациентки, несмотря на улучшение самочувствия (повысилась толерантность к физической нагрузке, уменьшились отеки на ногах, перестали беспокоить кардиальные боли) и принимаемую медикаментозную терапию (в т. ч. максимальные для нее дозы β-блокаторов), сохранялась выраженная одышка.
Учитывая высокую степень обструкции на выходном тракте ЛЖ, жалобы пациентки на одышку, оптимальное строение и расположение второй ветви, было решено провести повторную абляцию.
После абляции второй септальной ветви интраоперационно ГД в ВТЛЖ составил 43 мм рт. ст.
На контрольной ЭхоКГ через 3 суток отмечалась гипертрофия базального сегмента МЖП до 1,2 см с локальным истончением на небольшом протяжении до 0,8 см с уменьшением контрактильной способности на этом участке и сохранением общей сократительной способности левого желудочка (ФВ 62 % Sim), ГД в выходном тракте ЛЖ 20-22 мм рт. ст., СДПЖ 35 мм рт. ст. (рис. 4). Данные показатели сохранялись при проведении контрольной ЭхоКГ через 1, 3, 6 мес.
Клинически у больной отмечалось улучшение самочувствия, в том числе значительное уменьшение одышки.

Рисунок 4. Доплерограмма выходного тракта левого желудочка после септальной абляции
Figure 4. Left ventricular outflow tract Doppler post septal ablation
По данным литературы, устранение или значительное снижение градиента давления в выходном тракте левого желудочка наблюдается более чем у 90 % больных ГКМП после хирургического вмешательства, что приводит к значительному улучшению клинической картины в 70-80 % случаев [8, 9]. Несмотря на большой опыт лечения этого заболевания, остается высокая летальность у пациентов с ХСН 3-4 ФК (42 %) [10]. В нашем случае, несмотря на проводимую адекватную медикаментозную терапию с высокими дозами β-блокаторов, у пациентки наблюдалась клиническая картина выраженной сердечной недостаточности и сохранялись высокие значения градиента давления в выходном тракте ЛЖ. Ситуацию усугубляло наличие установленной кавернозной ангиомы головного мозга. После продолжительного обсуждения, учитывая высокий риск осложнений при открытой миоэктомии, было решено провести септальную миоабляцию. Хирургическая коррекция была эффективной, несмотря на двукратное вмешательство. Повышение субаортального ГД после первой операции, видимо, было связано с редукцией базальной части МЖП на недостаточном протяжении и ремоделированием миокарда.
После второй абляции были достигнуты оптимальные значения градиента давления, которые сохранялись в течение 6 месяцев, и улучшение других показателей по данным ЭхоКГ. Также хотелось отметить, что, несмотря на индуцированный локализованный инфаркт, общая сократительная способность миокарда не пострадала. Одновременно с положительным изменением показателей данных инструментальных обследований отмечалось выраженное улучшение самочувствия больной и компенсация хронической сердечной недостаточности.
Заключение
Спиртовая септальная абляция является малоинвазивным, эффективным и относительно безопасным методом лечения гипертрофической обструктивной кардиомиопатии при резистентности к медикаментозной терапии. Также может быть лечением выбора при наличии высокого риска осложнений операции на открытом сердце. А выполнение контрастной эхо-кардиографии позволяет диагностировать зоны, допустимые для введения этанола, исключить повреждение гемодинамически значимых структур миокарда и этим самым повысить безопасность хирургического лечения.
Список литературы
1. ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J. 2014;35(39):2733–79. DOI: 10.1093/eurheartj/ ehu284
2. Mischi M. Contrast echocardiography for cardiac quantifications [dissertation]. Eindhoven: Technische Universiteit Eindhoven; 2004. DOI: 10.6100/IR579395
3. Бокерия Л.А. Гипертрофическая обструктивная кардиомиопатия. Анналы хирургии. 2013;(5):5–14.
4. Каплунова В.Ю., Шакарьянц Г.А., Кожевникова М.В., Хабарова Н.В., Привалова Е.В., Беленков Ю.Н. Современные подходы к проблеме гипертрофической кардиомиопатии. Клиническая медицина. 2016;94(10):754–63. DOI: 10.18821/0023-2149-2016-94- 10-754-763
5. Gietzen F., Leuner C., Gerenkapm T., Kuhn H. Relief of obstruction in hypertrophic cardiomyopathy by transient occlusion of the first septal branch of the left coronary artery. Eur Heart J. 1994;15(Suppl.):125. DOI: 10.1093/eurheartj/15.Abstract_Supplement.1
6. Mukherjee D., Bates E.R., Roffi M., Lange R.A., Moliterno D.J. Cardiovascular catheterization and intervention: a textbook of coronary, peripheral, and structural heart disease. 2nd ed. Boca Raton: CRC Press; 2018.
8. Осиев А.Г., Кретов Е.И., Курбатов В.П., Мироненко С.П., Найденов Р.А., Артамонова Е.А. и др. Новый подход к оценке результатов транскоронарной септальной аблации у больных с гипертрофической обструктивной кардиомиопатией. Патология кровообращения и кардиохирургия. 2013;17(3):46–9. DOI: 10.21688/1681-3472-2013-3-46-49
9. Maron B.J., Tpstein S.E., Morrow A.G. Symptomatic status and prognosis of patients after operation for hypertrophic obstructive cardiomyopathy: efficacy of ventricular septal myotomy and myectomy. Eur Heart J. 1983;4(Suppl. F):175–85. DOI: 10,1093 / eurheartj / 4.suppl_f.175
10. Schulte H.D., Gramsch-Zabel H., Schwartzkopff R. Hypertrophic obstructive cardiomyopathy: surgical management. Schweiz Med Wochenschr. 1995;125(41):1940–9. PMID: 7481652
Об авторах
Николаева Ирина Евгеньевна — к.м.н., главный врач, главный внештатный кардиолог Министерства здравоохранения Республики Башкортостан
Республиканский кардиологический центр
Россия
Мухаметьянов Азат Минисламович — врач по рентгенэндоваскулярным диагностике и лечению
Бикташев Ренат Марисович — врач по рентгенэндоваскулярным диагностике и лечению
Бузаев Игорь Вячеславович — к.м.н., зав. отделением рентген-хирургических методов диагностики и лечения № 1, доцент кафедры госпитальной хирургии
Республиканский кардиологический центр
Россия
Халикова Гульчачак Амировна — к.м.н., врач функциональной диагностики

Эмболизация аневризм - современный метод высокотехнологичного лечения патологического выпячивания сосудов. Аневризмы - это мешковидное или веретенообразное расширение сосуда с истончением его стенки. Тонкая сосудистая стенка может разорваться и вызвать большое кровотечение, которое без помощи хирургов, вероятно убьёт пациента. Аневризму можно вырезать, отключить или закрыть. Преднамеренная окклюзия (закрытие) просвета кровеносного сосуда с помощью специально введённого в лечебных целях вещества (эмбола) , называется эмболизацией.
Эмболизация — это малоинвазивная процедура, являющаяся альтернативой хирургии. Она показана в случаях, когда выполнение открытого оперативного вмешательства очень травматично или чревато осложнениями. В нейрохирургии эндоваскулярная эмболизация аневризмы головного мозга всё больше вытесняет операции с трепанацией черепа.
Цель эмболизации аневризмы заключается в предотвращении кровотока в аневризматическом мешке путём заполнения его полости специальными спиралями. Это должно предотвратить разрыв и кровотечение. Эндоваскулярная эмболизация аневризмы головного мозга не восстанавливает области уже повреждённого мозга.
Материалами для окклюзии служат спирали, специальные губки или гистоакрил. Для лечения аневризмы обычно используются спирали, либо эмболизирующее вещество.
Спирали бывают разной конфигурации, длины и диаметра. Структурные спирали изготавливают из платины, которая при введении в сосуд сворачивается в трёхмерную фигуру для заполнения полости аневризмы.
Могут потребоваться дополнительные устройства, такие как стент, чтобы помочь удержать спирали внутри аневризмы. Вмешательство с помощью стента подразумевает постоянное размещение его в сосуде, прилегающем к аневризме, для обеспечения поддержки, которая удерживает спирали внутри мешка. Самыми сложными технологиями пользуются для эмболизации аневризм сосудов головного мозга, потому что риски заболевания очень высоки, а доступ к ним, открытым методом очень затруднён.
Подготовка к лечению
- Не ешьте твёрдой пищи после полуночи в день операции. Питьё воды допускается утром в день процедуры, если не указано иное.
- Вы должны прекратить приём антикоагулянтов за 5 дней до процедуры. Эти препараты включают аспирин, плавикс и Варфарин.
- Если вы находитесь на инсулине, спросите своего врача о любых корректировках, которые могут потребоваться.
![Схема эмболизации аневризмы]()
Как проходит лечение
После местной анестезии врач вставляет полую пластиковую трубку (катетер) в в бедренную артерию и продвигает его, используя ангиографию, до места аневризмы.
Используя направляющий катетер,спирали платиновой проволоки или маленькие латексные шарики проводят через катетер и вводят их в аневризму. Они заполняют аневризматический мешок, выключая его из кровообращения, вызывая образование сгустка крови (тромба), который полностью пломбирует полость аневризмы. Мягкость платины позволяет спирали соответствовать причудливой форме мешка. Для полного его заполнения требуется в среднем 5-6 спиралей.
Средняя продолжительность процедуры составляет 1-2 часа.
Когда шейка аневризмы слишком широка иногда требуется установить стент в основной сосуд, чтобы удерживать спирали внутри мешка. Поскольку стент действует как барьер между аневризмой и материнским сосудом, очень маловероятно, что из неё будут выступать катушки.
Возможные осложнения
Эмболизация как метод лечения имеет небольшой риск. Возможные осложнения включают в себя такие симптомы, как слабость в одной руке или ноге, онемение, покалывание, нарушения речи и проблемы со зрением. При эмболизации аневризм церебральных артерий может быть непродолжительная головная боль.
Серьёзные осложнения, такие как инсульт или смерть, встречаются редко. Курение, ожирение и высокое артериальное давление увеличивают шанс получения осложнений после процедуры.
Прогноз
Эффективны как открытая хирургия, так и эндоваскулярные методы. Выбор лечения зависит от ряда факторов: есть ли риск разрыва аневризмы, её размер, форма и местоположение. Как и все медицинские решения, наилучший вариант лечения следует обсудить с вашим врачом.
Процедуру иногда требуется выполнить несколько раз в течение жизни пациента.
Эмболизация вен и артерий — это малоинвазивная эндоваскулярная операция. Выполняется рентгенохирургическим методом и заключается в избирательной закупорке вен и артерий эмболами — специальными мелкодисперсными наполнителями или лекарственными препаратами. Целью закупорки является выведение патологически измененного участка кровеносной сети из общего кровообращения. Это может быть необходимо при сосудистых аномалиях (опасное расширение и истончение стенок сосудов), кровотечениях или опухолях для прекращения их питания.

Cпециально оборудованные рентгенохирургические операционные и опытные эндоваскулярные хирурги, в совершенстве владеющие данной инновационной методикой хирургической помощи.
Высокая эффективность выполняемых операций при различных патологиях систем организма, включая онкологию.
Какие операции по эмболизации вен и артерий мы проводим
-
Эмболизация артерий таза Эмболизация артерий предстательной железы Эмболизация вен семенного канатика
Показания к эмболизации артерий и вен
Эмболизация артерий и вен призвана решить две основные задачи:
- исключить патологически измененный участок кровеносной сети из общего кровообращения
- прекратить кровоснабжение патологического образования
Показаниями для проведения эмболизации артерий и вен являются:
- Кровотечения различного происхождения (травматические, желудочно-кишечные, маточные, носовые, в брюшную полость, в раннем послеродовом периоде).
- Свищи и патологические соединения вен и артерий, нарушающие общее кровообращение и лишающие питания отдельные ткани и органы.
- Другие состояния, которые требуют исключения отдельного участка кровеносного русла из общего кровоснабжения.
- Аневризмы артерий, в т.ч. головного мозга.
- Фибромиома матки как причина чрезвычайно продолжительных или необычайно обильных менструаций.
- Растущая неоперабельная опухоль с целью прекращения ее питания кровью и роста раковых клеток.
- Варикоцеле — варикозное расширение вен мошонки, грозящее мужским бесплодием.
Подготовка к эмболизации вен и артерий
Операция предваряется полным обследованием пациента для выявления возможных противопоказаний и правильного выбора хирургической тактики. После приема у сердечно-сосудистого хирурга ему необходимо сделать электрокардиограмму, получить заключение кардиолога, пройти лабораторную диагностику мочи и крови для выявления инфекционных патологий, определение группы, резуса и свертываемости крови, ее общих и биохимических показателей для оценки работы печени и почек. Также необходимо пройти обзорную рентгенографию состояния органов грудной полости. По индивидуальным показаниям могут быть назначены другие аппаратные исследования.
Очень важно поставить врача в известность обо всех своих хронических и перенесенных заболеваниях, планируемой или имеющейся беременности, поскольку операция проводится под рентгенологическим контролем.
После госпитализации пациента консультирует врач-анестезиолог для принятия решения о безопасной анестезии.

Техника проведения
Хирургическое вмешательство эндоваскулярным методом производится под местной анестезией. По показаниям или по желанию пациента может быть использована успокоительная седация. Во время операции присутствует врач-анестезиолог, осуществляется мониторинг сердцебиения, артериального давления, других жизненно важных показателей.
Операция проводится в условиях рентгенологической операционной, оснащенной ангиографом и другой интервенционной радиологической аппаратурой. Визуальный контроль осуществляется рентгенологически, для чего в кровь пациента вводится контрастное вещество.
Чаще всего для чрезкожного доступа используется бедренная артерия. Через небольшой точечный разрез оперирующий хирург вводит в нее длинную тонкую пластиковую трубку-катетер и проводит его по естественному кровяному руслу до нужного места. Убедившись, что конец катетера достиг нужной точки, врач вводит через него специальный синтетический наполнитель, платиновые микроспиральки или лекарственный эмболизирующий препарат.
В некоторых случаях, чаще всего при аневризме с крупной шейкой, операция дополняется установкой стента — тонкой металлической сетки, удерживающий стенки сосуда в нормальном положении и не допускающий выпирания наполнителя в кровяное русло.
В заключение операции делается серия рентгенологических снимков для того, чтобы убедиться в том, что кровоток в месте эмболизации отсутствует. На место разреза накладывается тугая асептическая повязка.

Реабилитационный период
Эндоваскулярные операции намного менее травматичны, нежели открытые хирургические вмешательства, они не требуют даже наложения швов. Больной проводит в постели несколько часов, а затем 1-2 дня находится в стационаре клиники под наблюдением врача, после чего выписывается домой. В течение нескольких месяцев после операции на сосудах необходимо исключить авиаперелеты, горячие процедуры (бани и сауны) и другие повышенные нагрузки на сердечно-сосудистую систему.

Читайте также:


