Интервал между приготовлением навеска продукта их разведений и посева в питательной среде
Обновлено: 05.10.2024
2.6.16. Определение микробного загрязнения поверхности проб продукта проводят смывом с помощью ватных тампонов.
Стерильный ватный тампон смачивают пептонно-солевым раствором и протирают им в разных местах поверхность различных кусков анализируемого продукта общей площадью .
Площадь анализируемой поверхности измеряют при помощи стерильных шаблонов с отверстиями надлежащего размера.
Тампон помещают в пробирку, содержащую пептонно-солевого раствора. Содержимое пробирки тщательно перемешивают при помощи пипетки. Полученную суспензию считают исходным разведением.
2.7.1. Первое дестятикратное разведение навески является исходным, исходное разведение готовят в соответствии с п. 2.6. Из него получают последующие разведения.
2.7.2. Последующее второе разведение готовят из одной доли исходного разведения и девяти долей пептонно-солевого раствора путем смешивания в пробирке.
Если для перемешивания исходного разведения применяли пипетку, то этой же пипеткой вносят исходного разведения в пептонно-солевого раствора, не касаясь пипеткой поверхности раствора. Разведение перемешивают другой пипеткой путем десятикратного насасывания и выдувания из него содержимого пробирки.
2.7.4. Интервал между приготовлением навесок продукта, их разведений и посева в питательные среды не должен превышать 30 мин.
Техника посевов микроорганизмов на питательные среды

Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.


Рис. 24. Посев на агар в чашки Петри шпателем Дригальского
Глубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:
N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.
2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы культивирования микроорганизмов
Food products.
Methods for cultivation of microorganisms
Дата введения 1993-01-01
1. РАЗРАБОТАН И ВНЕСЕН Всесоюзным научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП)
Техническим комитетом по стандартизации 93 "Продукты переработки плодов и овощей"
В.И.Рогачев, д-р техн. наук; Б.И.Голод, канд. биолог. наук
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Комитета стандартизации и метрологии СССР от 25.12.91 N 2117
3. Срок проверки - 1997 г., периодичность проверки - 5 лет
5. Взамен ГОСТ 26670-85
6. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Настоящий стандарт распространяется на пищевые продукты и устанавливает методы культивирования для выявления присутствия (отсутствия) или определения количества микроорганизмов соответствующих групп, семейств, родов или видов.
Методы основаны на посеве продукта, разведении навески продукта или осажденных на мембранном фильтре клеток микроорганизмов в питательные среды, с последующим культивированием посевов в условиях, благоприятных для роста микроорганизмов.
Требования стандарта являются обязательными.
1. МЕТОДЫ ОТБОРА И ПОДГОТОВКИ ПРОБ
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669.
2. АППАРАТУРА И ПИТАТЕЛЬНЫЕ СРЕДЫ
Аппаратура и питательные среды по нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
3. ПОДГОТОВКА К АНАЛИЗУ
3.1. Степень разведения навески продукта
3.1.1. Степень разведения навески продукта для посева на плотные среды выбирают так, чтобы общее количество колоний, выросших на чашке Петри, колебалось в пределах 15-300; количество колоний специфических групп бактерий (например, колиформных) - 15-150; плесеней 5-50.
3.1.2. Степень разведения навески продукта для посева в жидкие среды выбирают так, чтобы хотя бы в одной пробирке наибольшего разведения отсутствовали микроорганизмы.
3.1.3. Количество продукта, которое необходимо профильтровать для получения изолированных колоний на фильтре, должно быть указано в нормативно-технической документации на методы анализа соответствующих групп, семейств, родов или видов микроорганизмов.
3.2. Объем навески продукта или его разведения для посева
3.2.1. При посеве глубинным методом 1 см жидкого продукта или разведения навески продукта смешивают с расплавленной питательной средой.
3.2.2. При посеве поверхностным методом 0,1 или 0,2 см жидкого продукта или разведения навески продукта вносят на поверхность плотной среды.
3.2.3. Для выявления присутствия (отсутствия) микроорганизмов и определения их таксономических свойств в жидкие среды вносят до 50 г (см) продукта; при определении количества микроорганизмов в жидкие среды вносят до 100 см жидкого продукта или разведения навески.
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Глубинный метод посева в плотные среды
4.1.1. Жидкий продукт или разведение навески вносят параллельно в две чашки Петри и заливают не позднее чем через 15 мин расплавленной и охлажденной до температуры (45±1) °С питательной средой. Высота слоя питательной среды должна быть 4-5 мм.
4.1.2. Среду немедленно равномерно перемешивают с посевным материалом круговыми движениями чашки так, чтобы среда не вытекла из чашки и не загрязняла крышку. После застывания среды чашки с посевами вверх дном помещают в термостат.
4.2. Поверхностный метод посева на плотные среды
4.2.2. На подсушенную среду наносят жидкий продукт или разведение навески и немедленно равномерно растирают по поверхности шпателем - изогнутой стеклянной палочкой.
4.2.3. Засеянную поверхность подсушивают, выдерживая чашки в горизонтальном положении в течение 15 мин.
4.3. Метод посева в жидкие среды
4.3.1. В колбу или пробирки с питательной средой вносят навеску продукта или разведение навески.
4.3.2. При определении наиболее вероятного числа (НВЧ) микроорганизмов из навески продукта готовят исходное и ряд десятикратных разведений до такой степени, чтобы можно было определить предполагаемое НВЧ микроорганизмов.
Самое низкое разведение и высеваемые объемы его инокулума выбирают в зависимости от предполагаемого количества микроорганизмов и чувствительности метода следующим образом:
по 1 см из разведения 10 и высших разведений, если надо определить количество микроорганизмов, превышающее 3 клетки в 1,0 г (см) продукта;
по 10 см из разведения 10 или 1 см неразведенного продукта и по 1 см из разведения 10 и более высокого разведения, если надо определить количество микроорганизмов, превышающее 3 клетки в 10,0 г (см) продукта;
по 10 и 1 смнеразведенного продукта и ряда его разведений, если надо определить количество микроорганизмов, превышающее 3 клетки в 100 см прод
4.3.3. Все разведения и неразведенный продукт высевают параллельно в три пробирки с питательной средой. Инокулум объемом 1 см высевают в 10 см среды нормальной концентрации, инокулумы объемом 10 см - в 10 см среды двойной концентрации.
4.4. Метод мембранных фильтров
Метод мембранных фильтров применяют для анализа легко фильтруемых жидких продуктов или продуктов, дающих растворы с высоким осмотическим давлением.
4.4.1. Подготовка фильтров
4.4.1.1. При работе с мембранными фильтрами следует соблюдать следующие условия:
выбирают фильтры, размеры пор которых позволяют осадить на нем основное количество микроорганизмов определенных видов или групп; для улавливания бактерий применяют фильтры со средним диаметром пор 0,3 мкм;
визуально контролируют отсутствие механических повреждений фильтров, и во избежание повреждений фильтры берут пинцетом, не имеющим рубчиков;
фильтры хранят в сухом состоянии;
перед использованием фильтры освобождают от остатков растворителей, пузырьков воздуха и загрязнений кипячением по ГОСТ 18963 в дистиллированной воде;
для фильтрации жидкостей применяют аппарат Зейтца, прибор Гробара и другие установки;
части установки для фильтрации, соприкасающиеся с фильтруемым раствором, стерилизуют или кипятят;
стерильный влажный фильтр осторожно помещают блестящей стороной вверх на подкладку из пористого материала или сетку фильтрующей аппаратуры.
Мембранные фильтры не применимы для фильтрации суспензий или гомогенатов продуктов, загрязняющих при фильтрации поры фильтров.
4.4.2. Проведение фильтрации
4.4.2.1. Для фильтрации раствора с высоким осмотическим давлением раствор предварительно разводят дистиллированной или пептонной водой в соотношении, позволяющем легко профильтровать разведенные растворы.
Жидкий продукт, содержащий небольшое число взвешенных частиц, фильтруют в два этапа. Для освобождения от взвешенных частиц его фильтруют через фильтр со средним диаметром пор 4 мкм, а затем - через фильтр, диаметр и размеры пор которого выбраны в соответствии с группой или видом выявляемых микроорганизмов. Оба фильтра культивируют в аналогичных условиях.
После осаждения микроорганизмов на фильтре из растворов с высоким осмотическим давлением или из растворов, содержащих антимикробные вещества, его промывают дистиллированной водой или пептонно-солевым раствором.
4.4.2.2. Фильтрацию заканчивают в момент исчезновения влаги на поверхности фильтра. Немедленно после окончания фильтрации фильтр переносят на плотные или в жидкие питательные среды. На плотную среду фильтр накладывают нижней стороной так, чтобы она полностью соприкасалась с поверхностью среды.
4.5. Посевы термостатируют в благоприятных для роста микроорганизмов условиях, указанных в нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. Подсчет микроорганизмов на плотных средах
5.1.1. В посевах на плотных питательных средах, полученных глубинным, поверхностным методами или методом мембранных фильтров:
для подсчета общего числа жизнеспособных микроорганизмов учитывают все выросшие колонии;
для подсчета количества микроорганизмов определенных таксономических групп на селективных средах учитывают колонии, характерные по морфологии для выявляемой группы;
для подсчета количества определенных групп или видов микроорганизмов на селективно-диагностических или диагностических средах учитывают колонии характерной морфологии, показавшие характерную цветную реакцию с присутствующим в среде индикатором.
Колонии подсчитывают невооруженным глазом или с помощью линзы с шестикратным увеличением, или с помощью специально предназначенного для подсчета колоний прибора.
5.2. Выявление и подсчет микроорганизмов в жидких средах
5.2.1. Живые микроорганизмы в жидких средах выявляют по помутнению среды, появлению осадка, пленки, газообразованию или по наличию роста микроорганизмов в пересевах на плотных питательных средах.
Микроорганизмы определенных физиологических или таксономических групп выявляют по изменению цвета индикаторов, образованию газа из определенных веществ и по другим признакам, специфическим для метаболизма выявляемой группы или видов микроорганизмов.
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
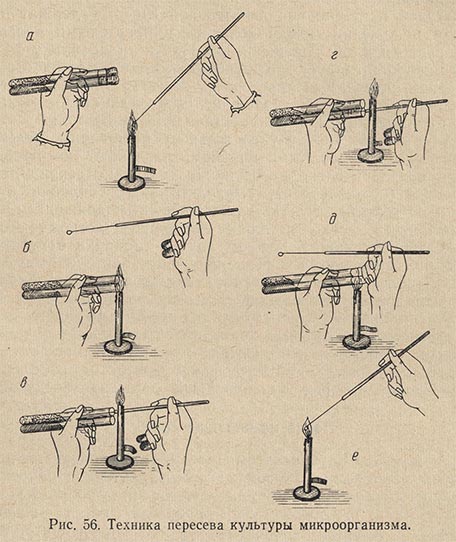
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
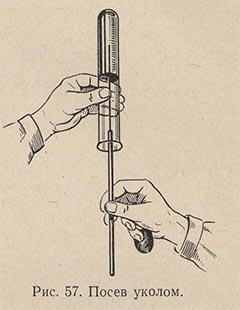
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
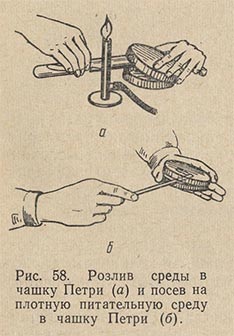
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
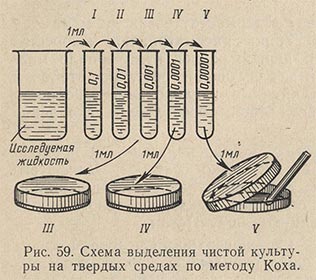
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Читайте также:

