Как на практике повышают выживаемость клеток при посеве с низкой посевной концентрацией
Обновлено: 05.10.2024
Урожайность сельскохозяйственных культур зависит от многих факторов: почвенно-климатических условий, сорта, состава и объёмов удобрений, средств защиты растений, распространённости вредителей и болезней, соблюдения технологии возделывания, а также от качества обработки почвы и посева. Причин разницы в урожайности несколько, и одна из них — большие потери урожая в ряде хозяйств из-за несоблюдения главных требований к качеству обработки почвы и посева. На практике чаще всего наблюдается:
- нарушение структуры почвы;
- неоптимальное распределение семян по глубине и площади поля;
- некачественное формирование семенное ложе;
- неправильный весенний уход за озимыми.
Боронование и подкормка азотом посевов озимых зерновых
Основные мероприятия по ранневесеннему уходу за посевами озимых должны быть направлены на сохранение накопленной влаги, очищение посевов от сорных растений, плесени, на повышение микробиологической активности почвы. При необходимости посевы уплотняют или пересевают (при их полной гибели).
Мероприятия по сохранению влаги являются одними из важнейших, особенно на легких почвах. Песчаные почвы имеют постоянный дефицит влаги (600-700 м 3 /га), что и ведет к недобору 7-8 ц/га зерна или 50-60 ц/га картофеля.
Весной, особенно в солнечные и ветреные дни, за сутки может теряться до 3-5 мм почвенной влаги. Поэтому для большинства районов республики прием закрытия влаги чрезвычайно важен, а в системе ухода за озимыми — просто необходим. В солнечные дни посевы быстро теряют влагу, почва растрескивается, повреждается корневая система, что неизбежно ведет к снижению урожая. Чтобы избежать этого, необходимо проводить ранневесеннее боронование посевов озимых зерновых. В результате разрыхления верхнего слоя уменьшаются потери влаги, уничтожаются розетки перезимовавших сорняков, очищаются растения от плесени, усиливается микробиологический процесс в почве. По многолетним данным исследований аграрных институтов стран СНГ, весеннее боронование посевов озимых зерновых способствовало повышению урожая на 1,9-3,0 ц/га, при этом засоренность посевов снижалась на 20-44%.
Особенно эффективно боронование посевов озимых зерновых с подкормкой азотными удобрениями. Ранневесенняя подкормка растений азотом по таломерзлой почве при наличии максимального количества влаги в почве играет огромную роль в питании растений. Удобрения растворяются и усваиваются растениями с первых же дней весеннего развития и роста. Подкормленные посевы быстро оправляются, начинают куститься, увеличивают число продуктивных стеблей, что в дальнейшем отражается на размере колоса, числе колосков и крупности зерна. Прибавка урожая озимой ржи при весенней подкормке посевов азотом, по сравнению с предпосевной или осенней подкормками, в опытах БелНИИЗ составляла 4,7-6,8 ц/га.
Для качественного и высокоэффективного выполнения боронования посевов озимых зерновых разработаны специальные бороновально-прополочные агрегаты.
Нарушение оптимального состояния почвы при ее обработке
Способ обработки почвы — один из важнейших факторов, влияющих на рост, развитие и формирование урожая сельскохозяйственных культур, а также на степень деградации почв. От него зависят агрофизические характеристики почвы, создающие определенные водно-воздушные и термические условия, которые во многом определяют судьбу произрастающих растений. Агрономической наукой установлено, что в идеале для роста растений почва обрабатываемого слоя должна содержать примерно 45% минеральных веществ, 5% органических веществ и 50% пористого пространства, заполненного равным количеством (по 25%) воды и воздуха. Нарушение этого состояния ведет к недобору урожая. Поэтому основная задача при обработке почвы — сформировать посевной слой в соответствии с агрономическими требованиями культуры. В рамках этой задачи самым актуальным для Беларуси является вопрос формирования в обрабатываемом слое требуемой воздушной составляющей.
Как показывают исследования, применяемые в настоящее время способы и техника для обработки почвы не в полной мере способствуют получению в обработанном слое почвы требуемого количества воздуха и в большинстве случаев ведут к его снижению, что в свою очередь чревато недобором урожая до 10-20%. Это происходит в основном из-за переуплотнения почвы колесами тракторов, наличия плужной подошвы и уплотнения слоев почвы после прохода культиваторных, плоскорезных и других лап. Особенно переуплотняется почва весной под действием ходовых систем техники.
Первые полевые работы проводятся при повышенной влажности почвы, когда она сильно подвержена уплотнению. В результате при движении ходовых колес почва под ними уплотняется на глубину 50-60 см и более (рис. 2). При этом на глубине 20-30 см она может иметь плотность 1,4-1,5 г/см 3 , то есть близкую к критической (1,6-1,7 г/см 3 ), при которой корневые волоски растений уже не распространяются.

Если опоздали с поднятием зяби
Таким образом, при обработке почвы весной следует соблюдать ряд важнейших условий:
- Не начинать работы слишком рано, когда еще избыточно влажная почва и могут образовываться глыбы и глубокая колея от прохода машин.
- Не вносить фосфорно-калийные удобрения тяжелыми агрегатами в весенний период. Более эффективно это можно сделать осенью на зябь.
- Для увеличения опорной поверхности снижать давление в колесах трактора до значений 1,0-1,1 г/см 3 .
- Использовать тяжелые трактора мощностью 200-350 л.с. и более, только со сдвоенными колесами. По данным полевых опытов А.И. Пупонина, использование на севе трактора К-700 со сдвоенными колесами приводило к повышению урожая ячменя на 12,9% по сравнению с тем же трактором, но без сдвоенных колёс.
Не меньший ущерб урожаю, особенно пропашных культур, наносит плужная подошва (рис. 3). Многолетние исследования БЕЛНИИПА (1981-1985 гг.) и БелНИИМиЛ (2001 г.) показали, что глубокое (до 40 см) рыхление плужной подошвы на старопахотных почвах повышает урожайность культур, особенно пропашных (свеклы, картофеля), на 6-26,3% (табл. 1). На мелиорированных почвах при рыхлении на глубину до 65 см прирост урожая еще больший — 10,0-68,9%.
* Данные БелНИИПЛ 1981-1985 гг.
** БелНИИМиЛ, 2001 г., рыхление приспособлением РПП-20 одновременно со вспашкой
Нарушения распределения семян по глубине заделки и площади поля
Немаловажную, а иногда и решающую роль в судьбе урожая играют качество подготовки семенного ложа и равномерность распределения семян по глубине заделки и площади поля. От этих факторов зависит полевая всхожесть, равномерность и дружность всходов, выживаемость и эффективность дальнейшего развития растений.
Таким образом, соблюдение оптимальной глубины заделки семян является одним из важнейших агротехнических требований к посеву. Посев с отклонением от заданной глубины ведет к резкому снижению продуктивности растений (рис. 4).

Согласно исследованиям, отклонение от оптимальной глубины сева на 10 мм снижает полевую всхожесть семян на 5-10%, а в дальнейшем урожайность –— на 10-30% в зависимости от культуры.
Вторым требованием качественного сева является равномерное распределение семян по площади
Теоретически оптимальной с точки зрения использования влаги, солнечного света, углекислоты воздуха и питательных веществ, а также ослабления отрицательного взаимодействия растений является площадь питания каждого растения, приближенная к кругу. На практике достичь этого требования при посеве зерновых культур невозможно. Наиболее приемлемым для практики, как доказано многими исследованиями, является вариант, при котором площадь питания приближается к квадрату.
Агротехнически обоснованные оптимальные площади питания в зависимости от норм высева представлены в таблице 2. Для сравнения здесь же представлена картина фактического распределения семян и площади их питания при использовании сеялок с междурядьем 125 мм. Как видно, даже в идеальном случае семена располагаются в рядке на расстоянии 16-23 мм друг от друга, а форма площади питания имеет ярко выраженную форму вытянутого прямоугольника, что, естественно, не может способствовать повышению урожайности из-за нерационального использования предоставленной растениям площади питания. С увеличением междурядий эта картина еще больше усугубляется.

Переход от обычного рядового к узкорядному посеву позволяет более равномерно распределять растения по площади. При этом сокращение расстояния между рядами на 10 мм дает прирост урожая до 1%. Еще лучший результат обеспечивает ленточный посев. Так, ленточный посев с шириной ленты 70 мм и расстоянием между сошниками 125 мм позволяет повысить урожайность до 6% по сравнению с рядовым посевом с междурядьем 125 мм. Однако сдерживающим фактором применения такого посева является современный сошник, который качественно выполняет посев только при качественно подготовленном посевном слое и отсутствии растительных остатков.
На дерново-подзолистых почвах Европейской территории общепринятой шириной междурядий посева зерновых является 125 мм. Обоснована она конструктивными и технологическими возможностями посевных машин.
На практике применяются различные способы подготовки сплошного семенного ложа. Однако исследованиями, выполненными в 80-90-е годы Институтом экспериментальной ботаники им. В.Ф. Купревича АН БССР совместно с Центральным НИИ механизации сельского хозяйства Нечерноземной зоны СССР, обоснованы параметры посевного слоя, при котором важнейшие факторы внешней среды сочетаются наиболее оптимально. На основании этих параметров установлены требования к технологическому процессу и рабочим органам формирования семенного ложа:
Посевная бороздка должна создаваться с плотным дном, поскольку оно позволяет влаге поступать по капиллярам к высеянным семенам.
Обеспечить контакт семян с влажным дном семенной бороздки, определяющий скорость их набухания и прорастания.
Влажная уплотненная почва с семенами должна быть закрыта слоем рыхлой почвы, снижающей испарение влаги.
Технологический процесс работы включает:
- рыхление посевного слоя почвы;
- подуплотнение его колесными или катковыми почвоуплотнителями перед каждым сошником;
- укладку семян в бороздки, раскрытые сошником;
- прикатывание бороздок с семенами обрезиненными каточками, ширина обода которых несколько больше ширины дна бороздки, благодаря чему семена полностью закрываются обжатой почвой (рис. 5).
Прикатанные бороздки закрываются рыхлой почвой, для чего предусмотрены пружинные боронки (загортачи за сошниками).

Рис. 5. Подготовка семенного ложа с послепосевным прикатыва- нием бороздок: а) технологический процесс; б) состав рабочих органов.
- невзрыхленный (капиллярный) слой почвы ниже дна обработки;
- взрыхленный слой почвы на глубину обработки;
- подуплотненный слой колесными или катковыми уплотнителями;
- уплотненная зона цилиндрическими катками сошников;
- рыхлая почва в бороздках.
Достоинства варианта:
- хороший контакт семян с почвой и обеспеченность влагой;
- прикатанная почва в бороздках уменьшает толщину слоя залегания семян, повышает равномерность их заделки по глубине;
- полосовое прикатывание посевного слоя улучшает воздухообмен почвы по сравнению со сплошным прикатыванием;
- заполненные рыхлой почвой бороздки замедляют процесс испарения влаги из уплотненного слоя почвы с семенами.
Таким образом, несоблюдение основных требований к качеству обработки почвы и посева может привести к недобору урожая культур до 10-30% и более.
ВЫЖИВАЕМОСТЬ ПРОБИОТИЧЕСКИХ БАКТЕРИЙ ПРИ РАЗЛИЧНЫХ ВИДАХ КОНСЕРВИРОВАНИЯ

Исследование жизнеспособности Propionibacterium shermanii , Bifidobacterium bifidum и Lactococcus lactis при замораживании и сублимационном высушивании

Сохранение штаммов культур в жизнеспособном состоянии без потери производственно-ценных свойств является одной из важных задач в пищевой биотехнологии. Анабиоз как естественный процесс выживания клетки остается наиболее эффективным способом консервирования бактерий. Длительность хранения бактерий, введенных в ксероанабиоз, достигает 50 лет с сохранением высокой плотности популяций в препарате.
В связи с огромным разнообразием существующих микроорганизмов единого протокола сохранения микробных культур, отвечающего всем предъявляемым требованиям, не существует. Методы хранения микробных культур широко варьируют для разных видов микроорганизмов в силу большого разнообразия присущих им биологических свойств. Даже для разных штаммов одного вида не всегда приемлем один и тот же метод [3].
Изучение способности пробиотических микроорганизмов переживать стрессовые условия при замораживании и сублимации вызвано научным интересом в рамках теории адаптации и необходимостью создания продуктов на основе устойчивых пробиотических культур, длительное время сохраняющих способность к размножению, без утраты и изменения нативных свойств.
Объекты и методы исследований

Объектом исследований являлась ассоциация культур бактерий Propionibacterium shermanii, Bifidobacterium bifidum и Lactococcus lactis из фонда ВКПМ (г. Москва).
Наращивание биомассы консорциума пробиотических микроорганизмов проводили на сывороточной среде с добавлением буферных солей, структурирующего агента и антиоксидантов с промежуточной нейтрализацией до наступления стационарной фазы. Для оптимизации среды в целях повышения синтезэкзополисахаридов микроорганизмами закваски использовали стерильный 1%-ный раствор селенита натрия.
Лиофилизацию биомассы бактерий проводили на аппарате сублимационной сушки марки VacuPro II. Для количественного учета микроорганизмов использовались стандартные бактериологические методы.
Результаты и их обсуждение
Длительное хранение бактерий с сохранением ценных свойств основано на ингибировании протекающих обменных процессов в клетке. К таким способам относятся криоанабиоз микроорганизмов и высушивание бактерий из замороженного состояния (лиофилизация). Эффект консервации при сублимации достигается путем снижения активности воды путем удаления свободной влаги в условиях субнулевых температур.
При замораживании для защиты биомассы применяли среду на основе сахарозы и натрия лимоннокислого. В присутствии в среде натрия лимоннокислого происходят обратимые повреждения аминокислотной транспортной системы клетки, сахароза повышает вязкость среды, снижая скорость движения молекул воды и обезвоживания мембран.

Рисунок 1 – Выживаемость культур консорциума при замораживании
Как видно из представленных данных, количество жизнеспособных клеток снижается незначительно, культуры консорциума обладают устойчивостью к повреждающим факторам криоконсервации. Экзополисахариды (ЭПС), вырабатываемые бактериями, обладают гидрофильными свойствами, что способствует дополнительному повышению вязкости среды. ЭПС в бактериальной клетке выполняют защитную функцию, предотвращая высыхание. Замораживание и высушивание высокопродуктивных ЭПС-синтезирующих культур возможны без дополнительных протекторов, однако устойчивость таких препаратов при длительном хранении и реактивации требует дальнейшего изучения.
Чувствительность разных видов микробов к замораживанию-оттаиванию неодинакова. В литературе имеются сведения, что грамотрицательные бактерии более чувствительны к замораживанию, чем грамположительные. Из грамположительных микробов наибольшей устойчивостью обладают кокки. Подобное различие, вероятно, связано с особенностями строения клеточной стенки. Даже в пределах одного вида разные штаммы показывают неодинаковую чувствительность к низким температурам [3].
К достоинствам криогенного хранения относят малое количество технологических операций и контрольных критических точек, повышающих вероятность вторичного обсеменения культур, обеспечение постоянства свойств микроорганизмов и доступность компонентов для подготовки протективной среды.
К недостаткам данного способа относят относительно короткую продолжительность хранения. Максимальный рекомендованный срок составляет 12 мес.
На следующем этапе была изучена жизнеспособность пробиотических культур консорциума в условиях сублимационного высушивания.
Высушивание биоматериалов из замороженного состояния (лиофилизация, сублимационное высушивание, замораживание-высушивание) - широко распространенный способ, при котором вода испаряется в условиях вакуума без оттаивания льда, что позволяет полностью сохранять первичную структуру объекта сушки. При использовании данного способа многие физиологически разнородные виды бактерий и бактериофаги удается сохранять в жизнеспособном состоянии 50 лет и более [2].
Лиофилизацию проводили после концентрирования биомассы бактерий путем центрифугирования в течение 20 мин при частоте n=3000 об./мин. Далее биомассу в асептических условиях смешивали с защитной средой в соотношении 1:1 и замораживали при температуре минус 20 о С.
После полного замораживания биомассу высушивали при следующих условиях: p=(0,01-0,03) атм., Т= минус (50,3-51,2) о С, τ=28 ч. Количественные показатели по выходу концентрированной биомассы рассмотрены в таблице 1.
Таблица 1. Выход биомассы консорциума пробиотических бактерий
Первый этап создания нового лекарства – это его доклинические испытания, которые, как правило, начинаются с исследований in vitro, то есть вне живого организма. При этом многие эксперименты проводятся на культуре живых клеток. На сегодняшний день методы in vitro очень популярны как с точки зрения высокой инновационности, так и с позиции гуманного обращения с животными.
Цель работы: определить показатель цитотоксичности LC50 и терапевтический индекс 2-аминопиримидина для раковой клеточной линии Jurkat методом МТТ-теста.
Задачи
- Получить теоретические представления о методах клеточной биологии, необходимых для данного исследования, и ознакомиться с необходимой терминологией.
- Подготовить клетки раковой линии для эксперимента.
- Воздействовать на клетки раствором 2-аминопиримидина в различных концентрациях.
- Оценить выживаемость клеток с помощью МТТ-теста.
- Определить значение летальной концентрации (LC50) 2-аминопиримидина.
- Провести аналогичный эксперимент для здоровых лейкоцитов и рассчитать терапевтический индекс 2-аминопиримидина.
Содержание работы
В работе была проведена оценка степени токсичности 2-аминопиримидина для клеточной линии Jurkat.
Для эксперимента криоконсервированные клетки Jurkat были разморожены и культивировались на питательной среде. Затем проводилась подготовка клеток для МТТ-теста: подсчёт числа живых клеток с помощью счетной камеры Горяева и обработка их раствором 2-аминопиримидина различных концентраций.
Затем с этими клетками проводился МТТ-тест, и по полученным данным была определена зависимость выживаемости клеток от концентрации 2-аминопиримидина.
Для оценки терапевтического индекса 2-аминопиримидина был проведен также аналогичный эксперимент со здоровыми лейкоцитами. На основе полученных зависимостей были рассчитаны летальные концентрации 2-аминопиримидина для клеточной линии Jurkat и для здоровых лейкоцитов. Затем был рассчитан терапевтический индекс 2-аминопиримидина для клеточной линии Jurkat.
Оснащение и оборудование, использованное при создании работы:
- ламинарный бокс II класса биобезопасности Hera Safe Thermo electron corporation;
- центрифуга настольная Eppendorf Centrifuge 5810 R;
- микроскоп инвертированный Zeiss Axiovert 40 CFL;
- анализатор микропланшетный автоматический Tecan Infinite M200 PRO;
- дозаторы одноканальные с переменным объемом 0,1–5000 мкл;
- дозаторы восьмиканальные с переменным объемом 20–100 мкл;
- наконечники к дозаторам 0,1–5000 мкл;
- флаконы культуральные площадью 25 см 2 ;
- пробирки центрифужные типа эппендорф 1,5–2,0 мл;
- пробирки центрифужные 15 мл;
- пипетки на 1, 2, 5, 10 мл;
- планшеты культуральные плоскодонные 96-луночные.
Выводы
Проведенный эксперимент наглядно продемонстрировал возможность использования тестов in vitro для прогнозирования токсических концентраций химических веществ в организме человека. Цель работы достигнута. Цитоксичность 2-аминопиримидина оказалась выше по отношению к раковым клеткам Jurkat, чем к здоровым лейкоцитам.
Однако полученный терапевтический индекс очень низкий для того, чтобы сказать, что 2-аминопиримидин является эффективным и безопасным лекарственным веществом. В ИБМХ им. В. Н. Ореховича, на базе которого проводилось данное исследование, ведется работа по поиску наиболее эффективных комплексов на основе 2-аминопиримидина для лечения лейкемии. Данное исследование позволило сделать вывод, что для достижения наилучшего результата необходимо модифицировать 2-аминопиримидин и изучать цитотоксичность этих веществ.
Перспективы использования результатов работы
Полученные нами данные могут быть использованы для сравнения с терапевтическими индексами исследуемых в ИБМХ им. В. Н. Ореховича комплексов на основе 2-аминопиримидина для лечения лейкемии.
Сотрудничество с вузом/учреждением при создании работы
Научно-исследовательский институт биомедицинской химии имени В. Н. Ореховича.
Особое мнение
«Этот проект дал мне возможность общения с экспертами в той области науки, которую я исследовала в своей работе.
Я сумела развить уверенность в себе и своих силах, стала больше ценить проделанный мною труд. Работая над проектом, я смогла превратить мечту в цель и стала ещё больше изучать ту сферу, в которой хотела бы работать в будущем.
На примере классического представителя клеток прокариот – радиоустойчивого штамма бактерий Escherichia coli B/r – исследована зависимость относительной биологической эффективности (ОБЭ) α–излучения от предрадиационных условий культивирования клеток – состава питательных сред. Также проанализировано изменение формы кривой выживаемости клеток. Стандартная бактериальная среда, и среды, содержащие разные концентрации (6 % и 13 %) солодового экстракта, были использованы в качестве питательных сред для выращивания бактериальных клеток до облучения. После воздействия ионизирующего излучения клетки культивировали только на стандартной бактериальной среде. Источником редкоионизирующего излучения являлся 60Со (γ-кванты, ЛПЭ = 0,2 кэВ/мкм, 22 Гр/мин), а источником плотноионизирующего излучения – 239Pu (α-частицы, ЛПЭ = 120 кэВ/мкм, 25 Гр/мин). Показано, что, что существует зависимость реакций клеток на облучение от качества ионизирующего излучения и условий культивирования. Продемонстрировано, что предрадиационное выращивание бактерий на средах, содержащий солод, приводит к трансформации формы кривой выживаемости клеток из экспоненциальной в S-образную. В результате этого ОБЭ альфа-частиц изменяется от 1 до 4–5 при переходе от стандартных условий культивирования к выращиванию бактерий на 6 % солодовом агаре. Наблюдавшиеся реакции бактерий на действие γ- и α-излучений интерпретируются с позиции зависимости процессов репарации клеток от условий предрадиационного культивирования.

1. Авакян Ц.М., Мкртчян Н.И., Симонян Н.В., Хачатрян Г.Э. Биологическое действие электронов с энергией 7.5 МэВ на клетки бактерий E. coli K-12 разного репарационного генотипа// Доклады НАН Армении. – 2011. – Т. 111, № 2. – С. 164–170.
2. Белкина С.В., Петин В.Г. Прогнозирование повышения радиочувствительности клеток млекопитающих при последовательном применении гипертермии и ионизирующего излучения // Российский биотерапевтический журнал. – 2014. – Т. 13, № 3. – С. 65–69.
7. Ярмоненко С.П., Вайнсон А.А. Радиобиология человека и животных. – М.: Высшая школа, 2004. – 552 с.
8. Hall E.J., Giaccia A.J. Radiobiology for the Radiologist, 7th edn. Philadelphia. – PA: Wolters Kluwer, 2011. – 576 p.
9. Petin V.G., Kapultcevich Yu.G. Radiation quality and the shape of dose–effect curves at low doses of ionizing radiation for eukaryotic cells // Math. Biosc. – 2014. – Vol. 252. – P. 1–6.
10. Petin V.G., Kim J.K. Synergistic Interaction and Cell Responses to Environmental Factors. – NY: Nova Science Publishers, 2014. – 338 p.
Для лечения онкологических заболеваний, являющихся одной из основных причин смерти и инвалидизации населения в мире [3], в мировой практике наблюдается тенденция увеличения использования плотноионизирующих излучений. Актуальной проблемой современной радиобиологии остается оценка относительной биологической эффективности излучений. Это связано с перспективой использования плоноионизирующих излучений в лучевой терапии благодаря нескольким факторам. Во-первых, эффективность таких излучений значительно превышает действие редкоионизирующих излучений. Во-вторых, при использовании плотноионизирующих излучений подавляется способность клеток восстанавливаться от потенциально летальных и сублетальных повреждений [5, 9]. Кроме того, доступное в настоящее время формирование полей облучения плотноионизирующими излучениями может обеспечивать меньшую дозу на нормальные, незлокачественные клетки. Малоисследованным аспектом этой проблемы является зависимость ОБЭ от предрадиационных условий культивирования клеток. Поэтому в данной работе анализируется зависимость ОБЭ α–излучения от предрадиационных условий культивирования клеток – состава питательных сред.
Изучение зависимости вариабельности ОБЭ от генотипа клеток и от их формы кривой выживаемости проанализирован для бактерий и дрожжевых клеток [4, 5, 10]. В этих монографиях показана корреляция ОБЭ со способностью клеток к пострадиационному восстановлению. Молекулярный процесс восстановления от радиационных повреждениях детально изучен на бактериальных клетках [5]. Представляют значительный интерес данные [6], продемонстрировавшие изменение способности клеток к восстановлению за счет их культивирования до облучения на средах, содержащих глюкозу. Такое культивирование снижало радиочувствительность штамма E. coli B/r. Было выявлено, что при культивировании бактерий на средах, содержащих глюкозу, изменяется форма дозовой кривой по сравнению с клетками, росшими на стандартной среде. Наиболее интригующими результатами является сигмоидная форма кривой доза-эффект после α-облучения в условиях культивирования клеток на средах, содержащих глюкозу. Вместе с тем, хорошо известно, что сигмоидная форма кривой доза-эффект после действия редкоионизирующего излучения превращается в экспоненциальную после облучения α-частицами клеток млекопитающих [7, 8] и дрожжей [9, 10]. Наличие сигмоидной кривой доза-эффект у бактерий, облученных α-частицами, представляет интерес с фундаментальной точки зрения. Не исключено, что четко выраженная сигмоидная форма кривой доза-эффект после действия плотноионизирующего излучения могла быть обусловлена восстановлением клеток в процессе длительного облучения за счет очень низкой мощности дозы. Применение значительно большей мощности дозы подтвердило наличие плеча кривой выживаемости после α-облучения [6]. Однако в этой работе мощность дозы была не известна, что не позволило авторам оценить ОБЭ α-частиц. Целью данного исследования являлось изучение влияния состава питательных сред, модифицирующих способность клеток к восстановлению, на ОБЭ и форму кривых выживаемости бактерий E. coli B/r, облученных редко- и плотноионизирующим излучением.
Материалы и методы исследования
Работа выполнена на бактериальных клетках E. coli, радиоустойчивый штамм В/r. Для исследования использовали культуру клеток, выращенную или на стандартной твердой питательной среде (пептон – 10 г/л, агар – 20 г/л, хлорид натрия – 10 г/л, дрожжевой экстракт – 20 мл/л), или на среде, содержащий солод. Эту среду готовили на основе неохмеленного солодового экстракта Maltax 10 (6 % или 13 %) с добавлением 2 % агара. Клетки культивировали при 37 °С в течение 18 часов, когда бактерии выходили на стационарную фазу роста.
После воздействия любого из исследуемых видов ионизирующего излучения, а также контрольные интактные клетки высевали на чашки Петри на поверхность стандартной твердой бактериальной среды и инкубировали при 37 °С в течение 20 часов. Выживаемость клеток рассчитывали как относительное содержание клеток, сформировавших видимые невооруженным глазом колонии, среди всех облученных клеток. Каждый эксперимент повторяли 5–7 раз. Детали экспериментальных исследований описаны ранее [2, 9].
Результаты исследования и их обсуждение
Биологическим тестом, использованным в данной работе, является выживаемость клеток, которая для теста репродуктивной гибели определялась [4] как способность облученных клеток к бесконечному размножению. Относительное содержание жизнеспособных клеток среди всех облученных, то есть выживаемость S рассчитывали как:
где N – число макроколоний, образовавшихся из облученных клеток в единице объема облученного образца, а No – то же в контрольном образце.
Результаты влияния γ- и α-излучения с разной ЛПЭ на выживаемость бактерий E. coli B/r при выращивании их до облучения на различных питательных средах приведены на рис. 1. На этом рисунке представлены кривые выживаемости E. coli B/r после γ- (светлые значки) и α-облучений (темные значки). В одной серии экспериментов клетки выращивали в течении 20 часов до облучения на стандартной бактериальной среде (рис. 1, А), а в другой – на субстрате, содержащем 6 %-й солод (рис. 1, Б). Следует подчеркнуть, что после облучения бактерии этих двух серий экспериментов культивировали на одинаковом стандартном бактериальном субстрате. Из рисунка видно, что предрадиационное культивирование клеток на солодовом агаре (панель Б), приводит к значительному увеличению радиорезистентности бактерий по сравнению с предрадиационным выращиванием культуры на стандартной среде (панель А) независимо от вида излучения. Видно, что главной особенностью влияния данной питательной среды на выживаемость E.coli B/r к воздействию излучения является изменение формы кривой доза-эффект с экспоненциальной на S-образную, а наклон экспоненциальных участков кривых выживаемости изменялся незначительно. Так для γ-излучения такая характеристика зависимости выживаемости бактерий от дозы как Do меняется не очень сильно – 65 Гр для клеток E.coli, росших до облучения на стандартной твердой питательной среде (рис. 1, А, кривая 2), и 75 Гр для бактерий, росших на 6 % солодовом агаре (рис. 1, Б, кривая 2).
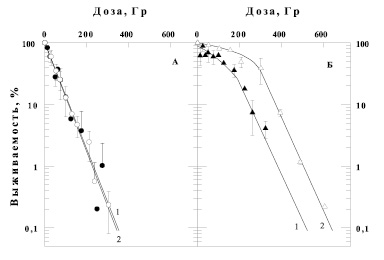
Рис. 1. Зависимость выживаемости бактерий E. coli B/r от дозы ионизирующего излучения (темные значки – α-облучение, светлые значки – γ-излучение), а также от условий предрадиационного культивирования клеток: стандартная среда (панель А) или 6 % солодовый агар (панель Б)
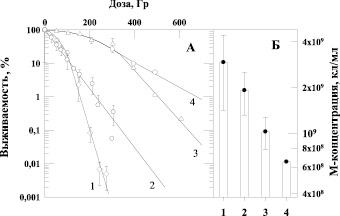
Рис. 2. Зависимость выживаемости бактерий E. coli B/r от дозы γ-излучения (панель А) и величина М-концентрации клеток (панель Б) при выращивании культуры до облучения на различных питательных средах: 1 – бактоагар Плоскирева, 2 – стандартная среда, 3 – 6 % солодовый агар, 4 – 13 % солодовый агар
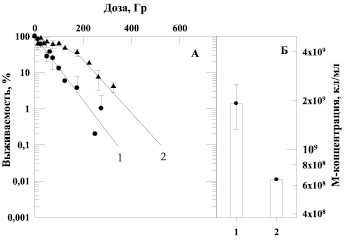
Рис. 3. Зависимость выживаемости бактерий E. coli B/r от дозы α-излучения (панель А) и величина М-концентрации клеток (панель Б) при выращивании культуры до облучения на различных питательных средах: 1 – стандартная среда, 2 – 6 % солодовый агар
Известно, что биологическая эффективность излучений разного типа определяется как физическими характеристиками излучений с высокими ЛПЭ, которые индуцируют широкий спектр первичных повреждений ДНК, так и биологическими механизмами, направленными на репарацию этих повреждений [1, 5, 9]. В опытах по изучению выживаемости бактерий после действия как α-частиц, так и ускоренных электронов было продемонстрировано [1], что эффективная работа систем репарации радиорезистентного мутанта E. coli K-12 приводит к формированию плеча на кривой выживаемости, в то время как выживаемость исходного родительского штамма бактерий характеризуется экспоненциальной зависимостью. Эти данные подтверждают точку зрения о влиянии систем репарации на формирования плеча кривой доза-эффект.
Подтверждением этих наблюдений являются данные, приведенные на рис. 2, которые отражают зависимость выживаемости бактерий E. coli B/r, облученных γ-квантами, от состава питательной среды, на которой клетки культивировали до облучения. На рис. 3 приведены аналогичные данные о влиянии воздействия α-частиц на выживаемость этой же культуры клеток при ее предрадиационном выращивании на различных средах. В наших экспериментах было отмечено, что максимальные концентрации клеток (М-концентрация), достигаемые за 20 часов культивирования на разнообразных средах, заметно различаются (рис. 2, Б и рис. 3, Б). Мы использовали как питательные среды, в состав которых входят органические субстраты (6 %-й или 13 %-й солодовый агар), так и солевую синтетическую среду – бактоагар Плоскирева, включающую в качестве источника энергии углеродсодержащие соединения (7,5 % сахара). Четко прослеживается зависимость радиочувствительности от максимальной концентрации (М-концентрации) бактерий в стационарной фазе роста: чем меньше М-концентрация, тем меньше радиочувствительность клеток. Тем самым продемонстрировано, что состав питательных сред, на которых культивировали бактерии, приводит к снижению М-концентрации бактерий и возрастанию радиоустойчивости штамма как к γ-излучению (рис. 2, А), так и к воздействию α-частиц (рис. 3, А).
Характер зависимости выживаемости клеток от дозы ионизирующего излучения может быть обусловлен процессами, связанными с образованием поврежденых участков ДНК, приводящими к возникновению двунитевых разрывов. Одним из факторов, влияющих на формирование плеча на кривой выживаемости, может являться увеличение числа копий генома [1]. Сигмоидность кривых выживаемости полигиномных клеток бактерий обуславливается тем, что для их инактивации необходимо возникновение нескольких эффективных повреждений, возможно, в каждой из копий генома. Явление формирования многокопийности генома у бактерий E. coli, выращенных на питательных средах, содержащих глюкозу, также отмечена и в работе [6].
В данной работе показано, что сигмоидная форма кривой выживаемости бактерий, выращенных на солодовом агаре, сохраняется и при облучении α-частицами. Следовательно, системы репарации, ответственные за формирование сигмоидного участка кривой выживаемости, эффективно работают после действия редко- и плотноионизирующих излучений. Более подробное исследование биохимических процессов, приводящих к изменению формы кривой доза-эффект с экспоненциальной на S-образную, выходит за рамки данной работы.
Таким образом, нами было продемонстрировано, что состав питательной среды, на которой культивировали клетки до облучения, оказывает существенное влияние не только на выживаемость бактерий, но и на относительную биологическую эффективность плотноионизирующего излучения. Полученные закономерности могут представлять интерес не только для фундаментальной радиобиологии, но и в прикладных областях. Так, в клинической радиобиологии остро стоит проблема радиоустойчивости нормальных тканей к воздействию ионизирующего излучения при радиотерапии. Устойчивость микроорганизмов к повышенному радиационному фону востребована в системах биологической очистки радиоактивных отходов.
Читайте также:

