Какую среду необходимо регенерировать перед посевом
Обновлено: 05.10.2024
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
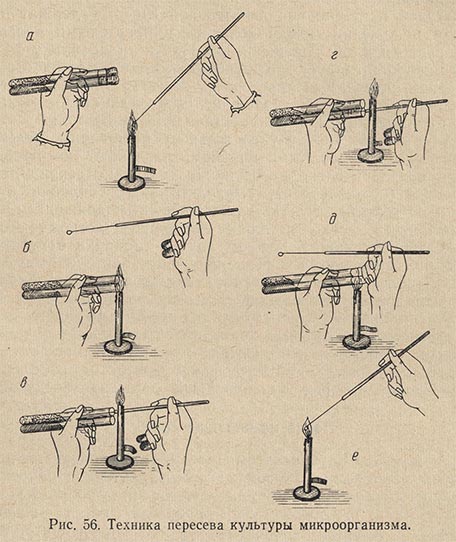
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
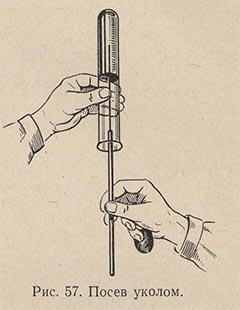
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
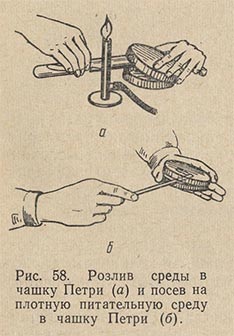
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
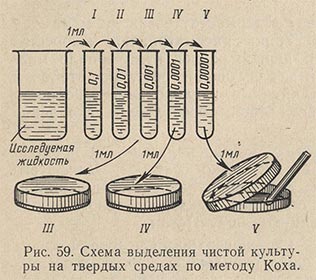
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Стратификация, обеззараживание и замачивание — рассказываем, как эффективно подготовить семена перед посадкой в грунт.


В магазине для дачи и садоводства можно найти самые разнообразные семена. Многие производители не только предлагают качественные и правильно отобранные, но и проводят специальную обработку. Об этом они пишут на упаковке. Если нашлись такие, то дополнительные процедуры перед посадкой не нужны. Однако если вы покупаете материал у знакомых или собираете его сами, то обязательно нужна подготовка. Какие способы использовать — зависит от определенной культуры и ваших предпочтений. Рассказываем о самых популярных методах предпосевной обработки семян, которые используют в домашних условиях.
Все о предпосевной обработке семян
Особенности обработки семян перед посевом
В основном обработка семян нужна, чтобы улучшить рост растений, уберечь их от болезней и сделать более устойчивыми к холодным температурам и их перепадам. Эти процедуры позволят сохранить большую часть урожая, ведь обычно около половины гибнет из-за различных болезней.
Однако к обработке необходимо подходить с умом. Не стоит использовать все виды, перечисленные в статье, иначе даже самые здоровые семечки погибнут. Определитесь, что может повлиять на выращивание и препятствовать росту. Например, слишком твердая оболочка и низкая водопроницаемость или недоразвитость зародыша. Исходя их этого подбирайте нужные процедуры.


Виды обработки
1. Калибровка
Эта процедура необходима, чтобы отделить хороший посевной материал от плохого. Для этого понадобится обычная вода или раствор поваренной соли в концентрации 3-5%. Семечки опускают в емкость, заливают жидкостью и дают постоять около 5 минут. По истечении этого времени жидкость со всплывшими семенами сливают, а оставшиеся внизу оставляют — они годятся для проращивания. Их промывают в чистой воде, затем кладут сушиться в темное место. При этом не стоит размещать их около отопительных приборов, например, батареи.
Для мелких семечек используют другой метод калибровки. Для этого берут палочку из пластмассы и наэлектризовывают: достаточно хорошенько потереть ее о шерстяное изделие. Затем рассыпают посевной материал на чистый лист бумаги, проводят над ним палочкой. Расстояние между ними должно быть не меньше 2 см. К пластмассе прилипнут плохие семена, которые не годятся для проращивания.

2. Обеззараживание (протравливание)
Обеззараживание семян перед посевом — обязательная процедура, которую не стоит игнорировать. Больные семена от здоровых отличить довольно сложно, а ведь из-за них может погибнуть весь урожай. Чтобы обезопасить ростки от бактериальных и грибковых инфекций, нужно их протравить. В таком случае получится избавиться от возбудителей, которые могут находиться как на внешней части оболочки, так и на внутренней. Также процедура предохранит всходы от болезней, поджидающих их в земле.
Именно поэтому очень важно обеззаразить семена, которые куплены с рук на рынке и находились на уличном лотке. Проводить процедуру не стоит, если на упаковке указано, что материал уже был протравлен.
Для обработки можно использовать три простых метода. В первом случае вам понадобится раствор марганцовки. Необходимо взять 1 грамм перманганата калия и добавить его в 100 мл чистой воды комнатной температуры. Затем поместить в получившуюся жидкость семечки и оставить на 20 минут. При работе с марганцовкой стоит быть осторожными, так как это едкое вещество. Обязательно наденьте перчатки и старайтесь не просыпать препарат на рядом лежащие вещи, иначе он их окрасит.
Для второго метода понадобится 3% перекись водорода. Ее нужно нагреть до 40 градусов, затем поместить в раствор семена и подержать их там около 8 минут.
В третьем случае вам не нужны дополнительные ингредиенты, используется только вода. Подготовьте две емкости с горячей (около 50 градусов) и холодной жидкостью. Чередуйте обработку водой с разной температурой в течение 15 минут.
Важным условием, которое необходимо соблюдать на всех этапах выделения и идентификации анаэробов, является защита этих микробов от токсического действия молекулярного кислорода. Время между взятием материала и его посевом на питательные среды должно быть максимально коротким.
Анаэробные бактерии можно культивировать только на специальных бескислородных средах с низким окислительно-восстановительным потенциалом (10 — 150мВ). Для контроля за степенью насыщения этих сред кислородом используют специальные редокс — индикаторы (метиленовый синий, резазурин), восстановленные формы которых бесцветны. При возрастании окислительно-восстановительного потенциала (ОВП) метиленовый синий окрашивает среды в синий, а резазурин — в розовый цвет, что указывает на непригодность таких сред для культивирования облигатных анаэробов. Для сохранения низкого ОВП питательные среды должны быть агаризированы. Добавление даже 0,05% агара повышает их вязкость и уменьшает аэрацию.
Анаэробный тип энергетического метаболизма во много раз менее продуктивный, чем аэробный, поэтому питательные среды для анаэробов должны быть богаче питательными субстратами и витаминами. В практических лабораториях для выделения анаэробов из патологического материала чаще всего используют среду для контроля стерильности крови (СКС), среду Китта-Тароцци, анаэробный кровяной агар (на основе эритрит-агара или агара Д), среду Вильсона — Блера, среду Шедлера и др. Эти свежеприготовленные питательные среды должны быть использованы для посева в течение 2-х часов во избежание насыщения кислородом.
Методы создания анаэробных условий. Создание анаэробных условий достигается с помощью физических, химических, биологических и смешанных методов.
Физические методы. Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается:
1. посевом в среды, содержащие редуцирующие и легко окисляемые вещества; В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных тканей (печень, мозг, почки, селезенка, кровь). Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10-15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла. В качестве легко окисляемых веществ используют глюкозу, лактозу и муравьинокислый натрий. Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта-Тароцци, которая используется для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов.
2. посевом микроорганизмов в глубину плотных питательных сред. Посев микроорганизмов в глубину плотных сред производят по методу Вейнберга
Метод Вейнберга. 1-2 капли материала со среды Кита-Тароцци вносят в пробирку с МПБ для разведения. Затем пастеровской пипеткой с запаянным концом переносят материал последовательно в 3-5 узких пробирок с сахарным МПА, предварительно расплавленным и прокипяченным в течение 20 мин и остуженным до 50°С, погружая капилляр пипетки в расплавленный агар до дна пробирки. Засеянные пробирки быстро охлаждают под струей холодной воды, при этом агар застынет и зафиксирует разобщенное положение отдельных микробных клеток. Инкубируют в анаэробных условиях. Через сутки отбирают колонии, на уровне колонии пробирку распиливают, колонию отсасывают пипеткой и переносят в среду Китта-Троцци для накопления и идентификации.
3. механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы; Удаление воздуха производят путем его механического откачивания их специальных приборов — анаэростатов, в которые помещают чашку с посевом анаэробов. Переносной анаэростат представляет собой толстостенный металлический или пластиковый цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса.
4. заменой воздуха в сосуде каким-либо индифферентным газом. Замену воздуха индифферентным газом (азотом, водородом, аргоном, С02) можно производить в анаэростатах путем вытеснения его газом из баллона.
Приборы и среды для культивирования анаэробов:
Микроанаэростат — используется для создания вакуума с дозированным содержанием кислорода. Прибор представляет собой герметически закрывающийся сосуд, снабженный манометром, в который помещают посевы и откачивают воздух. Микроанаэростат помещают в термостат.
Эксикатор — стеклянный лабораторный сосуд с притертой крышкой. В его донной части имеется дополнительная емкость, куда наливается смесь пирогаллола и едкого натра или гидросульфита натрия и двууглекислой соды. На сетку-подставку помещают посевы и притирают крышку с помощью вазелина. Эксикатор помещают в термостат.

Газ-пак (Generbag anaer). Для создания анаэробных условий используются газогенераторные пакеты с реагентами — GasPak, GasPak Plus (газогенераторный пакет спалладиевым катализатором) и другие.
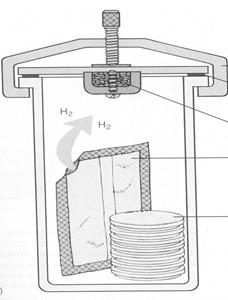
Винтовой зажим с герметичной прокладкой
Рис. 9 Газогенераторные пакеты
Система Generbag anaer состоит из воздухонепроницаемых емкостей, изготовленных из прозрачной пластмассы и генераторов, содержащих смесь веществ, поглощающих кислород (рис. 9). При применении GasPak Plus необходимо увлажнить таблетку боргидрида натрия, при этом выделяется водород и в присутствии палладиевого катализатора он соединяется с кислородом с образованием воды. Последовательность работы: вынуть генератор из пакета, поместить в нижнюю часть воздухонепроницаемого пакета, затем поместить чашки (или пробирки) с посевами и закрыть пакет. Инкубация при 37°С.
Анаэробный бокс — прозрачная плексиглассовая камера со шлюзом, отверстиями для рук с рукавами, заканчивающимися резиновыми перчатками. В нем создаются стерильные условия, его заполняют газовой смесью и поддерживают температуру 37°С.
Среда Китта-Тароцци. Содержит мясо-пептонный бульон (МПБ), 0,5% глюкозы и 0,15% агара. На дно пробирки для адсорбции О2 помещают кусочки вареной печени или фарша слоем 1-1,5 см и заливают 6-7 мл среды. Среду перед посевом регенерируют (прогревают 15-20 мин на водяной бане для удаления воздуха, а затем быстро охлаждают). После посева среду заливают вазелиновым маслом и помещают в термостат.
Полужидкий сахарный агар (высокий столбик). В пробирку с 6-7 мл расплавленного и охлажденного до 40-45 0 полужидкого питательного агара, содержащего 0,5-1% глюкозы, вносят исследуемый материал и перемешивают. Посевы помещают в термостат.
Химические методы. Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэростате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия.
1. Применение щелочных растворов пирогаллола для поглощения кислорода в замкнутой воздушной среде.
2. Можно применять гидросульфит натрия. Для связывания кислорода в 1 л объема берут 100 мл свежеприготовленного 20% раствора Na2S204и 16 мл 50% КОН.
3. Использование веществ — редуцентов, к которым относятся тиогликолевая кислота или тиогликолат натрия (0,01-0,02%), аскорбиновая кислота (0,1%), различные сахара (0,1-3%), цистин и цистеин (0,03-0,05%), муравьинокислый натрий (0,25-0,75%) и др.
Применение газогенерирующих систем для создания анаэробных условий в замкнутой воздушной среде (микроанаэростатах, эксикаторах, прозрачных газонепроницаемых пластиковых пакетах). Для образования водорода и двуокиси углерода, необходимых для роста облигатных анаэробов, используют специальные таблетки, которые активируются добавлением воды. Водород, генерируемый таблетками боргидрида натрия, связывает кислород воздуха в присутствии палладиевого катализатора с образованием воды. Углекислый газ вырабатывается при взаимодействии лимонной кислоты с бикарбонатом натрия.
Биологические методы
1. Совместное выращивание анаэробов и аэробов (метод Фортнера). При этом на одну половину чашки Петри с плотной питательной средой засевают исследуемый материал, а на другую — культуру аэробного микроорганизма, способного энергично поглощать кислород. После посева чашку закрывают крышкой, края которой для герметизации заливают парафином или заклеивают пластилином. В качестве активного поглотителя кислорода из замкнутого пространства часто используют культуру “чудесной палочки” (Serratia marcescens), которая является своеобразным индикатором качества анаэробиоза. При недостаточной герметизации чашки этот микроорганизм образует ярко-красный пигмент, а при сохранении строго анаэробных условий вырастают бесцветные или бледно-розовые колонии.
2. Помещение в питательную среду кусочков печени, головного мозга, почек и других внутренних органов. При этом тканевые клетки активно поглощают и адсорбируют на себе кислород, в результате чего в среде создаются анаэробные условия. Примером питательной среды, сконструированной по этому принципу, является содержащая кусочки печени среда Китта — Тароцци. К тому же в печеночной ткани содержится большое количество веществ с SH-группой (цистеин, глютатион и др.), обладающих сильным редуцирующим действием.
3. Культуры некоторых облигатных анаэробов можно поддерживать путем пассажа на лабораторных животных, однако в настоящее время этот метод используется достаточно редко.
Комбинированные методы основаны на сочетании физических, химических и биологических методов создания анаэробиоза, и используются в большинстве практических лабораторий. Для работы с наиболее чувствительными к молекулярному кислороду анаэробами используют строгую анаэробную технику (метод Хангейта). Принцип метода заключается в использовании лишенных кислорода питательных сред, воздух над которыми удаляется и замещается бескислородным газом.
III. План практической работы
1. Изучить аппаратуру для стерилизации, культивирования бактерий аэробов и анаэробов, зарисовать схему устройства микроанаэростата
2. Изучить технику и зарисовать схемы посевов исследуемого материала на питательные среды с целью получения изолированных колоний
3. Выписать цель и схему бактериологического метода исследования
6. Посеять смесь бактерий истощающим штрихом на МПА с целью выделения чистой культуры
7. Решить ситуационные задачи
IV. Примеры ситуационных задач
Ситуационная задача № 1
Из материала больного выделили кишечную палочку. Какие питательные среды используют для того, чтобы выделить чистую культуру и отличить ее от других представителей кишечной микрофлоры:
1. Дифференциально-диагностические среды
2. Универсальные среды
3. Среды обогащения
4. Синтетические среды
Ситуационная задача № 2
Для проведения бактериологических исследований необходимо подготовить стерильные чашки Петри, пипетки, колбы и др. посуду. Какой метод стерилизации используют:
1. Стерилизацию сухим жаром
2. Стерилизацию облучением
3. Химическую стерилизацию
4. Стерилизацию текучим паром
Ситуационная задача № 3
Из больного с опасением на анаэробную инфекцию взяли материал (раневой экссудат). Какие среды используют для культивирования возбудителя:
1. Среду Китта-Тароцци
2. Среду Вильсона — Блера
3. Среду Плоскирева
Ситуационная задача № 4
Врач-бактериолог в мазке из исследуемого материала выделил смесь нескольких микроорганизмов. Что необходимо для дальнейшей идентификации возбудителя:
1. Получение чистых культур микроорганизмов
2. Посев исследуемого материала на среду накопления
3. Произвести реакцию агглютинации с поливалентными сыворотками
4. Произвести посев материала на ряд Гиса

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Читайте также:

