Кровотечения при язвенной болезни луковицы двенадцатиперстной кишки
Обновлено: 05.10.2024
При этом очевиден ряд противоречий. Во-первых, сегодня нет четкого указания на то, какое кровотечение следует считать рецидивным, во-вторых, доминирует мнение о том, что при наиболее тяжелом состоянии больных сначала следует добиться его стабилизации путем временного гемостаза и только потом оперировать [2, 15, 16].
Из этого следует, что для улучшения результатов лечения больных с язвенными кровотечениями, а также для стандартизации полученных результатов и возможности их корректного сравнения необходимо прежде всего четко определить само понятие рецидива кровотечения.
Цель данной работы - оптимизировать тактику лечения больных с остановившимся кровотечением из язвы двенадцатиперстной кишки путем уточнения самого понятия рецидива кровотечения и конкретизации показателей прогнозирования развития рецидива.
Материал и методы
Исследование проводилось в три этапа. Всего в исследование были включены 279 пациентов. Всем пациентам при поступлении в стационар была произведена фиброгастродуоденоскопия (ФГДС), признаки язвенного кровотечения у этих больных описаны эндоскопистом как Forrest 2b.
Критерии включения в исследование:
1) экстренная госпитализация по поводу язвенного дуоденального кровотечения, но с остановившимся кровотечением, что было подтверждено при ФГДС;
2) Язвенное дуоденальное кровотечение у всех больных в анамнезе в различные сроки до госпитализации.
Все больные поступали в экстренном порядке в Самарскую ГКБ №1 им. Н.И. Пирогова и клиники Самарского государственного медицинского университета в период с 1995 по 2006 г.
При поступлении всем без исключения больным проводили тщательное физикальное обследование. Выполняли обязательное исследование содержания гемоглобина, эритроцитов крови, гематокрита, определяли группу крови и резус-фактор, время свертывания крови. Для определения тяжести кровопотери использовали классификацию А.И. Горбашко [4]. У 176 (63,1%) пациентов было выполнено развернутое исследование гемостаза. Удаленные во время операции участки кишки с язвой исследовали гистологическим методом и сопоставляли полученные данные с эндоскопической картиной. Морфологические препараты готовили по стандартной методике, окрашивали гематоксилином и эозином под микроскопом Leica Galen ІІІ (объектив 40, окуляр 10).
Сначала ретроспективно всех больных мы разделили на 2 группы. 1-я группа - 223 пациента, у которых при поступлении в стационар остановившееся кровотечение не возобновлялось, а операции отдельным больным выполнялись на основании признаков возможного рецидива кровотечения.
2-я группа - 56 пациентов с остановившимся дуоденальным кровотечением, у которых после поступления в стационар оно возобновилось в течение ближайших 2 нед. Этих пациентов оперировали только при возобновлении кровотечения.
Следует особо отметить общие моменты для пациентов обеих групп:
- у всех больных по данным ФГДС кровотечение трактовалось как Forrest 2b;
- в первые сутки пребывания в стационаре ни один пациент не был оперирован;
- метод эндоскопического временного гемостаза не применялся;
- консервативное лечение при поступлении было одинаковым и заключалось в назначении дицинона, викасола, 1% хлористого кальция. Проводили переливание до 800 мл одногруппной свежезамороженной плазмы. Противоязвенная терапия заключалась в применении кваматела по 20 мг внутривенно 2 раза в день или омепразола по 20 мг внутрь 2 раза в день. С целью воздействия на Helicobacter pylori проводили антибактериальную терапию (метронидазол по 250 мг внутрь в день и ампициллин по 1,0 г внутримышечно 4 раза в день в течение 10 дней).
В ходе исследования было проведено сопоставление:
1) летальности в обеих группах;
2) выраженности нарушений показателей гемостаза в различных группах больных;
3) морфологического состояния язвы в удаленных препаратах у больных, оперированных по поводу рецидива кровотечения в течение ближайших 2 нед.
Результаты
На первом этапе мы исследовали влияние сроков повторения кровотечения из язвы двенадцатиперстной кишки на результаты лечения.

Характер выполненных операций представлен в таблице.
В 1-й группе на основании критериев угрозы рецидива кровотечения были оперированы 39 (17,5%) человек. Из 39 оперированных умер 1 пациент. Послеоперационная летальность составила 2,6%.
Во 2-й группе были оперированы 56 (100%) человек. В послеоперационном периоде умерли 10 больных. Послеоперационная летальность составила 17,9%.
Разница показателей послеоперационной летальности статистически достоверна. χ 2 Пирсона составил 3,86 (р 9 /л, то вероятность рецидива кровотечения составляла 67%.
Третий этап исследования был морфологическим. Мы оценивали степень эпителизации язвенного дефекта и сопоставляли эти данные с результатами ФГДС. Оказалось, что у всех оперированных больных с рецидивом кровотечения эпителизация язвы не началась. Точно такая же картина имелась в препаратах язв у больных, которых мы оперировали до начала рецидива кровотечения, ориентируясь только на признаки угрозы возможного рецидива.

Типичная картина язвенного дефекта при рецидиве кровотечения из язвы двенадцатиперстной кишки представлена на рисунке. Рисунок 1. Кровоточащая язва двенадцатиперстной кишки больного С., 42 лет. Зона фибриноидного некроза без признаков эпителизации. Окраска гематоксилином и эозином. Объектив 40, окуляр 10.
На всех препаратах отчетливо видно, что эпителизация дуоденальной язвы еще не началась. С точки зрения морфологов, под началом эпителизации язвы следует понимать наползание клеток эпителия слизистой двенадцатиперстной кишки на край язвенного дефекта [12].
Проведя сравнительный анализ результатов исследования гемостаза (тромбоцитарное звено), данных морфологического исследования и результатов ФГДС, мы обнаружили, что они коррелируют с вероятностью 96%.
В наше время сохраняют актуальность слова Б.С. Розанова [10], который писал, что если бы хирург располагал какими-нибудь средствами, позволяющими предугадать, остановится ли данное кровотечение самостоятельно или на это рассчитывать нельзя, то вопрос тактики лечения решался бы совсем просто и никаких разногласий в выборе методов лечения не было бы.
Хорошо известно, что тактика лечения при рецидиве язвенного дуоденального кровотечения и при повторном кровотечении из язвы двенадцатиперстной кишки различна. Так, при рецидиве кровотечения из язвы всем больным показано экстренное оперативное лечение, при повторном кровотечении из язвы вопрос об операции и ее срочности должен решаться индивидуально в зависимости от характеристик развившегося эпизода кровотечения (продолжается кровотечение или нет, его интенсивность, объем кровопотери). Именно поэтому для четкого планирования действий хирурга важно дать четкое определение рецидива кровотечения.
По нашему мнению, для решения вопроса о том, чем является развившийся эпизод кровотечения - рецидивом кровотечения или повторным кровотечением из язвы, следует учитывать такие моменты, как подтвержденный при ФГДС факт остановки кровотечения и факт компенсации развившихся при кровопотере патологических изменений. И если ответ на первый вопрос прост (для этого надо лишь повторить ФГДС), то для ответа на второй вопрос необходимо учитывать ряд факторов. Это и состояние системы гемостаза, и степень компенсации кровопотери, и состояние язвенного дефекта. Так, под началом эпителизации язвенного дефекта эндоскописты понимают появление сглаженности краев язвы и уменьшение диаметра язвы [11]. При этом эндоскопические признаки начала эпителизации всегда проявляются позднее фактического начала этого процесса.
С нашей точки зрения, целесообразно в качестве ориентира использовать такой морфологический показатель, как начало эпителизации язвенного дефекта. Следовательно, рецидивным надо считать кровотечение из язвы, развившееся до появления признаков начала эпителизации, повторным - кровотечение, которое развивается после начала эпителизации язвенного дефекта. Временной фактор у разных пациентов будет различаться и зависеть от индивидуальных особенностей каждого организма компенсировать кровопотерю.
Таким образом, принципиально мы можем выделить два признака, на основании которых следует трактовать кровотечение как рецидивное.
Первый признак - это состояние системы гемостаза, а более конкретно - состояние тромбоцитарного звена гемостаза. По нашему мнению, его следует оценивать по таким показателям, как количество тромбоцитов и их способность к адгезии и агрегации. Критическим нужно признать количество тромбоцитов менее 120·10 9 /л. При таких и более низких показателях вероятность рецидива кровотечения из язвы составила 67%. Следовательно, проводя лечение больных с остановившимся кровотечением, необходимо контролировать именно этот показатель и при критических значениях целесообразно принимать решение об операции, не дожидаясь рецидива кровотечения.
Второй признак - оценка язвенного дефекта по данным ФГДС.
В работе, посвященной терапии длительно рубцующихся язв, показано, что эпителизация язвы не начинается до того, как наступит полное восстановление гомеостаза [13]. Наше исследование полностью подтвердило данное положение. Если кровотечение из язвенного дефекта развилось до начала его эпителизации, оно без сомнения рецидивное и следует предпринять самые активные хирургические действия для спасения жизни больного.
Таким образом, рецидив язвенного дуоденального кровотечения - это такое кровотечение, которое наступает до начала эпителизации язвы.
Исследование тромбоцитарного звена гемостаза следует признать обязательным экстренно выполняемым тестом у всех больных с язвенным кровотечением. Критическим в плане угрозы рецидива кровотечения нужно считать содержание тромбоцитов менее 120·10 9 /л.
Летальность больных при рецидиве язвенного дуоденального кровотечения статистически достоверно выше, чем при повторном кровотечении из язвы двенадцатиперстной кишки.
Комментарий
Определяя вероятность рецидива кровотечения из язвы, авторы не учитывают простых эндоскопических признаков (локализация язвы по малой кривизне или по задней стенке луковицы двенадцатиперстной кишки, глубина и размеры язвенного дефекта, диаметр тромбированного сосуда). Современные возможности эндоскопического исследования, совмещенного с УЗИ и дуплексным сканированием, позволяют точно определить диаметр сосуда, прилежащего к язве, и, соответственно, решить вопрос о вероятности рецидива кровотечения. Не вызывает сомнения, что эндоскопические признаки начала эпителизации язвенного дефекта являются важным фактом, свидетельствующим о хорошем эффекте проводимой терапии, но определение тактики лечения не должно опираться только на этот признак [4, 5].
Коллективом авторов проделана большая и трудная работа, результаты которой легли в основу статьи. Каждая публикация, посвященная лечению гастродуоденальных кровотечений, имеет практическую значимость и увеличивает наши знания о состоянии проблемы.
Проф. А.Г. Кригер
Литература
1. Винокуров М.М., Капитонова М.А. Тактика лечения больных с язвенным гастродуоденальным кровотечением. Хирургия 2008; 2: 33-36.
2. Захараш М.П., Полинкевич Б.С, Бекмурадов А.Р. Способ дренирования желудка в сочетании с ваготомией в лечении постбульбарных язв. Хирургия 2009; 2: 35-39.
3. Казымов И.Л., Курбанов Ф.С. Тактика лечения кровоточащих гастродуоденальных язв. Хирургия 2009; 1: 33-37.
4. Панцырев Ю.М., Федоров Е.Д., Михалев А.И. Кровотечения из верхних отделов пищеварительного тракта. В кн.: Руководство по неотложной хирургии органов брюшной полости. Под ред. Савельева В.С. М 2004.
5. Старков Ю.Г., Курбонов Х.Х., Солодинина E.П., Шишин К.Г. Эндоскопическая диагностика и лечение послеоперационных желудочно-кишечных кровотечений Хирургия 2008; 4: 4-10.
6. Федоров В.Д. Экстирпация желудка без наложения эзофагоэнтероанастомоза при профузных желудочных кровотечениях. Хирургия 2008; 3: 4-9.
Язвенная болезнь двенадцатиперстной кишки - мультифакториальное заболевание с образованием язв двенадцатиперстной кишки (ДПК), с возможным прогрессированием, хронизацией и развитием осложнений.
Острая язва представляет собой глубокий дефект слизистой оболочки, который проникает до собственно мышечной пластинки слизистой оболочки и глубже. Причины образования острой язвы аналогичны таковым при эрозиях. Острые язвы чаще одиночны; имеют округлую или овальную форму; на разрезе имеют вид пирамиды. Размер острых язв - от нескольких мм до нескольких см. Локализуются на малой кривизне. Дно язвы покрыто фибринозным налетом, она имеет ровные края, не возвышается над окружающей слизистой оболочкой и не отличается от нее по цвету. Зачастую дно язвы имеет грязно-серую или черную окраску вследствие примеси гематина-гидрохлорида.
Микроскопически: слабо или умеренно выраженный воспалительный процесс в краях язвы; после отторжения некротических масс на дне язвы - тромбированные или зияющие сосуды. При заживлении острой язвы в течение 7-14 дней образуется рубец (неполная регенерация). При редком неблагоприятном исходе возможен переход в хроническую язву.
Язва двенадцатиперстной кишки острая с кровотечением является осложнением стрессорных (симптоматических) язв в ДПК.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация Forrest (1974) играет важную роль при оценке риска рецидива кровотечения и смерти пациента. На основании эндоскопической картины возможно определить объем эндоскопических манипуляций для достижения гемостаза или определить показания к оперативному вмешательству.
В плане диагностики и значимости прогноза рецидива тип IIА (видимый сосуд) вызывает наибольшие дискуссии. Видимый сосуд в дне язвы может быть представлен "часовым" тромбом или "жемчужным" бугорком.
"Часовой" тромб представляет собой тромб, закупоривающий дефект в эрозированном сосуде, и выглядит, как красный или черный бугорок, выступающий над желтым дном язвы. В ряде случаев вокруг "часового" тромба может быть видна часть сохранившейся стенки сосуда в виде жемчужного ободка.
"Жемчужный" бугорок представляет собой эрозированный сосуд, дефект в стенке которого закрыт за счет его спазма, а не тромбом. Бугорок имеет жемчужно-белесый цвет и возвышается над дном язвы.
Наличие или отсутствие видимого сосуда ряд исследователей рекомендуют отражать в протоколе знаками "v+" и" v-". Таким образом, наличие "жемчужного" бугорка или "часового" тромба с жемчужным ободком будет трактоваться как тип FIIА v+ (риск рецидива кровотечения в этом случае особенно велик). Тип FIIА v- диагностируется при наличии "часового" тромба без жемчужного ободка.
Сравнительное изучение эндоскопической картины и морфологических исследований установило, что если при ЭГДС в дне язвы обнаружен жемчужного цвета бугорок или красный бугорок с жемчужным ободком (тип FIIА v+), то при морфологическом исследовании сосудистая стенка выступает над дном язвы и присутствует более тяжелое повреждение сосудистой стенки, чем в тех случаях, когда при ЭГДС выявляется "часовой" тромб без жемчужного ободка (тип FIIА v-) (Chen и соавт., 1997).
В исследованиях J.W. Law и соавт. (1998) показано, что у большинства больных эрозированный сосуд прикрыт фиксированным тромбом-сгустком.
Риск рецидива кровотечения считается невысоким при эндоскопической картине, соответствующей типу FIIС (плоское черное пятно).
При морфологическом исследовании у 20% больных с чистым (белым) дном (тип FIII) обнаруживают эрозированный сосуд в дне язвы. По-видимому, белый цвет сосуда не виден при эндоскопическом осмотре из-за маскировки фибрином. В этой ситуации клиническая картина и лабораторные данные имеют особенную значимость для эндоскописта, поскольку определенные ограничения обычной визуальной оценки создают предпосылки для ошибочного определения риска рецидива кровотечения, как минимального. Использование видеоэндоскопа и допплеровского исследования повышает возможности обнаружения сосуда в дне язвы.
Вопрос о дальнейшей тактике ведения больного решается после визуальной оценки источника кровотечения.
Этиология и патогенез
Симптоматические гастродуоденальные язвы
1. "Стрессовые" язвы:
- - язвы Курлинга - при распространенных ожогах;
- - язвы Кушинга - при черепно-мозговых травмах, кровоизлияниях в головной мозг, нейрохирургических операциях;
- - язвы при других стрессовых ситуациях: инфаркте миокарда, сепсисе, тяжелых ранениях и полостных операциях.
2. Лекарственные язвы.
3. Эндокринные язвы:
4. Гастродуоденальные язвы при некоторых заболеваниях внутренних органов:
- - при хронических неспецифических заболеваниях легких;
- - при ревматизме, гипертонической болезни и атеросклерозе;
- - при заболеваниях печени ("гепатогенные" язвы);
- - при заболеваниях поджелудочной железы ("панкреатогенные" язвы);
- - при хронической почечной недостаточности;
- - при ревматоидном артрите;
- - при прочих заболеваниях (сахарном диабете, эритремии, карциноидном синдроме, болезни Крона Болезнь Крона - заболевание, при котором отдельные участки пищеварительного тракта воспаляются, утолщаются и изъязвляются.
Подробно ).
Эпидемиология
Признак распространенности: Крайне редко
В целом риск кровотечения при язвенной болезни ДПК составляет 15-20%.
Кровотечение при язвенной болезни ДПК составляет около 30% всех кровотечений из верхнего отдела желудочно-кишечного тракта.
Причины кровотечения из ДПК могут быть не связаны непосредственно с язвенной болезнью ДПК (например, 10% при дуодените Дуоденит - воспаление двенадцатиперстной кишки.
, около 15% при циррозе печени и пр.).
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Гематемезис проявляется в виде рвоты кровью, либо рвотой в неизмененном виде, либо рвотой в виде темно-коричневого зернистого вещества ("кофейная гуща") - формируется в результате длительного нахождения крови в желудке и превращения соляной кислотой гемоглобина в метгемоглобин.
Мелена (появление измененной крови в прямой кишке) распознается по черному жидкому стулу, иногда с красным оттенком (когда кровь свежая и имеет характерный резкий запах). Это происходит из-за окисления гема кишечными и бактериальными ферментами и показывает, что источник кровотечения, вероятно, находится в верхнем отделе ЖКТ и определенно проксимальнее илеоцекального Илеоцекальный - относящийся к области соединения подвздошной и слепой кишки.
соустья. Следует иметь в виду, что мелена может продолжаться в течение нескольких дней после остановки активного кровотечения. Этот факт может сбивать врачей с толку. Кроме того, необходимо отличать мелену от результатов приема внутрь препаратов железа, вызывающих появление липкого, но сравнительно твердого стула серо-черного цвета.
Ректальное кровотечение неизмененной кровью напрямую предполагает, что источник кровотечения - толстая, прямая кишка или анальное отверстие. Однако, следует помнить, что интенсивное кровотечение из верхнего отдела ЖКТ может проявляться таким же образом. Поэтому у пациента с массивным ректальным кровотечением неизмененной кровью, особенно при наличии признаков гипoволемии, следует исключить кровотечение из желудка или ДПК.
Если пациенты прежде подвергались хирургическому вмешательству на аорте с установкой протеза, следует рассмотреть возможность аорто-энтерального свища с консультацией сосудистого хирурга.
Клинические признаки острой или хронической постгеморрагической анемии начинают выявляться лишь спустя несколько дней после язвенного кровотечения.
Диагностика
Эндоскопическое исследование с помощью гибкого эндоскопа является наиболее важным при обследовании пациентов с острым кровотечением из ДПК. Даже когда эндоскопическое исследование проводят не по жизненным показаниям, его следует выполнить в течение суток после поступления, поскольку это увеличивает вероятность установления диагноза и улучшает общие результаты лечения.
Эндоскопические признаки пептической язвы, которая кровоточила или все еще кровоточит, обеспечивают ценную прогностическую информацию, которая может быть использована для прогнозирования исхода и риска повторного кровотечения.
Эндоскопические признаки язвы с кровотечением:
1. Активное артериальное кровотечение.
Свидетельствует об эрозии артерии или артериолы. Хотя исследования указывают на то, что этот тип кровотечения может самопроизвольно остановиться у 40% пациентов, такое кровотечение рассматривают, как абсолютное показание к вмешательству.
3. Видимый сосуд - представляет собой возвышающееся в дне язвы патологическое образование - обнаженный сосуд или организовавшийся тромб, закрывший отверстие в подлежащем сосуде. Такое патологическое изменение является значимым, поскольку несет существенный риск повторного кровотечения в случае не проведения лечения.
Сложно установить точно степень риска, поскольку между эндоскопистами существует значительное расхождение во мнении, что будет происходить с видимым сосудом далее, но вероятность кровотечения находится в пределах 30-50%.
4. Плотно прилегающий кровяной сгусток.
Трудно дифференцируется с видимым сосудом, но данное различение и не является категорически необходимым, так как вызвавшие их причины обычно идентичны.
5. Красная /ноская поверхность или черное пятно.
Указывает на засохшую кровь в некротизированном дне язвы и имеет мало значения, частота повторного кровотечения составляет менее 5%.
Эти признаки изменяются достаточно быстро, а исследование, проведенное в Китае, показывает, что видимый сосуд исчезает примерно через 4 дня.
Другие методы необходимы, когда с помощью эндоскопического исследования, выполненного опытным эндоскопистом, не удается установить диагноз.
В случае когда крови не видно, а пациент гемодинамически нестабилен и остаются признаки кровотечения, то, скорее всего, наилучшей дальнейшей тактикой будет немедленное проведение мезентериальной ангиографии Ангиография - рентгенологическое исследование кровеносных и лимфатических сосудов после введения в них контрастного вещества.
.
Если у пациента возникают периодические кровотечения, определить источник кровопотери с помощью ангиoграфии иногда не удается. В этом случае сцинтиграфия с помощью меченых эритроцитов может обеспечить полезную информацию. Берут пробу крови, эритроциты метят изотопом, например, Wm Tc-метил бисфосфонатом или "' In (индием), и затем инъецируют кровь пациенту. При возникновении кровотечения часть клеток будет поступать в кишку, и их будет видно по изолированному "покраснению" на изображении, полученном с помощью гамма-камеры. Однако определение источника может быть неточным, т.к. кровь, однажды поступив в кишечник, быстро распространяется по нему. По этой причине важно регулярно и часто проводить сцинтиграфию в течение длительного времени, что, как правило, невыполнимо.
При неэффективности данных методов и продолжающейся кровопотере решается вопрос о диагностической лапарoтомии с ревизией ЖКТ.
Лабораторная диагностика
Необходимые исследования:
- ОАК;
- биохимия (печеночные пробы, электролиты);
- коагулограмма;
- анализ кала на скрытую кровь;
- определение группы крови и резус-фактора.
Дифференциальный диагноз
- кровотечений из других отделов ЖКТ (пищевода, желудка, тонкого и толстого кишечника);
- кровотечений неязвенной этиологии (аортодуоденальная фистула, карцинома ампулы, карцинома поджелудочной железы, гемобилия, панкреатит, цирроз печени, эрозивный дуоденит, коагулопатия и прочие).
Осложнения
Лечение
Когда у пациента с острым желудочно-кишечным кровотечением обнаруживают один из симптомов, характерных для язвы ДПК с кровотечением, используют следующий план оценки состояния и тактики ведения пациента:
3. Установить с помощью катетера крупного размера периферический венозный доступ, провести пробу на перекрестную совместимость крови и оценить состояние свертывающей системы крови.
4. Если пациент гемодинамически стабилен, требуется собрать полный анамнез, провести полный осмотр и продолжить обследование, выполняя его оперативно.
5. Если пациент гемодинамически нестабилен, следует немедленно начинать интенсивную инфузионную терапию. Если быстро достигается адекватный пульс и АД и их можно поддерживать без агрессивной инфузионной терапии, то пациента ведут далее, как гемодинамически стабильного. Однако, при возникновении каких-либо сложностей в достижении стабилизации, необходимо быстро обследовать пациента, нередко продолжая при этом интенсивную терапию.
Тактика инфузионно-трансфузионной терапии при шоке, вызванном острой кровопотерей:
1. Восполнение ОЦК производится коллоидно-солевыми растворами в соотношении 1:3-4. В качестве коллоидов рекомендуются производные ГЭК. "Стартовым" раствором являются кристаллоиды.
2. Целевой уровень АД сист. до остановки кровотечения рекомендуется поддерживать на уровне 90 мм.рт.ст. (при "рабочем" АД сист. пациента до 160 мм.рт. ст.)
3. Гемотрансфузии по показаниям - при Hb небольших кровоточащих сосудов скобками.
После остановки кровотечения пациенты должны получать этиотропную терапию, в т.ч. направленную на эрадикацию хеликобактерной инфекции ( если таковая доказана).
Прогноз
В основном благоприятный, но зависящий от множества факторов.
Подавляющее большинство кровотечений из язв ДПК заканчивается спонтанно или под влиянеим консервативной терапии.
Факторы, отягощающие прогноз:
- прием НПВС, антикоагулянтов;
- возраст;
- повторные кровотечения;
- сопутствующая патология.
Госпитализация
Профилактика
Своевременная диагностика и адекватное лечение язвенной болезни ДПК. Выявление факторов риска и их коррекция.
Наилучшим способом лечения кровотечения из дуоденальной язвы является резекция желудка, будь то гемигастрэктомия в сочетании со стволовой ваготомией или резекция 70% желудка. К местному гемостазу можно прибегать у пациентов в угрожающем состоянии, чтобы избежать выполнения резекции. Однако местный гемостаз не исключает возможности рецидива кровотечения, что случается достаточно часто. Для проведения местного гемостаза при кровотечении из дуоденальной язвы можно выполнить разрез длиной 3 см на передней стенке двенадцатиперстной кишки, который должен начинаться на 15 мм ниже привратника. Можно также произвести дуоденопилороантральный разрез (длиной 5 см), 2 см которого захватывают двенадцатиперстную кишку и приблизительно 3 см — антральный отдел желудка. Это тот же разрез, который используется при выполнении пилоропластики по Heineke—Mikulicz.
При массивных язвенных кровотечениях из даенадцатиперстной кишки, которые обычно случаются при локализациях язв на задней дуоденальной стенке с пенетрацией в поджелудочную железу, гемостаз представляет собой нелегкую задачу. В большинстве случаев массивное кровотечение из дуоденальной язвы является следствием эрозии дуоденального артериального комплекса, описанного Berne и Rosoff в 1969 году. Реже кровотечение из дуоденальной язвы не имеет отношения к этому комплексу. Если кровотечение связано с артериальным комплексом, то необходимо лигировать желудочно-даенадцатиперстную артерию выше, ниже и латеральнее места эрозии. Если эта артерия перевязана только выше кровоточащего участка, кровотечение будет продолжаться, так как кровь будет поступать через правую желудочно-сальниковую и верхнюю и переднюю поджелудочно-двенадцатиперстные ветви желудочно-даенадцатиперстной артерии.
Прошивание желудочно-двенадцатиперстной артерии выше и ниже эрозированного участка может оказаться недостаточным в случаях, когда поперечная артерия поджелудочной железы отходит медиально от желудочно-даенадцатиперстной артерии. Для проведения гемостаза с минимальным риском рецидива кровотечения необходимо выполнить тройное прошивание по Бете и Rosoff. Если источником кровотечения не являются артерии из гастродуоденального артериального комплекса, швы следует накладывать так же. как при язвах желудка.
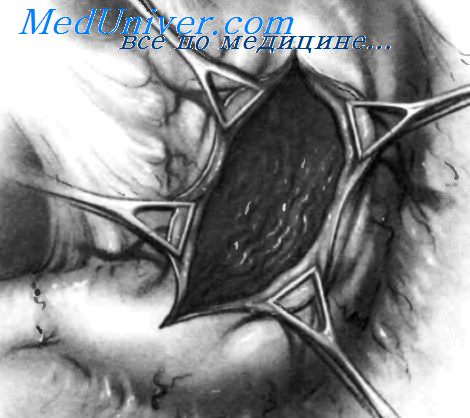
У пациентов с кровотечением из дуоденальных язв, расположенных в постбульбарной области или в нисходящей части двенадцатиперстной кишки, огромное значение приобретает местный гемостаз, позволяющий избежать выполнения резекции, которая очень опасна из-за близости язвы к большому дуоденальному сосочку и общему желчному протоку.
Осуществив местный гемостаз, некоторые хирурги заканчивают операцию проксимальной желудочной ваготомией или стволовой ваготомией с пилоропластикой. Если из-за наличия диагностического дуоденального разреза невозможно выполнить надежную пилоропластику, можно произвести гастроеюностомию, пилоропластику по Finney или гастродуоденостомию по Jaboulay.
У пациентов с кровотечением из язвы анастомоза операцией выбора, если позволяет состояние пациента, является резекция желудка. Если пациенту ранее уже выполнялась резекция желудка, необходимо выполнить повторную резекцию. Если пациенту ранее выполнялась ваготомия, следует выполнить контрольную повторную ваготомию, предпочтительно наддиафрагмальным доступом. У пациентов в очень тяжелом состоянии следует прибегнуть к местному гемостазу. Однако осуществить местный гемостаз бывает нелегко, если язва анастомоза возникает у пациента с выполненной ранее обширной резекцией желудка и позадиободочным анастомозом. У некоторых из этих пациентов местный гемостаз можно осуществить только с использованием торакоабдоминального доступа. Этот разрез следует использовать для выполнения наддиафрагмальной ваготомии.
На передней стенке желудка выполнен срединный разрез для ревизии его внутренней поверхности чтобы найти источник кровотечения и, при необходимости, осуществить местный гемостаз.
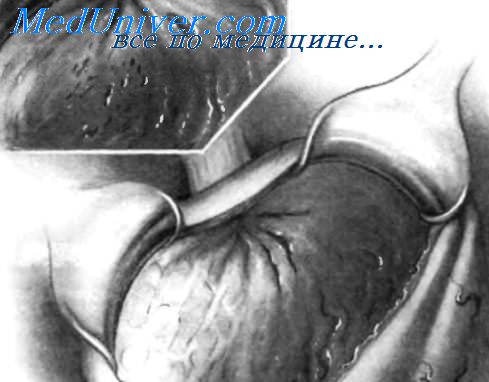
Передняя стенка желудка рассечена, и его края захвачены большими зажимами Duval. Это обеспечивает временную остановку кровотечения из многочисленных сосудов, расположенных в стенке желудка. Тракции, выполняемые с помощью этих зажимов, позволяют широко открыть желудок для его ревизии. Все сгустки крови из желудка необходимо удалить вручную.
Использование крючков для ревизии верхней части желудка позволяет улучшить качество исследования. На фрагменте А представлен тяжелый эрозивный гастрит с несколькими массивно кровоточащими острыми язвами. На фрагменте В изображено кровотечение из разрыва слизистой оболочки желудка вблизи пищеводно-желудочного соединения (синдром Mallory-Weiss). На фрагменте С изображена леиомиома желудка вблизи кардии, явившаяся причиной кровотечения.
Здесь показана массивно кровоточащая язва желудка, расположенная на задней стенке по малой кривизне. Местный гемостаз осуществляют прошиванием язвы нерассасывающимися нитями. Необходимое количество швов определяется размерами язвы и их эффективностью для остановки кровотечения.
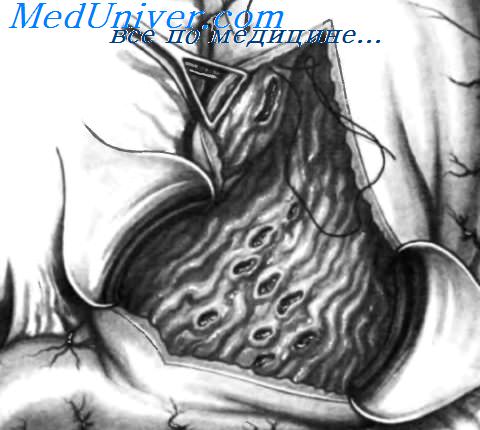
Массивное кровотечение из язвы желудка, локализованной в верхней его части на задней стенке около большой кривизны. Местоположение язвы показано пунктирной линией в форме овала. Передняя стенка желудка вскрыта и ее края удерживаются атравматическими зажимами Duval. Локализация язвы препятствует проведению адекватного местного гемостаза. Чтобы облегчить наложение гемостатических швов, желудочно-ободочная связка пересечена и перевязана на достаточном протяжении, что позволило инвагинировать большую кривизну и вывести язву в положение, более удобное для проведения местного гемостаза.
У некоторых пациентов невозможно предотвратить возникновение массивного кровотечения из острых язв желудка, несмотря применение очень эффективных профилактических средств, доступных в настоящее время. К операции следует прибегать в случаях, когда массивное кровотечение из острой язвы желудка не удается остановить с помощью медикаментозной терапии и эндоскопических методов. При тяжелом кровотечении некоторым пациентам может быть показана резекция желудка. Острые язвы желудка обычно невозможно обнаружить пальпаторно, поэтому их локализацию нельзя установить при осмотре желудка снаружи. Для того чтобы быть уверенным, что самая высокая кровоточащая язва резецирована, полезно обозначить ее месторасположение скобкой или швом, который затем иссекают при резекции, как показано на рисунке.
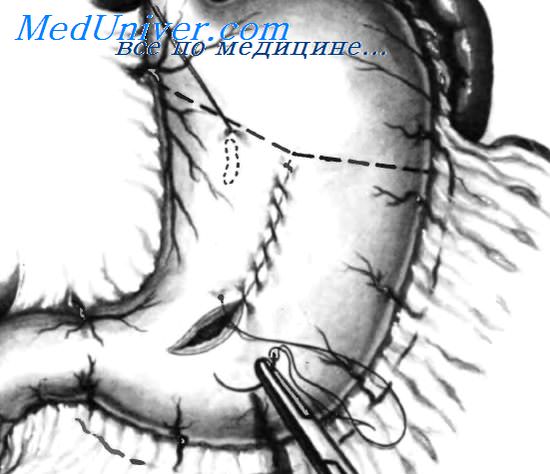
Самая высокая кровоточащая острая язва отмечена швом. Гастротомическое отверстие ушито непрерывным швом, после чего немедленно выполнена резекция желудка. Верхняя граница резекции показана пунктирной линией. Самая высокая язва обозначена пунктирной линией в форме овала.
Обычно синдром Mallory-Weiss, возникающий при разрывах слизистой оболочки желудка вблизи пищеводно-желудочного соединения, успешно лечится медикаментозными и эндоскопическими методами. В некоторых случаях бывает необходимо произвести оперативное вмешательство и осуществить гемостаз посредством ушивания разорванной слизистой оболочки, как показано на фрагменте рисунка.
У некоторых пациентов, имеющих показания к оперативному лечению по поводу кровоточащей язвы желудка, гемостаз может быть достигнут клиновидной резекцией содержащего язву участка. Однако показания выполнению клиновидной резекции очень ограничены. Клиновидная резекция выполнима, если кровоточащая язва расположена на малой кривизне несколько выше вырезки. Если язва расположена проксимальнее, выполнение клиновидной резекции затруднительно или невозможно. Если язва локализована ниже вырезки, клиновидная резекция противопоказана, так как при этом будут рассечены нервы Latarjet. Сразу после выполнения резекции дефект ушивают, как показано на рисунке.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

Гастродуоденальные кровотечения могут осложнять различные заболевания пищевода, желудка, двенадцатиперстной кишки, гепатопанкреатобилиарной системы, и от того, насколько клиницист ориентирован в современных методах диагностики и адекватном выборе тактики лечения, в конченом счете зависит жизнь больного [1].
По современным данным, кровотечения из верхних отделов желудочно-кишечного тракта (ЖКТ) занимают главенствующее место в структуре всех гастродуоденальных кровотечений и составляют 80–90% случаев [2]. Ежегодная заболеваемость среди взрослого населения составляет от 48 до 160 случаев в год на 100 тыс. человек [3, 4]. Актуальность проблемы подчеркивается уровнем летальности, которая колеблется от 6 до 14%, а в группе пациентов с тяжелым кровотечением достигает 50% [2, 3, 5].
Среди причин кровотечений из верхних отделов ЖКТ выделяют две большие группы – кровотечения язвенной природы (44–49% случаев) и кровотечения неязвенной природы (51–56% случаев) (табл. 1) [1].
Стоит отметить, что на сегодняшний момент в мире язвенная болезнь желудка и двенадцатиперстной кишки относится к наиболее частым заболеваниям (от 5 до 15%, в среднем 7–10% взрослого населения) и занимает второе место после ишемической болезни сердца [6, 7]. В РФ заболеваемость язвенной болезнью желудка и двенадцатиперстной кишки составила 157,6 на 100 тыс. населения [7, 8].
В последнее время в иностранной литературе нередко отмечается тенденция к снижению распространенности язвенной болезни желудка и двенадцатиперстной кишки в странах Западной Европы и Северной Америки, однако этот процесс не коррелирует с частотой язвенных кровотечений [3, 5]. При этом, несмотря на эффективность современной терапии, число больных с язвенными кровотечениями увеличивается [9]. По данным российских авторов, за последние 8–10 лет количество пациентов с язвенными кровотечениями возросло в 1,5 раза [1].
Представляется, что причины высокой частоты язвенных кровотечений в странах Европы и Северной Америки и России различны. Так, в России высокая частота язвенных кровотечений, скорее всего, связана с низким социальным уровнем населения, что в свою очередь обуславливает высокую распространенность основных факторов риска, таких как курение, инфицированность Helicobacter pylori (H. pylori) и др. [10, 11]. Напротив, в западноевропейской и североамериканской популяции за последние годы стремительно выросло потребление нестероидных противовоспалительных препаратов (НПВП) [5]. Прием НПВП повышает риск развития эрозивно-язвенных поражений слизистой в 3–5 раз, а риск кровотечений и перфораций в 8 раз [12].
Механизм формирования кровотечения при язвенной болезни желудка и двенадцатиперстной кишки обусловлен глубоким язвенным дефектом, когда дно язвы достигает стенки кровеносного сосуда. Опосредованно наступает истончение и некроз сосудистой стенки, инициируя кровотечение. Так, показано, что источником кровотечения язвенной природы могут быть как аррозированные сосуды различного диаметра, находившиеся в дне язвы, так и сами края язвенного кратера, диффузно кровоточащие вследствие воспалительно-деструктивных изменений в стенке пораженного органа. Стоит отметить, что наиболее часто массивные и жизнеугрожающие кровотечения исходят из каллезных язв малой кривизны желудка и заднемедиального отдела луковицы двенадцатиперстной кишки, что связано с особенностями кровоснабжения этих зон [1, 2, 13].
К основным факторам риска кровотечений язвенной природы стоит отнести пожилой возраст, а также прием НПВП, антикоагулянтов и глюкокортикоидов [5]. У мужчин гастродуоденальные кровотечения встречаются в 2,5–3 раза чаще, чем у женщин [3].
Выраженность клинических симптомов отражает индивидуальную реакцию больного на кровопотерю и определяется как интенсивностью и массивностью самого кровотечения, так и исходным состоянием организма, его компенсаторными возможностями. Наиболее яркие клинические проявления наблюдаются при массивных кровотечениях с потерей около 25% ОЦК в течение достаточно небольшого временного интервала (минуты–часы) [1]. В таких случаях клиническая картина соответствует геморрагическому (гиповолемическому) шоку и проявляется гипотонией, тахикардией, мраморностью кожных покровов, снижением центрального венозного давления.
Симптомокомплексы острых гастродуоденальных язвенных кровотечений можно подразделить на общие, характерные для любой кровопотери, и частные, характерные для внутрипросветного кровотечения.
Общие симптомы кровопотери разнообразны и включают в себя резкую общую слабость, головокружение, ощущение потемнения в глазах, сердцебиение, одышку. При массивных кровотечениях в силу нарастающей циркуляторной гипоксии может наступить потеря сознания.
К симптомам, характеризующим внутрипросветное кровотечение, относят рвоту кровью (гематемезис) и черный дегтеобразный стул (мелена). Считается, что для появления таких характерных признаков внутрипросветного кровотечения необходима потеря около 500 мл излившейся крови. Рвота кровью, как правило, всегда ассоциирована с меленой. Характерным признаком желудочного кровотечения являются рвотные массы в виде кофейной гущи, что определяется образованием хлорида гематина при взаимодействии гемоглобина крови с соляной кислотой желудка. Мелена появляется не ранее чем через 8 ч после начала кровотечения. Стоит отметить, что при массивном кровотечении (в случае внутрипросветного выделения более 1500 мл крови) не происходит формирование мелены, а из прямой кишки может отмечаться выделение малоизмененной алой крови (гематохезия) [2, 13, 14].
В зависимости от объема кровопотери и дефицита ОЦК выделяют 3 степени тяжести острого гастродуоденального кровотечения (табл. 2). Для вычисления ОЦК нередко используют показатель шокового индекса Алговера-Бурри (1967), определяемый соотношением частоты пульса и уровня систолического артериального давления. При индексе 0,8 и менее объем кровопотери равен 10% ОЦК, при 1,3–1,4 – 30%, при 1,5 и выше – 50% ОЦК и более [2].
Инструментальные методы исследования направлены на выявление точной локализации зоны кровотечения. На сегодня ведущим инструментальным методом диагностики гастродуоденального кровотечения является экстренная (неотложная) эзофагогастродуоденоскопия (ЭГДС) [1–3, 10, 14]. Данный метод дает возможность наиболее точно верифицировать источник и характер кровотечения, а также оценить риск ранних рецидивов. Также эндоскопическая картина лежит в основе классификации активности гастродуоденального язвенного кровотечения (по J.A. Forrest, 1974) [15]. В соответствии с данной классификацией принято выделять активное (Forrest Ia/Ib) и состоявшееся (Forrest II/III) кровотечение (табл. 3). Использование данной классификации позволяет унифицировать описание кровоточащей гастродуоденальной язвы, а значит, избежать разночтений и однозначно трактовать интенсивность кровотечения и его источник. Основываясь на вышеперечисленных показателях, врач-эндоскопист оценивает потенциальную возможность рецидива кровотечения.
Методы консервативного гемостаза направлены на создание условий для формирования, ретракции и организации тромба в просвете кровоточащего сосуда, предотвращение лизиса и дислокации тромба, реализации тканевого репаративного потенциала желудочной и дуоденальной стенки в периульцерозной зоне [16]. В ряде случаев выбирается комбинированный эндоскопический гемостаз, сочетающий инъекционное введение в края язвы адреналина и спирт-новокаиновой смеси с аргоноплазменной коагуляцией или диатермокоагуляцией. Однако успех терапии гастродуоденальных кровотечений заключается в сочетании эндоскопического гемостаза с адекватной медикаментозной терапией, базисными препаратами которой являются антисекреторные средства [2, 10, 14, 16].
Основанием для назначения антисекреторных препаратов, ингибирующих продукцию соляной кислоты является падение активности пепсина или его инактивация при повышении интрагастрального рН >4 ед., что приводит к снижению агрессивных свойств желудочного сока за счет нарушения активации пепсина, снижает обратную диффузию ионов водорода и их повреждающее воздействие на слизистую оболочку желудка. Помимо этого, в условиях, когда рН (6.0–7.0 ед.), содержимое желудка сдвигается в щелочную сторону, блокируется лизис свежих тромбов, что позволяет обеспечить полноценный сосудисто-тромбоцитарный гемостаз [17]. В силу этого важным является выбор антисекреторных препаратов, позволяющих обеспечить наиболее длительное защелачивание в полости желудка. К таким антисекреторным средствам относится класс ИПП, при этом использование более старого класса блокаторов гистаминовых Н2-рецепторов на сегодняшний день не рекомендуется [16, 18].
Основные позиции по применению ИПП в рамках медикаментозной терапии гастродуоденальных кровотечений были регламентированы международным консенсусом по ведению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ в 2010 г. [18].
Согласно положению А8 вышеназванного документа, вполне оправдано инфузионное введение ИПП до проведения первичного эндоскопического осмотра, что снижает частоту необходимости применения эндоскопических методов гемостаза (уровень доказательности 1b) [18]. При этом важно подчеркнуть, что такая тактика ни в коем случае не должна рассматриваться как предлог задержки проведения экстренного эндоскопического исследования [19].
В положении С3 утверждается, что после успешного эндоскопического гемостаза рекомендуется назначение внутривенного болюса с последующей непрерывной инфузией ИПП. Такая тактика снижает риск повторного кровотечения, а значит и смертность в этой группе пациентов (уровень доказательности 1a) [18].
Согласно крупномасштабному Кохрановскому метаанализу, включившему в себя 5 792 пациента, высокодозная внутривенная терапия ИПП (80 мг болюсно и 8 мг в час в виде продленной инфузии) привела к уменьшению частоты повторных кровотечений (ОР – 0.43, ДИ 0,27–0,67), хирургических вмешательств (ОР – 0,60 ДИ 0,31–0,96) и смертности (ОР – 0,57, ДИ 0,34–0,96). А низкие дозы ИПП как при внутривенном введении, так и перорально уменьшали частоту повторного кровотечения, но не снижали уровень смертности [20].
Согласно положению B6, в случае наличия плотнофиксированного к язвенному кратеру тромба-сгустка эндоскопический гемостаз может не проводиться, т. к. может оказаться достаточной интенсивная внутривенная высокодозная терапия ИПП (уровень доказательности 2b) [18]. Так, согласно метаанализу Laine L. и соавт. (2009), обобщившего данные 5 рандомизированных контролированных исследований (189 пациентов), не было выявлено значимого преимущества эндоскопического лечения, по сравнению с медикаментозным (ОР – 0.31, ДИ: 0.06–1.77) [21].
В положении С4 рекомендуется продолжить лечение ежедневными разовыми дозами ИПП перорально и после выписки пациента из стационара. Продолжительность такого лечения обусловлена этиологией заболевания (уровень доказательности 1с) [18]. Так, пациентам, нуждающимся в лечении НПВП, может потребоваться длительная вторичная профилактика [22]. Рядом экспертов у реконвалесцентов предлагается двукратный суточный прием ИПП, что позволяет профилактировать кислотные прорывы на фоне лечения [23].
Важными характеристиками при выборе ИПП являются спектр лекарственных форм (внутривенная, для приема внутрь перорально или через назо-гастральный зонд) и фармакокинетические свойства, позволяющие применять его у пациентов с полиорганной дисфункцией (почечной и печеночной). Внутривенные формы существуют у омепразола, пантопразола, эзомепразола и лансопразола. Пантопразол (препарат Контролок), начиная с первой дозы, обладает высокой биодоступностью (77%), благодаря чему быстро оказывает выраженное подавление секреции соляной кислоты. Внутривенное введение пантопразола в дозе 80 мг с последующей его инфузией в течение 24 ч со скоростью 8 мг/ч позволяло поддерживать внутрижелудочный рH на уровне более 4 в течение 99% 24-часового периода и выше 6 в течение 84% этого времени у 8 здоровых добровольцев. После эндоскопического исследования и гемостаза внутривенное введение пантопразола в дозе 80 мг с последующей постоянной инфузией со скоростью 8 мг/ч в течение 3 суток у 14 пациентов с язвенным поражением желудка и ДПК, осложненным кровотечением, повышало медиану внутрижелудочного pH до 6,3 (мониторинг – более 48 ч). В этом исследовании медиана относительного времени, в течение которого рН превышала 4, 5 и 6, составляла 97,5; 90,5 и 64,3% соответственно.
Контролок обладает постоянной линейной предсказуемой фармакокинетикой. При удвоении дозы ИПП, имеющих нелинейную фармакокинетику, их концентрация в сыворотке крови будет либо ниже, либо выше ожидаемой, т. е. она непредсказуема. Это может оказать влияние на безопасность использования препарата. У больных пожилого возраста или с тяжелой почечной недостаточностью (клиренс креатинина – 0,48–14,7 мл/мин) нет необходимости в коррекции дозы пантопразола. После его внутривенного введения в дозе 30 мг/сут в течение 5 дней пациентам с печеночной недостаточностью (класс А и В по Child-Pugh) значения AUC и периода полувыведения увеличивались в 5–6 раз по сравнению с таковыми у здоровых добровольцев. Пантопразол – это единственный препарат из ИПП, который не включается в известные метаболические пути взаимодействия с другими лекарственными средствами. По сравнению с другими ИПП пантопразол, благодаря специфичности I и II фаз биотрансформации, в меньшей степени влияет на систему цитохрома Р-450. В частности, он в меньшей степени угнетает систему цитохрома Р-450, чем омепразол или лансопразол. В связи с тяжестью состояния с антисекреторными препаратами идет активное применение большого количества лекарственных средств. Наиболее серьезными последствиями полипрагмазии являются повышение риска развития побочных реакций и взаимодействие принятых препаратов. Так, при приеме двух препаратов потенциальный риск их взаимодействия составляет 6%, а при приеме пяти – 50%. Для предотвращения этих неблагоприятных последствий (вне зависимости от количества одновременно принимаемых лекарств) предпочтительно принимать препарат, потенциально слабо взаимодействующий с другими медикаментами. В частности, пантопразол не вступает в клинически значимое взаимодействие с такими препаратами, применяемыми в интенсивной терапии, как антациды, кофеин, метопролол, теофиллин, амоксициллин, кларитромицин, диклофенак, напроксен, диазепам, карбамазепин, дигоксин, нифедепин, варфарин, циклоспорин, такролимус и др.
Режим дозирования препарата – болюсно или внутривенная инфузия – определяется индивидуально и зависит от уровня факторов риска развития стресс-повреждений ЖКТ. Согласно результатам ряда метаанализов клинических исследований терапия ИПП больных в критическом состоянии для профилактики эрозивно-язвенного поражения верхних отделов ЖКТ приводит к снижению потребности в трансфузионной терапии, продолжительности госпитализации и частоты возникновения и рецидивов ЖКТ.
Эксперты, принявшие участие в разработке рекомендаций международного консенсуса по ведению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ, большое внимание уделяют роли эрадикации H. pylori. Распространенность данной инфекции у пациентов с кровотечением из верхних отделов ЖКТ довольно высока и варьирует от 43 до 56% [24, 25].
В положении D5 говорится, что все пациенты, перенесшие язвенное кровотечение, должны тестироваться на наличие H. pylori и в случае его обнаружения получать эрадикационную терапию с обязательным подтверждением успешности проведенного антихеликобактерного лечения (уровень доказательности 2а) [18].
В соответствии с консенсусом Маастрихт IV (2010), регламентирующим стандарты диагностики и лечения инфекции H. pylori, в регионах с низкой резистентностью H. pylori к кларитромицину (менее 20%) в качестве эрадикационной терапии первой линии регламентируется тройная терапия, включающая ИПП, кларитромицин и амоксициллин. В регионах с высокой резистентностью H. pylori к кларитромицину (более 20%) в качестве эрадикационной терапии первой линии рекомендуется квадротерапия с препаратами висмута (ИПП + метронидазол + тетрациклин + висмута трикалия дицитрат) или последовательная эрадикационная терапия (первые 5 дней – ИПП + амоксициллин, последующие 5 дней – ИПП + кларитромицин + тинидазол/метронидазол) [26, 27].
В случае неудачи проведенной эрадикации по схемам терапии первой линии экспертный совет консенсуса Маастрихт IV регламентирует переход на схемы второй линии. Так, квадротерапия на основе препаратов висмута является приоритетной для регионов с низкой распространенностью резистентных штаммов H. pylori к кларитромицину, а в качестве альтернативы выдвигается тройная терапия с левофлоксацином (ИПП + амоксициллин + левофлоксацин). Что же касается регионов с высокой резистентностью штаммов H. pylori к кларитромицину, то согласно консенсусу Маастрихт IV терапией второй линии, при неэффективности квадротерапии первой линии, является тройная терапия с левофлоксацином (ИПП + амоксициллин + левофлоксацин) [26, 27].
Возвращаясь к терапевтическим аспектам лечения гастродуоденальных кровотечений, нельзя не упомянуть о положении D6 международного консенсуса по ведению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ, согласно которому H. pylori – негативный результат должен быть подтвержден повторно после остановки кровотечения (уровень доказательности 1b) [18]. В условиях острого кровотечения результаты тестов на H. pylori могут быть ложноотрицательными, хотя биологические механизмы в данном случае недостаточно изучены. Вероятный механизм этого явления может быть связан с буферным эффектом крови, т. к. в более щелочной среде ложноотрицательные результаты получают чаще [28]. Системный обзор 23 исследований, проведенных в целях рассмотрения консенсусом, показал высокую положительную прогностическую ценность (0,85–0,99) диагностических тестов на инфекцию H. pylori (включавших серологические, гистологические тесты, мочевина дыхательный тест, быстрый уреазный тест, определение антигена в стуле и выращивание в культуре) при низкой прогностической ценности этих тестов (0.45–0.75) в условиях гастродуоденального кровотечения. В этой группе пациентов ложноотрицательные результаты составили 25–55% [29].
Разработка стандартизированных подходов к ведению пациентов с неварикозными гастродуоденальными кровотечениями имеет целью снижение уровня повторных кровотечений, хирургических вмешательств и летальности. Заключение консенсуса по ведению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ выработано авторитетным сообществом экспертов на основании анализа обширных статистических данных. Основой успеха является своевременное обследование пациента и начало адекватного медикаментозного лечения, обсужденное выше.
Читайте также:

