Лабораторную посуду с посевами на питательных средах доставляют
Обновлено: 05.10.2024
271. Температурные условия при транспортировке материала для бактериологической диагностики при подозрении на дизентерию:
г) комнатная температура
д) с охлаждением (+)
272. Укажите биохимические свойства шигелл через 24 часа культивирования:
а) глюкоза+, лактоза+, сероводород+
б) глюкоза+, лактоза-, сероводород- (верный ответ)
в) глюкоза-, лактоза-, сероводород-
г) глюкоза-, лактоза+, сероводород-
д) глюкоза-, лактоза-, сероводород+
27 3. На среде Олькеницкого шигеллы:
а) не изменяют цвет скошенной части, не изменяют цвет нижней части столбика, не изменяют цвет верхней части столбика
б) изменяют цвет скошенной части, изменяют цвет нижней части столбика, изменяют цвет верхней части столбика
в) не изменяют цвет скошенной части, изменяют цвет нижней части столбика, не изменяют цвет верхней части столбика
г) не изменяют цвет скошенной части, не изменяют цвет нижней части столбика, изменяют цвет верхней части столбика (+)
д) изменяют цвет скошенной части, не изменяют цвет нижней части столбика, не изменяют цвет верхней части столбика
274. При кислой реакции рвотных масс перед посевом их нейтрализуют:
а) слабым раствором натриевой щелочи
б) 10% раствором питьевой соды (+)
в) 1% раствором питьевой соды
г) 1% уксусной кислотой
д) 0,85% раствором хлорида натрия
275. Инкубация засеянной селенитивой среды не должна превышать:
б) 18 часов (+)
276. Инкубация посева на висмут-сульфит агаре длится:
д) 48 часов (+)
277. Высев для выделения иерсиний проводят на среду:
а) висмут-сульфит агар
278. Для выделения иерсиний на среде накопления физ. раствор с посевом инкубируют при температуре:
279. Для исследования на холеру от людей материал доставляется в сроки
а) не позже 6 часов с момента отбора:
б) не позднее 2 часов (+)
в) не позднее 1 суток
г) не позднее 3 суток
д) на транспортной среде возможно сохранение до следующего дня
280. Ингибитор сопутствующей микрофлоры в транспортной среде для выделения холерного вибриона:
а) раствор щелочи
б) раствор кислоты
в) моющее средство “Прогресс” 0,1 – 0,2% (+)
г) хлорид натрия 10%
281. Инструментарий для отбора проб испражнений на холеру из индивидуального судна:
в) груша резиновая
г) резиновый катетер
д) стеклянная палочка
282. Транспортная среда для возбудителя холеры – 1 % пептонная вода без теллурита калия разливается в объеме:
а) 5 – 10 мл (+)
283. Инструментарий для ректального отбора материала на холеру:
б) алюминиевая петля (+)
д) резиновая груша
284. Посуду и другие средства для отбора материала на холеру можно использовать после следующей обработки:
а) дезинфекция 3% раствором хлорамина
б) кипячение в 2% содовом растворе (+)
в) обработка этанолом
г) мытье под проточной водой
д) обработка 1% соляной кислотой
285. При удлинении сроков доставки материала на холеру свыше 2 часов его доставляют:
б) на щелочном агаре
в) в 1 % пептонной воде (+)
д) в селенитовой среде
286. Кроме 1 % пептонной воды, транспортной средой для холерного вибриона может служить:
а) изотонический раствор хлорида натрия
б) солевые консерванты (+)
в) глицериновая среда
г) селенитовая среда
д) магниевая среда
287. Среды, приготовленные для отбора проб на холеру, можно хранить в холодильнике в течение:
д) хранить нельзя
288. При диагностике холеры в 5 – 6 мл транспортной среды испражнения помещают в количестве:
289. Испражнения для исследования на холеру от больного алгидной формой можно отобрать, используя:
а) алюминиевую петлю, вводимую в прямую кишку на глубину 8–10 см
б) резиновый катетер № 26, 28 (+)
в) ректальный тампон, вводимый на глубину 5 – 6 см
290. Кроме испражнений при исследовании на холеру можно брать исследуемый материал:
а) рвотные массы (+)
г) дуоденальное содержимое
д) биоптат желудка
291. От умершего с подозрением на холеру доставляют для бактериологического исследования:
а) отрезки толстого кишечника
б) отрезки тонкого кишечника (+)
в) стенку желудка
г) фрагменты печени
292. Для определения серогруппы холерного вибриона необходимо иметь сыворотки к антигенам:
293. Срок выращивания вибрионов на 1% пептонной воде:
б) 6-8 часов (+)
294. Срок выращивания вибрионов на 1% пептонной воде с теллуритом калия:
в) 12-18 часов (+)
295. Срок культивирования вибрионов на щелочном агаре составляет как минимум:
в) 14-16 часов (+)
296. Смывы с различных объектов окружающей среды отбирают для исследования на холеру
а) сухим тампоном
б) тампоном, смоченным физ. раствором
в) тампоном, смоченным 1% пептонной водой (+)
г) тампоном, смоченным глицерином
д) марлевой салфеткой
297. Остатки пищевых продуктов плотной консистенции в очаге холеры отбирают в количестве не менее:
298. Остатки жидких продуктов в очаге холеры отбирают в количестве
в) 0,5 литра (+)
г) не менее 1 литра
299. Основным методом лабораторной диагностики холеры является:
б) метод флюоресцирующих антител
г) бактериологический (+)
300. Серогруппу холерного вибриона определяют с применением теста:
в) реакция агглютинации (+)
г) реакция фаготипирования
д) реакция преципитации
301. Продолжительность хранения рабочего раствора теллурита калия:
г) до 1 недели (+)
302. Питательные среды с теллуритом калия допускается хранить в холодильнике:
б) до 2 дней (+)
303. Раствор основного пептона при посеве 0,5 л воды на холеру добавляют в количестве:
304. При исследовании на холеру молоко засевают в количестве:
а) 5 мл в 50-100 мл 1% пептонной воды
б) 25 мл в 100 мл 1% пептонной воды
в) к 0,5 л молока добавляют 5 мл раствора основного пептона
г) к 0,5 л молока добавляют 50 мл раствора основного пептона (+)
д) к 0,5 л молока добавляют 100 мл раствора основного пептона
30 5. pH 1% пептонной воды после посева на холеру доводят:
306. Плотные пищевые продукты засевают на холеру после размельчения в количестве:
а) 10 г на 100 мл пептонной воды (+)
б) 50 г на 100 мл пептонной воды
в) 100 г на 1 л пептонной воды
г) петлю материала на кровяной агар
д) петлю материала на мясопептонный агар
307. Время инкубации проб воды на 1% пептонной воде с теллуритом калия:
б) 18 – 20 часов (+)
308. Основными признаками, используемыми для дифференциации биоваров возбудителя холеры являются все, КРОМЕ:
В микробиологических лабораториях, кроме обычной лабораторной посуды (цилиндры, колбы, склянки для растворения и хранения реактивов, химические пробирки и т. п.), используется специальная: бактериологические, серологические пробирки, пипетки, чашки Петри, колбы и т. д.
Существует несколько типов пробирок:
1. Биологические пробирки — с круглым дном, неразвернутым краем (без ранта); их размеры приведены в таблице ниже.
2. Центрифужные пробирки —отличаются от биологических тем, что сужены книзу. Существует несколько разновидностей центрифужных пробирок:
а) пробирка высотой 95 мм и диаметром 17 мм;
б) пробирка для малых количеств вещества коническая;
в) пробирка для малых количеств вещества с оттянутым концом:
высота всей пробирки: 40-50 мм
высота нижней (узкой) части: 20-80 мм
диаметр верхней части: 6-8 мм
диаметр нижней части: 1-3 мм
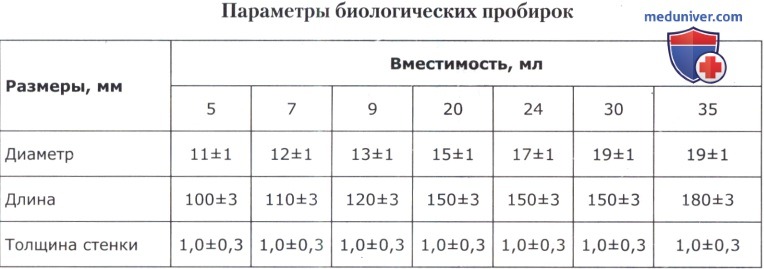
3. Прецинитационные пробирки — очень узкие: внутренний диаметр — 2-3мм, длина — 90-400 мм.
Все пробирки изготавливаются из прозрачного бесцветного стекла.
Для выращивания микроорганизмов на плотных питательных средах используют стеклянные чашки Петри. Они должны быть из прозрачного бесцветного стекла, не имеющего камней, пузырей и свилей. Высота чашки— 20-30 мм, диаметр — от 60 до 200 мм.
Для выращивания микроорганизмов на плотных и в жидких питательных средах, а также для работы с культурой ткани применяют плоские колбы или посевные матрасы.
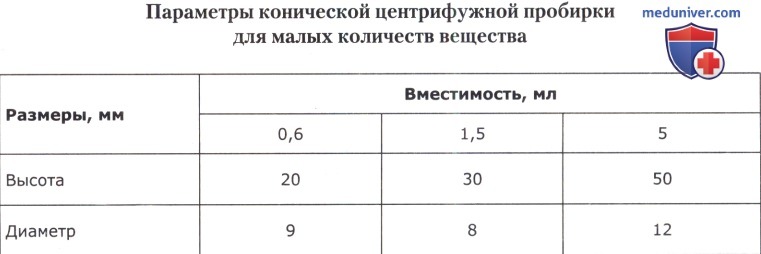
Для точного отмеривания определенных объемов жидкости служат пипетки. Они представляют собой трубки из прозрачного бесцветного стекла, не имеющие на глаз кривизны (ГОСТ 1770-74). Пипетки бывают разных размеров, а следовательно, разной вместимости.
Кроме измерительных (градуированных) пипеток широко применяются пипетки для отмеривания определенных объемов жидкости — так называемые пастеровские пипетки и пипетки Мора. Пастеровские пипетки представляют собой стеклянные трубки диаметром 5-7 мм, у которых один конец оттянут над пламенем горелки в виде капилляра, а пипетки Мора имеют одну отметку с расширением.
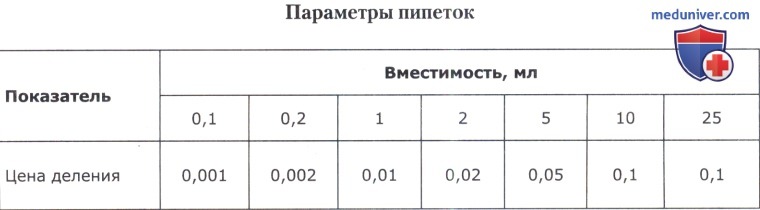
Для точного отбора жидкости в лаборатории помимо обычных пипеток могут применяться механические пипетки, или пипеточные дозаторы: дозаторы переменного, фиксированного объема, устройства для дозирования больших объемов, электронные дозаторы и флаконы-деспенсеры переменного объема дозирования.
При необходимости все время дозировать один и тот же объем используют механические пипетки-дозаторы фиксированного объема, позволяющие одномоментно дозировать только 50 или 100 либо 1000 мкл и т. д. Если требуется периодически изменять объем дозирования, пользуются электронными или механическими дозаторами переменного объема (от 50 до 100 мкл, от 100 до 1000 мкл и т. д.). Типы дозаторов приведены в таблице ниже.
В комплекте с дозатором поставляется набор для его сборки/разборки, мелкого ремонта, калибровки и смазки поршневой системы. Обычная калибровка дозаторов осуществляется в лаборатории при помощи весов и в соответствии с инструкцией производителя.
Для работы с пипеточными дозаторами необходимо использовать оригинальные наконечники (упакованы в пакеты, коробки) или специальные штативы. Наконечники, размещенные в штативах, наиболее удобны для работы в бактериологической лаборатории, так как при использовании штатива ручные операции по насадке наконечника на дозатор сводятся к минимуму. Некоторые фирмы производят наконечники нескольких типоразмеров для различных дозирующих устройств (QSP, США; LP, Италия; Ratiolab, Германия и др.), а также универсальные наконечники, посадочная часть которых изготовлена таким образом, что они подходят для большинства типов дозаторов и дозирующих станций (AHN Biotechnology, Германия и др.). В наконечник для дозатора может быть вмонтирован гидрофобный мембранный фильтр с целью защиты его внутреннего механизма (также непосредственно в основание посадочного конуса поршневой системы дозатора, как правило, помещается защитный аэрозольный фильтр для тех же целей).
Для снятия наконечника с дозатора используется специальное встроенное в дозатор устройство-толкатель, которое позволяет сбросить использованный наконечник, не прикасаясь к нему руками. Это крайне необходимо при работе с инфицированными материалами и агрессивными средами. Неоспоримым преимуществом пинеток-дозаторов является обеспечение максимальной биологической и химической защиты персонала лаборатории, сведение к минимуму их контакта с инфицированным материалом.
В электронных дозаторах для забора, сброса и дозирования жидкости имеется встроенный электродвигатель, создающий разряжение. Такой дозатор-насос снабжен аккумулятором и требует периодической подзарядки от электросети через зарядный штатив или сетевой адаптер (электронный дозатор может работать автономно в интенсивном режиме в течение нескольких часов, после чего его необходимо подзарядить). В отличие от механического дозатора, при работе с которым необходимо большим пальцем руки постоянно нажимать на поршень, что требует достаточно большого усилия (до 2,5 кг и более), управление электронным дозатором осуществляется простым нажатием соответствующих кнопок на рукоятке (усилие — до 100 г).
Для одномоментного дозирования больших объемов жидкостей (50 мл и более) можно использовать, наряду со стеклянными, аналогичные градуированные пластиковые пробирки, мерные цилиндры и стаканы. При дозировании жидкостей обычными (объем от 1 до 100 мл) стеклянными или пластиковыми пипетками традиционную резиновую грушу можно заменить электронными бюретками-тираторами, а также специальными электронными устройствами-насосами. Эти устройства имеют встроенный электронасос и позволяют производить взятие и сброс жидкости с регулируемой скоростью. В них размещается гидрофобный фильтр для предотвращения заброса жидкости в дозатор. Можно также использовать модели дозаторов с ручным механическим приводом.
Для порционного (по 50 мкл, 100 мкл, 1 мл и т. д.) дозирования больших объемов жидкости без периодического ее забора из емкости следует использовать шаговый дозатор-степпер (мультидиспенсер) (рис. 2.5); или программируемый электронный дозатор, который можно эксплуатировать в качестве степпера. Флаконом-диспенсером нужно пользоваться при порционном дозировании жидкостей непосредственно из бутылей.
Для получения качественных результатов при работе с дозаторами необходимо изучить инструкцию по работе с дозатором конкретного типа. Дозатор следует держать в вертикальном положении, взятие жидкости и дозирование при помощи механических устройств нужно проводить плавно без рывков. При взятии жидкости наконечник не следует опускать в нее слишком глубоко. Перед всасыванием жидкости нужно промыть наконечник этой жидкостью 2-5 раз путем заполнения/опорожнения. Это особенно важно при дозировании вязких жидкостей, а также жидкостей, имеющих температуру, отличную от температуры окружающей среды.
Дозаторы производят из материалов, устойчивых к коррозии и агрессивным веществам, которые выдерживают автоклавирование без повреждений и потерь точности.
Вся остальная посуда, используемая в микробиологических лабораториях, — это обычная общелабораторная посуда.
Для посева микроорганизмов на твердые питательные среды используют стеклянный шпатель, один конец которого согнут (шпатель Дригальского). Он предназначен для нанесения (распределения, втирания) микробиологического образца на плотную среду (агар). Для посева микроорганизмов, кроме шпателей, пользуются бактериологической петлей или иглой.
Бактериологические петли и иглы изготовляют из тонкой платиновой или никель-хромовой проволоки, которую закрепляют в металлическом или пластмассовом держателе. Диаметр бактериологической петли - 4-5 мм. Используют также одноразовые стерильные шпатели и петли из полистирола.
Стеклянная лабораторная посуда может быть заменена пластиковой. Когда особенно жестко ставится вопрос о контроле качества проводимых исследований, следует ориентироваться на использование пластиковой посуды и расходных материалов преимущественно однократного применения. Нужно стремиться к тому, чтобы все принадлежности, так или иначе контактирующие с биоматериалом и реактивами, предназначенными для анализа биоматериала на наличие микроорганизмов, были изначально стерильными и одноразовыми.
В микробиологических лабораториях пользуются широким ассортиментом одноразовой стерильной пластиковой посуды, поставляемой производителем в герметичной полиэтиленовой упаковке, устойчивой к внешним воздействиям, в индивидуальной упаковке. Это разнообразные пробирки (с пробками, крышками и т. п.), чашки Петри с крышками (в т.ч. двух-, трех- и многосекционными), разнообразными тест-планшетами, пастеровские и обычные пипетки, микробиологические петли и иглы, шпатели, стерильные емкости с различными оригинальными приспособлениями для взятия биоматериала, емкости с транспортными средами, чашками и пробирками с готовыми к употреблению питательными средами, а также комбинированными миниатюрными тест-системами для выявления и идентификации широкого спектра микробов и определения их чувствительности к антимикробным препаратам.
Пластиковая лабораторная посуда и принадлежности изготавливаются, как правило, из полипропилена, полиэтилена (высокого и низкого давления) и поли-стирена(полистирола).
Полипропилен (обозначение: ПП/РР) при комнатной температуре в высокой степени устойчив практически ко всем используемым в лаборатории реактивам (альдегидам, спиртам, щелочам/гидроксидам, маслам, фенолу, неорганическим и органическим кислотам, солям и растворам солей), выдерживает без деформации нагревание до 135-145 °С, хорошо стерилизуется автоклавированием. Из него изготавливают штативы, емкости для сбора и транспортировки проб, наконечники для дозаторов, различные пробирки, пробки и др.
Полиэтилен (обозначение: ПЭ/РЕ) при комнатной температуре чувствителен ко многим органическим растворителям, устойчив к сильным кислотам и щелочам. Автоклавировать можно только изделия из ПЭ низкого давления. Из ПЭ изготавливают транспортировочные пакеты для продукции и отходов, флаконы, штативы, крышки для пробирок и т. п.
Полистирен/полистирол (обозначение: ПС/PS) обладает сравнительно небольшой химической устойчивостью, при комнатной температуре чувствителен к фенолу, хлороформу и другим органическим растворителям. Изделия из ПС автоклавированием не стерилизуются. Из него изготавливают, как правило, продукцию с повышенными оптическими характеристиками: чашки Петри, кюветы (в т. ч. для фотометров), планшеты-панели, пробирки и др.
Для изделий в герметичных полиэтиленовых (или полипропиленовых) упаковках срок сохранения стерильности — до 3 лет, в упаковках других видов — до 1 года. Срок стерильности может быть увеличен на 1 год на конкретный вид продукции после истечения уже установленного срока и проведения повторного бактериологического анализа ранее отобранных образцов. В настоящее время отечественными производителями разрабатываются для серийного выпуска установки радиационной стерилизации изделий медицинского назначения непосредственно в ЛПУ.

Бактериологическая петля (а) и бактериологическая игла (б)
За рубежом достаточно большой ассортимент продукции производится в асептических условиях по так называемой асептической технологии, не требующей конечной стерилизации.
Из пластмасс (преимущественно из полипропилена) изготавливаются также приспособления многократного применения — штативы, капельницы, бутыли, ванночки, которые используют в случаях, когда не требуется соблюдения особых условий стерильности при обращении с реагентами или же при отсутствии прямого контакта с ними.
Специализированные принадлежности из пластика. Особо стоит отметить специальные комбинированные системы однократного применения, помещенные в пластиковые емкости. Их можно подразделить на 3 группы:
1. Системы для взятия и транспортировки биоматериала. Они состоят из пластиковой емкости или пробирки либо контейнера с приспособлением для забора биоматериала (лопатка, палочка, тампон и т. п.) или без приспособлений; в емкости может также находиться стерильный физиологический раствор или иная жидкость-разбавитель. Такие системы следует использовать для взятия материалов, если образцы предполагается доставить в бактериологическую лабораторию в течение 2-4 ч и если не предъявляется специальных требований к сохранности микрофлоры биоматериала.
3. Системы для определения свойств микроорганизмов после выделения чистой культуры. Это обычные или секционированные чашки Петри либо пробирки с уже внесенными в них готовыми к употреблению питательными средами, тест-панели микротестов для рутинной идентификации микроорганизмов и определения их чувствительности к антибиотикам после выделения чистой культуры и т. п.
Утилизация одноразовой пластиковой посуды имеет ряд существенных преимуществ перед традиционным обеззараживанием посуды многократного применения (в т. ч. пластмассовой), сопряженным с использованием достаточно трудоемких, материалоемких и энергоемких методов, таких как автоклавирование при температуре 120 ± 2 °С (давление 0,11 МПа или 1 атм) в течение 60 мин и длительное замачивание в дезинфицирующих растворах (например, в 3% растворе хлорамина или 6% растворе перекиси водорода в течение 1 сут.). Наиболее эффективным и безопасным способом утилизации использованной пластиковой посуды является сжигание.
Техника посевов микроорганизмов на питательные среды

Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.


Рис. 24. Посев на агар в чашки Петри шпателем Дригальского
Глубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:
N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.
2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.
Читайте также:

