Лекарственные растения применяемые для лечения гипохромных анемий
Обновлено: 18.09.2024
Наиболее распространенным нарушением питания в мире является дефицит железа, приводящий к развитию железодефицитных состояний. Различают три стадии дефицита железа: предлатентный, латентный и манифестный. Предлатентный дефицит железа характеризуется снижением запасов микроэлемента без уменьшения расходования железа на эритропоэз. Латентный дефицит железа наблюдается при полном истощении запасов микроэлемента в депо, однако признаков развития анемии нет. Манифестный дефицит железа, или железодефицитная анемия (ЖДА), возникает при снижении гемоглобинового фонда железа и имеет характерные симптомы [1].
ЖДА — полиэтиологичное заболевание, развитие которого связано с дефицитом железа в организме из-за нарушения поступления, усвоения или повышенных потерь данного микроэлемента, характеризующееся микроцитозом и гипохромной анемией [2].
По данным ВОЗ, распространенность анемии среди населения в целом во всем мире составляет 24,8 %, наиболее часто встречается у детей дошкольного возраста (47,4%) и у беременных женщин (41,8%), однако и 30 % небеременных женщин страдает от этой патологии [3].
Частыми причинами развития ЖДА являются:
- кровопотери (обильные менструальные кровотечения, беременность, роды, желудочно-кишечные, легочные, при заболевании почек);
- нарушения всасывания железа (резекция желудка и кишечника, недостаточность поджелудочной железы, глютеновая энтеропатия, болезнь Крона);
- повышенная потребности в железе (быстрый рост, недоношенные, новорожденные дети, подростки, беременность и лактация);
- недостаточное поступление с пищей (вегетарианская или веганская диета).
Биологическую роль железа трудно переоценить. Данный микроэлемент входит в состав порфириновых соединений, главным образом гемоглобина, миоглобина и порфирина, цитохромов и некоторых ферментов. Его функция определяется участием в окислительно-восстановительных процессах, реакциях кислородозависимого свободнорадикального окисления и антиокислительной системы, росте и старении тканей, механизмах общей и тканевой резистентности, кроветворении, снабжении органов и тканей кислородом, активации и ингибировании целого ряда ферментов. Многие метаболические процессы в организме: синтез стероидов, метаболизм лекарственных препаратов, синтез ДНК, пролиферация и дифференциация клеток, регуляция генов ‒ протекают с участием железа [6].
Этим определяется многообразие клинических проявлений анемии, состоящих из гипоксического и сидеропенического синдромов. Гипоксический синдром включает общие для всех анемий симптомы: бледность, усиленное сердцебиение, шум в ушах, головную боль, слабость. К проявлениям сидеропенического синдрома относятся: извращения вкуса, сухость кожи, изменение ногтей, выпадение волос, ангулярный стоматит, жжение языка, диспептический синдром [2]. Такие симптомы характеризуют манифестный дефицит железа. Предлатентный и латентный дефицит данного микроэлемента характеризуется отсутствием клинических признаков.
Исследования показали, что дефицит железа отрицательно сказывается на состоянии здоровья, особенно беременных женщин и детей.
Неблагоприятные исходы беременности, наблюдающиеся при анемии: невынашивание, плацентарная недостаточность, гипотрофия плода, аномалии родовой деятельности, гнойно-септических осложнения и гипогалактии у родильниц, патологическая кровопотеря в родах и послеродовом периоде [5,7]. Недостаток незаменимого микроэлемента в антенатальном периоде приводит к развитию анемии у новорожденного, нарушению его физического и когнитивного развития, повышает риск инфекционной заболеваемости в раннем возрасте и аллергическую настроенность детского организма [8].
Традиционно для диагностики анемий используют:
- концентрацию гемоглобина (НЬ),
- количество эритроцитов (Rbc – red blood cells),
- гематокрит (Hct – hematocrit),
- расчетные эритроцитарные индексы ‒ MCV (mean corpuscular volume ‒ средний объем эритроцита),
- MCH (mean corpuscular hemoglobin ‒ среднее содержание гемоглобина в отдельном эритроците),
- MCHC (mean corpuscular hemoglobin concentration ‒ средняя концентрация гемоглобина в эритроците),
- RDW (red cell distribution width ‒ ширина распределения эритроцитов по объему).
Учитывая стадийное развитие дефицита железа, ВОЗ рекомендует определение концентрации ферритина (белок, запасающий железо, который содержится во всех клетках, и его уровень можно измерить в сыворотке крови) одновременно с уровнем гемоглобина для диагностики дефицита железа у внешне здоровых людей, т.к. при отсутствии воспаления концентрация ферритина в плазме/сыворотке крови положительно коррелирует с общими запасами железа в организме.
Снижение концентрации сывороточного ферритина ниже 12 мкг/л у здоровых детей и 15 мкг/л у взрослых, с поправкой ниже 30 мкг/л у детей и 70 мкг/л у взрослых с инфекционными или воспалительными заболеваниями, означает неизбежное снижение концентрации гемоглобина в последующем [12].
Терапия железодефицитной анемии должна основываться на точном знании природы заболевания и носить патогенетический характер, которым является прием пероральных препаратов железа. В настоящее время врач имеет в своем распоряжении большое количество лекарств, обладающих различной биодоступностью, эффективностью, переносимостью и стоимостью.
Для правильного выбора лекарственного средства необходимо помнить, что в пище железо встречается трехвалентное окисное (Fe3+), в желудке оно растворяется и хелатируется муцином, аминокислотами, сахарами и аскорбиновой кислотой, чтобы быть пригодным к всасыванию в щелочной среде 12-перстной кишки и проксимальном отделе тонкого кишечника в виде закисного двухвалентного железа (Fe2+) через марганец-зависимые белки-транспортеры двухвалентных металлов (ДМТ1-белки). В клетках слизистой оболочки тонкого кишечника, во время процесса всасывания, закисное железо через белок ферропортин на базальной мембране поступает в кровь, где с помощью медь-зависимых феррооксидаз окисляется до трехвалентного состояния и связывается с транспортным белком ‒ трансферрином ‒ и транспортируется по всему организму в депо (печень, селезенка) и к эритроидным предшественникам в костный мозг. Попавший в клетки с помощью эндоцитоза комплекс Fе3+ ‒ трансферрин освобождает ионы железа, внутриклеточный свободный пул которого играет важную роль в регуляции пролиферации клетки, синтезе геминовых белков, экспрессии трансферриновых рецепторов, синтезе активных радикалов кислорода и др. [9].
Биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Фармакологический эффект препаратов быстрый, и нормализация уровня гемоглобина в среднем происходит через 2 недели ‒ 2 месяца, а восполнение депо железа происходит уже через 3‒4 месяца от начала лечения, в зависимости от тяжести анемии и дозировки препарата. В связи с чем ВОЗ рекомендует препараты двухвалентного железа в качестве стартовой терапии железодефицитной анемии [11]. Всасывание ионов из препаратов трехвалентного железа более медленное, так как необходима активная (энергозависимая) трансформация с участием феррооксидаз. Поэтому такие препараты требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны вообще [1].
Вышеописанными патогенетическими свойствами обладает лекарственный препарат Сорбифер Дурулес, содержащий 320 мг сульфата железа (II), что эквивалентно содержанию 100 мг Fe2+ и 60 мг аскорбиновой кислоты, которая способствует дополнительному увеличению биодоступности железа, т.к. улучшает всасываемость ионов в кишечнике. Применением препарата в среднесуточной дозировке по 1 таблетке 2 раза в день достигается цель лечения железодефицитной анемии – введение железа в количестве, необходимом для нормализации уровня гемоглобина, и соответствует рекомендации ВОЗ об оптимальной лечебной дозе железа [11]. Кроме того, технология дурулес у данного лекарственного препарата обеспечивает постепенное медленное высвобождение ионов железа (на протяжении 6 часов) и равномерное поступление лекарственного препарата, предотвращая развитие патологически высоких местных концентраций железа и повреждения слизистой оболочки желудочно-кишечного тракта.
Эффективность лечения железодефицитной анемии зависит не только от биодоступности применяемого препарата, но и от его доступности. Стоимость большинства других препаратов двухвалентных солей значительно выше, чем Сорбифер Дурулес, как и препаратов трехвалентного железа, а из-за их низкой усвояемости терапия более длительная, что делает лечение еще более дорогим и может послужить причиной отказа от применения препарата.
Для мониторинга и оценки эффективности препаратов железа, помимо оценки уровня гемоглобина, особенно при латентном дефиците железа, также может использоваться оценка уровня ферритина, который возрастает в ответ на применение препаратов железа и позволяет оценить насыщение депо железом [12].
Поэтому важно проводить своевременную диагностику дефицита железа, даже в отсутствие клинических проявлений, информировать пациента о его последствиях и подбирать оптимальный для каждого конкретного больного лекарственный препарат, применяя идеи персонифицированного подхода.

Железодефицитная анемия (ЖДА) - группа анемических синдромов, вызванных различными этиологическими факторами, объединенных единым патогенезом, в основе которого лежит нарушение микроэлементного гомеостаза. Фитотерапия ЖДА лишена недостатков, присущих лечению синтетическими лекарственными средствами и незаменима для профилактики железодефицита [2]. Многообразие этиологических факторов железодефицита наряду с тем обстоятельством, что индивидуальные растения редко содержат комплекс действующих веществ, обеспечивающих требуемую поливалентность действия фитопрепарата, современная фитотерапия ЖДА [1 ] базируется на применении фитосборов, позволяющих создавать композиции с максимальным содержанием необходимых биологически активных соединений.
Был проанализирован состав основных сборов используемых в народной медицине для лечения и профилактики ЖДА 4.
Всего в состав описанных фитосборов входят 42 единицы лекарственного растительного сырья, но наиболее часто встречаются в составе сборов (таблица): - листья крапивы, которая является источником витамина К и протопорфирина, которые участвуют в синтезе факторов свертывания крови; - листья березы, которая за счет увеличения диуреза способствуют выведению токсикантов; плоды шиповника - источник витамина С, необходимого для усвоения железа и трава земляники, которая используется в качестве источника микроэлементов, необходимых для процесса кроветворения.
Остальные лекарственные растения встречаются в составе сборов намного реже. Лекарственные растения, наиболее часто входящие в состав сборов имеют этиотропную направленность действия. Различная специфическая активность индивидуальных растений создает с учетом синэргизма фитокомпозицию, обладающую необходимой поливалентностью действия. Тем самым сбор приобретает более универсальные свойства и применимость сборов такого состава при лечении и профилактики ЖДА различного генеза существенно повышается.
Таблица 1. Лекарственное растительное сырье наиболее часто встречаемое в сборах, используемых в фитопрофилактике ЖДА
Лекарственное растительное сырье (ЛРС)
Дополнительное ЛРС, сочетающееся с данным, в составе сборов
Листья береза, ежевика, смородина, эвкалипт; шиповник плоды; овес стебель; одуванчик корень; трава земляника, полынь, тысячелистник, череда, будра, дымянка, медуница, пырей, репейничек, тимьян, чистотел; омела ветви.
Листья орех, мята; трава яснотка, зверобой, татарник, цикорий; можжевельник плоды.
Листья ежевика, смородина, орех, мята, подорожник; цветки калина,гречиха; корневище аир, дягиль; трава полынь, яснотка, череда, зверобой, лапчатка, синюха, сушеница, тимьян, цетрария, шалфей, первоцвет .
Овес стебель, тысячелистник трава, яснотка, зверобой; солодка корневище, черника побеги.
3. Практическое применение сборов лекарственных растений: Справрочник / Г.А.Гоменюк [и др]. - Киев; А.С.К., 2001.-432 с.
4. Соколов С.Я. Фитотерапия и фитофармакологня:Руководство для врачей/С.Я.Соколов.-М.: МИА. 2000.-976 с.
5. Фетисова Л.Я. Диагностика и фитопрофилактика латентного железодефнцитного состояния: автореф. дисс: канд.мед.наук /Л.Я.Фетисова; Саратов. гос.мед.унив. - Саратов, 1987. – 12 с.
Приведены рекомендации по применению лекарственных препаратов железа при железодефицитной анемии в различных клинических ситуациях.
Рассматриваются причины неэффективности терапии препаратами железа, а также особенности путей введения.
The paper gives recommendations for the use of iron drugs in iron deficiency anemia in different clinical situations.
It considers the causes of ineffective therapy with iron preparations and the specific ways of their administration.
Л. И. Дворецкий – ММА им. И.М. Сеченова
L. I. Dvoretsky – I. M. Sechenov Moscow Medical Academy
Ж елезодефицитная анемия (ЖДА) - клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
В основе развития ЖДА лежат разнообразные причины, среди которых основное значение имеют следующие:
- хронические кровопотери различной локализации (желудочно-кишечные, маточные, носовые, почечные) вследствие различных заболеваний;
- нарушение всасывания поступающего с пищей железа в кишечнике (энтериты, резекция тонкого кишечника, синдром недостаточного всасывания, синдром "слепой петли");
- повышенная потребность в железе (беременность, лактация, интенсивный рост и др.);
- алиментарная недостаточность железа (недостаточное питание, анорексии различного происхождения, вегетарианство и др.).
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). В целом ряде случаев радикальное устранение причины ЖДА не представляется возможным, например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных и при некоторых других ситуациях. В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами. Лекарственные препараты железа (ПЖ) являются средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА. ПЖ следует предпочитать пищевым продуктам, содержащим железо.
Таблица 1. Основные лекарственные препараты железа для приема внутрь
В настоящее время в распоряжении врача имеется большой арсенал лекарственных ПЖ, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику препарата, лекарственной формой. В клинической практике лекарственные ПЖ применяются внутрь или парентерально. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией.
Лечение препаратами железа для приема внутрь
Лечение ПЖ для парентерального введения
ПЖ могут применяться парентерально при следующих клинических ситуациях:
- нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по Бильрот II с включением двенадцатиперстной кишки);
- обострение язвенной болезни желудка или двенадцатиперстной кишки;
- непереносимость ПЖ для приема внутрь, не позволяющая дальнейшее продолжение лечения;
- необходимость более быстрого насыщения организма железом, например у больных ЖДА, которым предстоят оперативные вмешательства (миома матки, геморрой и др.).
В табл. 2 представлены ПЖ, использующиеся для парентерального введения.
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме.
Общая ориентировочная доза ПЖ для внутримышечного введения, необходимая для коррекции дефицита железа и анемии, может быть рассчитана по формуле: А = К • (100 - 6 • Нв) • 0,0066, где А - число ампул, К - масса больного в кг, НВ - содержание гемоглобина в гр%. При расчете необходимого количества ампул феррум ЛЕК для внутривенного введения можно также пользоваться приведенной формулой. При этом в 1-й день вводят 1/2 ампулы (2,5 мл), во 2-й день - 1 ампулу (5 мл), в 3-й день - 2 ампулы (10 9 мл). В последующем препарат вводят 2 раза в неделю до достижения необходимой рассчитанной общей дозы.
На фоне парентерального лечения ПЖ, особенно при внутривенном применении, нередко возникают аллергические реакции в виде крапивницы, лихорадки, анафилактического шока. Кроме того, при внутримышечном введении ПЖ может возникать потемнение кожи в местах инъекций, инфильтраты, абсцессы. При внутривенном введении возможно развитие флебитов. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из-за "перегрузки" железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза. В то же время при ошибочном назначении ПЖ внутрь никогда не наблюдается возникновение гемосидероза.
Тактика лечения ЖДА при различных клинических ситуациях
Лечение больных ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, старики), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Далее приводятся наиболее часто встречающиеся в клинической практике ситуации и некоторые особенности лечения больных ЖДА.
ЖДА у новорожденных и детей. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. У детей раннего возраста наиболее частой причиной ЖДА является алиментарный фактор, в частности вскармливание исключительно молоком, поскольку содержащееся в женском молоке железо всасывается в незначительных количествах. Среди ПЖ, которые показаны новорожденным и детям наряду с соответствующей коррекцией питания (витамины, минеральные соли, животный белок), следует назначать препараты для приема внутрь, содержащие малые и средние дозы двухвалентного железа (ферроплекс, фенюльс). Предпочтительнее назначение ПЖ в каплях или в виде сиропа (актиферрин, мальтофер). У детей раннего возраста удобно применение ПЖ в виде жевательных таблеток (мальтоферфол).
ЖДА у девушек-подростков является чаще всего следствием недостаточных запасов железа в результате дефицита железа у матери во время беременности. При этом имеющийся у них относительный дефицит железа в период интенсивного роста и с появлением менструальных кровопотерь может приводить к развитию клинико-гематологических признаков ЖДА. Таким больным показана терапия ПЖ для приема внутрь. Целесообразно использование препаратов, содержащих различные витамины (фенюльс, иррадиан и др.), так как в период интенсивного роста повышается потребность в витаминах группы А,В,С. После восстановления показателей гемоглобина до нормальных значений следует рекомендовать повторные курсы лечения, особенно если устанавливаются обильные месячные или имеются другие незначительные кровопотери (носовые, десневые).
ЖДА у беременных является самым частым патогенетическим вариантом анемий, возникающих во время беременности. Чаще всего ЖДА диагностируется во II - III триместре и требует коррекции лекарственными ПЖ. Целесообразно назначать препараты, содержащие аскорбиновую кислоту (ферроплекс, сорбифер дурулес, актиферин и др.). Содержание аскорбиновой кислоты должно превышать в 2 - 5 раз количество железа в препарате. С учетом этого оптимальными препаратами могут быть ферроплекс и сорбифер дурулес. Суточные дозы двухвалентного железа у беременных с нетяжелыми формами ЖДА могут не превышать 50 мг, так как при более высоких дозах вероятно возникновение различных диспептических расстройств, к которым и без того склонны беременные. Комбинации ПЖ с витамином В 12 и фолиевой кислотой, а также ПЖ, содержащих фолиевую кислоту (фефол, ирровит, мальтоферфол), не оправданы, так как фолиеводефицитная анемия у беременных возникает редко и имеет специфические клинико-лабораторные признаки.
Парентеральный путь введения ПЖ у большинства беременных без специальных показаний следует считать нецелесообразным. Лечение ПЖ при верификации ЖДА у беременных должно проводиться до конца беременности. Это имеет принципиально важное значение не только для коррекции анемии у беременной, но главным образом для профилактики дефицита железа у плода.
По рекомендации ВОЗ все беременные на протяжении II - III триместров беременности и в первые 6 мес лактации должны получать ПЖ.
ЖДА у женщин, страдающих меноррагиями. Независимо от причины меноррагий (миома, эндометриоз, дисфункция яичников, тромбоцитопатии и др.) и необходимости воздействия на соответствующий фактор, необходима длительная терапия ПЖ для приема внутрь. Доза, режим дозирования и конкретный ПЖ подбираются индивидуально с учетом содержания железа в препарате, его переносимости и т.д. При выраженной анемии с клиническими признаками гипосидероза целесообразно назначение препаратов с высоким содержанием двухвалентного железа, что позволяет, с одной стороны, осуществлять адекватную компенсацию дефицита железа, а с другой - облегчает и делает более удобным прием ПЖ (1 - 2 раза в сутки). После нормализации уровня гемоглобина необходимо проводить поддерживающую терапию ПЖ в течение 5 - 7 дней после окончания менструации. При удовлетворительном состоянии и стабильных показателях гемоглобина возможны перерывы в лечении, которые, однако, не должны быть длительными, так как продолжающиеся у женщин меноррагии быстро истощают запасы железа с риском рецидива ЖДА.
Таблица 2. ПЖ для парентерального введения

Железодефицитная анемия ЖДА — это гипохромная микроцитарная анемия, развивающаяся в результате абсолютного дефицита железа в организме.
Помимо анемического синдрома, для нее характерно нарушение функции кожи, ее придатков и слизистых оболочек — сидеропенический синдром.
ЖДА — это последняя стадия дефицита железа; до появления анемии часто при подробном расспросе и осмотре пациента можно обнаружить проявления сидеропении, что позволит своевременно выявить причину дефицита железа и предотвратить развитие ЖДА.
Эпидемиология
Впервые ЖДА описал немецкий врач Й. Ланге в 1554 г., а препараты для ее лечения впервые применил Т. Сиденгам в XVII в. Анемии, развивающиеся в результате дефицита железа в организме, наиболее широко распространены в клинической практике. По данным ВОЗ, около 2,5 млрд человек на Земле имеют скрытый дефицит железа и 1 млрд человек страдает ЖДА.
У женщин она наблюдается в 2–5 раз чаще, чем у мужчин , на 2-м месте по частоте встречаемости дети .
Достоверно доказано влияние ЖДА на увеличение частоты материнской и детской смертности. ЖДА встречаются у 12–13 % детей в возрасте от 6 мес. до 2 лет. В развивающихся странах этот показатель значительно выше: в Индии и странах Африки он достигает 72–76 %. В развитых странах Европы и Северной Америки ЖДА выявляется у 7,5–11 % всех женщин детородного возраста, а у 20–25 % наблюдается скрытый тканевой дефицит железа. Значительно большая частота ЖДА в странах Азии, Африки и Латинской Америки, где она достигает эпидемических величин и составляет 45–60 %. Из всех анемий, встречающихся в клинической практике, около 80 % являются железодефицитными. В Российской Федерации сведений по частоте ЖДА нет, однако, по нашим данным, в Москве ее частота составляет 30–35 % среди женщин детородного возраста, а скрытого дефицита железа — до 60 %.
Развитие анемии
Со временем дефицит железа прогрессирует, течет долгие годы латентно, а затем, после полного истощения запасов железа в депо, развивается ЖДА. Основной механизм развития анемии — нарушение гемоглобинообразования в эритрокариоцитах костного мозга. В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого гемоглобинизация эритронормобластов запаздывает по сравнению с процессом обратного развития ядерных структур. Поскольку синтез гемоглобина из-за дефицита железа страдает в большей степени, чем образование эритроцитов, для ЖДА при сравнительно умеренном снижении числа эритроцитов свойственно более выраженное падение содержания в них гемоглобина, что проявляется гипохромией эритроцитов и развитием гипохромной микроцитарной анемии.
Второй патологический механизм, который имеет место в условиях дефицита железа, — это снижение образования других важнейших белков, участвующих в накоплении и транспорте кислорода. Уменьшается содержание миоглобина в поперечнополосатой мускулатуре. Нарушение образования цитохромов и каталаз приводит к угнетению энергетического обмена всех клеток организма, при этом в основном страдают быстро делящиеся ткани (кожа и слизистые оболочки).
В зависимости от причин, вызывающих дефицит железа, выделяется пять групп ЖДА:
1) хронические постгеморрагические ЖДА;
2) ЖДА, связанные с нарушением всасывания и поступления железа с пищей;
3) ЖДА, связанные с недостаточным исходным уровнем железа в организме (чаще у детей);
4) ЖДА, обусловленные повышением потребности организма в железе (без кровопотери);
5) ЖДА, связанные с нарушением транспорта железа.
Стадии дефицита железа
В настоящее время выделяют несколько стадий дефицита железа:
1. Предрасположенность к развитию железодефицита (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических заболеваний ЖКТ или женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции 59Fe3+ в ЖКТ, которое может превышать 50 % (в норме 10–15 %).
3. Латентный дефицит железа. Характеризуется развитием сидеропенического синдрома, снижением запасов железа в организме по данным лабораторных исследований.
4. ЖДА . Диагноз устанавливается при снижении концентрации гемоглобина до менее 120 г/л у женщин и 130 г/л у мужчин.
Лечение анемии
Лечение ЖДА строится на следующих принципах. До начала лечения обязательно следует выявить и по возможности устранить причину развития ЖДА
Для лечения надо использовать только лекарственные железосодержащие препараты. Вне зависимости от тяжести анемии лечение начинается с пероральных препаратов, исключая противопоказания (острая язва желудка и двенадцатиперстной кишки, эрозивный гастрит), невозможность использования пероральных препаратов (нарушение глотания, отсутствие сознания, интубация и др.).
Лечебная доза пероральных препаратов железа составляет 100– 200 мг элементарного железа в сутки (максимально 300 мг), разделенная на 2 приема. Использование парентеральных средств возможно только при доказанном абсолютном дефиците железа, лечение должно проводиться только в стационаре, вводится только расчетная доза препарата. Внутримышечное введение препаратов железа в настоящее время не применяется. Трансфузии эритроцитарной массы обычно не используются. Они показаны только пожилым людям при наличии тяжелой анемии.
Сроки лечения при использовании пероральных препаратов железа зависят от тяжести анемии, составляют 3–4 мес. при использовании препаратов Fe2+ или 4–6 мес. при использовании препаратов Fe3+.
Эффективность лечения определяется по приросту гемоглобина через месяц после начала лечения. При отсутствии прироста гемоглобина на 10 г/л в месяц и более — отмена препаратов железа, исследование обмена железа, детальное обследование больного, консультация гематолога . Основанием для прекращения терапии является не нормализация гемоглобина, а нормализация содержания железа в депо (ФС > 30–50 мкгл)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Анемии: причины появления, симптомы, диагностика и способы лечения.
Определение
Анемия – это уменьшение содержания гемоглобина и/или снижение количества эритроцитов в единице объема крови, приводящее к снижению снабжения тканей кислородом.
Анемия встречается при ряде заболеваний (язвы и полипы желудочно-кишечного тракта, хроническая болезнь почек, онкологические, инфекционные заболевания, глистные инвазии и др). Чем ниже уровень гемоглобина, тем тяжелее протекает анемия.
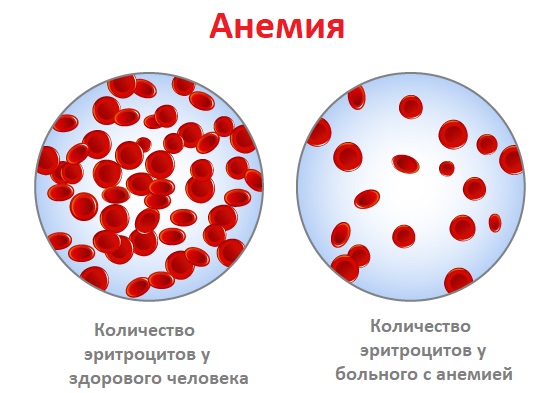
Причины появления анемии
Анемия может возникнуть в результате нарушения образования эритроцитов, повышенного их разрушения или потери эритроцитов с кровью.
Статистика утверждает, что самой распространенной является анемия, возникшая после кровопотери (острой или хронической). Острой считается кровопотеря с объемом крови более 500-700 мл (у взрослых), которая происходит в течение короткого промежутка времени. Потеря крови может быть видимой (кровотечение из ран, кровавая рвота, маточное, носовое кровотечения) и первоначально скрытой (кровотечения в кишечник, в полость живота и/или плевры, большие гематомы).
Хронические кровопотери развиваются в результате незначительных, но длительных потерь крови (обильные и длительные менструации, язва желудка, рак, геморрой, проведение процедур гемодиализа и др.). С течением времени незначительные кровопотери приводят к истощению запасов железа в организме, когда количество теряемого организмом железа превышает его поступление с пищей. В результате дефицита железа нарушается синтез гемоглобина.
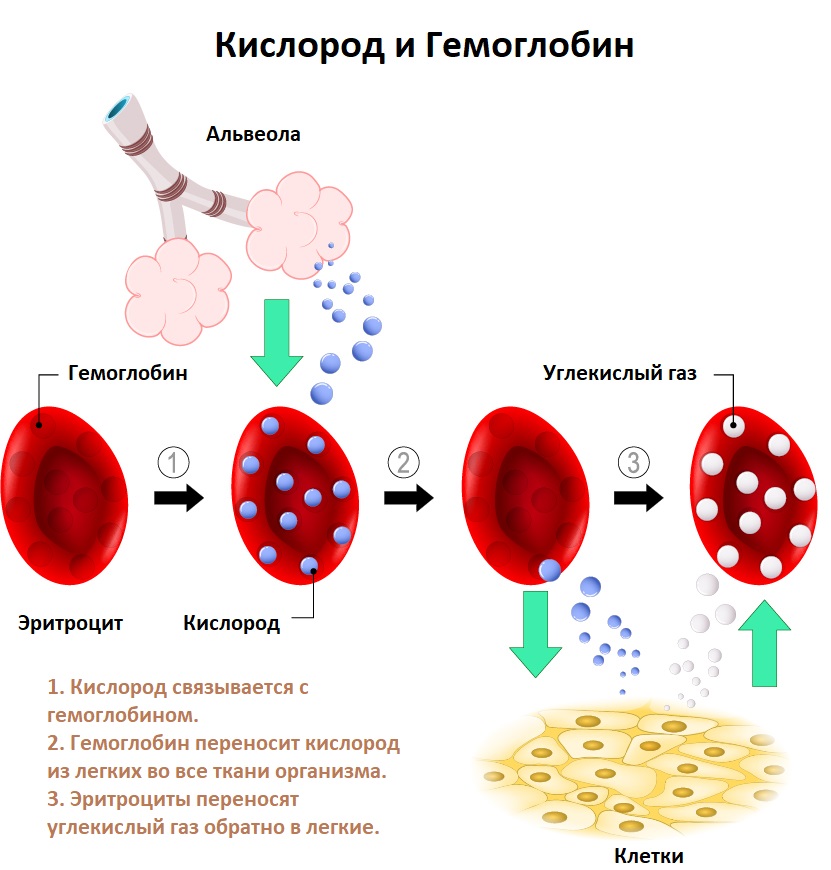
Дефицит железа может возникнуть из-за снижения всасывания железа в результате различных заболеваний двенадцатиперстной кишки и начальных отделов тонкой кишки (энтеритов, опухолей, состояний после оперативных вмешательств на данном участке кишечника). Состояния, приводящие к снижению уровня белков крови, являющихся переносчиками железа (нефротический синдром, нарушение белково-синтетической функции печени, синдром нарушенного всасывания, алиментарная недостаточность), также могут привести к его снижению и, как следствие, к анемии.
Железодефицитные анемии, связанные с исходно недостаточным уровнем железа (недостаток железа у матери в период беременности), наблюдаются у новорожденных и детей младшего возраста.
Анемии вследствие нарушенного кроветворения возникают:
- при недостаточном поступлении в организм или нарушении всасывания в желудочно-кишечном тракте компонентов, необходимых для образования эритроцитов (витамина В6, витамина В12, фолиевой кислоты и др.);
- поражении клеток костного мозга - предшественников эритроцитов токсическими веществами, ионизирующей радиацией;
- образовании вторичных очагов опухолевых клеток в костном мозге (метастазировании);
- нарушении синтеза небелковой части гемоглобина (гема) и накоплении его токсичных продуктов;
- нарушении регуляции образования эритроцитов (уменьшении продукции гормона, стимулирующего рост и размножение эритроцитов (эритропоэтин) или воздействии ингибиторов).
Развитие наследственных гемолитических анемий связано с генетическими дефектами (нарушением активности ферментов эритроцитов, нарушением структуры или синтеза гемоглобина, дефектами мембран эритроцитов).
Приобретенные гемолитические анемии могут быть обусловлены разрушением эритроцитов в результате воздействия на них антител, механических повреждений оболочки эритроцитов, химических повреждений эритроцитов, недостатка витаминов, разрушения эритроцитов паразитами.
Классификация анемий
1. Анемии, связанные с кровопотерей:
- анемии, связанные с нарушением образования гемоглобина;
- анемии, связанные с нарушением синтеза ДНК и РНК;
- анемии, связанные с нарушением процессов деления эритроцитов;
- анемии, связанные с угнетением пролиферации (размножения) клеток костного мозга.
- наследственные гемолитические анемии;
- приобретенные гемолитические анемии.
Существуют общие (неспецифические) проявления анемии и признаки, которые специфичны для определенного вида анемий.
Отсутствие этих признаков не исключает наличие анемии, поскольку при легкой и среднетяжелой форме заболевания, а также его медленном развитии клиническая картина может быть смазанной.
Клинические проявления недостатка железа в организме: сухость кожи, нарушение целостности эпидермиса, ломкость ногтей, волос, изъязвления и трещины в углах рта, мышечная слабость. Может наблюдаться чувство жжения языка, извращение вкуса в виде неукротимого желания есть мел, зубную пасту, землю, сырую крупу, сырое мясо, а также пристрастие к некоторым запахам (ацетона, бензина).
Дефицит витамина В12 также может проявляться поражением желудочно-кишечного тракта (атрофическим гастритом) и неврологической симптоматикой (парестезиями, нарушением чувствительности, онемением конечностей). При крайне тяжелом течении заболевания наблюдаются психические нарушения, бред, галлюцинации, приобретенное слабоумие и др.
Клиническая картина дефицита фолиевой кислоты очень похожа на дефицит витамина В12, но при фолиеводефицитных состояниях отсутствует неврологическая симптоматика и редко возникает воспаление языка. Дефицит фолиевой кислоты приводит к обострению шизофрении, учащению и утяжелению приступов эпилепсии.
Для гемолитических анемий характерны желтушность кожных покровов и слизистых, увеличение размера селезенки, склонность к образованию камней в желчных путях.
При массивном гемолизе эритроцитов (гемолитическом кризе) кроме анемии, желтухи и ухудшения общего состояния могут наблюдаться тошнота, рвота, расстройство сознания, судороги, развитие острой почечной и/или сердечно-сосудистой недостаточности.
При апластической анемии, которая возникает на фоне угнетения пролиферации клеток костного мозга, происходят кровоизлияния (преимущественно в области бедер, голеней, живота, в местах инъекций образуются гематомы). Часто диагностируются бронхиты, пневмонии.
Диагностика анемии
Анемия может возникать под влиянием самых разнообразных факторов. Чаще всего встречаются дефицитные анемии (железодефицитные, B12-дефицитные, фолиеводефицитные и др.).
Большую роль в выявлении причины анемии играют сведения, полученные при опросе пациента: возраст, наличие профессиональных вредностей, характер диеты, наличие сопутствующих заболеваний, прием лекарственных препаратов, информация о наследственности и др. Не менее важны данные осмотра: изменение цвета и состояния кожи; увеличение лимфатических узлов, печени, селезенки; наличие поражения нервной системы.
Первый этап диагностики анемии обычно включает следующие исследования:
-
клинический анализ крови: определение концентрации гемоглобина, количества эритроцитов, лейкоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоцитарной формулы и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Читайте также:

