Метод контроля стерилизации при котором осуществляется посев на чашку петри
Обновлено: 05.10.2024
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
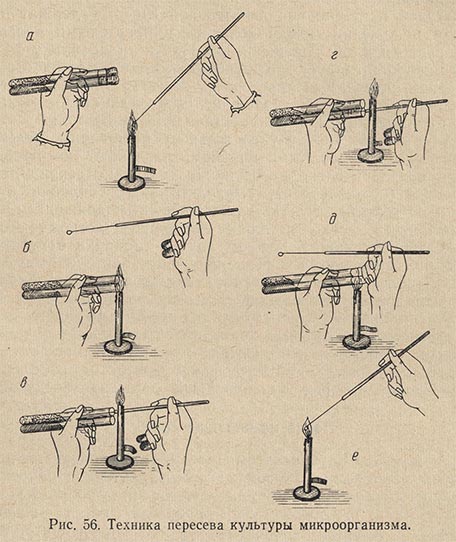
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
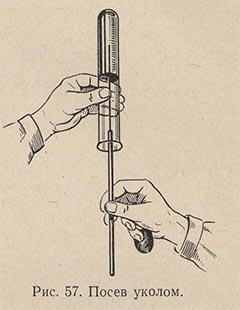
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
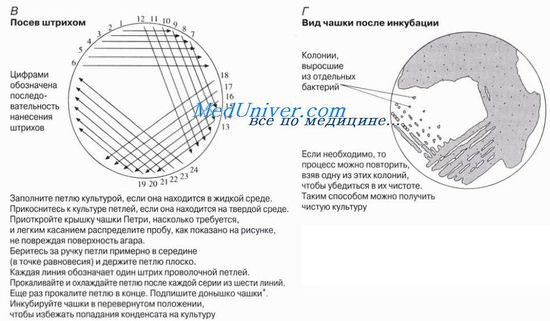
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
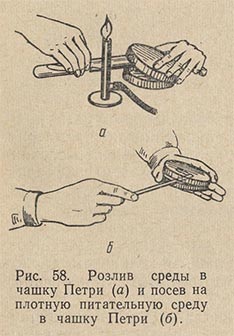
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
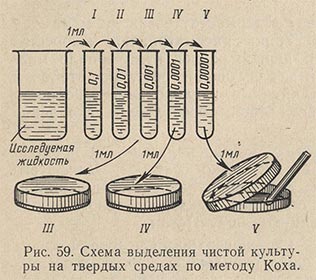
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности в лечебных организациях
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ ФБУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (А.И.Верещагин, М.В.Зароченцев, И.В.Новокшонова, М.А.Ярославцева); ФГУН ЦНИИ эпидемиологии Роспотребнадзора (А.В.Тутельян, С.Ш.Рожнова); ФБУН НИИ Дезинфектологии Роспотребнадзора (И.М.Абрамова, Л.Г.Пантелеева, Н.Ф.Соколова).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека.
3. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г.Г.Онищенко 15 июля 2011 г.
1. Область применения
1.1. Настоящие методические указания предназначены для специалистов органов, осуществляющих функции по контролю и надзору в сфере обеспечения санитарно-эпидемиологического благополучия населения, организаций и учреждений Роспотребнадзора, лечебно-профилактических и других организаций независимо от организационно-правовой формы и формы собственности.
1.2. Методические указания устанавливают методы санитарно-бактериологических исследований в учреждениях здравоохранения, других организациях лечебного профиля. Объектами санитарно-бактериологических исследований, на которые распространяются настоящие методические указания, являются:
объекты окружающей среды, в т.ч. изделия медицинского назначения, зонды, катетеры, бужи, резиновые перчатки и другие изделия из резин и металлов, шовный материал, подготовленный к использованию, и прочее, спецодежда;
1.3. Номенклатура, кратность и объем санитарно-бактериологических исследований устанавливаются действующими нормативно-методическими документами с учетом санитарно-эпидемиологической обстановки.
1.4. Для санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности изделий медицинского назначения в учреждениях здравоохранения и других организациях лечебного профиля могут быть использованы питательные среды лабораторного и промышленного приготовления, расходные материалы, биологические препараты, указанные в настоящих методических указаниях. Применение других коммерческих питательных сред (расходных материалов, биологических препаратов) допускается при наличии методик исследования, утвержденных и разрешенных к применению в установленном порядке.
2. Нормативные ссылки
3. Методы санитарно-бактериологических исследований
3.1. Исследования бактериальной обсемененности воздушной среды
3.1.1. Исследования бактериальной обсемененности воздушной среды проводят в помещениях лечебных организаций в зависимости от их функционального назначения на санитарно-микробиологические показатели:
общее количество микроорганизмов в 1 м воздуха (КОЕ/м);
количество колоний S. aureus в 1 м воздуха (КОЕ/м);
количество плесневых и дрожжевых грибов в 1 м воздуха.
3.1.2. Пробы воздуха отбирают аспирационным методом с помощью аппаратов и устройств, разрешенных к применению в установленном порядке.
Количество пропущенного воздуха должно составлять 100 дм для определения общего количества микроорганизмов, дрожжевых и плесневых грибов и 250 дм для определения S. aureus. Исследование воздуха седиментационным методом не допускается.
3.1.3. Для определения общего количества микроорганизмов в 1 мвоздуха забор проб проводят на питательный агар типа МПА, СПА, ГРМ-агар и другие, приготовленные согласно инструкций по применению. Посевы инкубируют при температуре 37 °С в течение (48±2) ч, подсчитывают количество выросших колоний и производят перерасчет на 1 м воздуха. При наличии роста колоний дрожжевых и плесневых грибов, их подсчитывают и делают пересчет на 1 м воздуха. В протоколе количество дрожжевых и плесневых грибов указывают отдельно.
Примечание: При переносе аппаратов и устройств для отбора проб воздуха из одного помещения в другое их поверхность обрабатывают раствором дезинфицирующего средства. Столик, внутренние стыки, крышку и прочие части прибора с внутренней и внешней стороны протирают спиртом (70%).
3.1.4. Схема бактериологического исследования на стафилококк.
Для определения наличия S. aureus забор проб проводят на желточно-солевые среды на основе сред: элективно-солевой агар, стафилококкагар, маннитолагар или среда N 10 по ГФ XII, агар Байд-Паркер. Чашки с посевами инкубируют в термостате при 37 °С (48±2) ч.
2. Второй-третий день
На вышеуказанных средах стафилококк растет в виде круглых, блестящих, маслянистых, выпуклых, пигментированных колоний. Следует учитывать, что стафилококки, выделенные от человека, дают положительную лецитовителлазную реакцию в 60-70% случаев. Отвивка на скошенный агар для дальнейшего исследования не менее 2 колоний, подозрительных на стафилококк. Для исследования отвивают прежде всего колонии, дающие положительную лецитовителлазную реакцию (образование радужного венчика). При отсутствии на чашках таких колоний дальнейшему исследованию подвергаются пигментированные колонии, схожие по морфологии со стафилококком. При одновременном наличии на чашках колоний стафилококка, отличающихся по пигменту, следует отвивать не менее двух колоний различного вида. Пробирки с посевом помещают в термостат при 37 °С на (24±2) ч.
3. Четвертый день
После инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие плазмокоагулирующей активности в реакции плазмокоагуляции (РПК).
Окраску по Граму проводят общепринятым методом. Под микроскопом окрашенные по Граму стафилококки имеют вид фиолетово-синих кокков, располагающихся гроздьями или небольшими кучками ("кружево").
Заливка чашек
Заливка чашек один из самых основных микробиологических методов. Чашкой называют чашку Петри, содержащую питательный агар. Чашки Петри — специально изготовленные неглубокие круглые контейнеры, которые могут быть стеклянными или пластиковыми. Они используются для роста бактерий, грибов или культуры тканей на твердой питательной среде. Обычно чашки Петри имеют около 9 см в диаметре. Стеклянные чашки можно использовать повторно после автокла-вирования. Пластиковые чашки выбрасывают после использования; обычно их автоклавируют, чтобы уничтожить культуру. При этом они плавятся. Чашки покупают в запечатанных упаковках, которые стерилизованы гамма-облучением. Крышки препятствуют загрязнению чашки, однако молекулы газов могут диффундировать между внутренним объемом чашки и окружающей средой через микроскопические неровности в местах соприкосновения донышка с крышкой. Поэтому кислород имеет доступ к культуре, а двуокись углерода выводится наружу.

Методы инокуляции
Во избежание загрязнения при введении небольшого количества микроорганизмов в питательную среду — инокуляции (или посева) — необходимо использовать асептические методы.
Процедуры посева различаются в зависимости от типа среды (жидкой или твердой).
Посев на твердую среду
Посев штрихом, или посев разведением
Метод представлен на рисунке. Он применяется для выделения чистых колоний бактерий из смеси бактерий. Для посева используют проволочную петлю, которую сначала нужно прокалить, как показано на рис. 12.4,Л, чтобы про-стерилизовать. Затем с помощью петли берут тонкую пленку жидкой суспензии или небольшое количество твердого материала, содержащего исследуемые микроогранизмы, из предварительно выращенной культуры или другого источника микроорганизмов. Петлей мягко проводят по поверхности среды, делая серии штрихов. После каждой серии штрихов чашку немного поворачивают, так чтобы в каждой новой серии распределялись бактерии из предыдущей серии штрихов, истощая таким образом штрихи до отдельных бактерий. (Не надейтесь что-нибудь увидеть на финальных штрихах до окончания времени инкубации!) Когда метод отработан, штрихи можно делать очень быстро.
С помощью этого метода можно выделять бактерии из естественных мест обитания, например из почвы, молока, воды. Образцы твердых субстанций, таких как почва, лучше суспендировать в небольшом количестве воды, либо предварительно проинкубировать в жидкой среде. Безопасным источником для рутинной работы является пастеризованное молоко. Перед тем как проводить эксперименты с бактериями или грибами, следует ознакомиться с инструкциями и правилами безопасности, чтобы снизить до минимума риск культивирования вредных организмов.
Посев на поверхность агара
Посев заливкой
Посев заливкой метод, альтернативный методу посева на поверхность агара, используется для инокуляции клеток из жидкой культуры, а также для подсчета жизнеспособных клеток. Поскольку клетки распределены по всей среде, а не только по поверхности агара, можно подсчитать гораздо большее их количество — до 1000 колоний на чашку. Однако размеры выросших колоний значительно меньше.
Определенный объем (до 0,5 см 3 ) клеточной суспензии вносят в подходящий объем (около 15—20 см 3 ) простерилизованного расплавленного в небольшом флаконе питательного агара, который предварительно был охлажден до 45—50 °С в водяной бане. Снимают крышку и перед добавлением клеточной суспензии прожигают горлышко флакона, как показано на рисунке. Суспензию клеток тщательно перемешивают с питательным агаром, поворачивая (не встряхивая) назад и вперед зажатый в ладонях флакон. Затем выливают смесь в стерильную чашку Петри, как показано на рисунке. Подписывают донышко чашки и инкубируют ее. После инкубации чашка выглядит, как показано на рисунке.
Посев уколом
Метод используют для культивирования анаэробных организмов или организмов, растущих при низкой концентрации кислорода (микроаэрофилов). Обычно используют пробирку с питательной агаризованной средой. Благодаря небольшой поверхности и достаточно большой глубине агара в пробирке по сравнению с чашкой доступ кислорода внутрь агара ограничивается. Посев производят прямой проволочкой (без петли), или бактериологической иглой. Небольшое количество культуры (твердой или жидкой) берут кончиком иглы и затем вертикально прокалывают ею агар. Культура растет в агаре во все стороны от линии прокола.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Техника посевов микроорганизмов на питательные среды

Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.


Рис. 24. Посев на агар в чашки Петри шпателем Дригальского
Глубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:
N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.
2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
Читайте также:

