Методика посева на общую бактериальную обсемененность
Обновлено: 07.07.2024
Санитарно-микробиологическое состояние молочных продуктов, а также различных объектов внешней среды оценивают, как правило, по косвенным микробиологическим показателям, позволяющим судить о возможном обсеменении их патогенными микроорганизмами.
К таким показателям относят общую бактериальную обсемененность, выраженную показателем КОЕ (колониеобразующие единицы), и наличие санитарно-показательных микроорганизмов.
1. Общая бактериальная обсемененность (аэробные и факультативно-анаэробные мезофильные микроорганизмы). Принято считать, что чем выше микробная обсемененность объекта, тем выше вероятность присутствия в них патогенных микробов. Общую бактериальную обсемененность выражают показателем КОЕ, который характеризует количество колоний микроорганизмов, которые вырастают на питательном агаре с гидролизованным молоком при посеве 1 см 3 или 1 г продукта или субстрата и культивировании посевов при 30°С в течение 72 ч.
При определении КОЕ образуются колонии аэробных и факультативно-анаэробных мезофильных микроорганизмов. Это в основном представители сапрофитной микрофлоры. Показатель общей микробной обсемененности значительно меньше, чем истинное количество микроорганизмов в исследуемом объекте. Это объясняется тем, что при высеве на агаре не дают роста мертвые клетки, а также клетки, утратившие способность к размножению, анаэробные микроорганизмы, термофилы и психрофилы, многие представители патогенной микрофлоры и молочнокислые бактерии, не растущие на обычных питательных средах. Кроме того, не учитываются плесени и актиномицеты, рост которых можно обнаружить только на 4-е сутки. Необходимо также иметь в виду, что не всегда разбиваются бактериальные конгломераты, и одна колония вырастает из нескольких клеток.
Пробы для микробиологических исследований отбирают в стерильную посуду, которую закрывают стерильными пробками, горлышко посуды и пробку обертывают бумагой и обвязывают. Отобранные пробы необходимо исследовать не позднее 4 ч с момента отбора, при условии хранения и транспортирования при температуре не выше +6°С.
Предложено два основных метода определения бактериальной обсемененности: посев в бактериологические чашки и редуктазная проба, которая является косвенным показателем микробного загрязнения молока.
Редуктазная проба.
1.1. Метод с метиленовым синим (арбитражный). По продолжительности обесцвечивания реактива оценивают бактериальную обсемененность молока.
Время наступления обесцвечивания содержимого пробирки связано с количеством микроорганизмов в молоке, вырабатывающих фермент редуктазу. Редуктаза обладает способностью обесцвечивать ряд органических красителей (метиленовую синь, резазурин).
Приборы и реактивы: редуктазник или водяная баня с терморегулятором, пробирки диаметром 20 мм и высотой 180 мм, пипетки вместимостью 1 и 20 см 3 , рабочий раствор метиленового синего (готовится из основного).
Основной раствор: 10 г. метиленового синего смешивают со 100 см 3 96%-ного этилового спирта. Раствор помещают в термостат при 37°С на 24 часа, а затем фильтруют.
Рабочий раствор: к 5 мл насыщенного спиртового раствора прибавляют 195 мл дистиллированной воды, тщательно перемешивают. Срок хранения – не более 7 суток.
Проведение анализа. В стерильные пробирки наливают по 1 см 3 рабочего раствора метиленового синего и по 20 см 3 исследуемого молока, закрывают резиновыми пробками и смешивают путем медленного трехкратного переворачивания пробирок. Пробирки помещают в редуктазник; вода в редуктазнике должна доходить до уровня жидкости в пробирке. Наблюдение за изменением окраски ведут через 40 мин, 2,5 и 3,5 ч с начала проведения анализа. Окончанием анализа считают момент обесцвечивания окраски молока.
В зависимости от продолжительности обесцвечивания молоко относят к одному из 4-х классов (табл. 8).
Определение бактериальной обсемененности и класса молока по
редуктазной пробе с метиленовым синим
| Класс молока | Продолжительность обесцвечивания, ч. | Ориентировочное количество бактерий в 1см 3 молока, КОЕ |
| Высший | Более 3,5 | До 300 тыс. |
| I | 3,5 | От 300 тыс. до 500 тыс. |
| II | 2,5 | От 500 тыс. до 4 млн. |
| III | 40 мин. | От 4 млн. до 20 млн. |
1.2. Метод с резазурином. По продолжительности изменения окраски резазурина оценивают бактериальную обсемененность сырого молока.
Приборы и реактивы: приборы и посуда те же, рабочий раствор резазурина (готовится из основного).
Основной раствор: 100 мг резазурина растворяют в 200 см 3 прокипяченной и озлажденной дистиллированной воды. Срок хранения не более 20 сут. при 3-5°С.
Рабочий раствор готовят из основного разбавлением прокипяченной и охлажденной дистиллированной водой в соотношении 1:10. Срок хранения не более 7 сут.
Проведение анализа. В пробирки наливают по 1 см 3 рабочего раствора резазурина и по 10 см 3 исследуемого молока, закрывают резиновыми пробками и трехкратно перемешивают. Пробирки помещают в редуктазник при 37°С. Вода после погружения пробирок должна доходить до уровня жидкости в пробирке или быть немного выше. Момент погружения считают началом анализа. По истечении 1 ч. пробирки вынимают из редуктазника и определяют окрашивание молока. Пробирки, имеющие сиреневую окраску, оставляют в редуктазнике еще на 30 мин. В зависимости от обесцвечивания или изменения цвета молоко относят к одному из 4-х классов (табл. 9).
Определение бактериальной обсемененности и класса молока
по редуктазной пробе с резазурином
| Класс молока | Время обесцвечивания, ч. | Окраска молока | Ориентировочное количество бактерий в 1см 3 молока, КОЕ |
| Высший | 1,5 | Серо-сиреневая до сиреневой со слабым серым оттенком | До 300 тыс. |
| I | 1 | Серо-сиреневая до сиреневой со слабым серым оттенком | От 300 тыс. до 500 тыс. |
| II | 1 | Сиреневая с розовым оттенком или ярко розовая | От 500 тыс. до 4 млн. |
| III | 1 | Бледно-розова или белая | От 4 млн. до 20 млн. |
2. Метод посева в бактериологические чашки основан на способности мезофильных анаэробных микроорганизмов размножаться на питательном плотном агаре при 30±1°С в течение 72 ч.
Приборы и реактивы: термостат; стерильная посуда: чашки Петри, пробирки диаметром 21 мм, пипетки объемом 1 см 3 , пробки, штативы; физиологический раствор, питательная среда (агар).
Проведение анализа. Стерильной пипеткой отбирают 1 см 3 исследуемой пробы молока, переносят в пробирку с 9 см 3 стерильного физиологического раствора (разведение 1:10). Из этого разведения другой стерильной пипеткой 1 см 3 переносят во вторую пробирку, также содержащую 9 см 3 физиологического раствора (разведение 1:100). Таким же путем делают последовательные разведения 1:1000, 1: 10 000, 1:100 000, 1:1000 000.
Каждое из последних трех разведений засевают в количестве 1 см 3 в чашки Петри с заранее маркированными крышками и заливают 10-15 см 3 расплавленной и охлажденной до 40-45°С питательной средой. Содержимое чашек тщательно перемешивают путем легкого вращательного покачивания. После застывания агара чашки Петри переворачивают крышками вниз и ставят в термостат на 72 ч.
Затем чашки просматривают. Количество выросших колоний подсчитывают на каждой чашке, поместив ее вверх дном на темном фоне. Каждую подсчитанную колонию отмечают на дне чашки чернилами. При большом количестве колоний и равномерном их распределении дно чашки делят на одинаковые сектора и подсчитывают число колоний в 2-3-х секторах, находят среднее арифметическое и умножают на количество секторов.
Общее количество бактерий в 1 см 3 вычисляют по формуле:
Где n – количество колоний; m – число десятикратных разведений.

Санитарно -бактериологический контроль смывов с одежды, рук, инвентаря, оборудования
В целях осуществления постоянного санитарно- бактериологического контроля на предприятиях общественного питания, пищевых отраслей различного профиля за поверхностью объектов, контактирующих с продукцией, применяются различные показатели. Например, определяют общую бактериальную обсемененность объекта (руки работников, спецодежда, оборудование и т.п.), наличие санитарно-показательной микрофлоры (БГКП, энтерококков), а также в отдельных случаях наличие на поверхности исследуемого объекта условно-патогенной и патогенной микрофлоры, характерной для данного производства (при использовании мясного сырья — микроорганизмов рода Salmonella , в кондитерском производстве — Staphylococcus ). Общую бактериальную обсемененность объекта определяют количественно (обычно в перерасчете на 1см 2 поверхности- микробное число), а также, в отдельных случаях- качественно.
Данные показатели определяются как в плановом порядке в лабораториях производства и работниками СЭС, так и внепланово по эпидемическим показаниям.
Отбор проб для санитарно-микробиологического исследования предметов обихода и оборудования проводится с помощью следующих методов:
• смывов (тампонами или салфетками );
• отпечатков (контактный метод );
Метод смывов. Этот метод является основным при отборе проб для исследования твердых поверхностей. Смывы с крупных плоских поверхностей (столы, подоконники, полы, стулья, оборудование, инвентарь и т.д.) производят перед началом рабочего дня, либо после санитарной обработки в санитарные дни. Общая площадь поверхности крупных объектов, с которой берется смыв — 100 см 2 . Для ограничения поверхности используют шаблон (трафарет) площадью 25 см 2 , изготовленный из металла, накладывая его последовательно на 4 разных участка. Трафареты перед отбором смывов должны быть простерилизован ы. Смывы с рук работников следует производить перед началом работы. При взятии смывов с рук протирают тампоном обе ладони рук, проводя не менее 5 раз по одной ладони и пальцам, затем протирают участки между пальцами, ногти и под ногтями. При взятии смывов с санитарной одежды протирают 4 площадки по 25 см 2 : нижнюю часть каждого рукава и две площадки с верхней и передней части спецовки. Смывы с посуды на предприятиях общественного питания производят, протирая тампоном всю поверхность исследуемых объектов — для тарелок, рабочую поверхность — для ложек, вилок и т.д. (в количестве 2-3 штуки для мелких объектов). Смывы с мелких предметов можно получить, погрузив их непосредственно в колбу со стерильной жидкостью. В течение 10 мин их встряхивают, затем полученную смывную среду используют для посевов. В каждом случае используют стерильные ватные или марлевые тампоны,
которые перед употреблением смачивают стерильным изотоническим раствором хлорида натрия, водой или питательной средой (чаще мясопептонным бульоном или средой Кесслера). При контроле жирных поверхностей пользуются сухими тампонами или салфетками.
Салфетки помещают в колбы с увлажняющей жидкостью и транспортируют в лаборатории с соответствующим сопроводительным документом, где проводятся соответствующие посевы: на общую обсемененность смыва или его разведения, на присутствие санитарно-показательных (БГКП, энтерококков), патогенных (сальмонелл, синегнойной палочки, протея) микроорганизмов на соответствующие сред ы.
Метод отпечатков, или контактный метод , применяется для определения биологической контаминации ровной гладкой поверхности (как горизонтальной, так и вертикальной ). Кусочки марли (в виде кружков диаметром 3—6 см), мембранные фильтры или полоски фильтровальной бумаги помещают в чашки Петри и заливают расплавленной плотной средой (3% мясо-пептонным агаром или средой Эндо двойной концентрации). После остывания стерильным пинцетом забирают кружочки или полоски и накладывают стороной, пропитанной средой, на исследуемую поверхность, прижимая осторожно пинцетом. Затем переносят в стерильную чашку Петри для последующей инкубации (нижней поверхностью вверх ). Метод отпечатков выгодно отличается от метода смывов возможностью непосредственного обнаружения загрязнения объектов окружающей среды и отсутствием потери микробов в исследуемых предметах (что всегда происходит при распределении микрофлоры со смытой поверхности в смачивающей жидкости).
Метод агаровой заливки применяется для определения микрофлоры различных горизонтальных поверхностей, а также тканей. Для отбора пробы используется специальная металлическая пластинка высотой 2 см в виде кольца усеченной формы с диаметром верхней поверхности круга 5 см и нижней меньшей — 4см. (рис. 9 ,а). Перед исследованием кольцо фламбируют обжиганием, охлаждают, помещают на поверхность исследуемого объекта нижним краем и заливают расплавленным и остуженным до 45 °С мясопептонным агаром или средой Эндо. Спустя 5 -10 мин после застывания среды кольцо осторожно снимают и вытряхивают в стерильную чашку Петри застывшую агаровую пластинку вверх нижней поверхностью, соприкасавшейся с исследуемым объектом. Метод удобен тем, что на поверхность среды захватываются все микроорганизмы, находящиеся на исследуемом участке объекта, но он не дает представления об общей обсемененности предметов из-за ограниченности исследуемой площади. Его рекомендуют применять при небольшой бактериальной загрязненности.
При оценке санитарного состояния предметов обихода, изготовленных из тканей (постельное белье, одеяла, одежда и т. д.) можно применять метод, заключающийся во встряхивании участка загрязненных тканей над чашкой Петри с питательной средой. Обследуемую ткань зажимают в специальной металлической обойме, состоящей из двух колец, вкладываемых друг в друга (рис.9, б), и помещают над чашкой Петри со средой. Встряхивание ткани можно производить просто поколачиванием по ее наружной поверхности стерильным пинцетом или, закрепив в центре ткани стерильную булавку, несколько раз ее оттягивают и отпускают. Вместе с пылью из ткани на питательную среду попадают и находящиеся в ней микроорганизм ы. Чашку закрывают и помещают в термостат для инкубаци и.
Определение общей микробной обсемененности объекта
Определение энтерококков в смывах Проводится титрационным методом или методом мембранных фильтров. Обильный рост колоний энтерококков свидетельствует о свежем фекальном загрязнении исследуемого предмета обихода. За титр энтерококка принимается то
предельное разведение смыва, в котором обнаружены энтерококки.
Исследование смывов на присутствие патогенных стафилококков, сальмонелл, протеев, синегнойной палочки проводят так же, как при санитарно-бактериологическом контроле пищевых продуктов.
Оценка санитарного состояния объектов окружающей среды
При оценке санитарно-микробиологического состояния объектов исходят из цели обследования и назначения этих объектов. Официальных регламентаций о состоянии, составе микрофлоры различных объектов практически нет.
Имеющиеся инструктивные материалы по санитарно- микробиологическому контролю предприятий обществен-ного питания и торговли пищевыми продуктами указывают на то, что фекальное загрязнение должно быть исключено, т. е. не должно быть БГКП на оборудовании (не соприкасающимся с сырыми продуктами), на вымытой посуде. На всех обследуемых предметах обихода и оборудования не должны обнаруживаться патогенные микроорганизм ы: их присутствие указывает на реальную опасность заражения. К сожалению, не всегда удается избежать фекального загрязнения на производстве, в больницах и т.д. В связи с этим, исходя из опыта санитарной практики, если БГКП обнаруживаются только в 5% проб, взятых с предметов обихода и оборудования, санитарно-гигиеническое состояние обследуемого предприятия (лечебного учреждения) расценивается как удовлетворительно е.
По показателям общей обсемененности: санитарное состояние поверхности считается отличным, если ОМЧ на 1см 2 не превышает 100, хорошим — при микробном числе от 100 до 1000, удовлетворительным — более 1000, плохим — более 10000.
В то же время выделение патогенных стафилококков в клиниках хирургического профиля и в родильных домах с предметов обихода и от персонала свидетельствует о санитарном неблагополучии. В этом случае проводится обязательное определение фаговаров и антибиотикограммы выделяемых стафилококко в.
При обследовании различных объектов на стерильность (перевязочный и шовный материал, системы переливания крови, шприцы, иглы, грудное молоко, жидкость для питья детей и т. д.) не должно быть роста во всех посевах.
Свидетельство и скидка на обучение каждому участнику
Исследование воды на общую бактериальную обсемененность и определение санитарно-показательных микроорганизмов
Общее количество бактерий в воде определяют путем посева воды в стерильные чашки Петри, в которые затем добавляют расплавленный и остуженный до 42—45°С агар. При исследовании чистой воды засевают 1 мл, а при исследовании загрязненных вод делают посевы по 1 мл определенных разведений воды (1 : 10— 1 : 100 и более). Чашки помещают в термостат при 37°С на 24 ч (или при 20—22°С на 48 ч) и по истечении срока инкубации подсчитывают все колонии, выросшие как на поверхности агара, так и в глубине его, выбирая чашки, в которых наиболее удобно произвести подсчет колоний.
Общее количество бактерий определяют в пересчете на число колоний, выросших при посеве 1 мл воды. Считают, что в чистой воде общее количество бактерий должно быть не более 100 в 1 мл воды, в воде сомнительной чистоты— от 100 до 1000, в загрязненной — свыше 1000. Общее количество бактерий в 1 мл водопроводной воды не должно превышать 100; для колодцев и открытых водоемов допускают до 1000.
Определение санитарно-показательных микроорганизмов. Интенсивность фекального загрязнения воды характеризуют два показателя:
1) индекс кишечной палочки (коли-индекс)—количество БГКП, обнаруженное в 1 л воды;
2) титр кишечной палочки (коли-титр) — наименьшее количество миллилитров воды, в котором обнаруживают БГКП.
Для определения количества БГКП используют метод мембранных фильтров, который основан на концентрировании определенных объемов воды на мембранных фильтрах с последующим посевом их на среду Эндо. Бродильные (титрационные) методы, предусматривают посев определенного количества воды на среды обогащения, а метод прямого посева — определенных разведений воды на среду Эндо. Бродильный метод удлиняет срок анализа на сутки.
Выбор метода исследования зависит от качества воды. Чистые воды, которые хорошо фильтруются (вода централизованного водоснабжения), исследуют методом мембранных фильтров. Если воды содержат различные примеси, применяют метод бродильных проб. Метод прямого посева на среду Эндо используют редко, при исследовании сильно загрязненных проб воды.
При определении БГКП учитывают все разновидности кишечной палочки, дифференцируя колонии по лактозному признаку, оксидазному тесту и ферментации глюкозы.
Метод мембранных фильтров. Сущность метода заключается в концентрации БГКП из определенного объема воды на мембранном фильтре, выращивании их при 37°С на среде Эндо, дифференциации выросших колоний и определении коли-индекса. Мембранные фильтры представляют собой проницаемые для воды нитроцеллюлозные пленки с порами разного диаметра в зависимости от номера фильтра. Для фильтрации воды централизованного водоснабжения используют фильтры № 2 и 3, диаметр пор которых меньше диаметра бактериальной клетки, а для, загрязненной воды применяют еще и фильтры № 6, задерживающие крупные частицы, взвешенные в воде. Перед употреблением фильтры стерилизуют 10 мин кипячением в дистиллированной воде, меняя ее 3—5 раз. Мембранные фильтры помещают в фильтровальный аппарат Зейтца. Фильтруют не менее 300—500 мл чистой воды, 100—10—: 1 мл или по 1 мл соответствующих разведений более загрязненной воды. После фильтрации пробы воды мембранный фильтр переносят на среду Эндо, разлитую в чашки Петри. Поверхность фильтра с осевшими на не микробами должна быть обращена вверх. Посевы выдерживают в термостате при 37°С в течение 18—24 ч. Если на фильтрах вырастают колонии, характерные для БГКП: красные, темно-красные с металлическим блеском или без него (лактозоположительные), из них готовят мазки, окрашивают по Граму, микроскопируют. При наличии грамотрицательных, не образующих спор палочек ставят тест на наличие оксидазы. Число колоний, не обладающих оксидазной активностью,
подсчитывают и при содержании; их более трех в 1 л питьевой воды и более десяти в 1 л воды колодцев немедленно дают ответ о наличии БГКП в количестве, превышающем норму. Сомнительные колонии— розовые с темным центром и бесцветные, содержащие грамотрицательные палочки и дающие отрицательный результат пробы на оксидазу, пересевают в полужидкую среду с глюкозой (2—3 колонии). При образовании кислоты и газа через 5—6 ч пребывания в термостате при 37°С выделенную культуру также относят к БГКП.
Отрицательный ответ об отсутствии в пробе воды БГКП дают при отсутствии роста на фильтре колоний кишечной палочки через 18—24 ч, а также рри наличии колоний, обладающих оксидазной активностью.
Результаты анализа выражают в виде коли-индекса, который высчитывают, умножив количество выросших колоний БГКП на 1000 и разделив на объем профильтрованной воды.
При исследовании воды открытых водоемов и сточных вод на фильтре подсчитывают только число лактозоположительных колоний кишечной палочки — ЛКП (темно- красные с металлическим блеском и без него). Наличие характерной морфологии, отрицательного теста на оксидазу свидетельствует о присутствии БГКП. При нетипичном росте, отсутствии реакции на оксидазу и в спорных случаях производят посев подозрительных колоний на полужидкую среду с лактозой и определяют ферментацию до кислоты и газа при 37°С. Учетом только лактозоположительных кишечных палочек можно закончить исследование воды водоемов (пресных и соленых) в местах хозяйственно-бытового и культурного водопользования, на этапах очистки питьевой воды, необеззараженных сточных вод и воды открытых водоемов.
Все БГКП (лактозоположительные и лактозоотрицательные варианты) определяют при изучении процессов самоочищения воды, при изучении искусственных водоемов (водохранилищ и каналов), выборе нового источника водоснабжения, преобладании на фильтре розовых оксидазоотрицательных колоний.
Титрационный (бродильный) метод. Сущность бродильного метода заключается в посеве определенного количества воды на жидкие питательные среды накопления, подращивании БГКП при 37° с последующим высевом на плотные питательные среды (среда Эндо), дифференциации выросших колоний и определении БГКП в 1 л воды. Выбор объема исследуемой воды зависит от характера водоисточника. Выбранные объемы проб засевают во флаконы и пробирки с глюкозопептонной или лактозопептонной средой, внося 100 и 10 мл воды в 10 мл или 1 мл концентрированной среды, а 1 мл воды или 1 мл соответствующего разведения воды — в пробирки с 5 мл среды обычной концентрации. Инкубируют при 37° С в течение 24 ч и делают высев на среду Эндо (с расчетом получения роста изолированных колоний) из каждого флакона и пробирки, где наблюдают помутнение, образование кислоты и газа или только помутнение и образование кислоты. Посевы выдерживают при 37°С в течение 16— 18 ч. При росте на среде Эндо темно-красных с металлическим блеском или без него колоний, в которых при микроскопии обнаруживают грамотрицательные палочки, не обладающие оксидазной активностью, ответ о присутствии БГКП выдают через 40—42 ч. При росте на среде Эндо розовых или бесцветных колоний, оксидазонегативных, содержащих грамотрицательные палочки, их отсевают на среду с глюкозой. Образование кислоты и газа в пробирке с этой средой через 24 ч инкубирования при 37°С свидетельствует о наличии БГКП. Результаты исследования выражают коли-индексом, величину которого определяют по таблице.
Определение оксидазной активности колоний БГКП проводят непосредственно на мембранном фильтре, который переносят на фильтровальный лист бумаги и смачивают реактивом. Через 2—5 мин его помещают обратно на среду Эндо и учитывают результаты. При отрицательной реакции цвет колоний не меняется, при положительной— колонии изменяют цвет на сине-фиолетовый.
При бродильном методе фильтровальную бумагу смачивают реактивом, часть колонии со среды Эндо переносят штрихом на бумагу. При положительном результате реакции не позднее 1—2 мин штрих синеет, при отрицательном — не меняется. Реактив можно закапать непосредственно на колонию или сектор посева на среде Эндо. Следует помнить, что реактив обладает бактерицидными свойствами, поэтому колонии для дальнейших исследований непригодны.
При отсутствии реактива для оксидазного теста делают прямой посев или высев со среды накопления на модифицированную среду Эндо с молоком или желатином. Дифференцируют БГКП от других грамотрицательных палочек, которым не придают санитарно-показательного значения, по наличию у последних протеолитической активности: образованию кратера на среде с желатином или зоны протеолиза (просветления вокруг колонии) на среде Эндо с молоком.
Дополнительные исследования, выявляющие наличие фекальных кишечных палочек (ФКГІ) —показателей свежего фекального загрязнения, проводят путем постановки теста ферментации лактозы до кислоты и газа при 43— 45°С, засевая колонии в желчно-лактозную среду с бриллиантовым зеленым, или лактозный бульон с борной кислотой, или полужидкую среду с лактозой. Наличие кислоты и газа при инкубации в течение 24 ч при 43—44,5°С, а также отсутствие роста на среде Козера (отношение к солям лимонной кислоты) указывает на свежее фекальное загрязнение воды.
Качество питьевой воды определено ГОСТ 2874-73, в котором предусмотрено как норма:
1) общее количество бактерий в 1 мл воды не более 100;
Источник первичного обсеменения молочных продуктов микроорганизмами – молоко-сырье. Обсеменение молока сырого происходит на этапе его получения, хранения, транспортировки и зависит от здоровья животных, в том числе их вымени; санитарно-гигиенического состояния ферм (чистоты оборудования, воды, воздуха, личной гигиены персонала) и качества кормов.
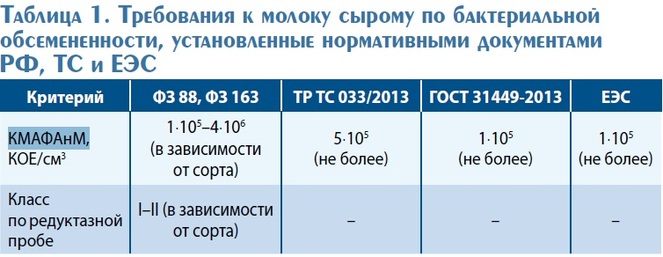
Требования к молоку сырому по бактериальной обсемененности, установленные нормативными документами РФ, Таможенного союза и ЕЭС, представлены в табл. 1.
В цепи производственного контроля молочного сырья и готовой продукции микробиологические исследования – самый сложный элемент. Как правило, стандартные методы микробиологических исследований достаточно трудоемки и для получения результата требуется нескольких суток. В итоге результат продолжительного микробиологического исследования не может быть использован в производственном процессе и является формальным.
Для управления технологическими процессами в молочной промышленности необходимы количест венные экспресс-методы микробиологического конт роля, дающие результат в режиме реального времени и обеспечивающие возможность быстрой микробиологической диагностики поступающих потоков сырого молока разного качества.
Решение глобальной проблемы нехватки качественного сырого молока состоит не только в увеличении продуктивности молочного стада, но и в оптимизации существующей производственной инфраструктуры. Наличие быстрых методов оценки гигиены производства, в том числе сырья, позволяет локализовать риски для оперативной санации и значимо улучшить качество поставляемого молока.
Работа с поставщиками сырого молока – эффективный путь повышения безопасности всей производственной цепи. Поэтому она должна сводиться не к формальному декадному контролю, а к объективной оценке микробиологического качества молока в реальном вре мени и помощи поставщикам в устранении текущих проблем. Под реальным временем оценки микробиологического качества молока следует понимать диапазон в несколько минут. В этом случае быстрый количественный микробиологический результат становится ключом к инновационной системе управления современным производством, где цифровые данные немедленно поступают в информационную систему для оперативного принятия решения.
По этой причине быстрые количественные микробиологические методы находятся в зоне пристального внимания ведущих специалистов молочной индуст рии. До последнего времени о такой возможности переработчики молока могли только мечтать.
Основной недостаток чашечного метода – длительность анализа, так как большинству микроорганизмов для образования видимых колоний необходимо не менее 2–3 сут.
Питательная среда, используемая для определения бактериальной обсемененности молока, должна обеспечивать рост единичных клеток, не ограничивая и не создавая условий для опережающего развития каких-либо отдельных групп микроорганизмов, а также обеспечивать должную выявляемость тех микроорганизмов, которые способны расти и размножаться в молоке и молочных продуктах. Большое значение для точности метода имеет размер колоний, образуемых на чашках и подлежащих подсчету. Чем больше диаметр колонии, тем выше вероятность того, что она будет визуально замечена и учтена при подсчете
Точность и воспроизводимость результатов определения бактериальной обсемененности молока чашечным методом зависит от ряда причин:
- ростовых характеристик питательной среды и правильности ее приготовления;
- точности работы микробиолога при приготовлении разведений продукта и проведении посева;
- правильности подсчета колоний и обработке результатов.
Для определения уровня бактериальной обсемененности молока сырого ГОСТ 32901-2014 предполагает возможность применения косвенного экспресс-метода – редуктазной пробы .
В процессе жизнедеятельности бактерии выделяют в окружающую среду, наряду с другими окислительновосстановительными ферментами, анаэробные дегидразы, по старой классификации называемые редуктазами. Существует зависимость между количеством мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) в молоке и содержанием в нем редуктаз, что дает возможность использовать редуктазную пробу как косвенный показатель уровня бактериальной обсемененности сырого молока.
Метод основан на восстановлении резазурина окислительно-восстановительными ферментами, выделяемыми в молоко микроорганизмами. По интенсивности изменения окраски резазурина через 1 ч оценивают уровень бактериальной обсеменности сырого молока.
Основные преимущества оценки уровня бактериальной обсемененности молока по редуктазной пробе:
- метод крайне прост в исполнении и не требует специального оборудования;
- метод малозатратный, не предполагающий дорогостоящих реактивов;
- метод, проверенный многолетним опытом применения в промышленности.
Основные недостатки метода:
- низкая чувствительность (порог чувствительности составляет 3⋅10 5 КОЕ/см 3 );
- дает возможность отнести молоко к тому или иному классу (до 500 тыс. в 1 см 3 молока – I класс; более 500 тыс. в 1 см 3 молока – II класс) без конкретных показателей количества бактериальных клеток.
Результаты определения могут быть представлены как в абсолютных значениях микробной биомассы, так и со-отнесены с результатами определения колониеобразую-щих единиц (КОЕ) или численностью клеток.
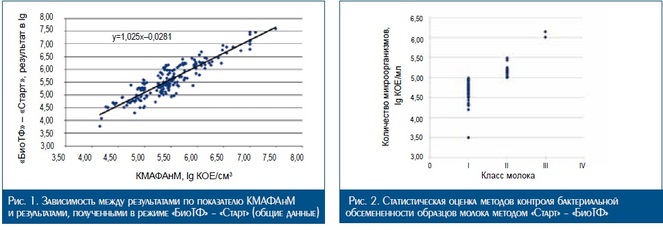
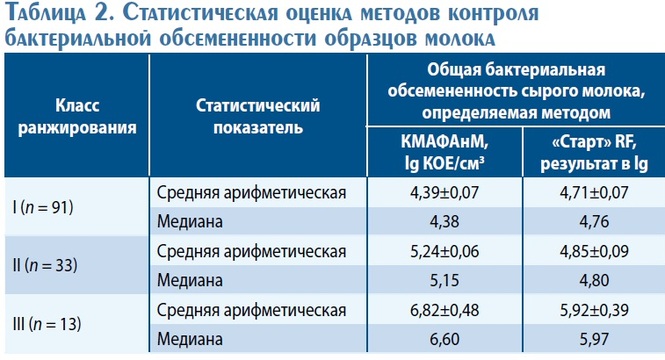
На рис. 2 и 3, а также в табл. 2 представлены результа ты статистической оценки методов контроля бактери альной обсемененности образцов молока, ранжирован ных по классам:
•• I класс – до 100 тыс. КОЕ/см3 ;
•• II класс – от 100 до 500 тыс. КОЕ/см3;
•• III класс – более 500 тыс. КОЕ/см3 .
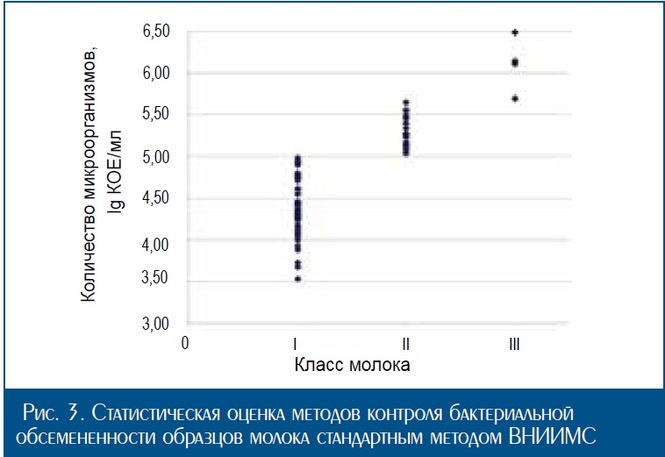
Среднее значение десятичного логарифма численности микроорганизмов в серии экспериментов стандартным и экспресс-методом составило 4,69 и 4,81 lg КОЕ/см3, со ответственно. Деление результатов, полученных в каждой серии экспериментов, на классы в соответствии с суще ствующей системой градации качества молока выявило тождественность методов.
Получите подробную консультацию по анализатору бактериальной обсемененности молока у специалистов компании Агролаб по телефону 8 (383) 280-42-38
Читайте также:

