Одревесневшие ткани стебля выдерживают в стерилизующем растворе
Обновлено: 05.10.2024
Нажмите ☆ , чтобы добавить сайт в избранное.
ГДЗ ответы по биологии учебник 6 класс Пасечник, многообразие покрытосеменных растений - ГДЗ к учебнику биологии 6 класс Пасечник, ответы к § 9 Строение стебля
Ответы к § 9. Строение стебля
Вопросы в начале параграфа
1. Что называют побегом?
Побегом называют стебель с расположенными на нём листьями и почками.
2. Какие функции выполняют механическая, проводящая, покровная ткани?
Перечисленные ткани выполняют следующие функции:
- механическая — обеспечивает прочность органов растений;
- проводящая — обеспечивает продвижение воды с растворёнными в ней питательными веществами;
- покровная — защищает внутренние органы растения от повреждений и проникновения вредных микроорганизмов.
3. Какие стебли имеют известные вам растения?
Можно выделить два основных вида стеблей растений: травянистые и деревянистые.
4. Чем различаются стебли деревьев, кустарников, трав?
Стебли трав и молодых побегов деревьев и кустарников — травянистые. Обычно они существуют только один сезон, а потом либо погибают, либо видоизменяются (происходит одеревенение).
Стебли деревьев и кустарников — деревянистые. Они прочные и твёрдые, а срок из существования может длится годами, десятилетиями, а у некоторых деревьев и столетиями.
Лабораторная работа: Внутреннее строение ветки дерева
1. Рассмотрите ветку, найдите на ней чечевички (бугорки с отверстиями). Какую роль в жизни дерева они играют?
Через чечевички происходит газообмен: дерево получает воздух из окружающей среды и выводит отработанный воздух наружу.

2. Приготовьте поперечный и продольный срезы ветки. С помощью лупы рассмотрите слои стебля на срезах. Используя учебник, определите название каждого слоя.
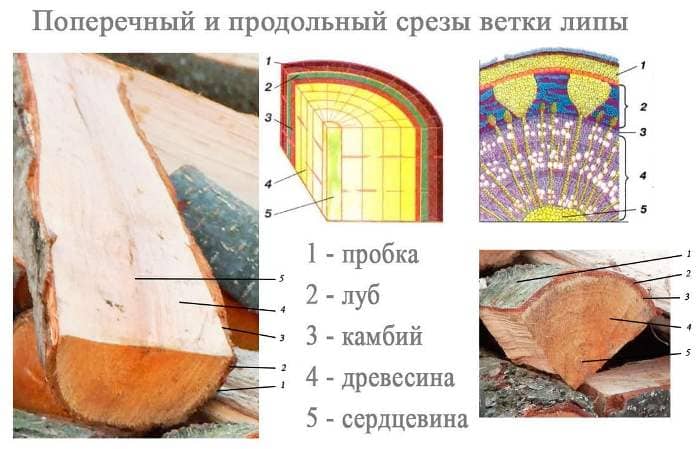
3. Иглой отделите кору, попробуйте её изогнуть, сломать, растянуть. Прочитайте в учебнике, как называется наружный слой коры. Что такое луб? Где он расположен и каково его значение для растения?
Внешний слой коры у молодых деревьев называется кожицей, а у взрослого растения — пробкой.
Луб — это внутренний слой коры. В его состав входят ситовидные трубки и лубяные волокна. По ситовидным трубкам перемещаются растворы органических веществ, необходимых для питания деревьев, а волокна проводят воду и минеральные вещества.
4. На продольном срезе рассмотрите кору, древесину, сердцевину. Испытайте каждый слой на прочность.
Если рассматривать кору (пробку), древесину и сердцевину, то самым прочным слоем ствола оказывается древе сина. Она состоит из механической ткани, созданной специально чтобы придавать растению прочность и твёрдость.
Сердцевина уже не такой прочный слой стебля. Она кажется рыхлой. По строению сердцевина состоит их крупных клеток с тонкими оболочками и служит для накопления запаса питательных веществ.
Кора (пробка) — наиболее хрупкий слой. Она состоит из отмерших клеток с большим количеством межклеточников, заполненных воздухом, потому очень быстро ломается.
5. Отделите кору от древесины, проведите пальцем по древесине. Что вы ощущаете? Прочитайте в учебнике об этом слое и его значении.
Если отсоединить кору от древесины, то можно на ощупь почувствовать слой, который называется камбий. Это тончайший слой, который состоит из узких и длинных клеток образовательной ткани. Увидеть его невооруженным взглядом практически невозможно, но если провести по древесине пальцем, то на месте отделения коры можно ощутить увлажнение. Такое увлажнение возникает из-за того, что при отделении коры клетки камбия разорвались и их содержимое вытекло.
Камбий выполняет важную функцию в жизни стебля. Клетки этого слоя обладают способностью делиться (относятся к образовательной ткани). Благодаря этому ствол постоянно увеличивается в толщину — утолщается слой древесины и слой луба.
6. Зарисуйте поперечный и продольный срезы ветки и подпишите названия каждой части стебля.
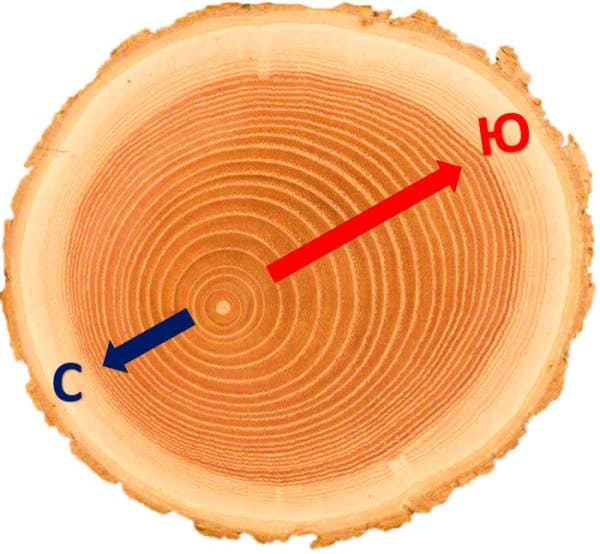
7. На спиле древесного стебля найдите древесину, подсчитайте с помощью лупы число годичных колец и определите возраст дерева.
Возраст этого дерева — 11 лет.

8. Рассмотрите годичные кольца. Одинаковы ли они по толщине? Объясните, чем отличается древесина, образовавшаяся весной, от древесины более позднего времени года.
Годичные кольца на этом спиле все разной толщины. Это значит, что условия произрастания в разные годы были различны. Например можно сказать, что 4-й, 5-й и 6-й год дерево получало значительно меньше влаги, поскольку годичные кольца, образованные в эти года, тоньше остальных.
Древесина, образованная весной, летом и осенью выглядит по разному. Весной и летом образуются крупные клетки, они дают более светлую древесину. А осенью древесина прирастает узким и более тёмным кольцом из мелких клеток.
9. Установите, какие слои древесины старше по возрасту — лежащие ближе к середине или к коре. Объясните, почему вы так считаете.
Чем ближе к сердцевине находится слой древесины, тем он старше и наоборот — чем ближе к коре слой древесины, тем он младше. Это объясняется тем, что слой камбий, который и производит новые клетки древесины, находится на границе между корой и древесиной.
Вопросы в конце параграфа
1. Каково внутреннее строение стебля дерева или кустарника?
Внутреннее строение стебля дерева включает в себя несколько основных слоёв (от центра): сердцевину, древесину, камбий и кору.
2. Какое значение имеют кожица и пробка?
Кожица у молодых деревьев и пробка у более взрослых растений — это внешний слой коры. Они состоят из покровной ткани и необходимы для защиты растений от различных механических повреждений, излишнего испарения, проникновения внутрь вредных микроорганизмов и опасных веществ, а также от проникновения внутрь болезнетворных бактерий.
Кроме того, кожица и пробка обеспечивают газообмен между деревом и окружающей средой. Для этого у кожицы имеются устьица, а на поверхности пробки образованы чечевички.
3. Где расположен луб и из каких клеток он состоит?
Луб — это внутренний слой коры. Он находится под пробкой или кожицей. Луб состоит из ситовидной ткани и лубяных волокон. Первые перемещают растворы органических веществ, а вторые — воду и растворённые в ней минеральные вещества.
Ситовидные трудки состоят из вытянутых живых клеток, у которых поперечные клетки пронизаны отверстиями словно сито. Ядра в клетках ситовидных трубок разрушены, а цитоплазма прилегает к оболочке.
У лубяных волокон клетки тоже вытянутые, но их содержимое разрушено, а стенки одеревенелые. это очень прочные и гибкие волокна образованные механической тканью.
4. Что такое камбий? Где он расположен?
Камбий находится между корой дерева и древесиной. Это очень тонкий слой образовательной ткани состоящий из узких длинных клеток способных постоянно делиться. В результате деления клеток камбия в стволе образуются новые клетки древесины и новые клетки луба, а дерево постоянно увеличивается в толщину.
5. Какие слои видны на поперечном срезе стебля при рассматривании невооружённым глазом и с помощью микроскопа?
Невооружённым взглядом на поперечном срезе стебля можно рассмотреть следующие слои: кору, древесину и сердцевину. Слой камбия можно определить на ощупь, если отделить от древесины кусочек коры.
Под лупой или в микроскоп можно выделить составляющие части коры: кожицу, пробку и луб.
6. Что такое годичные кольца? Как они образуются?
Годичное кольцо — это слой древесины образованной деревом в течении года (годичное кольцо прироста). Весной, летом и осенью клетки камбия начинают делится и образуют все новые и новые слои древесины. Весной и летом образуются крупные клетки, а осенью — мелкие. Увидеть разницу между весенними и осенними клетками чаще всего можно даже невооруженным взглядом.
Благодаря этому по срезу дерева можно определить его возраст и условия, в которых произрастало растение в тот или иной период времени. Например узкое годичное кольцо говорит либо о недостатке влаги для растения, либо о его плохой освещенности.
Подумайте
Что можно определить по годичным кольцам? Почему у многих тропических растений годичных колец не видно?
По годичным кольцам можно определить возраст растения и условия окружающей среды, в которых произрастало растения в тот или иной период его жизни.
У многих тропических растений годичные кольца отсутствуют поскольку в этой природной зоне климатические условия не меняются со сменой времён года. Растения и зимой, и летом развиваются одинаково. Клетки камбия делятся с одинаковой скоростью и образуют новые клетки древесины ничем не отличающиеся по внешнему виду от древесины, образованной в предыдущий сезон (весенние клетки древесины не отличаются от зимних).
Задания
1. Рассмотрите чечевички на ветвях бузины, черёмухи, дуба и других деревьев и кустарников.

2. Определите возраст какого-либо спиленного дерева по годичным кольцам. Сделайте рисунок спила. Укажите на рисунке сторону, которая у дерева была обращена к северу.
3. Возьмите ветки яблони, багульника (рододендрона сибирского), вишни и поставьте их в сосуд с водой в тёплом светлом помещении. Подливайте в сосуд свежую воду. Через полторы-две недели на ветках распустятся цветки. Используйте их при изучении строения цветка.
Словарик
Травянистый стебель — это нежные и гибкие стебли трав и молодые побеги растений, которые существуют обычно один сезон.
Деревянистый стебель — это твёрдые стебли деревьев и кустарников.
Прямостоячий стебель — это стебли, которые растут вертикально вверх.
Вьющийся стебель — это стебли, которые поднимаясь вверх обвивают опору.
Лазающий стебель — это стебли, которые поднимаясь вверх цепляются за опору усиками или придаточными корнями, отрастающими от стебля.
Ползучий стебель — это стебли, которые стелются по земле и могут укореняться в узлах.
Чечевички — это маленькие бугорки с отверстиями, которые образуются в пробке стебля для осуществления газообмена.
Пробка — это верхний покровный слой коры защищающий внутренние слои стебля (ствола) растения.
Кора — это покровный слой стебля состоящий из пробки (кожицы) и луба.
Луб — это внутренний слой коры, в состав которого входят ситовидные трубки и лубяные волокна.
Ситовидные трубки — это слой луба, по которой перемещаются растворы органических веществ.
Лубяные волокна — это слой луба, по которой проводятся растворённые в воде минеральные вещества.
Камбий — это слой стебля, который находится между лубом и древесиной и состоящий из постоянно делящихся клеток.
Древесина — это самый широкий и самый плотный слой стебля, обеспечивающий устойчивость и прочность стебля.
Сердцевина — это центральный рыхлый слой стебля, в котором откладываются запасы питательных веществ.
Сердцевинные лучи — это слой проводящих и запасающих клеток стебля, идущих от сердцевины в радиальном направлении через древесину и луб.
Исследования показали, что по скорости одревеснения побегов и опробковению листовых следов саженцы, подвергшиеся химической дефолиации, существенно превосходят те, на которых удаляли листья ручным способом. Было установлено также, что предвыкопочная химическая дефолиация благоприятствует подготовке саженцев к выкопке, транспортированию, перезимовке в прикопе и на постоянном месте и не сказывается отрицательно на их дальнейшем развитии.[ . ]
Различают лигнин первичный, находящийся в одревесненных клеточных стенках (природный лигнин) и вторичный — изолированный лигнин. Последний является в значительной степени веществом, измененным в процессе изолирования и загрязненным примесями посторонних веществ. Изменение лигнина выражается в отщеплении метоксильных групп, внутримолекулярной конденсации и в других признаках.[ . ]
Озимая совка (Agrotis segetum Schiff.) нападает на хлопчатник только до времени одревеснения стеблей всходое. Характер онтогенеза злаков имеет во взаимоотношениях между ними и шведской мухой (Oscinosoma frit L.) решающее значение. Относительная устойчивость злаков определяется в основном скоростью начального развития и темпом увеличения конусов нарастания.[ . ]
Клеточная оболочка легкопроницаема как для воды, так и для растворенных веществ. Одревеснение заметно снижает ее проницаемость, а опробковение делает ее непроницаемой, вследствие чего клетка отмирает.[ . ]
Применяют контактные гербициды, например минеральные масла на хлопчатнике, после одревеснения нижней части стебля так, чтобы гербицид не повредил культурное растение. При использовании избирательно действующих препаратов, проникающих через корневую систему, почву обрабатывают в рядках и междурядьях.[ . ]
Одревесневшие черенки получают от листопадных деревьев и кустарников в период покоя, когда произошло полное одревеснение стебля.[ . ]
Лигнин — наиболее устойчивое соединение довольно сложного состава; питательного значения не имеет; накапливается при одревеснении.[ . ]
Оптимальная доза регуляторов роста при обработке черенков одних и тех же пород и культур изменяется в зависимости от степени одревеснения и возраста черенков, а также сроков черенкования.[ . ]
На побегах появляется такой же мучнистый налет. Под иим образуются темные пятна, которые становятся хорошо заметными только после одревеснения побегов. Во многих случаях на поверхности пятен развиваются кленстотеции в виде скученно расположенных мелких черных точек.[ . ]
Во многих клетках клеточная оболочка с возрастом пропитывается веществами, еще более укрепляющими ее. Накопление в ней лигнина ведет к одревеснению оболочки. Одревесневают стенки клеток древесины и, часто, лубяных волокон, оболочки клеток кожуры семян, иногда околоплодника (рис. 30) и даже лепестков. Клетки с одревесневшими стенками не только прочнее, но и менее проницаемы для микробов, для воды. Оболочки некоторых других клеток — покровных тканей, а также на поверхностях поранений — опробковевают, пропитываясь суберином. Содержимое клеток после этого отмирает, так как суберин непроницаем для воды и газов, но ткань из таких мертвых клеток защищает внутренние живые части растения от вредных внешних воздействий. Как уже говорилось, наружные оболочки клеток эпидермиса обычно пропитываются или покрываются кутином и воском, и это сохраняет клетки от излишнего испарения воды, от проникновения инфекции. Оболочка может пропитываться и минеральными веществами, преимущественно солями кальция.[ . ]
Типы зеленых черенков. В практике вегетативного размножения растений используют различные типы зеленых черенков. В зависимости от степени одревеснения побега зеленые черенки делят на травянистые и полуодревесневшие.[ . ]
Зеленые части растения хлопчатника чувствительны к минеральным маслам и при опрыскивании могут быть повреждены и даже убиты. С возрастом происходит одревеснение основания стебля растений, благодаря чему эта часть его становится устойчивой к маслам.[ . ]
Характерной особенностью молодых растений является продолжительный период роста побегов в течение периода вегетации. За это время они достигают значительного размера, одревеснение клеточных стенок идет сравнительно медленно.[ . ]
Некоторые растения остаются травянистыми на протяжении всей своей жизни, стебли других во взрослом состоянии становятся твердыми и одревесневшими. Этот процесс, известный как одревеснение, наблюдается у деревьев и кустарников. Растения, в которых происходит одревеснение, обычно живут много лет. Они значительно выше растений, имеющих нежные и сочные стебли.[ . ]
Выкапывают хвойный посадочный материал чаще всего весной до начала вегетации растений, а в районах с малоснежными зимами во избежание иссушения сеянцев - осенью, после опадения листьев и одревеснения побегов. Лиственные породы, особенно плодовые, выкапывают, как правило, осенью. После выкопки сеянцев и саженцев их сортируют, применяя шаблон или заранее приготовленное модельное растение. Сортировку проводят под навесом, в тени, во избежание иссушения корневой системы. В период безветренной облачной погоды с повышенной влажностью воздуха возможна сортировка посадочного материала непосредственно на грядках. Отсортированные сеянцы и саженцы увязывают в пучки весом не более 10 кг. Сеянцы при высоте стволика до 40 см увязывают в пучки по 100 шт., более 40 см - по 50, а саженцы по 50, 25 и 10 шт. в зависимости от их размера.[ . ]
Необычный структурный дефект отмечается при заражении деревьев яблони вирусом поникания ветвей. Такие деревья неспособны синтезировать нормальные количества лигнина, т. е. не происходит нормального одревеснения [132].[ . ]
При заготовке побегов крыжовника следует обращать внимание на изменение их окраски. По наблюдениям К. Д Сергеевой (1989), оптимальный срок черенкования крыжовника, особенно сортов американского типа,— в начале одревеснения, когда верхние части побегов приобретают розоватую, буроватую, фиолетовую либо другую окраску Так, у сорта Русский побег окрашивается в розовый, у сорта Пионер — в красный цвет. Другим наглядным признаком наступления оптимального срока черенкования является образование самого длинного междоузлия, за которым следуют более короткие.[ . ]
Основные симптомы: вертикальные трещины, затем отслаивание коры ствола и крупных сучьев па значительных участках, растрескивание ее и отваливание большими участками. Сопутствующие симптомы: угнетение роста побегов, их рапиее одревеснение, опадание завязей, мелкоплодпость, потемнение парепхпмпых тканей ствола, гипертрофия и гиперплазия клеток листьев, затем их отмирание. Наиболее сильно страдают от укзо-кортиса деревья, привитые па дикий трехлиетнын лпмоп (Poncinis irifoliata L.).[ . ]
Одно и то же растение реагирует на внесение арборицида или гербицида неодинаково на протяжении вегетационного периода. Отечественный и зарубежный опыт предостерегает против ранневесенних обработок, так как это может отрицательно сказаться на хвойных породах до одревеснения их побегов.[ . ]
У сахарной свеклы могут появиться цветоносные стебли уже в первый год вегетации. Это так называемая цветуха. Ей, как правило, подвержены растения свеклы, развивавшиеся в условиях холодной весны и относительно длинного светового дня. Цветуха снижает сахаристость и вызывает частичное одревеснение тканей корнеплода.[ . ]
Биологические ритмы — периодически повторяющиеся изменения интенсивности и характера биологических процессов и явлений. Например, ритмичность в делении клеток, синтезе ДНК и РНК, секреции гормонов, суточное движение листьев и лепестков в сторону Солнца, осенние листопады, сезонное одревеснение зимующих побегов, сезонные миграции птиц и млекопитающих и т.д.[ . ]
Пейан, впервые установивший гетерогенный характер древесины, в 1838 г. открыл лигнин как ее составную часть /1/. Ботаникам еще раньше было известно, что некоторые растения, особенно высшие (древесные), в ходе своего роста постепенно становятся более твердыми и изменяются химически. Такие изменения были названы одревеснением (де Кандоль, 1833) /2/.[ . ]
При вегетативном размножении черенки смородины, крыжовника, вишни, сливы, яблони, винограда, лимона, сирени и других растений связывают в пучки и наполовину погружают в водные растворы стимуляторов на 1—24 часа. Концентрация растворов от 0,001% до 0,2%. Время выдерживания черенков в растворе зависит от концентрации раствора, вида растения и степени одревеснения черенков. Выдержанные в растворе черенки высаживаются во влажный песок в парники или теплицы, где они должны находиться до полного укоренения.[ . ]
Но и в этой третьей группе требуется отличать те фенольные соединения, которые столь широко или почти повсюду распространены в растениях, что не имеют большого значения для систематики. Существуют, однако, некоторые метаболиты и происходящие от них вещества, которые встречаются в сравнительно больших группах растений и связаны, например, со степенью одревеснения. Кроме того, существует целый ряд особых фенольных соединений, физиологическая функция которых до сего времени неизвестна, но наличие которых тесно связано с филогенетической близостью отдельных групп растений. Соединения эти могут представить большой интерес и послужлть в систематике растений удобным таксономическим признаком и аналогично - филогенетическим. Однако пока приходится констатировать, что исследования фенольных соединений еще не оказали достаточного влияния на классическую таксономию, и можно указать лишь немногочисленные примеры, когда химическое исследование растений помогло систематикам при практической классификации. Несколько больше примеров можно привести в филогенетических исследованиях.[ . ]
Побеги в оптимальный срок черенкования должны иметь определенные морфологические признаки и обязательно здоровые листья. Размер побега, его толщина, окраска коры стебля должны быть типичными для сорта. При этом учитывают специфику отдельных пород. Например, побеги вишни и сливы в период их заготовки должны отличаться активным ростом, четко выраженной точкой роста, зеленоватой окраской коры, слабым одревеснением в нижней части побега, окраска которого приобретает сероватый или серовато-коричневый оттенок.[ . ]
Несомненно, как защита против иссушения выработалась и плотпоподушковидпая форма роста у ряда пустынных маревых, обитающих в крайне аридных условиях. Даже анатомическое строение осевых органов маревых, исключая трибу хруплявииковых, отличается большим своеобразием: сосудисто-волокнистые пучки у них расположены чередующимися кольцами, по типу однодольных древесных. Благодаря этому происходит быстрое одревеснение и образование перидермы даже у однолетников, и, например, крупный разросшийся экземпляр обыкновенного солероса легко принять за многолетнее растение. Эта особенность маревых также способствует их приспособлению к жизни в аридных условиях.[ . ]
В верхней части ги-пантия у них имеется нектароносный диск, доступ к пыльце и нектару затруднен вертикальным расположением лепестков (у неурады) и паутинистым опушением зова гипантия. В образовании плода у всех неурадовых участвует гипантий. У неурады его основание сильно увеличивается, становится плоским и широким, и одновременно происходит сильное одревеснение его базальной части и многочисленных крупных и мелких шипов на его верхней поверхности (рис. 95). Благодаря такому строению плод после отделения его от ножки ложится на землю плоской стороной, а частички глины и песка, набивающиеся между шипами, сверху закрепляют его в этом положении. Прорастание семян происходит внутри плода, корешки выходят через отверстие, оставленное цветоножкой в дне гипантия. Обычно только 2, реже 3—4 растения, выросшие из одного плода, достигают зрелости, и гипантий сохраняется на их корневых шейках в виде жесткого воротничка в течение всей их жизни. Гипантий, таким образом, осуществляет закрепление плода в почве и защиту проростка на первых этапах развития от высыхания.[ . ]
Летом растения поливают мягкой водой, пропалывают, опрыскивают, подкармливают, обрезают. Гортензии нельзя сильно заливать (находясь постоянно в сырой почве, они заболевают). В августе полив прекращают. Для подкормки применяют минеральные и органические удобрения. При использовании аммиачных или алюминиевых квасцов (30-—50 г квасцов на 10 л воды) розовые цветки становятся синими. То же самое наблюдается при выращивании гортензий на почвах, содержащих соединения железа. Летом горшки периодически поворачивают вокруг оси для более равномерного одревеснения побегов. В начале осени растения заносят в теплицы с температурой 2—4°С. Горшки обмывают, желтеющие листья удаляют, слабые побеги вырезают на кольцо. Для уменьшения пересыхания почвы горшки укладывают на бок (рис. 27). Их периодически опрыскивают и очищают, от засохших листьев.[ . ]
Они выполняют функции запасных питательных веществ, содержатся во вторичных оболочках клеток многих семян (в кожуре и эндосперме). В процессе формирования клеточная оболочка растений нередко подвергается значительным изменениям, касающимся ее состава и структуры. Изменения химического состава клеточной оболочки в основном могут быть сведены к следующим процессам: одревеснению, кутинизации, ослизнению и минерализации.[ . ]
Отложение лигнина в оболочке может происходить лишь при жизни клетки, т. е. в присутствии протопласта. Но не следует думать, что лигнификация оболочки приводит к отмиранию клетки. В древесине имеющиеся немногие живые паренхимные клетки, наполненные запасными веществами и активно участвующие в метаболизме (обмене веществ), имеют, как правило, одревесневшие оболочки. Синтез лигнина происходит в цитоплазме, а исходные вещества поступают из камбия [22]. Образование и отложение лигнина связано с нарушением работы дыхательного аппарата клетки. Процесс одревеснения сопровождается усилением дыхания (усилением поглощения кислорода). Лигнин — продукт окисления ароматических веществ, служащих катализаторами при окислительно-восстановительных процессах, со ставляющих дыхательный цикл.[ . ]
Классические исследования акад. Н. А. Максимова показали, что чем ниже температура, тем большее количество воды в клетках тканей растений переходит в твердое состояние и тем более обезвоженной и сжимающейся ледяными кристаллами становится еще не замерзшая протоплазма. Переход за определенный предел сжатия протоплазмы вследствие вымораживания воды вызывает смерть живой клетки. Сахар, а также другие соединения, например минеральные и органические кислоты, соли, могут предохранить белковое вещество от свертывания при вымораживании и, следовательно, играют защитную роль. Одревеснение к осени побегов текущего года уменьшает общее количество воды, способной к замерзанию, и тем самым предохраняет их от гибели вследствие действия низких осенне-зимних температур. Сухие семена нечувствительны к морозу и выдерживают в опытах низкие температуры даже жидкого водорода, т. е. около —240°.[ . ]
Оболочку растительной клетки, одну из структур, отличающих растительные клетки от клеток животного организма, обычно считают отложением, или секрецией, цитоплазмы. Она состоит из трех основных групп соединений: целлюлозы, лигнина и пектина. Целлюлоза и ряд близко-родственных соединений, например гемицеллюлоза, образуют твердый слой клеточной оболочки. В основном эти соединения представляют собой разветвленные длинные цепочки (полисахариды), образованные из простого сахара— глюкозы. Гемицеллюлоза близка к целлюлозе, но, помимо сахаров, содержит и другие соединения. Целлюлоза и ее производные — высокоокисляемые вещества. Лигнин состоит из сложной смеси химически близких соединений, в частности полимеров фенольной кислоты. Отложение лигнина (одревеснение) делает целлюлозные оболочки клетки прочными и неэластичными, устойчивыми к разрушению микроорганизмами. Лигнин вызывает пожелтение бумаги, поэтому при изготовлении высококачественной бумаги он должен быть вымыт из древесной пульпы. Пектины представляют собой водорастворимые полимеры галакту-роновой кислоты, которые при соединении с водой образуют золи и гели. Наиболее знакомый нам пектин это тот, который используется для затвердения джемов и желе.[ . ]
Шпалера — это горизонтальные бруски или решетки, вдоль которых направляют растения (обычно плодовые или вьющиеся) для выведения в плоской форме. Растения, сформированные таким способом, также называют шпалерами. Шпалеру с одним или двумя побегами, растущими в противоположном или параллельном направлениях, называют кордоном. Поскольку сильная обрезка требует больших затрат труда, промышленное выращивание плодовых деревьев в форме шпалер в США не применяется. Однако виноград обычно выращивают на шпалерах по широко применяв мой системе формирования Книффина. Правильно выведенные шпалеры исключительно привлекательны в декоративном отношении. Создаются они сочетанием обрезки и сгибания побегов, когда последние еще находятся в травянистом состоянии (рис. 96). После одревеснения побеги сохраняют приданную им форму. Правильно сформированные в форме шпалер растения способны обходиться без опор, хотя в первые годы они им необходимы.[ . ]
Клеточная оболочка способна к утолщению и видоизменению. В результате этого образуется ве вторичная структура. Утолщение оболочки происходит путем наложения новых слоев на нервпчпуго оболочку. Ввиду того что наложепие идет уже иа твердую оболочку, фибриллы целлюлозы в каждом слое лежат параллельно, а в соседних слоях — под углом друг к другу. Этим достигается значительная прочность и твердость вторичной оболочки. По мере того как число слоев фибрилл целлюлозы становится больше и толщина стенки увеличивается, она теряет эластичность и способность к росту. Во вторичной клеточпой стенке содержание целлюлозы значительно возрастает, в некоторых случаях до 60% и более. По мере дальнейшего старения клеток матрикс оболочки может заполняться различными веществами — лигнином, суберином (одревеснение или опробковение оболочки). Лигнин образуется из гемицеллюлозы н пектиновых веществ.[ . ]
Развиваясь на питательной среде, микроорганизмы выделяют продукты своего метаболизма, изменяют ее состав; кроме того, они могут развиваться и на самом экспланте, приводя его к гибели. Поэтому перед введением в
культуру проводят поверхностную стерилизацию растительного материала, все манипуляции с культурой изолированных тканей осуществляют в ламинар-боксе, используя стерильные питательные среды, стерильную посуду и инструменты, соблюдая при этом правила асептики.
Стерилизация ламинар-бокса. В ламинар-боксе размещают спиторку, спички, емкость с 96 % спиртом, стерильную посуду и инструменты, необходимые для работы.
Перед работой ламинар облучают бактерицидной ультрафиолетовой лампой в течение 20…30 мин, затем осуществляют продувку в течение не менее 30 мин, после чего все поверхности обрабатывают спиртом и приступают к работе. Перед работой руки моют с мылом и протирают спиртом, работают в чистых халатах.
Стерилизация посуды. Посуду моют, используя бытовые моющие средства, тщательно промывают водопроводной водой, ополаскивают дистиллированной водой, высушивают, заворачивают в плотную бумагу или помещают в биксы. После этого её стерилизуют сухим жаром в сушильном шкафу при 160 С в течение не менее 2 часов или влажным паром в автоклаве 1 час при давлении 1 атм (121 С).
Стерилизация питательных сред. Питательные среды стерилизуют в автоклаве при давлении 1 атм, в течение 20 мин. Если в состав питательных сред входят вещества, не выдерживающие высокой температуры, их стерилизуют, пропуская через бактериальные фильтры с диаметром пор 0,2…0,45 мкм и добавляют в автоклавированную, остывшую до 40 С питательную среду.
Поверхностная стерилизация растительного материала проводится с целью освобождения растительных тканей от микроорганизмов. Получение первичных культур является сложной задачей, поскольку поверхность всех органов растений заселена сапрфитными грибными и бактериальными организмами или их спорами, которые in vitro получают возможность для бурного роста и развития и подавляют рост растительной ткани. Поэтому перед посадкой эксплантов на питательную среду их необходимо освободить от внешних сапрофитов, т.е. провести поверхностную стерилизацию. Внутренние ткани растений считаются стерильными, однако в ряде случаев в них могут находиться сапрофитные микроорганизмы, которые не всегда обнаруживаются визуально. Основным условием успешного введения
исходного материала в культуру является правильно подобранная и проведённая поверхностная стерилизация.
Поверхностная стерилизация проводится в несколько этапов:
- механическая очистка растительной ткани от почвы и растительных остатков; -Тщательная промывка бытовыми моющими средствами;
-Ополаскивание дистиллированной водой; -Обработка дезинфицирующим веществом;
- прмывка стерильной дистиллированной водой;
-обработка в растворе антибиотика.
В качестве дезинфицирующих веществ используют различные химические вещества, при этом их концентрация и длительность воздействия подбираются индивидуально в зависимости от особенностей растительного объекта (табл. 2). На подготовительном этапе (для удаления воскового налета на плотных кожистых листьях) используется 70 0 этиловый спирт (С 2 Н 5 ОН), который, кроме того, добавляют к другим дезинфекторам для усиления их действия.
Для поверхностной стерилизации используют следующие вещества:
- содержащие активный кислород: перекись водорода (Н 2 О) или смесь перекиси водорода с этиловым спиртом (1:1), марганцовка (КМnO 4 );
- ядовитые вещества: диацид, сулема, мертиолят; наиболее сильно на растительную ткань действует мертиолят, несколько слабее – сулема, самый слабый из ядов – диацид.
Таблица 2 Вещества и способы поверхностной стерилизации растительного материала
Нежные ткани (пыльники, молодые
листья, тонкие корни)
Семена, одревесневшие стебли, листья,
почки, мясистые корни, клубни
Семена, одревесневшие стебли, листья,
почки, мясистые корни, клубни
H 2 O 2 10-12% (до30%)
Семена, листья, почки
Семена, одревесневшие стебли, листья,
почки, мясистые корни, клубни
Семена, одревесневшие стебли, листья,
почки, мясистые корни, клубни
Семена, одревесневшие стебли, листья,
почки, мясистые корни
Длительность воздействия дезинфицирующего раствора (экспозиция) зависит от свойств используемого вещества и от особенностей растительной ткани.
С целью удаления внутренней инфекции, содержащейся, как правило,
в сосудах растений, растительную ткань дополнительно обрабатывают растворами антибиотиков: ампициллина (0,5…1,0 г/л), бензилпенициллина
(830 мг/л), тетрациклина (200…400 мг/л).
Для поверхностной стерилизации плодовых тел грибов, корнеплодов, луковиц, клубней применяют также фламбирование – растительный материал обрабатывают этиловым спиртом и обжигают в пламени горелки.
Ход работы. Отобрать 50 здоровых семян сосны об., провести их поверхностную стерилизацию по предложенной схеме.
СХЕМА СТЕРИЛИЗАЦИИ СЕМЯН СОСНЫ ОБЫКНОВЕННОЙ
1. Семена (30-50 шт.) завязывают в марлю, помещают в химический стакан ёмкостью 250 мл, сверху стакан плотно завязывают марлей и ставят под струю водопроводной воды на 15 мин., после чего воду сливают.
3. Отмывка семян от дезинфицирующего раствора. Семена заливают 3 раза по 10…15 мин. Стерильной дистиллированной водой. Длительность отмывки должна равняться длительности стерилизации, чтобы дистиллированная вода проникла в ткани на ту же глубину, что и стерилизующий раствор, и вытеснила оттуда его остатки.
В ламинар-боксе разложить по 10 семян в стерильные влажные камеры и поместить их в термостат при t = 25 С. Через 7 дней определить результаты проведённой поверхностной стерилизации: подсчитать количество незараженных проросших семян. Стерильные проростки используются в последующей работе.
Культура каллусной ткани, индукция морфогенеза
Материалы и оборудование: культуральные сосуды с каллусной тканью из различных органов растений; культуральные сосуды с каллусогенными средами; стерильная посуда, инструменты, пробирочные растения; этиловый спирт, спиртовая горелка, ламинар-бокс.
Объяснение. Каллусная культура – это неорганизованная пролиферирующая (беспорядочно делящаяся) ткань, состоящая из дедифференцированных (неспециализированных) клеток.
Каллус может образоваться как in vitro (на изолированных фрагментах растительной ткани - эксплантах), так и in vivo (на раневой поверхности растений).
Различают морфогенные и неморфогенные каллусные ткани. Морфогенная ткань имеет светло-зеленую окраску, в ней легко инициируются процессы органогенеза. Неморфогенная каллусная ткань in vitro имеет белую или желтоватую окраску, к органогенезу она не способна. С возрастом в каллусных тканях накапливаются фенолы и они приобретают темно-коричневую окраску.
Культуры каллусов могут быть получены практически из любой части растения (корней, побегов, листьев) или из определенных типов клеток (эндосперма, пыльцы). Выбор экспланта для получения каллуса определяется задачами исследования. Из молодых тканей каллусные культуры получить проще, чем из старых. Каллусогенная активность культур из специализированных тканей (например, эндосперма) зависит от времени введения их в культуру. Хорошим исходным материалом для получения каллуса являются семена. В этом случае в качестве экспланта используют стерильные проростки корней, стеблей, семядольные листья. Размер и форма исходного экспланта, как правило, не оказывают влияния на пролиферацию каллуса, но экспланты размером менее 0,5 см калуссогенной активностью не обладают.
В зависимости от происхождения и условий выращивания каллусная ткань различается по консистенции, она может быть:
- рыхлой, такие каллусы состоят из оводненных клеток, которые легко распадаются на отдельные мелкие агрегаты;
- средней плотности; такие каллусы имеют хорошо выраженные меристематические зоны;
- плотной; в такой каллусной ткани могут дифференцироваться элементы проводящей системы.
Превращение специализированных растительных клеток в каллусные связано с индукцией клеточного деления, этот процесс регулируется соотношением фитогормонов (ауксинов и цитокининов).
Специализированные (дифференцированные) клетки утрачивают способность к делению. После дедифференцировки (когда клетки как бы возвращаются в меристематическое состояние), они могут приобрести эту способность вновь, и тогда их деления и неорганизованный рост приводят к образованию каллусной ткани. Дедифференцировку вызывают ауксины, под их действием клетки подготавливаются к делениям; цитокинины вызывают пролиферацию (деление) дедифференцированных клеток. Дедифференцировке клеток способствует повреждение тканей, поэтому для получения каллуса дифференцированную ткань (листья, стебель и т.д.), перед тем как их поместить на каллусогенные среды, надрезают.
Образование каллусной ткани происходит в течение 3-8 недель. После того, как размер каллуса становится достаточным для пересадки (около 2,0х2,0 см), его можно пересаживать на свежую питательную среду.
Ход работы. В ламинар-боксе с соблюдением условий стерильности вынуть из пробирок проростки семян сосны, измельчить их стерильным лезвием, поместить на поверхность каллусогенной среды и слегка вдавить для обеспечения хорошего контакта со с средой.
Можно использовать и растения-регенеранты: отделить листья, разрезать их стерильным лезвием вдоль центральной жилки и поместить на поверхность каллусогенной среды.
Культуры инкубировать в темноте при температуре 25 С в течение 3…5 недель, каждую неделю просматривать их и проводить учет, отмечая состояние тканей, момент потери ими зеленой окраски, начало образования каллусной ткани, место её появления; рассмотреть и зарисовать образовавшийся каллус.
Субкультивирование каллусных культур и снятие ростовых характеристик.
Материалы и оборудование: культура каллусной ткани; стерильные чашки Петри, бумажные фильтры, инструментарий; культуральные сосуды питательной средой; лупы; этиловый спирт, спиртовая горелка, ламинарбокс.
Объяснение. Рост каллусных клеток в культуре графически можно отобразить в виде S-образной кривой, состоящей из пяти фаз (рис. 3)
Рис. 3. Ростовая кривая при периодическом культивировании каллусных тканей. Фазы роста: 1 – латентная; 2 – логарифмическая; 3 – линейная; 4 – замедления; 5 – стационарная.
Следует обращать внимание на размеры кусочков каллуса, переносимого на свежую питательную среду: если они слишком малы (менее 0,5 см), в дальнейшем рост каллусной культуры может угнетаться.
МЕТОД СОМАТИЧЕСКОГО ЭМБРИОГЕНЕЗА
Материалы и оборудование: растения-регенеранты березы, полученные путем клонального микроразмноженеия, культуральные сосуды со средой Мурасиге и Скуга приготовленной на герлите с добавлением ауксина 2,4-Д, пинцеты, скальпели, этиловый спирт 96 , спиртовая горелка, ламинар-бокс.
Объяснение. В основе метода соматического эмбриогенеза лежит дифференциация из соматических клеток соматических эмбриоидов - биполярных зародышеподобных структур, имеющих две меристемы, одна из которых дает начало корню, другая - стеблю. По внешнему виду эмбриоиды напоминают зиготические зародыши (возникающие в результате полового процесса), но отличаются от них происхождением - соматические зародыши развиваются асексуально, вне зародышевого мешка.
Соматический эмбриогенез может происходить как непосредственно в тканях экспланта (прямой эмбриогенез), так и в каллусе, полученном из этих тканей (непрямой эмбриогенез). При индукции эмбриогенеза очень важно правильно определить стадию развития и физиологическое состояние донорных тканей. Лучше для этих целей использовать незрелые зародыши, полностью дифференцированные ткани, как правило, не дают начала эмбриогенным культурам.
В настоящее время методом соматического эмбриогененза размножают более 200 видов растений. Среди древесных таким способом можно размножать осину, эвкалипт, дуб красный и скальный, ель обыкновенную, орех грецкий, липу обыкновенную и крупнолистную.
Для отвердения питательных сред, используемых для индукции соматического эмбриогененза, вместо агара используется гельрит - заменитель агара, природное желирующее вещество, образуемое в процессе ферментации бактериями глюкороновой ксилоты, рамнозы, глюкозы; образует прозрачный, бесцветный гель, широко используемый в микробиологии. Это вещество является дополнительным стимулом индукции эмбриогенеза в соматических тканях и препятствует процессу витрификации эксплантов (оводнению тканей) при длительном их культивировании.
В процессе соматического эмбриогенеза ткани листа претерпевают ряд последовательных изменений. Вначале эксплант увеличивается в размерах и покрывается красными прожилками. Затем начинается интенсивное деление клеток и образуется каллус. Каллусные ткани, как правило, белого цвета, полупрозрачные, через 10. 15 дней они начинают покрываться сферическими узелками разного размера. В это время в каллусной ткани образуются зоны эмбриогенной активности - глобулярные проэмбрио, в тканях которых формируются проэмбриоиды, которые проходят несколько стадий развития (глобулы, сердца, торпеды) с последующим формированием эмбриоидов, которые могут развиваться до полноценного растения.
Ход работы. В ламинар-боксе, соблюдая правила асептики, отделить от растений-регенерантов листья и поместить их на эмбриогенные среды. В течение трех недель проводить наблюдения за изменениями, происходящими с тканями листьев и фиксировать их в тетради, зарисовать стадии изменения растительной ткани и эмбриогенный каллус.
УЧЕТ РЕЗУЛЬТАТОВ ПЕРВОГО ЭТАПА КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ, ОПРЕДЕЛЕНИЕ ЖИЗНЕСПОСОБНОСТИ
Материалы и оборудование: культуральные сосуды с эксплантами, лупы, линейки.
Объяснение. Главной задачей первого этапа клонального микроразмножения растений является получение стерильной и хорошо растущей культуры.
Поверхность любой растительной ткани заселена микроорганизмами и их спорами, которые in vitro быстро развиваются, используют питательные вещества среды, выделяя при этом продукты метаболизма, отрицательно действующие на развитие экспланта. Поверхностная стерилизация позволяет освободить эксплант от микроорганизмов, при этом нужно правильно подобрать концентрацию и экспозицию дезинфицирующих растворов, с таким расчетом, чтобы растительная ткань осталась жизнеспособной и не утратила морфогенной активности.
В течение первых 10 дней после введения в культуру экспланты просматривают (не вынимая из культуральных сосудов) и отбирают погибшие в результате жесткой стерилизации и те, на которых отмечено развитие микроорганизмов (грибов или бактерий).
На 14-й день культуры вновь просматривают, определяя их жизнеспособность, при этом обращают внимание на цвет эксплантов, их состояние, наличие изменений ткани. Жизнеспособные экспланты с признаками начала морфогенеза пересаживают на свежую питательную среду того же состава. Последующие пересадки проводят с интервалом в 14.
18 дней. Продолжительность первого этапа составляет 1.. .2 месяца.
На этом этапе можно активизировать рост эксплантов с помощью антиоксидантов (аскорбиновой кислоты, глютатиона и др.), вводя их вводят в
состав питательной среды, или, соблюдая асептику, выдерживая экспланты в их растворах в течение 4. 24 часов. В ряде случаев в питательную среду добавляют адсорбент - древесный активированный угль (0,5. 4 %).
Ход работы. Не открывая культуральных сосудов, внимательно рассмотреть с помощью лупы экспланты, введенные в культуру in vitro на предыдущих занятиях методом индукции адвентивных почек непосредственно тканями эксплантов и методом активации имеющихся в растении меристем. Описать их состояние, отметить при этом жизнеспособные культуры, культуры, на которых развиваются микроорганизмы (указать какие) и погибшие (установить причину их гибели). Сделать вывод об эффективности проведенной поверхностной стерилизации, определить процент жизнеспособных культур в эксперименте.
ГРИБОВОДСТВО КАК ОТРАСЛЬ БИОТЕХНОЛОГИИ
Культивируемые грибы выращивают двумя способами: интенсивным и экстенсивным. Интенсивный способ предусматривает использование специализированных помещений с регулируемыми условиями микроклимата и позволяет при коротком технологическом цикле круглогодично получать высокие урожаи.
При экстенсивном культивировании используются отходы лесной промышленности - низкосортная древесина тех пород, на которых этот гриб произрастает в природе, оно проще и дешевле, но урожаи ниже, чем при интенсивном культивировании и отличаются сезонностью, однако, при использовании на плантации штаммов гриба, различающихся сроками плодоношения, можно добиться образования плодовых тел в течение всего сезона с температурой выше 8 С.
Выращивание культивируемых грибов проводится поэтапно.
I этап - получение чистой культуры гриба:
поверхностная стерилизация плодовых тел;
инкубация инокулюма на питательной среде;
отсев мицелия в пробирку и его хранение.
II этап - наработка посевного мицелия:
получение мицелиального газона;
выращивание бутылочной культуры;
выращивание пакетной культуры;
контроль качества посевного мицелия.
III этап - подготовка субстрата:
для интенсивного культивирования (в мешках):
пастеризация или ксеротермическая обработка субстрата;
затаривание подготовленного субстрата в мешки;
для экстенсивного культивирования (на брусках древесины):
подготовка отверстий в брусках для внесения посевного мицелия;
инкубация мицелия в субстрате.
IV этап - плодоношение и сбор плодовых тел грибов:
условия плодоношения при интенсивном и экстенсивном способе культивирования;
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Стебель — осевая часть побега. Он служит опорой для других органов растения, обеспечивает передвижение воды с минеральными и органическими веществами, а также в нём могут запасаться питательные вещества . Выполняемые функции обуславливают особенности строения этого органа.

На поверхности молодых стеблей находится кожица . У многолетних стеблей древесных растений кожица заменяется пробкой. Её клетки мёртвые, в них находится воздух.
Кожица и пробка относятся к покровным тканям. Эти ткани защищают внутренние слои стебля от механических повреждений, проникновения различных микроорганизмов, перепадов температуры. Через покровные ткани происходит газообмен: в кожице — через устьица , а в пробке — через чечевички . Чечевички — это небольшие бугорки с отверстиями. Они состоят из крупных клеток основной ткани с большими межклетниками.

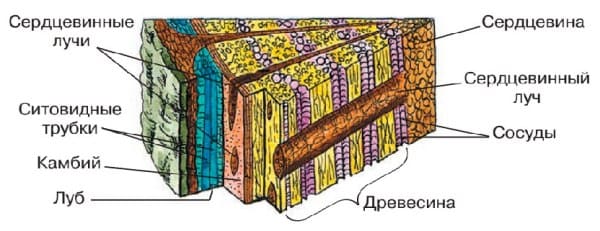
Под кожицей и пробкой находятся клетки коры , относящиеся к разным видам тканей. Снаружи располагаются слои клеток покровной и механической тканей с утолщёнными оболочками и тонкостенных клеток основной ткани, которые могут содержать хлорофилл. Под покровной тканью находится луб .
Луб образован ситовидными трубками, клетками механической ткани (лубяными волокнами) и клетками основной ткани.
Ситовидные трубки представляют собой цепочки удлинённых живых безъядерных клеток, стенки которых имеют множество мелких отверстий (как у сита). Это проводящие элементы луба, которые обеспечивают перемещение растворённых в воде органических веществ (продуктов фотосинтеза).
Лубяные волокна — это клетки механической ткани. Они имеют удлинённую форму, мёртвые, с одревесневшими стенками.
В коре некоторых растений луб имеет хорошо развитые и прочные волокна. Из лубяных волокон липы раньше изготавливали мочало и рогожу, а из лубяных волокон льна и в настоящее время прядут нити и ткут ткани.
Между корой и древесиной находится камбий — тонкий слой клеток образовательной ткани. Клетки камбия постоянно делятся. За счёт этого стебель растёт в толщину и в нём образуются годичные кольца.
Внутренний слой стебля представлен сердцевиной , в которой откладываются про запас органические вещества. Сердцевина образована клетками запасающей ткани. Сердцевина связана с древесиной и лубом сердцевинными лучами , выполняющими проводящую функцию.

У некоторых растений (бузина) в сердцевине много межклетников, она рыхлая и хорошо заметна. У других растений (дуб) сердцевина, наоборот, очень плотная, и отличить её от древесины сложно.
Читайте также:

