Определение минеральных удобрений практическая работа
Обновлено: 12.09.2024
Цель работы. Научиться выполнять опыты, демонстрирующие реакции ионного обмена, проводить качественные реакции на ионы.
Оборудование. Штатив с пробирками. Реактивы: растворы: NaOH , хлорида бария BaCl 2 , (перечислите все)
В пробирку насыпьте на кончике мерной ложечки немного суперфосфата Ca ( H 2 PO 4 ) 2 . К нему налейте 1 мл раствора хлорида бария ( II ) BaCl 2 . Выпадает белый осадок, частично растворимый в азотной кислоте.
В пробирку насыпьте немного суперфосфата Ca ( H 2 PO 4 ) 2 . К нему налейте 1 мл раствора нитрата серебра AgNO 3 . Выпадает желтый осадок Ag 3 PO 4 .
В пробирку насыпьте немного нитрата аммония NH 4 NO 3 . К нему прилейте 1 мл концентрированной серной кислоты H 2 SO 4 и добавьте медных стружек. Пробирку нагрейте. По выделению газообразного оксида азота ( IV ) NO 2 бурого цвета будем судить о наличии нитрат – ионов NO 3 - . Медь растворяется.
В пробирку насыпьте немного нитрата аммония NH 4 NO 3 . К нему прилейте 1 мл раствора щелочи NaOH . Ощущается запах аммиака.
В пробирку насыпьте немного сульфата аммония ( NH 4 ) 2 SO 4 . К нему прилейте 1 мл раствора хлорида бария ( II ) BaCl 2 . Выпадает белый осадок, нерастворимый в азотной кислоте.
В пробирку насыпьте немного сульфата аммония ( NH 4 ) 2 SO 4 . К нему прилейте 1 мл раствора щелочи NaOH . Ощущается запах аммиака.
В пробирку насыпьте немного натриевой селитры NaNO 3 . К нему прилейте 1 мл концентрированной серной кислоты H 2 SO 4 и добавьте медных стружек. Пробирку нагрейте. По выделению газообразного оксида азота ( IV ) NO 2 бурого цвета будем судить о наличии нитрат – ионов NO 3 - . Медь растворяется.
В пробирку насыпьте немного хлорида калия K С l . К нему прилейте 1 мл раствора нитрата серебра AgNO 3 . Выпадает белый творожистый осадок.
Свои наблюдения запишите в виде отчета, заполнив таблицу:
Что делали (Рисунки опытов)
Вывод должен содержать уравнения реакций в молекулярном, полном и сокращенном ионном виде.
В пробирку налейте 1 мл раствора бромида калия KBr . В раствор добавьте 1 мл нитрата серебра AgNO 3 . Что наблюдаете? Какое вещество образовалось в ходе реакции? Свои наблюдения запишите в таблицу.
В пробирку налейте 1 мл раствора йодида калия KJ . В раствор добавьте 1 мл нитрата серебра AgNO 3 . Что наблюдаете? Какое вещество образовалось в ходе реакции? Свои наблюдения запишите в таблицу.
В пробирку налейте 1 мл раствора хлорида алюминия AlCl 3 . В раствор добавьте 1 мл гидроксида натрия NaOH . Наблюдайте появление белого желеобразного осадка, который при избытке OH - растворяется. Свои наблюдения запишите в таблицу.
Полный текст материала Лабораторная работа по химии "Определение минеральных удобрений"; 9 класс смотрите в скачиваемом файле.
На странице приведен фрагмент.
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.

Есть мнение?
Оставьте комментарий
Смотрите похожие материалы
Упражнения на технику чтения и понимания прочитанного
Тонкости и секреты работы в Яндекс.Почте
Как работать с детьми с СДВГ в обычном классе?
Отправляя материал на сайт, автор безвозмездно, без требования авторского вознаграждения, передает редакции права на использование материалов в коммерческих или некоммерческих целях, в частности, право на воспроизведение, публичный показ, перевод и переработку произведения, доведение до всеобщего сведения — в соотв. с ГК РФ. (ст. 1270 и др.). См. также Правила публикации конкретного типа материала. Мнение редакции может не совпадать с точкой зрения авторов.
Для подтверждения подлинности выданных сайтом документов сделайте запрос в редакцию.
О работе с сайтом
Мы используем cookie.
Публикуя материалы на сайте (комментарии, статьи, разработки и др.), пользователи берут на себя всю ответственность за содержание материалов и разрешение любых спорных вопросов с третьми лицами.
При этом редакция сайта готова оказывать всяческую поддержку как в публикации, так и других вопросах.
Если вы обнаружили, что на нашем сайте незаконно используются материалы, сообщите администратору — материалы будут удалены.
Свидетельство и скидка на обучение каждому участнику
Практическая работа № 4 стр. 75 Определение минеральных удобрений
Условие задачи: Практическая работа № 4 стр. 75 Определение минеральных удобрений
1) Различить: суперфосфат, нитрат аммония, сульфат аммония.
а) Действия : К содержимому пробирок добавляем воду. Наблюдения : В одной из пробирок вещество растворилось не полностью. Выводы: Это суперфосфат, так как он слабо растворим. б) Действия : К этому р-ру добавляем раствор нитрата серебра (I). Наблюдения : Выделяется желтый осадок. Уравнения реакции:

Выводы: В данной пробирке находится суперфосфат, т.к. данная реакция является качественной на фосфат -ионы. в) Действия : К оставшимся р-рам добавляем р-р хлорида бария. Наблюдения : В одной из пробирок выпадает белый осадок. Уравнения реакции:
Выводы: В данной пробирке находится сульфат аммония, т.к. данная реакция является качественной на сульфат-ион. г) Действия : К веществу в оставшейся пробирке добавляем концентрированную серную кислоту и добавляем медь. Нагреваем. Наблюдения : Выделяется газ бурого цвета; раствор приобретает голубую окраску; медь растворяется. Уравнения реакции:

Выводы: В данной пробирке находится нитрат аммония, т.к. данная реакция является качественной на нитрат-ион.
2) Различить: хлорид аммония, нитрат натрия, хлорид калия.
а) Действия : К веществам добавляем раствор щелочи, нагреваем. Наблюдения : Из одной пробирки ощущается запах аммиака.
Выводы: В данной пробирке находится хлорид аммония, т.к. эта реакция является качественной на ион аммония. б) Действия : К двум оставшимся веществам добавляем раствор нитрата серебра (I). Наблюдения : В одной из пробирок белый осадок. Уравнения реакции:
Выводы: Эта реакция является качественной на
поэтому в данной пробирке содержится хлорид калия. в) Действия : К оставшемуся веществу добавляем концентрированную серную кислоту и добавляем кусочек меди. Нагреваем. Наблюдения : Выделяется газ бурого цвета
раствор становится голубого цвета; медь растворяется. Уравнения реакции:

Выводы: В данной пробирке нитрат натрия, т.к. данная реакция является качественной на нитрат-ион.
Решение экспериментальных задач
1) Получите аммиак и проделайте с ним характерные химические реакции
(см. практическую работу №3).
2) Получить двумя способами нитрат меди (II).
а) Действия : Берем оксид меди (II), добавляем
нагреваем. Наблюдения : Оксид меди (II) растворяется; раствор приобретает голубую окраску. Уравнения реакции:

б) Действия : Берем медь, добавляем азотную кислоту и нагреваем. Наблюдения : Медь растворяется; выделяется газ бурого цвета; раствор становится голубого цвета. Уравнения реакции:
![]()
4) Различить кристаллические вещества:
Na 2 SO 4 , NH 4 Cl, NaNO 3
а) Действия : К исследуемым веществам добавляем раствор щелочи. Наблюдения : Из одной пробирки ощущается запах аммиака. Уравнения реакции:

Выводы: В данной пробирке содержится хлорид аммония, т.к. проведенная реакция является качественной на ион аммония. б) Действия : К оставшимся в-вам добавляем р-р хлорида бария. Наблюдения : В одной из пробирок выпадает белый осадок. Уравнения реакции:
![]()
Выводы: В данной пробирке находится сульфат натрия, т.к. эта реакция является качественной на сульфат-ион. в) Действия : К оставшемуся веществу добавляем концентриро-ванную серную кислоту и кусочек меди. Нагреваем. Наблюдения : Выделяется газ бурого цвета; раствор становится голубого цвет ; медь растворяется. Уравнения реакции:

Выводы: Реакция является качественной на нитрат-ион, поэтому в данной пробирке находится нитрат натрия.
5) Различить растворы ортофосфорной и серной кислот
Действия : К обоим растворам добавляем нитрат серебра (I). Наблюдения : В одной пробирке наблюдается помутнение раствор , в другой образуется желтый осадок. Уравнения реакции:

Выводы: Та пробирка, в которой образовался желтый осадок, содержит ортофосфорную кислоту, другая - серную.
6) Различить ортофосфаты натрия и кальция
Действия : Добавляем в обе пробирки воду. Наблюдения : В одной соль растворяется, в другой - нет. Выводы: Растворившаяся в результате реакции соль - ортофосфат натрия, не растворившаяся - ортофосфат кальция.
Определение минеральных удобрений.
В пробирках даны образцы следующих минеральных удобрений: 1) суперфосфат, нитрат аммония, сульфат аммония; 2) хлорид аммония, нитрат натрия, хлорид калия. Определите, в какой пробирке находится каждое из указанных удобрений, используя таблицу 20. Составьте уравнения происходящих химических реакций. (Для реакций, происходящих в водном растворе, уравнения составьте в ионном и сокращенном ионном виде.)
Решение экспериментальных задач. 1. Получите аммиак и проделайте с ним характерные химические реакции.
2. Получите нитрат меди(И) двумя различными способами.
3. Опытным путем докажите, что сульфат аммония, нитрат аммония, хлорид аммония и аммофосы нельзя смешивать с известью. Приведите соответствующие объяснения.
4. В четырех пробирках находятся следующие кристаллические вещества: сульфат натрия, хлорид аммония и нитрат натрия. Определите, в каких пробирках находится каждое из этих веществ.
5. В одной пробирке дан раствор ортофосфорной кислоты, а в другой — раствор серной кислоты. Определите каждую из этих кислот.
6. В одной пробирке дан ортофосфат натрия, а в другой — ортофосфат кальция. Определите эти соли.
Определение минеральных удобрений.
1) К содержимому пробирок добавляем воду. В
пробирке с суперфосфатом вещество растворилось
не полностью. Затем к этому раствору добавля-
ем раствор нитрата серебра. Выделяется желтый
осадок.
К оставшимся растворам добавляем раствор хло-
рида бария. В пробирке с сульфатом аммония вы-
падает белый осадок.
В оставшиеся пробирки добавляем концентри-
рованную серную кислоту и медь при нагревании.
Выделяется газ бурого цвета; раствор приобретает
голубую окраску; медь растворяется.
В данной пробирке находится нитрат аммония,
так как данная реакция является качественной на
нитрат-ион.
2) К веществам добавляем раствор щелочи, на-
греваем. В пробирке с хлоридом аммония образуется
газ с резким запахом — аммиак.
К двум оставшимся веществам добавляем рас-
твор нитрата серебра. В пробирке с хлоридом калия
выпадает белый осадок.
К оставшемуся веществу добавляем концентри-
рованную серную кислоту и медь при нагревании.
Выделяется газ бурого цвета (NO2); раствор ста-
новится голубого цвета; медь растворяется.
Решение экспериментальных задач.
1.
Взаимодействие с водой:
Взаимодействие с азотной кислотой:
Взаимодействие с щелочными металлами:
2. 1) азотная кислота с оксидом меди (II)
2) медь с азотной кислотой:
1. При смешивании сульфата, нитрата, хлори-
да аммония, аммофосов с известью выделяется
аммиак:
В результате этого азот, который необходим для
растений, не будет поступать в почву.
2. К исследуемым веществам добавляем раствор
щелочи и нагреваем. В пробирке с хлоридом аммо-
ния выделяется аммиак — газ с резким запахом.
В оставшиеся пробирки добавляем раствор хло-
рида бария. В пробирке с сульфатом натрия обра-
зуется белый осадок:
К оставшемуся веществу добавляем концентри-
рованную серную кислоту и кусочек меди при
нагревании. Выделяется газ бурого цвета; рас-
твор становится голубого цвета; медь растворяется.
В этой пробирке находится нитрат натрия.
3. К обоим растворам добавляем нитрат се-
ребра. В одной пробирке наблюдается помутнение
раствора, а в другой образуется желтый осадок.
Осадок Ag2SО4 растворим в кислотах, поэтому
раствор мутнеет.
4. Добавляем в обе пробирки воду. В пробирке
с ортофосфатом натрия вещество растворится. Во
второй пробирке вещество не растворится, следова-
тельно, в ней находится ортофосфат кальция, так
как он не растворим в воде.
Измельченные удобрения поместите в пробирки и залейте их водой объёмом примерно в 1,5-2 раза большим, чем объём удобрения. Результаты исследования занесите в таблицу.
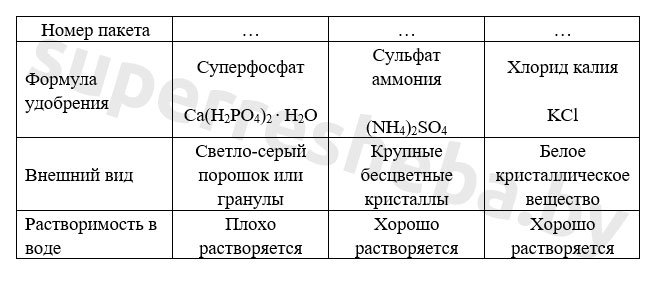
Вариант 2
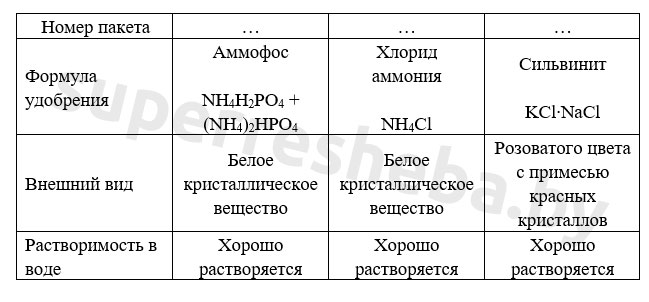
Вариант 1
Разделите растворы двух оставшихся удобрений на две части. Для определения сульфата аммония прилейте в обе пробирки раствор гидроксида кальция и слегка нагрейте их содержимое. К отверстию пробирки поднесите влажную индикаторную бумажку. Результаты исследования занесите в таблицу.
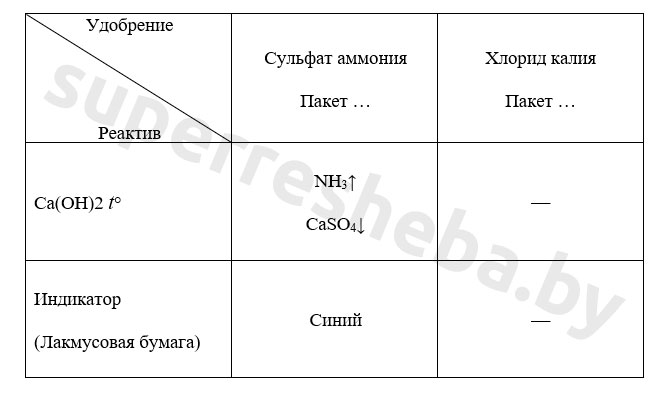
Уравнение реакции в молекулярном и ионном виде:
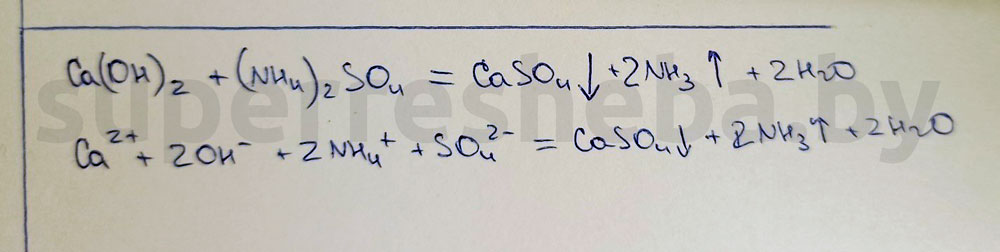
Вариант 2
Для распознавания аммофоса и хлорида аммония отлейте содержимое каждой пробирки в чистые пробирки и добавьте к нему раствор гидроксида кальция. Содержимое пробирки с хлоридом аммония и гидроксидом кальция слегка нагрейте. К отверстию пробирки поднесите влажную индикаторную бумажку. Результаты исследования занесите в таблицу.
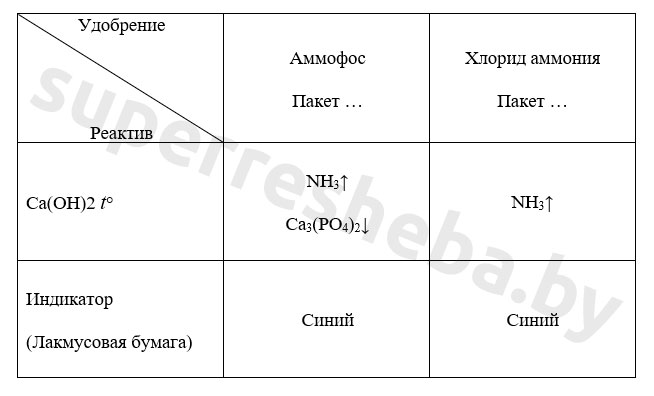
Уравнение реакции в молекулярном и ионном виде:
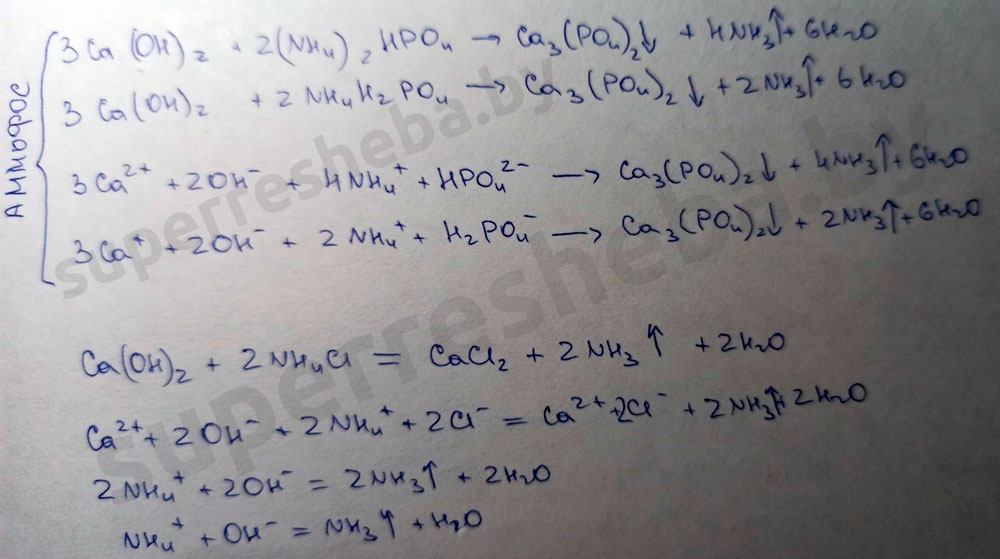
Вариант 1
Для подтверждения того, что оставшееся удобрение – хлорид калия, к раствору прилейте несколько капель раствора нитрата серебра. Что при этом наблюдается? Наличие каких ионов подтверждает выпадение белого осадка?
Наблюдается выпадение белого осадка. Белый осадок подтверждает наличие ионов хлора.
Уравнение химической реакции в молекулярном и ионном виде:
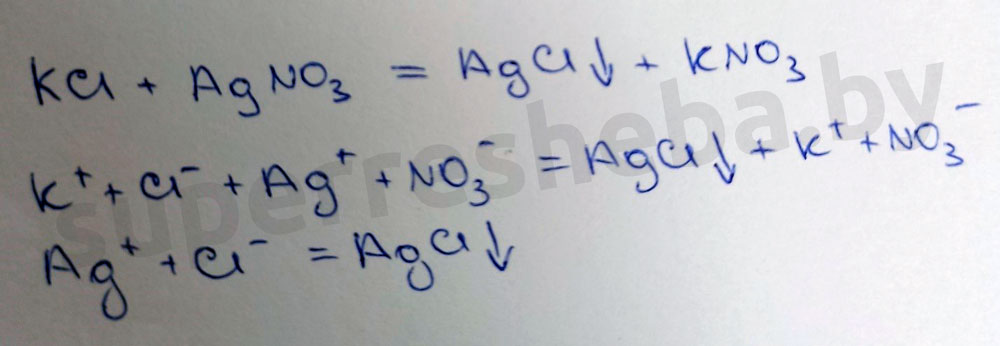
Вариант 2
Наблюдается выпадение белого осадка. Белый осадок подтверждает наличие ионов хлора.
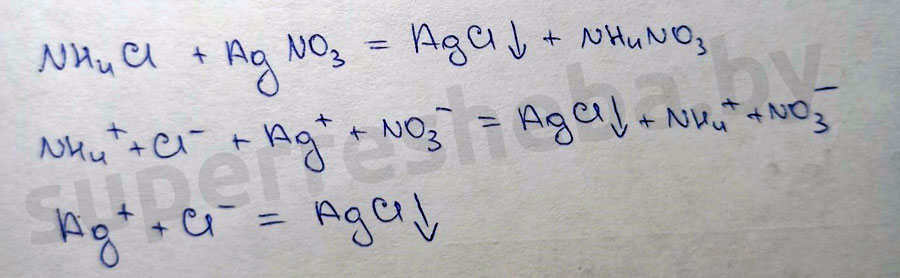
Сделайте вывод, ответив на вопросы:
1. К какому классу соединений относятся удобрения?
Удобрения относятся к солям
2. На основании каких опытов вы распознали удобрение?
В1. На основании опытов с гашеной известью и нитратом серебра (I), а также на основании растворимости удобрений. В2. На основании опытов с гашеной известью и нитратом серебра (I).
3. Пронумеруйте пакеты с удобрениями в соответствии с данными учителя.
Читайте также:

