Посев бактерий на свежую питательную среду до достижения ими максимальной скорости деления клеток
Обновлено: 19.09.2024
Для большинства патогенных бактерий оптимальна слабощелочная среда (pH 7,2-7,4). Исключение составляют холерный вибрион - его оптимум находится в щелочной зоне (pH 8,5-9,0) и возбудитель туберкулёза, нуждающийся в слабокислой реакции (pH 6,2-6,8).
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили pH, среды́ должны обладать буферностью, т.е. содержать вещества, нейтрализующие продукты обмена.
- быть изотоничными для микробной клетки; т.е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальная среда, соответствующая 0,5% раствору натрия хлорида.
- быть стерильными, т.к. посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды.
- плотные среды́ должны быть влажными и иметь оптимальную для микроорганизмов консистенцию.
- обладать определённым окислительно - восстановительным потенциалом, т.е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH2. Например, анаэробы размножаются при RH2, не выше 5, а аэробы - при RH2 не ниже 10.
- быть по возможности унифицированным, т.е. содержать постоянное количество отдельных ингредиентов.
Желательно, чтобы среды́ были прозрачными - удобнее следить за ростом культур, легче заметить загрязнение среды посторонними микроорганизмами.

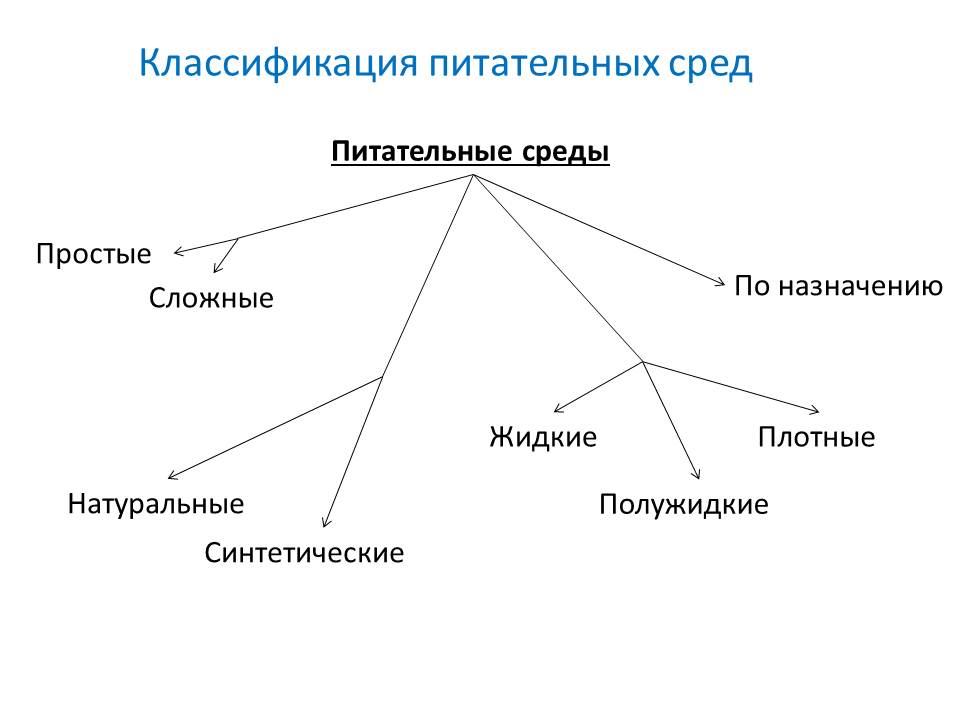
- По исходным компонентам:
- натуральные среды - готовят из продуктов животного и растительного происхождения(мясо, костная и рыбная мука, кормовые дрожжи, сгустки крови и др.)
- синтетические среды - готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.
- жидкие
- полужидкие
- плотные
Плотные и полужидкие среды готовят из жидких, к которым прибавляют агар-агар или желатин. Кроме того, в качестве плотных сред применяют свёрнутую сыворотку крови, свёрнутые яйца, картофель, среды с селикагелем.Некоторые микроорганизмы используют желатин как питательное вещество - при их росте среда разжижается.
- По составу:
- простые: мясопептонный бульон(МПБ), мясопептонный агар(МПА), , питательный желатин,
- сложные - готовят прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества.
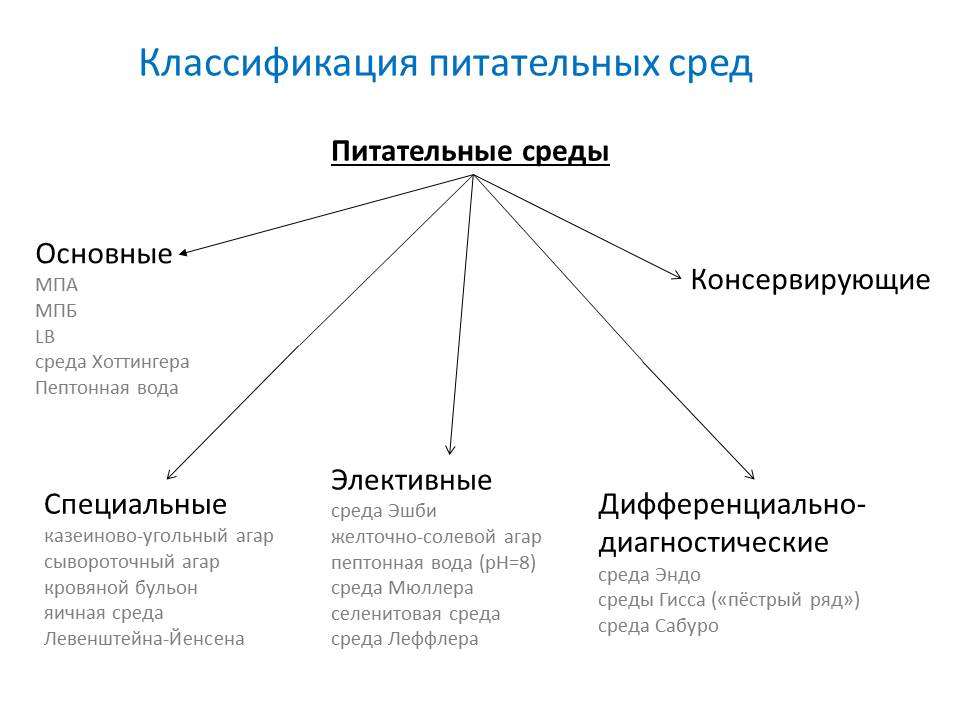
- основные - служат для культивирования большинства патогенных микробов. МПБ, МПА, бульон и агар Хоттингера, пептонная вода.
- специальные - служат для выделения и выращивания микроорганизмов, не растущих на простых средах.
- элективные( избирательные) - служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Среды становятся элективными при добавлении к ним определённых антибиотиков, солей, изменения pH. Жидкие элективные среды называют средами накопления.
- дифференциально-диагностические - позволяют отличить один вид микробов от другого по ферментативной активности.
- консервирующие - предназначены для первичного посева и транспортировки исследуемого материала.
![]()
Простые
- мясо-пептонный бульон (МПБ) — жидкая среда
- мясо-пептонный агар (МПА) — плотная среда
Специальные
Специальные методы характеризуются добавлением специфического компонента или заменой основы.
- казеиново-угольный агар
- сывороточный агар
- кровяной бульон
- яичная среда Левенштейна-Йенсена
Элективные
Элективные методы характеризуются получением роста только интересующего микроорганизма.
- Среда Эшби – для азотфиксаторов
- желточно-солевой агар (ЖСА) — для стафилококка
- пептонная вода (1 %,pH=8) — для холерного вибриона
- среда Мюллера — для сальмонелл
- селенитовая среда — для сальмонелл
- среда Леффлера — эффективна для коринебактерий дифтерии
Дифференциально-диагностические
Позволяют произвести идентификацию отдельных типов, видов и групп бактерий.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Синхронные культуры
Синхронные культуры – это бактериальные культуры или популяции, в которой все клетки находятся на одинаковой стадии клеточного цикла. В естественных культурах – периодических и проточных – такого явления не наблюдается. Даже в экспоненциальной фазе роста в культуре содержатся неделящиеся и находящиеся на разных стадиях деления клетки. Синхронное деление клеток вызывают искусственно, воздействуя на культуру различными факторами, например, пониженной или повышенной температурой . Считается, что неблагоприятные температуры больше сказываются на развитии делящихся клеток, более чувствительных к действию различных факторов. В результате происходит торможение развития. За это время к делению подготовятся другие клетки культуры. Следующее за ним воздействие оптимальной температуры постепенно вызывает синхронное деление клеток. Для получения синхронных культур используют метод вынужденного голодания . Клетки помещают на неполноценную среду, культивируют, затем переносят на полноценную. У фотосинтезирующих бактерий синхронные культуры получают чередованием световых и темновых режимов культивирования . Также используют механические методы: пропускание культуры через специальные фильтры (отбор клеток одинакового размера) и центрифугирование (клетки, находящиеся в начале цикла деления, более мелкие и оседают медленнее ).
Синхронные культуры используют для изучения синтеза отдельных клеточных компонентов в процессе деления клетки.
Непрерывные культуры
В 50-е годы 20 века был разработан метод непрерывного культивирования микроорганизмов (метод проточных культур). Сущность метода состоит в том, что в культиватор, где производится выращивание бактерий, все время поступает свежая питательная среда и одновременно с такой же скоростью выводится культуральная жидкость. В результате для микроорганизмов создаются неизменные условия в отношении наличия питательных веществ и фактически отсутствия продуктов обмена. Регулируя скорость проточной среды, можно управлять развитием бактериальной популяции, например, задержать культуру в логарифмической фазе роста на любое длительное время.
Непрерывное культивирование осуществляется в специальных приборах – хемостатах и турбидостатах. В хемостатах рост культуры контролируется концентрацией субстрата. Поддерживая постоянной концентрацию одного из необходимых субстратов (источник азота или углерода) путем регулирования скорости протока среды, можно стабилизировать скорость роста культуры и плотность популяции. При больших скоростях протока среды рост культуры более интенсивный и приближается к максимальному; при меньших – более медленный вследствие ограниченного поступления субстрата. Однако увеличение скорости протока с целью устранения ограничения роста культуры субстратом приводит к вымыванию культуры, снижению плотности популяции.
В отличие от хемостатов принцип работы турбидостата основан на регулировании скорости протока среды плотностью популяции. В турбидостате плотность популяции контролируется с помощью фотоэлемента, соединенного с реле, которое регулирует подачу среды. Как только плотность популяции достигнет заданного уровня, реле срабатывает и в культиватор начинает поступать свежая среда. В результате концентрация клеток уменьшается до определенного уровня, после чего автоматически отключается подача среды. В турбидостате достигается максимальная скорость роста культуры при большей плотности популяции и большей точности регулирования поступления среды.
Проточное культивирование микроорганизмов используется в изучении физиологии микроорганизмов, т.к. позволяет их культивировать в контролируемых условиях. Кроме того, этот метод нашел широкое применение в микробиологической промышленности, т.к. дает возможность управлять биосинтетическими процессами микроорганизмов.
![]()
Выделение чистых культур микроорганизмов
Чистой культурой называют такую культуру, которая содержит микроорганизмы одного вида. Выделение чистых культур бактерий - обязательный этап бактериологического исследования в лабораторной диагностике инфекционных болезней, в изучении микробной загрязненности различных объектов окружающей среды, и, в целом, при любой работе с микроорганизмами. Исследуемый материал (гной, мокрота, фекалии, кровь и другой материал от больных; вода, почва, воздух, пищевые продукты, трупы животных и человека, переносчики) обычно содержит ассоциации микробов.
Выделение чистой культуры позволяет изучить морфологические, культуральные , биохимические, антигенные и другие признаки, по совокупности которых определяется видовая и типовая принадлежность возбудителя, то есть производится его идентификация.
Для выделения чистых культур микроорганизмов используют методы, которые можно разделить на несколько групп.Техника посевов микроорганизмов на питательные среды
![]()
Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.
![]()
![]()
Рис. 24. Посев на агар в чашки Петри шпателем ДригальскогоГлубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
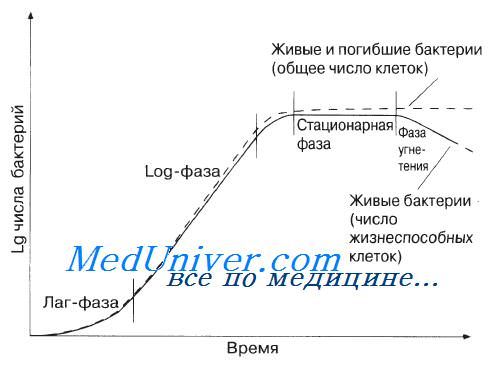
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
Рост бактерий происходит в результате множества взаимосвязанных биохимических реакций, осуществляющих синтез клеточного материала. У бактерий различают индивидуальный рост бактериальной клетки и рост бактерий в популяции.
Об индивидуальном росте судят по увеличению размеров отдельных особей. Скорость роста зависит от внешних условий и физиологического состояния самой клетки. При постоянных условиях рост осуществляется с постоянной скоростью. Палочковидные бактерии растут преимущественно в направлении длинной оси, кокки растут равномерно во всех направлениях. В промежутке между клеточными делениями бактерии имеют большие размеры, чем сразу после деления.
Размножение бактерий
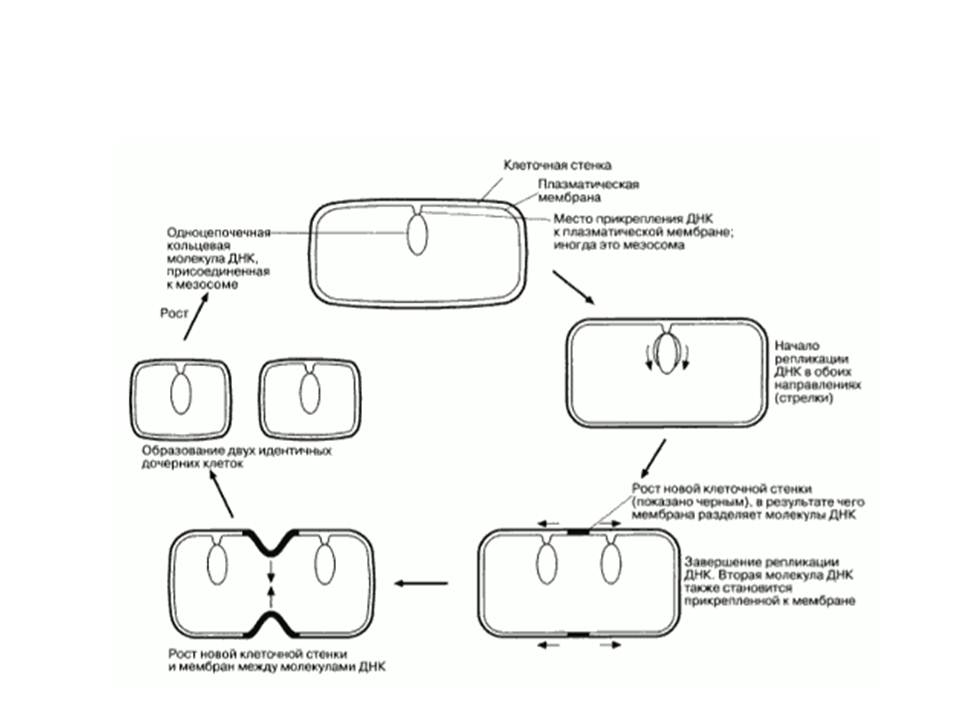
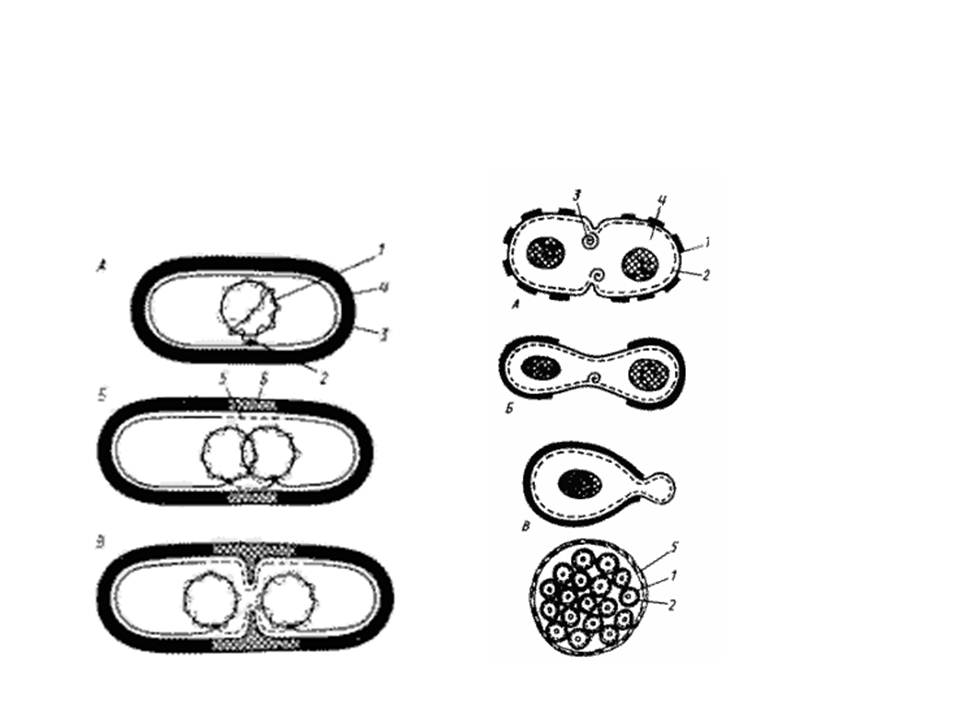
Наиболее часто бактерии размножаются путем бинарного деления, когда из одной клетки образуется две, каждая из которых вновь делится. Процессу деления всегда предшествует репликация (удвоение) ДНК. Существует два типа деления – деление перетяжкой (перешнуровывание) и с помощью поперечной перегородки (рисунок А.7) .
Деление перетяжкой (констрикция) сопровождается сужением клетки в месте ее деления, и в этом процессе принимают участие все слои клеточных оболочек. Выпячивание оболочек внутрь клетки все более ее сужает и, наконец, делит на две. Это деление присуще грамотрицательным бактериям. Деление с образованием поперечной перегородки присуще грамположительным бактериям. Однако у некоторых групп бактерий отмечена смена способов деления (тионовые бактерии, микобактерии). У шаровидных бактерий может образовываться несколько поперечных перегородок (тетракокки, сарцины). Почкование убактерий является разновидностью бинарного деления. Этот способ размножения присущ бактериям, имеющим диморфные или полиморфные клеточные циклы. Почкующимся бактериям присуща полярность клеток. Некоторые бактерии размножаются с помощью экзоспор (но не эндоспор!), некоторые – фрагментами гиф (актиномицеты). У некоторых бактерий имеются половые ворсинки, или F-пили.
Период от деления до деления называется клеточным циклом. Различают несколько типов вегетативного клеточного цикла: мономорфный – образуется только один морфологический тип клеток (например, бациллы), диморфный – два морфологических типа клеток, полиморфный – несколько (актиномицеты). При диморфном и полиморфном циклах различают дочерние и материнские клетки.
Бактерии характеризуются высокой скоростью размножения. Например, в благоприятных условиях кишечная палочка делится каждые 20-30 мин, за сутки это дает 2 72 , т.е. 72 поколения. В условиях, исключающих гибель, эта биомасса составит 4720 т. Скорость размножения зависит от факторов внешней среды (температуры, условия питания, влажность, реакция среды и др.) и от видовых особенностей бактерий. Высокая скорость размножения бактерий обеспечивает их сохранение на земле даже в условиях массовой гибели. Сохранившиеся отдельные клетки размножаются и вновь дают поколение.
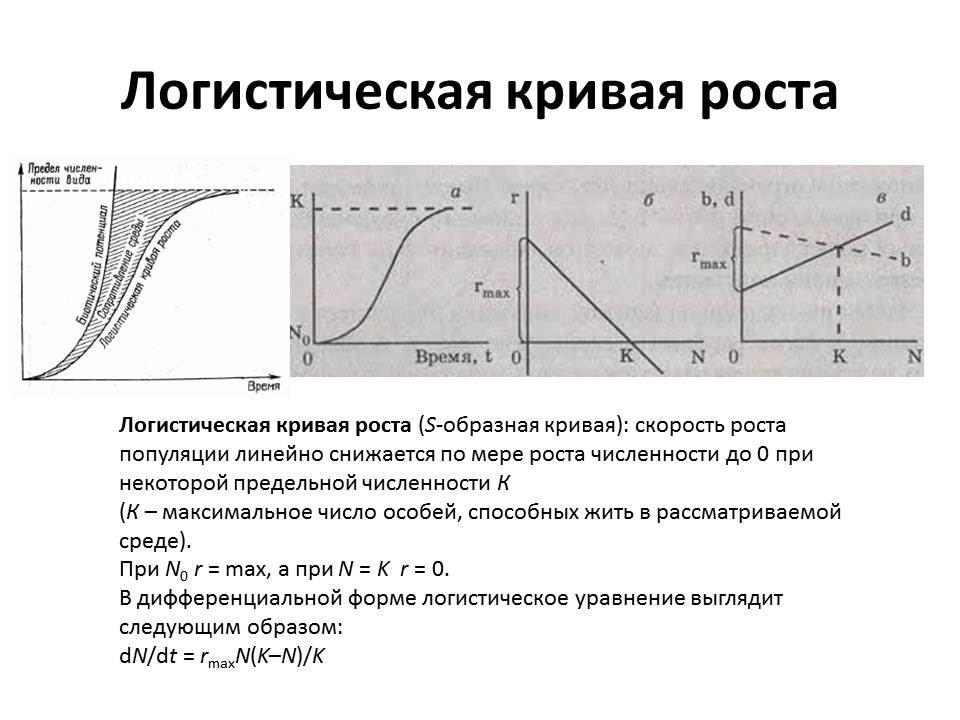
Рост бактерий в популяции. Популяция (фр. population – население) – это совокупность бактерий одного вида (чистая культура) или разных видов (смешанная ассоциация), развивающихся в ограниченном пространстве (например, в питательной среде). В бактериальной популяции постоянно происходит рост, размножение и отмирание клеток. Культивирование микроорганизмов в искусственных условиях бывает периодическим, непрерывным и синхронным.
Периодическое (стационарное) культивирование происходит без притока и оттока питательной среды. Оно характеризуется классической кривой роста микроорганизмов, в которой выделяют отдельные фазы роста бактериальной популяции, отражающие общую закономерность роста и размножения клеток.
Лаг-фаза (англ. lag – отставание) начинается с момента посева бактерий в свежую питательную среду. Клетки адаптируются к данным условиям культивирования, растут, но не размножаются, они достигают максимальной скорости роста. Абсолютная и удельная скорость роста увеличиваются от нуля до максимально возможных значений.
Абсолютная скорость роста определяется отношением:
V = dx/dt, (1.1)
где V – прирост биомассы или числа клеток, выражается в массовых единицах, числе клеток или в условных единицах в единицу времени.
х – биомасса или число клеток;
t – время.
Удельная скорость роста определяется по формуле:
µ = (dx/dt) ? 1/х, (1.2)
где µ - прирост биомассы е единицу времени на единицу биомассы,
х – начальная биомасса.
Продолжительность лаг-фазы зависит от биологических особенностей бактерий, возраста культуры, количества посевного материала, состава питательной среды, температуры, аэрации, рН и др. Одни бактерии обладают коротким периодом задержки роста, другие длинным. Чем моложе культура, тем период короче. Чем состав питательной среды ближе к тому, в котором выращивали микроорганизмы, тем короче лаг-фаза. Изменения в питательной среде приводят к изменению лаг-фазы, так как необходимо время для синтеза ферментов, либо повышения их активности. Таким образом, факторы задержки роста можно разделить на внешние (состав среды, рН, температура и др.) и внутренние (возраст культуры). Длительность фазы моет быть от нескольких минут до нескольких часов и даже дней. В этой фазе μ = 0.
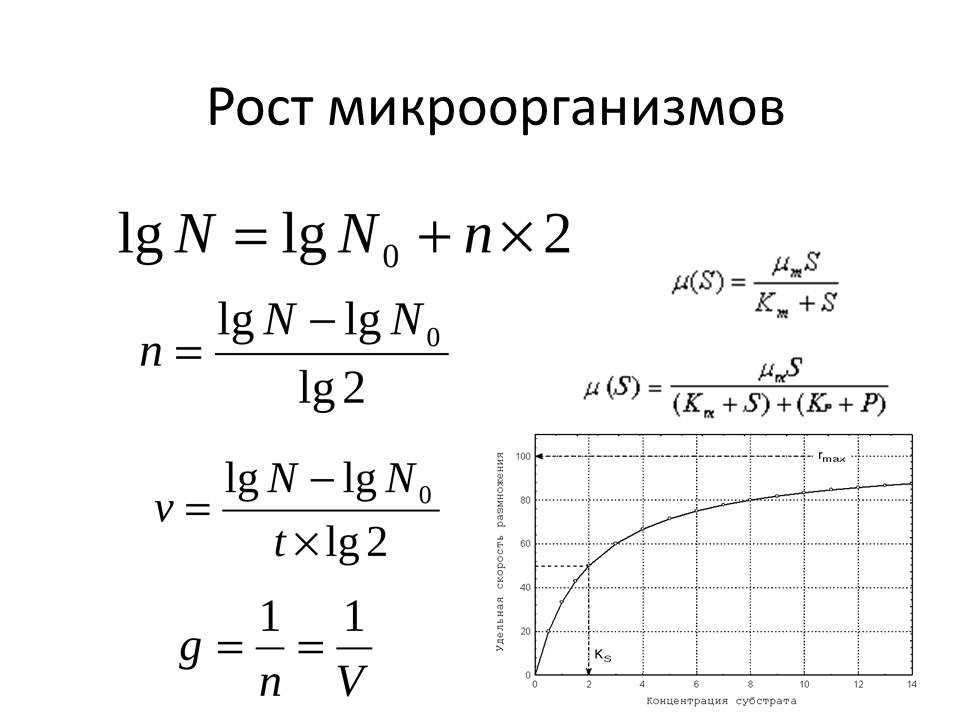
Лог-фаза (логарифмическая, или экспоненциальная) характеризуется максимальной скоростью деления бактерий. Общее количество бактерий определяется по формуле:
N = N0?2 n , (1.3)
где N и N0 - общее количество клеток в конце фазы и в начале фазы соответственно;
n – число поколений, или генераций.
В микробиологической практике для выражения общего числа микробных клеток чаще всего пользуются не абсолютными числами (так как они достигают огромных величин), а их логарифмами. Прсле логарифмирования уравнения (1.3): lg N = lg N0 + n?lg2, n?lg2 = lg N - lg N0, отсюда число поколений равно: n = (lg N - lg N0)/ lg2
Скорость размножения одной клетки, или период генерации:
g = t/n , (1.4)
где t – время;
n – число поколений;
g– период генерации.
Значит: g = t ?lg 2 / (lg N - lg N0) (1.5)
Приведенные уравнения основаны на предположении, что в лог-фазе все 100% клеток жизнеспособны. Однако экспериментально установлено, что около 20% клеток даже в эту фазу отмирает, поэтому в приведенные формулы вносится поправка – вместо 2 берется 1,6.
Экспоненциальный рост популяции описывается уравнением:
Х = Х0 ? е μ max ? t ,(1.6)
где Х и Х0 - количество клеток (или биомасса) в конце и в начале опыта соответственно;
t – время опыта;
е – основание натурального логарифма;
μmax – максимальная удельная скорость роста.
В период логарифмической фазы большинство клеток является физиологически молодыми, биохимически активными, а также наиболее чувствительными к неблагоприятным факторам внешней среды. В этой фазе μ = max.
Фаза замедленного роста. Она объединяет две фазы – фазу линейного роста (μ = const) и фазу отрицательного ускорения. Фаза характеризуется в период линейного роста постоянной скоростью прироста биомассы (числа клеток). Затем при переходе в фазу отрицательного ускорения численность делящихся клеток уменьшается. Наступление фазы объясняется количественными изменениями состава питательной среды (потребление питательных веществ, накопление продуктов метаболизма).
Стационарная фаза характеризуется равновесием между погибающими и вновь образующимися клетками. Факторы, лимитирующие рост бактерий в предыдущей фазе, являются причиной возникновения стационарной фазы. Прироста биомассы нет (μ = 0). В этой фазе наблюдается максимальная величина биомассы и максимальная суммарная численность клеток. Эти максимальные величины называются урожаем, или выходом.
Фаза отмирания (экспоненциальной гибели клеток) характеризуется уменьшением числа живых клеток, возрастанием гетерогенности популяции (появляются клетки, не воспринимающие краситель, со слабым развитием муреинового слоя и др.). Процесс отмирания превалирует над делением (μ > Р, когда величиной Р можно пренебречь. скорость роста ограничена только концентрацией субстрата. Если S >> KS , то скорость роста лимитирована накоплением продуктов обмена.
Непрерывное культивирование. Если в емкость, где находится бактериальная популяция, непрерывно подавать свежую питательную среду и одновременно с такой же скоростью выводить культуральную жидкость, содержащую бактериальные клетки и продукты метаболизма, то получается непрерывное культивирование. Регулируя скорость проточной среды, можно управлять ростом бактериальной популяции, например, удлинять логарифмическую или стационарную фазу на любое необходимое время. Непрерывное культивирование осуществляется в специальных приборах - хемостатах и турбидостатах. Непрерывное культивирование микроорганизмов используется для изучения их физиологии, биохимии, генетики и др., а также широко используется в микробиологической промышленности.
Синхронные культуры – это культуры, в которых некоторое время все клетки делятся одновременно (синхронно) за счет одинаковой готовности к делению всех особей. Синхронизация достигается физическими и химико-биологическими методами. К физическим методам относится температурное воздействие, дифференциальное центрифугирование или дифференциальное фильтрование, химико-биологическим - вынужденное голодание бактерий, выращивание бактерий на неполноценных средах с последующим переносом их в полноценные среды. Синхронные культуры используются для генетических и цитологических исследований, для изучения синтеза отдельных клеточных компонентов в процессе деления бактерий.
Посев различных бактерий представляет собой один из наиболее эффективных и широко распространенных способов, который в настоящее время активно применяется в сфере медицинской микробиологии. Также данный метод незаменим в области биотехнологии, где он играет важную роль в изучении различных свойств как биологического, так и биохимического характера. Под данным методом подразумевается процесс культивирования микроскопических организмов с использованием питательных сред, различающихся между собой по характеристикам и свойствам.![Питательные среды]()
Бактериологические посевы могут проводиться с целью тщательного исследования отделяемых клеток глаз, половых органов человека, а также с целью максимально точного анализа крови, мочи или кала. Также выполняются бактериальные посевы спермы и мокроты для исследования. Довольно часто встречается процедура посева на анаэробные бактерии.
Какими бывают среды для питания бактерий
При выборе среды для осуществления посева в первую очередь следует ориентироваться на характер содержания, присущего бактериям, которые являются главным объектом исследования. В том случае, если необходимо получить изолированные колонии бактерий, а также определить чистую культуру, следует выполнять посев на плотные питательные среды.
Но если материал, подверженный исследованию, содержит в себе не очень большое количество микроорганизмов, можно в этих целях использовать жидкую питательную среду.
Существует несколько разновидностей питательных сред, в которых осуществляется бактериальный посев. Итак, принято различать простые и специальные среды, а также элективные и дифференциально-диагностические. Каждая категория сред питания отличается своими индивидуальными особенностями и характеристиками.
![Изучение микробов в лаборатории]()
Простые питательные среды, в свою очередь, бывают как плотными, так и жидкими. В первом случае это мясопептонный агар, а во втором – мясопептонный бульон.
Главной особенностью специальных сред является абсолютная замена основы либо смешивание ее с другим компонентом, обладающим специфическими свойствами и характеристиками. В результате такого процесса можно выделить следующие виды питательных сред:
- агар на основе сыворотки;
- агар на основе казеина и активированного угля;
- яичная среда, открытая бактериологами Леванштейном и Йенсеном;
- бульон на основе агара и стерильной дефибринированной крови кролика, лошади или барана.
Известны в микробиологии и элективные питательные среды, отличительной чертой которых является получение роста только того из микроорганизмов, который на данный момент представляет интерес для исследования.
К элективным средам относят:
- пептонную воду;
- щелочной агар;
- среду Мюллера;
- среду Леффлера;
- желточно-солевой агар;
- селенитовую среду.
С целью исследования сальмонелл бактерии высеиваются на селенитовую среду и среду Мюллера. Наиболее эффективной для работы с коринебактериями дифтерии признана питательная среда Леффлера. Для стафилококка бактерии высеивать необходимо на желточно-солевой агар, а для холерного вибриона – в пептонную воду.
![Девушка смотрит в микроскоп]()
При помощи дифференциально-диагностических питательных сред появляется возможность проведения максимально точной идентификации отдельно взятых категорий, групп и типов бактерий. Среди данных сред можно выделить два основных типа – это:
Какие различают способы и техники посева
Принято различать несколько техник и методов посева. В большинстве случае данный процесс осуществляется при помощи специальных микробиологических петель. При посеве на специальные чашки Петри данный процесс происходит с применением особых игл или шпателей, изготовленных из стекла или металла. Такой инструмент, как бактериальная петля, можно с уверенностью назвать универсальным, поскольку он применяется в разных техниках бактериального посева. В случае с жидкими материалами применяют специальную петлю в сочетании с пипетками – пастеровскими или градуированными.
Инструмент под названием чашка Петри предназначен специально для осуществления посева на плотные питательные среды. Это выполненный в форме невысокого и плоского цилиндра лабораторный сосуд, изобретенный в 1877 году знаменитым немецким бактериологом Юлиусом Ризардом Петри, который являлся ассистентом микробиолога Роберта Коха. Для изготовления чашки Петри, как правило, используют стекло либо полистирол с прозрачной текстурой. Самый широко используемый размер чашки Петри – высота до 15 миллиметров и диаметр от 50 до 100 миллиметров.
![Чашка Петри]()
В данном случае техника бактериального посева такова: немного приоткрывают крышку чашки Петри, а затем наносят на поверхность плотной питательной среды – агара – требуемое количество посевного материала.
После того как произойдет инкубация бакпосева, бактерии начнут расти густо и равномерно, превращаясь в полноценную культуру и подразделяясь на отдельные колонии.
В данном процессе можно использоваться как стеклянные, так и пластмассовые чашки Петри. Первый вид предназначается для многоразового, а второй – для одноразового применения. Пластиковые чашки Петри являются стерильными, а поставляют их в специальных надежных герметических упаковках. Стеклянные сосуды, в свою очередь, требуют тщательной стерилизации перед осуществлением каждого нового посева.
Если при бакпосеве на плотные среды применяются чашки Петри, то в случае с жидкими средами можно использовать пробирки. Бактериальный посев позволяет быстро вырастить культуру бактерий с определенными свойствами и характеристиками.
Особенности бактериального посева мочи
Анализ, подразумевающий бактериальный посев мочи, предназначается для выявления, идентификации различных микроорганизмов, а также позволяет определить точную их концентрацию. Чтобы провести данную процедуру, мочу, которая является в данном случае основным биоматериалом, помещают в специальную среду питания, которая окажется для нее максимально благоприятной. Если после этого микроорганизмы не начнут расти, результат анализа является отрицательным.
Если же после проведения такого анализа концентрация микроорганизмов в моче окажется достаточно высокой для их размножения, то его результат, бесспорно, положителен.
![анализ мочи]()
В каких случаях пациентам назначают анализ мочи с посевом бактерий?
Проведение анализа с бактериальным посевом мочи является актуальным в нескольких случаях:
- при наличии инфекционных заболеваний органов мочевыводящей системы;
- при заболевании сахарным диабетом;
- при беременности;
- с целью уточнения диагноза, если заболевание носит нетипичный характер.
Для проведения этого вида анализа требуется утренняя порция мочи пациента, приблизительное количество которой составляет от трех до пяти миллилитров. Перед сбором мочи на анализ пациент должен обязательно провести соответствующие гигиенические процедуры, однако применять при этом средства с антисептическими свойствами нельзя. Доставку собранной мочи для анализа необходимо производить в кратчайшие сроки. С этой целью применяется стерильный одноразовый контейнер, который гарантирует правильную транспортировку и максимально точные результаты.
Образование высшее филологическое. В копирайтинге с 2012 г., также занимаюсь редактированием/размещением статей. Увлечения — психология и кулинария.
Если клетки, которые собираются высевать, находятся в жидкости, например в воде, молоке или бульоне, то для переноса пробы в пробирку с питательной средой используют проволочную петлю. Петлю погружают в среду и мягко взбалтывают ее. Не забывайте прокаливать горлышко флакона, если снимаете крышку или удаляйте ватную пробку.
Если засеваемая культура находится внутри или на поверхности твердого субстрата, например почвы или питательного агара, то можно также использовать проволочную петлю для посева в жидкую среду. Для успешного переноса достаточно потереть петлю о внутреннюю поверхность сосуда с питательной средой.
В обоих случаях для перемешивания культуры пробирку с засеянной жидкой средой можно слегка потрясти.Рост бактерий. Рост популяции
Когда бактериальные клетки достигают определенных размеров, они переходят к бесполому размножению, которое называется простым делением; при этом клетка делится на две идентичные дочерние клетки. Детали этого процесса описаны в одной из статей. В этой главе мы подробно рассмотрим рост целой популяции.
Если одиночную бактерию поместить в питательную среду в оптимальных условиях роста, то она и ее потомки будут делиться каждые 30 мин, как показано в таблице.
![рост бактерий]()
Увеличение числа клеток, как показано в таблице, характерно для логарифмического, или экспоненциального, роста. Его легко объяснить, если рассмотреть строку В в таблице, где число бактерий выражено в виде числа 2, возведенного в определенную степень. Показатель степени можно назвать логарифмом (log), или экспонентой. Логарифмы, или экспоненты, образуют линейно увеличивающийся ряд 0, 1,2, 3, и т. д., соответственно числу делений.
Числа в графе А таблицы можно представить в виде логарифмов по основанию 2, как показано в строке Г. (Сравните строку В со строкой Г.) Однако принято использовать логарифмы с основанием 10, как в строке Б. Таким образом, 1 это 10 0 , 2 это 10 0,3 ,4 это 10 0,6 , и т. д.Кривая на графике А в вопросе представляет собой логарифмическую, или экспоненциальную, кривую. Такие кривые роста можно преобразовать в прямые, построив графики в полулогарифмическом масштабе. Таким образом, в идеальных условиях рост бактерий является экспоненциальным. При экспоненциальном росте время, которое требуется для удвоения числа бактерий, постоянно. Оно называется временем удвоения, или временем генерации, и его можно рассчитать, исходя из графика.
Идеальную модель роста популяции бактерий можно сравнить с ростом реальной популяции в закрытом сосуде, где нет внешних воздействий, например не добавляются питательные вещества. Заметьте, что приведены две кривые, одна из которых отражает общее число бактерий, включая погибших. На практике легче всего определить именно это число. Второй график, наиболее интересный для изучения, отражает число жизнеспособных бактерий. Эта кривая имеет четыре фазы. Первая — это лаг-фаза, в ходе которой бактерии адаптируются к новой среде обитания, и максимальная скорость роста не достигается. В этот период в клетках бактерий могут, например, синтезироваться новые ферменты, необходимые для усвоения тех питательных веществ, которые присутствуют в новой среде.
Следующая фаза роста популяции бактерий — логарифмическая, когда бактерии растут с максимальной скоростью, число бактерий увеличивается почти экспоненциально, т. е. кривая роста представляет собой почти прямую линию. В ходе этой фазы время удвоения остается постоянным и имеет минимальное значение. Со временем рост колонии начинает замедляться, время удвоения начинает увеличиваться, и культура входит в стационарную фазу, когда скорость роста популяции равна нулю и когда резко возрастает конкуренция за пищевые ресурсы. Образование новых клеток замедляется и затем совсем прекращается. Любое увеличение числа клеток компенсируется одновременной гибелью других клеток, поэтому суммарная численность живых клеток остается постоянной. Переход к этой фазе определяется действием ряда факторов: истощением необходимых питательных веществ, накоплением токсичных продуктов распада, таких как спирт, а в случае аэробных бактерий еще и ограничением доступа кислорода. Рост бактерий замедляется также при изменении рН.
Во время последней фазы — фазы замедления роста — возрастает скорость гибели клеток, и она становится выше, чем скорость размножения. Со временем клетки вообще прекращают воспроизводиться. Методы подсчета числа бактерий описаны в следующем разделе.
Те же принципы применимы к росту любых популяций, даже популяций человека. Теоретически любая популяция может достичь экспоненциального роста, если время удвоения остается постоянным. Однако рано или поздно в дело вступают лимитирующие факторы, и изучение этих факторов составляет основу популяционной экологии.
- Вернуться в оглавление раздела "Биология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.Читайте также: