Посев методом штрих с площадкой
Обновлено: 05.10.2024
Во избежание загрязнения при введении небольшого количества микроорганизмов в питательную среду — инокуляции (или посева) — необходимо использовать асептические методы. Процедуры посева различаются в зависимости от типа среды (жидкой или твердой).
12.4.1. Посев на твердую среду
Посев штрихом, или посев разведением
Метод представлен на рис. 12.4. Он применяется для выделения чистых колоний бактерий из смеси бактерий. Для посева используют проволочную петлю, которую сначала нужно прокалить, как показано на рис. 12.4,А, чтобы простерилизовать. Затем с помощью петли берут тонкую пленку жидкой суспензии или небольшое количество твердого материала, содержащего исследуемые микроогранизмы, из предварительно выращенной культуры или другого источника микроорганизмов. Петлей мягко проводят по поверхности среды, делая серии штрихов. После каждой серии штрихов чашку немного поворачивают, так чтобы в каждой новой серии распределялись бактерии из предыдущей серии штрихов, истощая таким образом штрихи до отдельных бактерий (рис. 12.4). (Не надейтесь что-нибудь увидеть на финальных штрихах до окончания времени инкубации!) Когда метод отработан, штрихи можно делать очень быстро.
С помощью этого метода можно выделять бактерии из естественных мест обитания, например из почвы, молока, воды. Образцы твердых субстанций, таких как почва, лучше суспендировать в небольшом количестве воды, либо предварительно проинкубировать в жидкой среде. Безопасным источником для рутинной работы является пастеризованное молоко. Перед тем как проводить эксперименты с бактериями или грибами, следует ознакомиться с инструкциями и правилами безопасности, чтобы снизить до минимума риск культивирования вредных организмов.

Рис. 12.4. Посев штрихом, или разведение культуры.
Посев на поверхность агара

Рис. 12.5. Посев на поверхность агара.
Этот метод, альтернативный методу посева на поверхность агара, используется для инокуляции клеток из жидкой культуры, а также для подсчета жизнеспособных клеток. Поскольку клетки распределены по всей среде, а не только по поверхности агара, можно подсчитать гораздо большее их количество — до 1000 колоний на чашку. Однако размеры выросших колоний значительно меньше (рис. 12.6).
Определенный объем (до 0,5 см 3 ) клеточной суспензии вносят в подходящий объем (около 15—20 см 3 ) простерилизованного расплавленного в небольшом флаконе питательного агара, который предварительно был охлажден до 45—50 °С в водяной бане. Снимают крышку и перед добавлением клеточной суспензии прожигают горлышко флакона, как показано на рис. 12.3, A и Б. Суспензию клеток тщательно перемешивают с питательным агаром, поворачивая (не встряхивая) назад и вперед зажатый в ладонях флакон (рис. 12.6, А). Затем выливают смесь в стерильную чашку Петри, как показано на рис. 12.3, В. Подписывают донышко чашки и инкубируют ее. После инкубации чашка выглядит, как показано на рис. 12.6, Б.

Рис. 12.6. Посев заливкой.
Метод используют для культивирования анаэробных организмов или организмов, растущих при низкой концентрации кислорода (микроаэрофилов). Обычно используют пробирку с питательной агаризованной средой. Благодаря небольшой поверхности и достаточно большой глубине агара в пробирке по сравнению с чашкой доступ кислорода внутрь агара ограничивается. Посев производят прямой проволочкой (без петли), или бактериологической иглой. Небольшое количество культуры (твердой или жидкой) берут кончиком иглы и затем вертикально прокалывают ею агар (рис. 12.7). Культура растет в агаре во все стороны от линии прокола.

Рис. 12.7. Посев уколом.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Для выделения бактерий в виде чистых культур известно сравнительно мало методов. Чаще всего это делают путем изолирования отдельных клеток на твердой питательной среде, используя метод посева штрихом или разлива по чашкам небольшого количества жидкой культуры (метод предельных разведений). Однако получение отдельной колонии не всегда гарантирует чистоту культуры, поскольку колонии могут вырасти не только из отдельных клеток, но и из их скоплений. Если микроорганизмы образуют слизь, то часто к ней прикрепляются посторонние формы. Для очистки предпочтительно использовать неселективную среду (МПА), поскольку на ней лучше растут контаминирующие микроорганизмы и их легче обнаружить.
Получение изолированных колоний на твердой питательной среде достигается либо путем рассева взвеси микроорганизмов шпателем (метод Коха), либо с помощью бактериологической петли (метод истощающего штриха). В результате механического разобщения клеток микроорганизмов каждая из них может дать начало изолированной колонии одного вида микробов.
Рассев шпателем (метод Коха) производят в следующей последовательности:
1) на поверхность питательной среды в чашке № 1 наносят стерильной пипеткой каплю накопительной культуры и распределяют ее стерильным шпателем;
2) шпатель достают, чашку быстро закрывают и переносят шпатель в чашку № 2, не стерилизуя его. Имитируют распределение культуры по всей поверхности среды, прикасаясь к ее поверхности той же стороной шпателя, которой ранее распределяли пробу;
3) точно те же действия проводят и в чашке № 3, после чего шпатель стерилизуют;
4) засеянные чашки помещают в термостат и инкубируют при оптимальной температуре.
Через определенное время чашки достают из термостата и изучают рост микроорганизмов. Обычно в чашке № 1 наблюдают сплошной рост бактерий, в последующих чашках отмечают колонии.
Рассев петлей (метод истощающего штриха) предполагает высев бактериологической петлей из накопительной культуры на поверхность агаризованной среды в чашках Петри. На первом этапе петлей с культурой наносят ряд параллельных штрихов на агаризованной среде (рисунок 4.2, А). Петлю стерилизуют, остужают о незасеянную часть агаризованной среды и проводят серию штрихов в направлении, перпендикулярном первым (рисунок 4.2, Б). Затем петлю вновь стерилизуют, остужают и штрихи наносят в направлении В (рисунок 4.2), а после очередной стерилизации – в направлении Г (рисунок 4.2). Чашки помещают в термостат и через определенное время учитывают результаты. Обычно на штрихах А и Б вырастает большое число колоний (иногда сплошной рост), тогда как на штрихах В и Г формируются изолированные колонии.
Рисунок 4.2 – Схема рассева бактерий штрихами для получения изолированных колоний
Последовательные разведения в твердой среде– самый простой способ посева по чашкам, который заключается в том, что после инокуляции пробы в пробирку со стерильным расплавленным и охлажденным агаром, среду перемешивают, выливают в чашку Петри и дают ей застыть. Для получения хорошо изолированных колоний готовят ряд последовательных десятикратных разведений и по 1 мл проб вносят сразу в чашку, добавляют 15–20 мл расплавленной агаризованной среды и смешивают, покачивая чашку. Иногда отдельные колонии оказываются погруженными в агар и извлечь их можно только механически. Плохо и то, что бактерии некоторое время находятся в среде при температуре расплавленного агара.



В Г Д
Рис. 6. Удобный метод посева штрихом в чашки для получения отдельных колоний. А. Для маркировки на обратной стороне чашки Петри карандашом наносят букву Т, разделяющую дно на 3 сектора. Б. Петлей с культурой зигзагом наносят штрихи на поверхности агара в секторе 1, как показано на рисунке. Для этого крышку чашки сначала приподнимают, а после нанесения штриха сразу закрывают. Петлю стерилизуют в пламени и дают ей остыть (15 с). В. Проводят петлей по поверхности среды в секторе 1, как показано на рисунке, и затем немедленно наносят ею зигзагом штрихи на поверхности среды в секторе 2. Прогревают петлю в пламени и дают ей остыть. Г. Проводят петлей по поверхности среды в секторе 2, как показано, и затем наносят ею зигзагом штрихи на поверхности среды в секторе 3. Д. Инкубируют опрокинутые вверх дном чашки, как показано на рисунке, для того, чтобы конденсирующаяся вода с крышки не попала на поверхность агара. В секторе 1 вырастает большое число колоний, тогда как в секторах 2 и 3 появляются отдельные хорошо изолированные колонии.
Получение чистой культуры методом рассева в глубине среды (по Коху)
Три пробирки, содержащие по 15 мл мясо-пептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43—45°С. В пробирку вносят одну бактериальную петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого прокаленной и остуженной петлей содержимое 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского
Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливающегося роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во вторую и третью чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 180°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся на петле, расходуется постепенно, и по линиям сетки, нанесенным в конце посева, вырастают изолированные колонии микробов.
Существует ряд методов получения чистых культур микроорганизмов. Наиболее распространенными способами получения чистых культур в производственных условиях являются методы истощающего посева, основанные на механическом разделении клеток и выращивании их потомства в виде изолированных колоний:
5.2.1 истощающий посев газоном;
5.2.2 истощающий посев штрихом по секторам;
5.2.3 истощающий посев розливкой.
5.2.1 Истощающий посев газоном
Посев производится на трех пронумерованных чашках Петри (1,2,3) с питательной средой. Посев производится простерилизованным в пламени спиртовки и охлажденным стеклянным шпателем Дригальского.
На поверхность питательной среды в чашке 1 наносят петлей или стерильной пастеровской пипеткой каплю исследуемого материала и растирают ее стерильным шпателем, двигая его сначала взад и вперед на небольшом участке, а затем круговыми движениями по всей питательной среде. При этом чашку приоткрывают левой рукой настолько, чтобы в щель мог пройти только лишь шпатель.
Вынимают шпатель из чашки 1, закрывают ее и быстро переносят шпатель в чашку 2, не прожигая его. Растирают материал по всей поверхности среды, прикасаясь к ней той же стороной шпателя, которой растирался материал в чашке 1. Чашку 2 закрывают.
Затем переносят шпатель в чашку 3 и растирают материал по поверхности среды. Закрывают чашку, шпатель прожигают или опускают в дезинфицирующий раствор. Чашки подписывают и ставят в термостат вверх дном. Через сутки на чашке 1, где было много материала, получается сплошной рост бактерий, и отдельных колоний нет. На чашке 2 и, в особенности на чашке 3, колонии распределились изолированно. Поэтому они легко доступны исследователю.
5.2.2 Истощающий посев штрихом по секторам
Соблюдая правила стерильности, разливают питательную среду в чашки Петри. Затем дают среде остыть, слегка подсушивают ее в термостате. Затем чашку переворачивают вверх дном и расчерчивают карандашом по стеклу на четыре сектора. Чашку переворачивают крышкой вверх.
Приоткрыв чашку Петри, на один из секторов наносят каплю микробной взвеси, распределяют петлей на небольшой площадке, затем делают посев штрихом поочередно в каждом секторе. Сеять нужно осторожно, слегка прикасаясь петлей, чтобы не повредить среду. Посевы подписывают и термостатируют. Через сутки в первых секторах наблюдается сплошной рост по штриху, а в последнем секторе вырастают изолированные колонии.
5.2.3 Истощающий посев розливкой
Этот метод получения чистых культур был впервые предложен Робертом Кохом и поэтому иначе называется методом пластинчатых разводок Коха или методом чашечных культур Коха.
При выделении чистой культуры бактерий методом Коха основным условием является предварительное разведение концентрации микроорганизмов в исследуемом материале с таким расчетом, чтобы при посеве его на питательной среде выросли изолированные колонии. Этот метод употребляется в тех случаях, когда нужно произвести количественное определение микроорганизмов в определенном объеме исследуемого материала (вода, молоко, пиво, зерновая болтушка и т.д.). Разведение исследуемого материала можно производить как непосредственно в питательной среде при посеве, так и в стерильной водопроводной воде перед посевом.
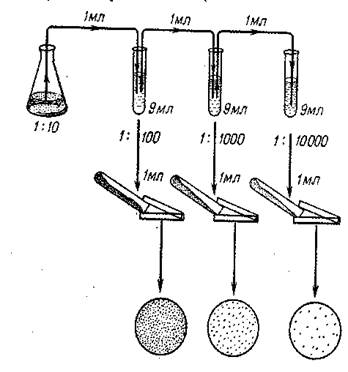
Рисунок 4 - Выделение чистых культур методом
пластинчатых разводок Коха
В первом случае берут несколько пробирок с 9 см 3 МПА, расплавляют их в водяной бане, охлаждают до 50-55°С и помещают в стакан с водой, имеющий примерно такую же температуру. Стерильной пипеткой набирают 1см 3 исследуемого материала, вносят в первую пробирку с МПА и перемешивают. Получается первое разведение – 10 -1 (1:10). Второй стерильной пипеткой забирают 1см 3 разведения 10 -1 , переносят во вторую пробирку, перемешивают, получая разведения 10 -2 (1:100) и т.д. Количество пробирок, взятых для опыта, зависит от степени загрязненности исследуемого материала. Затем полученные разведения в питательной среде выливают в чашки Петри, предварительно согретые в термостате во избежание неравномерного застывания агара. Пробирки берут по порядку, обжигают край, вливают содержимое в чашку Петри, открывая их настолько, чтобы в щель вышло лишь устье пробирки.
Опорожненные пробирки опускают в дезинфицирующий раствор. Покачивая чашки, распределяют МПА равномерно по всей поверхности дна.
Во втором случае проводят аналогичное разведение исследуемого материала, но в стерильной водопроводной воде, получая разведение 10 -1 , 10 -2 , 10 -3 и т.д. Затем забирают отдельными стерильными пипетками из каждой пробирки по 0,1-1 см 3 соответствующего разведения, вносят в стерильные чашки Петри, осторожно приподнимая их крышки, и заливают примерно 10 см 3 расплавленного, но охлажденного до 45°С МПА. Легким покачиванием чашки среду равномерно распределяют по дну и дают ей застыть. Затем чашки переворачивают вверх дном, подписывают и ставят в термостат для выращивания микроорганизмов.

В микробиология, полосы это метод, используемый для выделения чистого напряжение от одного вида микроорганизмов, часто бактерии. Затем из полученных колоний можно взять образцы и микробиологическая культура можно выращивать на новой чашке, чтобы можно было идентифицировать, изучить или протестировать этот организм.
Современный метод полосовой пластины развился благодаря усилиям Роберт Кох и другие микробиологи для получения микробиологические культуры бактерий с целью их изучения. Метод разведения или выделения штрихами был впервые разработан Леффлером и Гаффки в лаборатории Коха, который включает разбавление бактерий путем систематического нанесения штрихов на внешнюю поверхность агар в чашка Петри для получения изолированных колоний, которые затем вырастут в клетки или изолированные колонии. Если на поверхности агара растут микроорганизмы, все генетически одинаковые, культура считается микробиологическая культура.
Содержание
Техника
Штрихи - это быстрый и в идеале простой процесс разбавления изоляции. Этот метод заключается в разбавлении сравнительно большой концентрации бактерий до меньшей концентрации. Уменьшение количества бактерий должно показать, что колонии достаточно разнесены, чтобы повлиять на разделение разных типов микробы. Штрих делается с помощью стерильный инструмент, такой как ватный тампон или обычно инокуляционная петля. Асептические методы используются для поддержания микробиологические культуры и для предотвращения загрязнения среда роста. Существует множество различных методов нанесения штрихов на тарелку. Выбор техники является делом индивидуальных предпочтений и может также зависеть от того, насколько велико количество микробы образец содержит.

Иллюстрация процедуры микропланшета для получения изолированных колоний с использованием асептической техники.
Трехфазная полоса, известная как Т-образная полоса, рекомендуется для начинающих. Штрихи выполняются с помощью стерильный инструмент, такой как ватный тампон или обычно инокуляционная петля. Посевную петлю сначала стерилизуют, пропуская ее через пламя. Когда петля остынет, ее опускают в инокулят например, бульон или образец от пациента, содержащий много видов бактерий. Затем петлю для посева протаскивают по поверхности агар назад и вперед зигзагообразным движением, пока не будет покрыто примерно 30% пластины. Затем петлю повторно стерилизуют и пластину поворачивают на 90 градусов. Начиная с участка с ранее нанесенными штрихами, петля протягивается через него два-три раза, продолжая зигзагообразный узор. Затем процедура повторяется еще раз, стараясь не касаться ранее нанесенных полосами секторов. Каждый раз петля собирает все меньше и меньше бактерий, пока не соберет только отдельные бактериальные клетки, которые могут вырасти в колонию. Пластина должна показать самый сильный рост в первой части. Вторая секция будет иметь меньший рост и несколько изолированных колоний, тогда как последняя секция будет иметь наименьший рост и много изолированных колоний.
Среда роста
Выборка распределена по одному квадранту чашка Петри содержащий среда роста. Бактериям для роста нужны разные питательные вещества. Сюда входит вода, источник энергии, источники углерода, серы, азота, фосфора, некоторых минералов и других витаминов и факторов роста. Очень распространенный тип сред, используемых в микробиологических лабораториях, известен как агар, студенистое вещество, полученное из морских водорослей. В питательный агар содержит много ингредиентов с неизвестным количеством питательных веществ. С одной стороны, это может быть очень селективная среда для использования, поскольку упомянутые бактерии являются особенными. Если в среде есть определенное питательное вещество, бактерии определенно не могут расти и могут умереть. С другой стороны, этот носитель очень сложный. Сложные среды важны, потому что они обеспечивают широкий диапазон роста микробов. Эта среда может во многом поддерживать рост бактерий, отчасти благодаря большому количеству питательных веществ. Выбор среды для выращивания зависит от того, какой микроорганизм культивируется или для которого выбран.

Инкубация
В зависимости от деформации пластина может быть инкубированныйобычно от 24 до 36 часов, чтобы бактерии могли размножаться. В конце инкубации должно быть достаточно бактерий, чтобы образовались видимые колонии в областях, затронутых петлей посева. Из этих смешанных колоний можно идентифицировать отдельные виды бактерий или грибов на основе их морфологических различий (размер / форма / цвет), а затем субкультивировать в чашку с новой средой, чтобы получить чистую культуру для дальнейшего анализа.
Автоматизированное оборудование используется на промышленном уровне для нанесения штрихов на твердую среду с целью достижения лучшей стерилизации и однородности штрихов, а также для надежно более быстрой работы. При ручном нанесении штрихов важно избегать царапин на твердой среде, поскольку последующие штриховые линии будут повреждены, а неравномерное осаждение посевного материала на поврежденных участках среды приведет к кластерному росту микробов, который может распространяться на соседние штриховые линии.
Важность
Бактерии присутствуют в воде, почве и продуктах питания, на коже и кишечнике. нормальная флора. Ассортимент микробы которые существуют в окружающей среде и на человеческих телах, огромны. В человеческом теле есть миллиарды бактерий, которые создают нормальную флору, борющуюся с вторгающимися патогенами. Бактерии часто встречаются в смешанных популяциях. Очень редко можно найти единственный встречающийся вид бактерий. Чтобы иметь возможность изучать культурные, морфологические и физиологические характеристики отдельных видов, жизненно важно, чтобы бактерии были отделены от других видов, которые обычно происходят из окружающей среды. Это важно при определении бактерия в клиническом образце. Когда бактерии разделены и изолированы, можно идентифицировать возбудителя бактериального заболевания.
Читайте также:

