Посев на среду китта тароцци
Обновлено: 05.10.2024
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
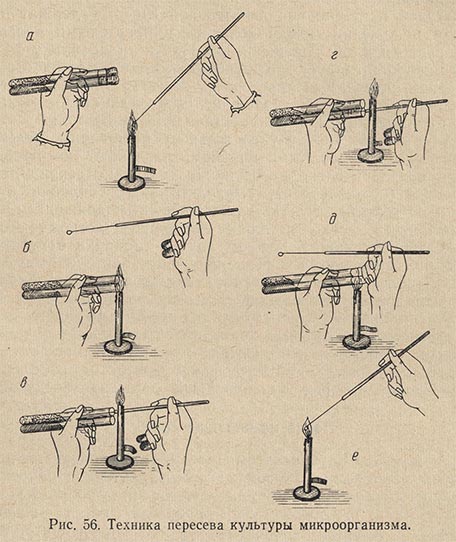
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
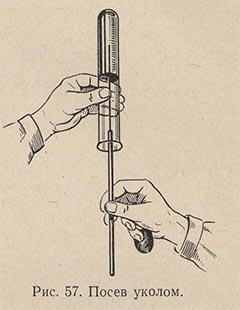
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
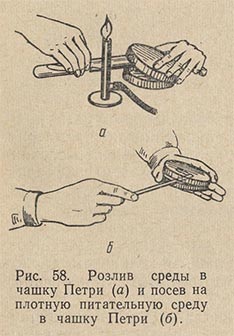
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
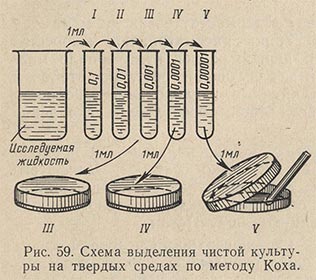
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Питательная среда Китта-Тароцци предназначена для культивирования облигатно-анаэробных бактерий, преимущественно клостридий, в том числе возбудителей анаэробной газовой инфекции (C.perfringens, C.novyi (oedematiens), C.septicum и др.).
Среда выпускается в герметично укупоренных флаконах по 200 мл.
В стерильные пробирки опускают кусочки проваренной печени или проваренного мяса весом около 1 г. Разливают бульон Китта-Тароцци по пробиркам таким образом, чтобы столбик жидкости составлял не менее половины высоты пробирки. Поверх бульона наслаивают вазелиновое масло, слой которого должен быть около 1 см. Пробирки закрывают ватно-марлевой пробкой и автоклавируют при 0,5 атм. в течение 30-35 мин.
Производят глубинный посев культуры или биологического материала (под вазелин).
УСЛОВИЯ И СРОК ХРАНЕНИЯ:
Хранить в прохладном, защищённом от света месте.
Срок годности среды в герметично укупоренных флаконах - 6 месяцев.
Похожие документы:
Питательные среды для медицинской микробиологии
. буферный растворы. Инструкция по лабораторной диагностике . среды, разрывы среды) такая же, как при применении среды Клиглера. Отдельную группу составляют питательные среды . рН 7,2 – 7,4 (* см.среду Китт-Тароцци) Среда используется при выделении и, что .
Научно-методический центр пищевых инфекций методы частной бактериологии
. В соответствии с действующей инструкцией при лабораторной диагностике злокачественного . . Питательные среды для культивирования клостридий Среда Китта-Тароцци. Мясо . По Граму часто окрашивается биполярно. Выделение требует применения селективных сред; .
Материалы для самостоятельной изучения по курсу ветеринарно санитарной экспертизе
. САМОСТОЯТЕЛЬНОЙ ИЗУЧЕНИЯ ПО КУРСУ ВЕТЕРИНАРНО . технические условия, инструкции и др.). . копченостей отмечается при применении сырья (шпика) . Китта-Тароцци. Подлежащие бактериологическому исследованию банки консервов выдерживают 5 сут. в термостате. Среды .
Для создания бескислородных условий используются физические, химические и биологические методы.
1) посев в глубину плотных питательных сред (кровяной или сахарный агар):
а) посев уколом в высокий столбик агара (анаэробы вырастают в глубине посева);
б) посев в трубках Виньяля-Вейона;
2) выращивание на специальных средах на среде Китта-Тароцци (жидкая питательная среда - 0,5 % глюкоза, кусочки животных тканей, например, печени, которая связывает кислород). Перед посевом среду кипятят и быстро охлаждают. После посева заливают слоем стерильного вазелинового масла.
в) выращивание в анаэростатах – специальный сосуд, из которого удален кислород.
Анаэростат – толстостенный металлический цилиндр с хорошо притертой крышкой с резиновой прокладкой. В него ставят чашки Петри (крышкой вверх) с посевами и удаляют воздух или вытесняют инертным газом.
Химические методы - поглощение кислорода воздуха в герметически закрытом сосуде (аппарате Аристовского) химическими веществами (такими как щелочной пирогаллол или гидросульфит натрия).
Биологические методы (метод Фортнера) - совместное выращивание анаэробов и аэробов. После посева чашки Петри герметически закрывают пластилином или парафином. Вначале в чашке Петри размножаются аэробы, а когда весь кислород используется, начинают расти анаэробы.
Выделение чистой культуры аэробных и анаэробных бактерий.
Чистая культура микроорганизмов – это популяция клеток (видимый рост) одного вида , выросшая на стерильной питательной среде.
Выделение чистой культуры – бактериологический метод. Этот метод является основным методом диагностики бактериальных инфекций.
Для получения чистой культуры необходимо отделить бактериальные клетки разных видов друг от друга . Чаще всего используются механические способы отделения клеток – специальные методы посева:
а) посев шпателем по Дригальскому в три чашки Петри; на третьей чашке вырастают отдельные колонии; каждая колония – один вид, т.к. колония – потомство одной клетки;
б) посев петлей "штрихами" или "сеткой": делают посев прерывистыми штрихами; в том месте, где на агар попало большое количество микробных клеток, рост будет в виде сплошного штриха, а на штрихах с небольшим количеством клеток вырастут отдельные колонии;
Таким образом, при помощи специальных методов посева получают изолированные колонии разных видов бактерий.
Выделение чистой культуры проводят в три этапа:
Первый этап (1-ый день):
а) из материала (смесь бактерий разных видов) готовят мазок , окрашивают по Граму и микроскопируют;
б) делают посев материала (смеси бактерий) на чашку Петри с МПА штриховым методом или по методу Дригальского и ставят в термостат при 37°С на 24-48 часов.
Второй этап (2-ой день):
а) наблюдают посевы и проводят описание колоний разных видов (размер, форма, цвет, поверхность, форма края, структура, консистенция);
б) из колоний готовят мазки и окрашивают по Граму (колония должна содержать один вид бактерий);
в) делают пересев разных колоний в разные пробирки со скошенным МПА для накопления чистой культуры; выращивают в термостате при 37°С 24 часа.
Третий этап (3-ий день): проделывают работу по идентификации (определение вида) культуры и проверяют чистоту культуры. Для определения вида изучают морфологические, культуральные, тинкториальные и биохимические свойства:
а) отмечают характер роста выделенной чистой культуры на МПА (визуально она характеризуется однородным ростом);
б) готовят мазок , окрашивают по Граму и микроскопируют; если культура чистая, то обнаруживают одинаковые морфологические и тинкториальные клетки;
в) делают посев на среды Гисса и МПБ для изучения сахаролитических и протеолитических свойств чистой культуры; оставляют в термостате при 37° С на 24 часа.
По совокупности морфологических, тинкториальных, культуральных и биохимических свойств делают вывод о видовой принадлежности выделенной чистой культуры бактерий. При необходимости изучают и другие признаки (факторы вирулентности, антигенную структуру, чувствительность к фагам и др.).
В бактериологической практике установление вида возбудителя позволяет поставить диагноз заболевания, поэтому выделение и идентификация чистой культуры - это и естьбактериологический метод диагностики инфекционных заболеваний . Постановка этого метода обязательно включает и определение чувствительности выделенной чистой культуры возбудителя к антибиотикам (определение антибиотикограммы).
Выделение чистой культуры анаэробных бактерий также осуществляется в три этапа. При этом также получают чистую культуру из одной клетки и добиваются роста микроорганизмов в виде изолированных колоний с последующим ее пересевом и идентификацией.
Особенностью работы по выделению чистой культуры анаэробов является применение различных методов создания бескислородных условий (см. выше).
Три этапа:
Первый день . Делают посев (земля, гной) на среду Китта-Тароцци.
Второй день : для получения колоний делают пересев со среды Китта-Тароцци по методу Цейсслера, методу Вейнберга и методу Перетца.
Третий день : колонии пересевают в пробирку с новой средой Китта-Тароцци для накопления чистой культуры; проводят идентификацию чистой культуры анаэробов по морфологическим, культуральным, тинкториальным, биохимическим и антигенным свойствам.
Посев по методу Цейсслера. Каплю (петлю) материала со среды Китта-Тароцци последовательно засевают в три чашки Петри с кровяным агаром. Посевы ставят в анаэростат или аппарат Аристовского, которые ставят в термостат. На следующий день на третьей чашке вырастают отдельные колонии. Делают пересев этих колоний на среду Китта-Тароцци для накопления чистой культуры, изучения ее свойств и точного определения вида микроорганизмов.
Посев по методу Вейнберга. Пастеровской пипеткой переносят материал со среды Китта-Тароцци последовательно в 3-5 узких пробирок с сахарным МПА, погружая пипетку в расплавленный агар до самого дна пробирки. Пробирки быстро охлаждают под холодной водой. Агар застывает и разобщает микробные клетки в глубине агара. Из этих клеток вырастают колонии, которые пересевают в новую среду Китта-Тароцци, накапливают чистую культуру и идентифицируют.
В 975 см 3 среды из сухого питательного агара непосредственно перед применением асептически добавляют 25 см 3 стерильного раствора глюкозы концентрации 200 г/дм 3 .
К 700 см 3 воды добавляют 300 см 3 томатного сока, 2 г дрожжевого экстракта или 10 см 3 раствора дрожжевого экстракта, 10 г глюкозы, доводят рН 5,5-5,6, фильтруют, разливают по 100 см 3 в стерильные колбы и стерилизуют в автоклаве при температуре (117±1) °С в течение 20 мин. Отдельно в 500 см 3 дистиллированной воды растворяют при нагревании 20 г агара, разливают по 100 см 3 в колбы и стерилизуют в автоклаве при температуре (121±1) °С в течение 20 мин. Перед посевом в асептических условиях смешивают 100 см 3 жидкой среды со 100 см 3 расплавленногоагара. Агаризованную среду вносят в чашки, содержащие 0,25 г стерильного углекислого кальция.
Для приготовления среды Китт-Тароцци стерильные пробирки заполняют на 1,0-1,5 см кусочками печени, мяса или рыбы и заливают приготовленным мясо-пептонным бульоном с глюкозой и агаром. В 1 дм 3 мясо-пептонного, рыбо-пептонного или печеночного бульона вносят 10 г глюкозы и 1,5 г агара, который при нагревании постепенно расплавляют (высота слоя бульона в обычных пробирках 12-13 см, в высоких 15-18 см) и стерилизуют 20 мин при температуре (121±1) °С. Требуемую величину рН проверяют до и после стерилизации.рН среды после стерилизации должно быть (7,1±0,1).
При приготовлении среды впрок вместо добавления к ней агара на поверхность среды перед стерилизацией в пробирки наслаивают 0,5-1,0 см вазелинового масла.
При применении среды Китт-Тароцци без добавления в нее агара или вазелинового масла на поверхность среды после окончания посева наслаивают голодный агар или парафиновую смесь высотой 1,0-1,5 см.
При посевах в свежеприготовленную среду Китт-Тароцци (не более 3 сут с момента приготовления) добавлять агар, вазелиновое масло или наслаивать на ее поверхность голодный агар не обязательно.
После кипячения устанавливают рН 7,7-7,8. Кусочки мяса фасуют в пробирки до 2,5 г и заливают 10 см вышеприготовленной жидкости. Стерилизуют при температуре (121±1) °Св течение 20 мин. После стерилизации среда должна иметь рН 7,4-7,5. Для выделения С. botulinum и сахаролитических анаэробных микроорганизмов в среду добавляют раствор глюкозы из расчета содержания ее в среде 0,5-1,0%. На поверхность среды наслаивают голодный агар, вазелиновое масло или парафиновую смесь.
50 г порошка сухого питательного агара высыпают в 1 дм холодной водопроводной воды, тщательно перемешивают и кипятят на слабом огне 1-2 мин при помешивании до полного расплавления агара, не допуская пригорания в закрытом сосуде. Устанавливают рН среды 7,0-7,2. Расплавленный раствор фильтруют через вату, разливают в пробирки, флаконы или колбы и стерилизуют 20 мин при температуре (121±1) °С.
В 975 см среды из сухого питательного агара непосредственно перед применением асептически добавляют 25 см стерильного раствора глюкозы концентрации 200 г/дм.
К 700 см воды добавляют 300 см томатного сока, 2 г дрожжевого экстракта или 10 смраствора дрожжевого экстракта, 10 г глюкозы, доводят рН 5,5-5,6, фильтруют, разливают по 100 см в стерильные колбы и стерилизуют в автоклаве при температуре (117±1) °С в течение 20 мин. Отдельно в 500 см дистиллированной воды растворяют при нагревании 20 г агара, разливают по 100 см в колбы и стерилизуют в автоклаве при температуре (121±1) °Св течение 20 мин. Перед посевом в асептических условиях смешивают 100 см жидкой среды со 100 см расплавленного агара. Агаризованную среду вносят в чашки, содержащие 0,25 г стерильного углекислого кальция.
Для приготовления среды Китт-Тароцци стерильные пробирки заполняют на 1,0-1,5 см кусочками печени, мяса или рыбы и заливают приготовленным мясо-пептонным бульоном с глюкозой и агаром. В 1 дм мясо-пептонного, рыбо-пептонного или печеночного бульона вносят 10 г глюкозы и 1,5 г агара, который при нагревании постепенно расплавляют (высота слоя бульона в обычных пробирках 12-13 см, в высоких 15-18 см) и стерилизуют 20 мин при температуре (121±1) °С. Требуемую величину рН проверяют до и после стерилизации.рН среды после стерилизации должно быть (7,1±0,1).
При приготовлении среды впрок вместо добавления к ней агара на поверхность среды перед стерилизацией в пробирки наслаивают 0,5-1,0 см вазелинового масла.
При применении среды Китт-Тароцци без добавления в нее агара или вазелинового масла на поверхность среды после окончания посева наслаивают голодный агар или парафиновую смесь высотой 1,0-1,5 см.
При посевах в свежеприготовленную среду Китт-Тароцци (не более 3 сут с момента приготовления) добавлять агар, вазелиновое масло или наслаивать на ее поверхность голодный агар не обязательно.
Готовят среду Китт-Тароцци с углекислым кальцием, но в мясо-пептонный бульон перед фасовкой вносят 2 г дрожжевого экстракта или 10 см 3 раствора дрожжевого экстракта. Перед анализом в регенерированную среду Китт-Тароцци с углекислым кальцием и дрожжевым экстрактом асептически вносят аскорбиновую кислоту из расчета 100 мкг на 1 дм 3 среды.
Для внесения аскорбиновой кислоты в среду раствор, приготовленный по п.4.10, разводят в стерильной дистиллированной воде в 100 раз и 0,2 см 3 приготовленного раствора вносят на 1 дм 3 среды.
В 1 дм 3 водопроводной воды добавляют 20 г порошкообразной печени, при отсутствии сухой порошкообразной печени применяют печеночную воду - 1 дм 3 , но в этом случае водопроводная вода из среды исключается, 50 г кукурузной муки (белой или желтой), все хорошо размешивают, чтобы не было комков. Нагревают в течение 1 ч в текучем паре до полного растворения всех компонентов. Устанавливают рН 7,0-7,2, разливают и стерилизуют 1 ч при (121±1) °С.
Применяют для выявления мезофильных анаэробных и микроорганизмов при анализе консервов с рН 4,4 и ниже.
10 г пептона растворяют в небольшом количестве водопроводной воды, добавляют 5 г растворимого крахмала, предварительно растворенного в 50 см 3 воды, и доводят объем водопроводной водой до 1 дм 3 , устанавливают рН 6,7-6,8. Фильтруют через бумажный фильтр, добавляют 500 мкг триптофана, 5 г глюкозы, 20 г агара, нагревают до полного растворения агара и добавляют индикатор бромкрезол-пурпур и бромтимоловый синий (пп.4.7, 4.8). Разливают в стерильную посуду и стерилизуют 20 мин при температуре (116±1) °С.
В 1 дм 3 дистиллированной воды вносят 2 г азотнокислого калия, 2 г двузамещенного фосфорнокислого калия, 1 г агара, 30 г желатина, дают набухнуть желатину и нагревают на водяной бане до полного растворения желатина и агара, добавляют 25 см 3 стерильного мясо-пептонного бульона и 10 см 3 раствора 2, 3, 5-трифенилтетразолиум хлорида концентрации 10 г/дм 3 , устанавливают рН (7,1±0,1), стерилизуют 3 сут подряд при температуре (100±1) °Св течение 20 мин или однократно при температуре (110±1) °С в течение 15 мин. Среда должна быть бесцветной.
В 1 дм 3 горячей дистиллированной воды растворяют 10 г пептона и 40 г глюкозы или мальтозы, разливают в стерильную посуду и стерилизуют 20 мин при температуре (112±1) °С.
5 г глюкозы, 10 г пептона или триптона, или триптозы (Дифко), 20 г агара растворяют при подогревании в 950 см 3 воды; отдельно 5 г растворимого крахмала растворяют в 50 см 3 воды и раствор вносят в среду, устанавливают рН (7,1±0,1) и стерилизуют при температуре (117±1) °С в течение 20 мин.
Применяют для культивирования аэробных и факультативно-анаэробных кислотообразующих термофильных микроорганизмов.
10 г пептона растворяют в небольшом количестве воды, добавляют 5 г растворимого крахмала, предварительно растворенного в 50 см 3 воды, доводят объем водой до 1 дм 3 , устанавливают рН (6,2±0,1). Фильтруют через бумажный фильтр, добавляют 500 мкг триптофана, 5 г глюкозы, 20 г агара, нагревают до полного растворения агара и добавляют 10 см 3 раствора бромкрезолпурпура концентрации 0,4 г/дм 3 , разливают в стерильную посуду и стерилизуют при температуре (116±1) °С в течение 20 мин.
Читайте также:

