Посев по методу дригальского
Обновлено: 05.10.2024
Чистой называют культуру, содержащую микроорганизмы одного вида и полученную как потомство одной клетки.
Культуры бактерий одного вида, выделенные из различных источников или из одного источника в разное время, называют штаммами. Разные штаммы одного и того же вида бактерий могут отличаться друг от друга по ряду свойств, например по чувствительности к антибиотикам, способности к образованию токсинов, ферментов и др.
Чистые культуры можно получить из исходной микробной клетки, изолированной при помощи микроманипулятора, или из изолированных колоний путем их пересева в отдельные пробирки с питательной средой.
При получении чистой культуры из изолированных колоний предпочтительно производить высев исследуемого материала на неселективные среды, поскольку в случае использования селективных сред в колонии или рядом с ней могут присутствовать жизнеспособные, но не растущие на этих средах сопутствующие микроорганизмы, которые будут пересеяны вместе с выделяемым микроорганизмом. На неселективных же средах сопутствующие микроорганизмы образуют видимые колонии.
Для выделения чистой культуры по способу Дригальского расплавленную питательную среду разливают в 3 чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность способствует сливному росту. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды.
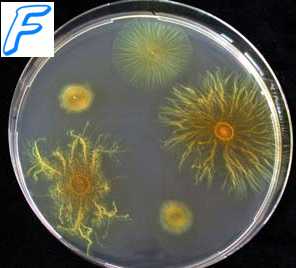
Далее, не набирая нового материала и не прожигая шпателя, последний переносят во вторую, а затем и в третью чашки, втирая в поверхность питательных сред оставшийся на нем материал. При посеве материала, обильно обсемененного микрофлорой, на второй и на третьей чашках вырастают изолированные колонии. Полученные отдельные колонии служат для пересева в пробирки с жидкой или твердой питательной средой и получения чистой культуры микроорганизма.
Метод рассева по поверхности, предложенный Дригальским, наиболее широко применяется для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют по всей чашке параллельными штрихами в одном направлении. Затем, повернув чашку на 90 °, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
При получении чистой культуры методом рассева в глубине среды (по Коху) три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43-45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями.
После этого одну петлю (прокаленную и остуженную) содержимого первой пробирки переносят во вторую и таким же образом из второй в третью. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Современные световые микроскопы характеризуются предельной разрешающей способностью 0,2 мкм, под которой понимают наименьшее расстояние между двумя точками,различимое с помощью микроскопа. Разрешающая способность микроскопа описывается формулой d=Лямда/NA,где лямда-длина волны проходящего света,NA-численная спер ума объективах
Работа с иммерсионной системой.
При работе с иммерсионной системой необходимо соблюдать следующие правила: после нанесения на поверхность препарата небольшой капли иммерсионного под контролем глаза сбоку погрозить в нее фронтальную линзу иммерсионного объектива,затем глядя в окуляр,при помощи макроскопического,а затем микроскопического винта установить препарат в фокусе микроскопа. После работы иммерсионная система и столик должны быть очищены от масла.
1.3.Приготовление нативного препарата"раздавленная капля".
На середину предметного стола нанести каплю жидкой бактериальной культуры. Осторожно покрыть ее покровным стеклом,чтобы не было пузырьков воздуха, после чего микроскопировать с малым с малым сухим, а затем с большим сухим и иммерсионным объективами. 1.3.1.берется из колбы бактериальная культура. 1.3.2.береться из чашки Петри и смешивается с физ.раствором.
1.4. Приготовление нативного препарата "висячая капля".
На середину поурочного стекла нанести каплю исследуемой жидкой культуры. Каплей вниз опустить покровное стекло на предметное стекло с углублением(лункой), края которого смазаны вазелином. Капля должна свободно свисать и не касаться дна углубления. Создается такая закрытая камера,в которой бактерии могут наблюдаться 4-6 часов. Микроскопировать с малым сухим,затем с большим сухим и иммерсионным объективами. 1.4.1. Смотри выше. 1.4.2.⬆️
Прижизненная окраска бактерии.
Для такой окраски применяются сильно разбавленные растворы красителей, которые не оказывают токсического действия на бактерии. На предметное стекло нанести каплю 0,001% раствора метиленового синего,в которую внести взвесь бактерий,после чего приготовить препарат "раздавленная капля" и микроскопировать его.
Приготовление фиксированных препаратов.
Для фиксации мазков высушенный препарат проводят через пламя горелки 3-4 раза,при чем в пламени нельзя выдерживают препарат больше 2 с. Если фиксация произошла правильно,то стекло при прикосновении с тыльной поверхностью руки тотчас после окончания процесса слегка обжигает кожу.
Простой метод окраски препаратов.
Простой метод окрашивании мазков заключается в окрашивании мазков одним красителем и ознакомлением с общей морфологией микробов. Доя окраски используют: метиленовый синий,кристаллический фиолетовый,фуксин,гематоксилин и тд.
Окраска по методу Грамма.
1)на фиксированный препарат поместить полоску фильтровальной бумаги и на нее нанести раствор карболового генцианвиолета на 1-2 мин.
2)краситель слить,снять фильтровальную бумагу и обработать препарат в течение 1-2 мин. раствором Люголя до почернения препарата.
3) слить раствор Люголя и на препарат нанести несколько капель этилового спирта на 30-60 с.
4)помыть водой и докрасить препарат водным фуксином в течение 1-3 мин.
5)слить окраску,промыть водой,высушить и микроскопировать препарат с иммерсионной системой.
Граммположительные бактерии окрашиваются в темно-фиолетовый цвет,а граммотрицательные- в красный или розовый.Сушность метода заключается в том что клеточная стенка грамм+ бактерий прочно фиксирует комплекс генцианвиолет-раствор Люголя,не обесцвечиваются этанолом и поэтому не воспринимает дополнительный краситель,а грамм- наоборот обесцвечиваются этанолом и поэтому имеют дополнительную окраску.
Выявление капсулы по методу Бури-Гинса.
1) на край предметного стекла нанести каплю туши,а рядом каплю исследуемой культуры. Капли быстро перемешать и с помощью шлифованного стекла приготовить тонкий мазок.
2)после высушивания мазок фиксировать над пламенем и окрасить фуксином в течении 1-2 мин.
3)осторожно помыть водой и высушить. Бактерии окрашиваются в красный цвет,капсула не окрашивается и имеет вид светлой зоны вокруг бактерии Га темном фоне.
Бактериологический метод: посев исследуемого материала на чашки Петри с плотной питательной средой - шпателем( метод Дригальского ).
Берут три чашки Петри с плотной питательной средой. На середину первой петлей вносят каплю исследуемого материала и круговыми движениями шпателя производят сплошной посев. Этим же шпателем не стерилизуя его, распределяют материал по второй третьей чашкам.
Петлей ( по Гольду )
Посев производится следующим способом: делается 4-5 параллельных штрихов в направлении А, затем петля прожигается в пламени горелки и ею проводятся штрихи в направлении Б поперек первоначально нанесенных полос. Петля снова прожигается и делаются штрихи в направлении В а затем Г.
Отсев культур в пробирку с плотной питательной средой методом " укола "
Используют высокий столбик плотной или полужидкой питательной среды , полускошанные питательные среды. Во всех случаях бактериальной петлей с посевным материалом делают прокол среды с поверхности до дна. Пробирку держать верх дном чтобы не наступила контаминация среды воздушной микрофлорой.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.003)
Чистой культурой считается совокупность микроорганизмов, принадлежащих к одному виду. Получение данного материала является необходимым моментом исследования в выполнении лабораторных диагностических методик. Для выделения чистых культур бактерий используют мазки из крови, мокроты, фекалий, исследуют гнойный, а также другой биологический материал. В естественных условиях (в воздухе, воде, почве), продуктах пищевого назначения, в трупах (человеческих, животных) содержатся ассоциации различных видов микроорганизмов.

Отделение чистой культуры важно для подробного изучения свойств микробов: морфологических, культуральных, биохимических, а также антигенных. По результатам данных методик исследования можно установить принадлежность возбудителя к определенному виду и типу, иными словами, выполнить его идентификацию.
Свойства микроорганизмов, учитываемые при выделении культуры
Принципы биологического разъединения бактерий подразумевают учет особенностей жизнедеятельности микробов с целью выбрать наиболее оптимальные методы исследования. Выбранные методы должны соответствовать возбудителю по определенным параметрам.
- Тип дыхания. Среди бактерий выделяют группы аэробных и анаэробных представителей. Для получения анаэробных микробов материал для исследования прогревают. Следующий этап – культивирование микроба в анаэробных условиях. Методики получения аэробных и анаэробных бактерий различны.
- Спорообразование. Способность некоторых бактерий к спорообразованию обеспечивает защиту и сохранность микроорганизмов.
- Устойчивость бактерий к агрессивному воздействию щелочей и кислот. Устойчивость некоторых видов бактерий к данным веществам обеспечивает максимальное очищение исследуемого материала от примеси других бактерий с применением растворов щелочи либо кислоты.
- Подвижность бактериальных организмов. Для отделения чистой культуры подвижных микроорганизмов используются методы отделения культур микробов в капле конденсата.
- Чувствительность микроорганизмов к антибиотикам, некоторым химическим веществам и другим антимикробным средствам. Для некоторых возбудителей наиболее предпочтительны методы выделения культур с применением селективных (специфических) питательных сред.
- Антибиотики. Очищают материал от дополнительных микроорганизмов.
- Способность бактерий проникать сквозь неповрежденные кожные покровы. Это свойство присуще некоторым разновидностям, которые обладают факторами агрессии.
- Чувствительность животных к некоторым болезням инфекционного генеза.

Методики проведения оценки возбудителя
Для получения чистых культур бактериальных клеток применяется ряд методов. Каждый из них применяется в той или иной ситуации и имеет последовательные четкие этапы получения колоний возбудителя заболевания. Рассмотрим наиболее популярные.
Методика Пастера
Представляет собой разведение чистых культур в среде для бактериального роста (жидкой консистенции) до получения концентрации с 1 клеткой на объем жидкости. Данный метод выделения имеет важнейшее историческое значение.
Методика Коха
Посевы обычно проводят с 3-4 последних разведений, так как бактерий там уже мало. Таким образом, при росте микробов на питательной среде проявляются обособленные колонии микроорганизмов, которые рождаются из единственной материнской клетки. Затем из глубины агара можно выбрать изолированную колонию, и пересеять ее на свежую питательную среду. Следующий этап – идентификация и выделение возбудителя.
Методика Шукевича
При данном методе отделения чистой культуры подвижные клеточные организмы (протей) поднимаются на верхушку скошенного агара, а неподвижные формы не меняют своего расположения на среде посева. Путем пересевания верхних краев проросшей культуры, можно вывести чистую бактериальную культуру.
Методика Дригальского
Способ Дригальского довольно широко используется в исследовании биологического материала путем разведения культур в пробирке с бульоном либо с физиологическим раствором.

Следующий этап: одну каплю полученного раствора при помощи стерильного шпателя из стекла распределяют равномерно по поверхности среды питания в 1-ой чашке. Потом, не прожигая шпатель на огне, делают им же посев на 2-ой и 3-ей чаше. Суть метода Дригальского заключается в том, что с каждым последующим посевом культур концентрация бактерий (аэробов) все меньше. На 3-ей чашке они распределяются довольно обособленно, каждая бактериальная клетка при этом дает клональные клетки (в виде изолированной колонии). Их пересевают на скошенный агар для накопления возбудителей.
Методика Вейнберга
Определенные затруднения вызывает выделение чистых культур анаэробных возбудителей, если микроорганизмы не гибнут при контакте с кислородными молекулами. Суть методики заключается в выведении анаэробных микробов (в составе материала) в слегка остывшей (45-50°С) расплавленной среде питания (агарозированной). Проводят 6-10 разведений. Затем идет следующий этап: необходимо быстро охладить состав в пробирке и залить ее поверхность смесью из масла вазелина и парафина, что препятствует проникновению воздуха и способствует развитию анаэробных условий.
При благоприятном посеве прорастают изолированные колонии на второй день, которые можно извлечь из пробирки путем ее нагревания при помощи горелки. Из разрезанного агарового столбика петлей набирают культуры для дальнейшего исследования. Полученные колонии размещают в жидкую питательную среду, на чем этапы выделения колонии анаэробных возбудителей можно завершить.
Методика Хангейта
Ее часто применяют для выделения аэробных микробов, обладающих высокой кислородочувствительностью. В проведении такого выделения культуры аэробов применяется методика вращения пробирок.
Методы засевания аэробных бактерий предполагают выведение их на агаризированной расплавленной среде. Наличие инертного газа в пробирке дает возможность вырастить изолированные колонны аэробных бактерий таким образом, что выделенные культуры аэробов хорошо можно увидеть даже невооруженным глазом на 2-3 день.
Микроманипулятор
Это методика выделения отдельных бактериальных клеток путем применения микроманипулятора. Микроманипулятор представляет собой специальный прибор, которым можно выловить из суспензии одну клетку, а также обеспечить возможность посева культуры в пробирку.
Дальнейшая идентификация возбудителя проводится с учетом всех перечисленных свойств возбудителя (аэробов и анаэробов), а также особенностей их взаимодействия с различными веществами.
Работаю врачом ветеринарной медицины. Увлекаюсь бальными танцами, спортом и йогой. В приоритет ставлю личностное развитие и освоение духовных практик. Любимые темы: ветеринария, биология, строительство, ремонт, путешествия. Табу: юриспруденция, политика, IT-технологии и компьютерные игры.
Чистой культурой называют такую культуру, которая содержит микроорганизмы одного вида. Выделение чистых культур бактерий – обязательный этап бактериологического исследования в лабораторной диагностике инфекционных болезней, в изучении микробной загрязненности различных объектов окружающей среды, и, в целом, при любой работе с микроорганизмами. Исследуемый материал (гной, мокрота, фекалии, кровь и другой материал от больных; вода, почва, воздух, пищевые продукты, трупы животных и человека, переносчики) обычно содержит ассоциации микробов.
Выделение чистой культуры позволяет изучить морфологические, культуральные, биохимические, антигенные и другие признаки, по совокупности которых определяется видовая и типовая принадлежность возбудителя, то есть производится его идентификация.
Для выделения чистых культур микроорганизмов используют методы, которые можно разделить на несколько групп.
1. Метод Пастера – последовательное разведение исследуемого материала в жидкой питательной среде до концентрации одной клетки в объеме (имеет историческое значение).
4. Метод Дригальского – широко применяется в бактериологической практике, при этом исследуемый материал разводят в пробирке стерильным физиологическим раствором или бульоном. Одну каплю материала вносят в первую чашку и стерильным стеклянным шпателем распределяют по поверхности среды. Затем этим же шпателем (не прожигая его в пламени горелки) делают такой же посев во второй и третьей чашках. С каждым посевом бактерий на шпателе остается все меньше и меньше и, при посеве на третью чашку, бактерии будут распределяться по поверхности питательной среды отдельно друг от друга. Через 1-7 сут выдерживания чашек в термостате (в зависимости от скорости роста микроорганизмов) на третьей чашке каждая бактерия дает клон клеток, образуя изолированную колонию, которую пересевают на скошенный агар с целью накопления чистой культуры.
5. Метод Вейнберга. Особые трудности возникают при выделении чистых культур облигатных анаэробов. Если контакт с молекулярным кислородом не вызывает сразу же гибели клеток, то посев производят по методу Дригальского, но после этого чашки сразу помещают в анаэростат. Однако чаще пользуются методом разведения. Сущность его заключается в том, что разведения исследуемого материала проводят в расплавленной и охлажденной до 45-50 0 С агаризированной питательной среде. Делают 6-10 последовательных разведений, затем среду в пробирках быстро охлаждают и заливают поверхность слоем смеси парафина и вазелинового масла, чтобы помешать проникновению воздуха в толщу питательной среды. Иногда питательную среду после посева и перемешивания переносят в стерильные трубки Бурри или капиллярные пипетки Пастера, концы которых запаивают. При удачном разведении в пробирках, трубках Бурри, пипетках Пастера вырастают изолированные колонии анаэробов. Чтобы изолированные колонии хорошо были видны, используют осветленные питательные среды. Для извлечения изолированных колоний анаэробов, пробирку слегка нагревают, вращая ее над пламенем, при этом агар, прилегающий к стенкам, плавится и содержимое пробирки в виде агарового столбика выскальзывает в стерильную чашку Петри. Столбик агара разрезают стерильным пинцетом и извлекают колонии петлей. Извлеченные колонии помещают в жидкую среду, благоприятную для развития выделяемых микроорганизмов (например, среду Китта-Тароцци). Агаризированную среду из трубки Бурри выдувают, пропуская газ через ватную пробку.
6. Метод Хангейта – когда хотят получить изолированные колонии бактерий с особенно высокой чувствительностью к кислороду (строгие аэробы) используют метод вращающихся пробирок Хангейта. Для этого расплавленную агаризированную среду засевают бактериями при постоянном токе через пробирку инертного газа, освобожденного от примеси кислорода. Затем пробирку закрывают резиновой пробкой и помещают горизонтально в зажим, вращающий пробирку, среда при этом равномерно распределяется по стенкам пробирки и застывает тонким слоем. Применение тонкого слоя в пробирке, заполненной газовой смесью, позволяет получить изолированные колонии, хорошо видимые невооруженным глазом.
Читайте также:

