Посев производят в над пламенем горелки платиновой петлей
Обновлено: 07.07.2024
Техника посевов и пересевов культур микроорганизмов.Универсальным инструментом для производства посевов является бактериологическая петля (металлическая многоразовая или пластмассовая одноразовая). Кроме нее, для посева уколом применяют специальную бактериологическую иглу, а для посевов на чашки Петри – металлические, стеклянные или пластиковые шпатели. Для посевов жидких материалов наряду с петлей используют пастеровские и градуированные пипетки.
Все манипуляции с микробами осуществляют с помощью стерильных инструментов вблизи пламени горелки.Металлическую бактериологическую петлю перед использованием, после каждой манипуляции и по окончании работы стерилизуют путем прокаливания в пламени горелки.
Культивирование микробов осуществляют посевом их на питательные среды с последующей инкубацией в оптимальных условиях температуры, влажности, газового состава атмосферы и т.д. С этой целью материал, содержащий микроорганизмы (материал от больного, из чистой культуры, из изолированной колонии и т.д.), помещают (засевают) в жидкие или на плотные среды. В последнем случае посев может быть произведен как на поверхность, так и в глубину агара уколом. Предварительно посуду (пробирку, чашки Петри и др.) надписывают, указывая дату посева и характер посевного материала (номер исследования или название культуры).
В зависимости от техники посева и концентрации микробов в посевном материале бактерии на поверхности плотной питательной среды могут давать равномерный сплошной рост-бактериальный газон,"сливной рост" (возникает при помещении большого количества микроорганизмов на ограниченный участок поверхности агара) или образовывать изолированные колонии.
Посев на плотные питательные среды. Плотные питательные среды используют для посева материала на их поверхность и в толщу среды.
Посев петлей на среду в чашку Петри. Заранее подписанную чашку Петри с агаровой средой приоткрывают под углом во избежание попадания микробов извне. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде. Штрихи, наносимые петлей, должны располагаться как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить на поверхности среды изолированные колонии микробов.
Окончив посев, петлю фламбируют, чтобы уничтожить оставшихся на ней микроорганизмов, и ставят в штатив. Пробирку закрывают, предварительно обеззаразив ее края и ту часть пробки, которая входит в горлышко пробирки. Чашку Петри с посевами переворачивают вверх дном, во избежание размыва колонии конденсационной водой, и ставят в термостат для культивирования.
Посев шпателем на среду в чашку Петри. Исследуемую микробную культуру наносят на поверхность питательной среды у края чашки. Стерильным шпателем распределяют ее равномерно по всей поверхности. Чашку подписывают, переворачивают вверх дном и помещают в термостат для выращивания.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.

Посев в жидкую питательную среду. При посеве в жидкую питательную среду обе пробирки (одна с исследуемой культурой, другая с питательной средой) берут в левую руку между большим и указательным пальцами так, чтобы их основания находились поверх кисти руки. Все действия проводят над пламенем горелки (радиус 10- 15 см). Пробки из пробирок вынимают мизинцем и безымянным пальцами правой руки, не прикасаясь к той части пробки, которая входит внутрь пробирки. Края пробирок при вынимании пробок прожигают. Остальные три пальца правой руки остаются свободными для взятия петли или пипетки, посредством которых материал переносят из одной пробирки в другую и распределяют в питательной среде. Бактериальную петлю прокаливают на огне непосредственно перед взятием материала. Чтобы остудить горячую петлю, ее вводят в глубь пробирки и погружают в конденсационную жидкость. При взятии петлей материала для посева должна образоваться в кольце петли тонкая прозрачная пленка – “зеркальце”. Петлю с находящимся на ней материалом погружают в питательную среду. Если материал вязкий и с петли не снимается, его растирают на стенке пробирки и смывают жидкой средой. Пробирки закрывают пробками, предварительно профламбировав их края. Петлю обеззараживают и ставят в штатив. Пробирку с посевами подписывают и помещают в термостат для культивирования.

Рис7.3. Механизмы транспорта веществ через ЦПМ
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
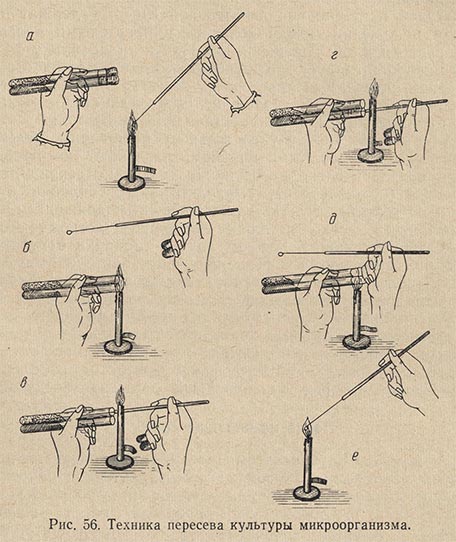
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
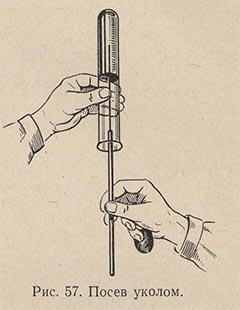
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
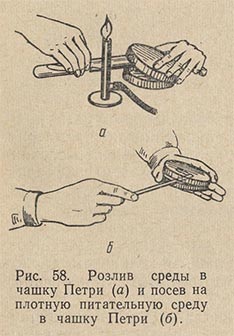
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
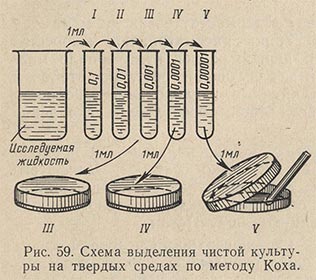
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Посев на плотную среду
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
Фазы роста бактерий на искусственной питательной среде
Рост бактерий обычно включает три фазы
Когда популяция бактерий попадается к богатому на питательные вещества окружению, которое позволяет рост, клеткам нужен определенное время, чтобы приспособиться к новому окружению. Первая фаза роста, фаза медленного роста, является фазой такого приспособления. Эта фаза характеризуется высокой скоростью биосинтеза ферментов и активного транспорта. За ней следует фаза экспоненциального роста, который характеризуется быстрому экспоненциальным ростом количества бактерий. Скоростью роста полагает время удвоения бактерий на протяжении этой фазы. Последняя фаза роста — стационарная фаза, которая вызвана истощением питательных веществ. Клетки сокращают свою метаболическую деятельность и потребляют несущественные клеточные белки. Стационарная фаза — это переход от быстрого роста к стрессовому состоянию, которое характеризуется увеличением экспрессии генов, которые принимают участие в ремонте ДНК и антиоксидантном метаболизме.
Условия культивирования микроорганизмов
В микробиологии выведение бактерий аэробного типа может происходить в следующих условиях:
1. Условия, для которых берутся плотные питательные среды либо прослойка жидкой среды, в которой получение кислорода происходит из окружающего воздуха.
2. Условия, при которых размножение происходит в питательных жидких средах (глубинный метод культивирования). Получение кислорода микроорганизмами в данном случае происходит из растворенных растворенных в жидкости молекул. Чтобы при низком содержании кислорода бактерии аэробного типа росли более интенсивно, жидкость потребуется аэрировать.

Используя такие методы, можно получить чистые аэробные культуры, используемые для разнообразных целей не только в медицине, но и промышленной и пищевой индустрии.
Принципы выращивания анаэробных микроорганизмов представляют собой более длительную и хлопотную процедуру, чем культивирование аэробных форм. Связано это с тем, что контакт культур с кислородом нужно свести к минимуму. Чтобы анаэробные условия были правильными, применяются разные методы, которые условно разделяются на биологические, химические и физические. Несмотря на свои особенности, все они имеют один сходный принцип – обеспечение замкнутого пространства.
Под физическими методами культивирования подразумевается выращивание микроорганизмов посредством микроанаэростата. В данном вакуумном агрегате вместо воздуха применяется газовая смесь.
К химическим методикам культивирования можно отнести:
1. Методы, при которых используются химические вещества, способные поглощать кислородные молекулы. Для реализации в лабораторных условиях берутся хлорид меди одновалентной, раствор пирогаллола щелочной, дитионит натрия, а также другие реактивы.
2. Метод, для которого используются восстанавливающие агенты, добавляемые с целью уменьшения окислительно-восстанавливающего эффекта среды. Происходить это может благодаря аскорбиновой кислоте, цистеину, тиогликолату натрия.
Что касается биологических способов размножения бактерий, то для их выполнения применяется, к примеру, чашка Петри, разделенная на две половины посредством желобка. В одной из половин помещаются анаэробные, а в другой – аэробные микроорганизмы, после чего края чаши заливаются парафином. Как только аэробы используют весь кислород, активируется рост анаэробных организмов.
Методы выделения чистых культур
Все методы выделения чистых культур из микробных смесей можно разделить на 2 группы:
1. Методы, основанные на принципе механического разделения микроорганизмов;
2. Методы, основанные на биологических свойствах микроорганизмов.
Методы, основанные на принципах механического разделения микроорганизмов
Рассев шпателем по Дригальскому
Берут 3 чашки Петри с питательной средой. На первую чашку петлей или пипеткой наносят каплю исследуемого материала и растирают шпателем по всей поверхности агара. Затем шпатель переносят во вторую чашку и втирают оставшуюся на шпателе культуру в поверхность питательной среды. Далее шпатель переносят в третью чашку Петри и аналогичным образом производят посев. На первой чашке вырастает максимальное количество колоний (сплошной pocт) на третьей - минимальное в виде отдельно расположенных колоний.
Метод истощающего штриха
В целях экономии сред и посуды можно пользоваться одной чашкой, разделив её на 4 сектора и последовательно засеяв штрихом. Для этого материал берут петлёй и проводят ею на расстоянии 5 мм друг от друга ряд параллельных штрихов сначала по поверхности первого сектора, а затем последовательно оставшимися на петле клетками засевают все другие секторы. При каждом последующем штрихе происходит уменьшение количества засеваемых клеток. После рассева чашки переворачивают вверх дном, чтобы конденсационная вода, образовавшаяся на крышке чашки Петри, не мешала получить изолированные колонии. Чашки выдерживают в термостате 1-7 суток, так как скорость роста различных микроорганизмов неодинакова.
Таким образом, в первых секторах получается сплошной рост, а вдоль последующих штрихов вырастают обособленные колонии, представляющие собой потомство одной клетки.
Метод прогревания
Позволяет отделить спорообразующие бациллы от неспоровых форм. Прогревают исследуемый материал на водяной бане при 80°С 10-15 минут. При этом погибают вегетативные формы, а споры сохраняются и при посеве на соответствующую питательную среду прорастают, образуя колонии только спорообразующих бактерий.
Метод обогащения
Исследуемый материал засевают на элективные питательные среды, способствующие росту определенного вида микроорганизмов.
Пробирку с агаром или желатиной держат дном кверху. Материал, подлежащий посеву, берут платиновой иглой, которую отвесно вкалывают в поверхность агара или желатины и продвигают по оси пробирки до самого дна. Иглу затем извлекают, обжигают и закрывают пробирку пробкой.(Рис. 5.3).

Рис. 5.3. Посев уколом в МПА
5.5. Посев в чашку Петри.
Посев в чашку осуществляют, как правило, для получения изолированных колоний микроорганизмов, что позволяет выделять чистые культуры бактерий. Чистой культурой называется совокупность клеток только одного определенного вида. Методов выделения чистых культур существует в основном три: а) посев на чашку Петри, б) посев на элективную (избирательную) среду, в) выделение культуры из организма животного, чувствительного к тому или иному микроорганизму.
Посев на плотную питательную среду можно производить разными методами: с помощью петли – штрихом, с помощью шпателя – рассевом и др.(Рис. 5.4)


Рис. 5.4. Методы посева на плотную среду в чашку Петри.
При посеве шпателем на поверхность агара наносят петлей одну каплю исследуемой бактериальной суспензии. Затем, приоткрыв чашку, прокаленным и остуженным стеклянным шпателем размазывают каплю по всей поверхности, производя легкие поглаживающие движения во все стороны по поверхности агара.
Если необходимо выделить чистые культуры из суспензии с высокой концентрацией бактерий посев можно сделать в несколько чашек не обжигая шпателя. Шпателем распределяют каплю бактериальной суспензии по поверхности среды, затем этим же шпателем протирают поверхность плотной среды последовательно во 2-й, 3-й и 4-й чашках. Обычно, в первых двух чашках наблюдают сплошной рост микроорганизмов, тогда как в последующих - изолированные колонии.
Для получения относительных количественных характеристик микрофлоры на поверхность среды наносят мерное количество бактериальной суспензии с определенной концентрацией клеток. Подсчитывая затем количество выросших колоний.
Рассевать культуру можно петлей методом истощающего штриха. В этом случае петлей берут каплю суспензиии, касаются ей поверхности плотной среды в углу чашки, давая капле стечь, а затем проводят штрихи в таком порядке, как указано на рисунке 5.4
При высокой концентрации клеток каплю суспензии рассевают сначала в первой чашке, а затем той же петлей, не набирая материала, вновь наносят штрихи на второй и третьей чашке с агаром. В первой чашке может получиться сплошной рост, тогда как во второй и третьей наблюдается рост единичных, изолированных колоний.
Каждая колония представляет обособленное скопление клеток – потомков исходной – клон бактерий одного вида. При последующем пересеве из колоний на скошенный агар или другую питательную среду получают чистую культуру.
После посева чашки помещают в термостат крышками вниз, чтобы конденсационная вода, образовавшаяся на крышке чашки Петри при застывании агара, не помешала получить изолированные колонии. Чашки выдерживают в термостате в течение 1-7 суток в зависимости от скорости роста микроорганизмов.
Исследования природных субстратов предполагает определение как видового разнообразия бактерий, так и количества их клеток, содержащихся в том или ином объеме субстрата. Число клеток в единице объема можно посчитать различными методами. Иногда, для определения абсолютного числа, проводят прямой счет клеток в исследуемой среде. Однако это отнимает много времени и сил. Часто достаточно относительной количественной оценки. Одним из методов такой оценки является метод высева на плотные среды.
5.6. Определение количества клеток методом высева на плотные среды (чашечный метод). Сущность метода заключается в высеве определенного объема исследуемой суспензии микроорганизмов на плотную среду в чашки Петри и последующем подсчете выросших колоний. При этом исходят из того, что каждая колония является результатом размножения одной клетки. Чашечный метод особенно широко используется для определения количества микроорганизмов в почве и других естественных субстратах. Однако следует учитывать, что для микроорганизмов, образующих цепочки или другие скопления клеток, результаты по определению их числа будут всегда несколько занижены. Поэтому в микробиологической практике часто используют понятие колониеобразующей единицы (КОЕ). Колониеобразующая единица это одна или несколько клеток, давших начало колонии.
Работа этим методом включает три этапа:
- посев на плотную среду в чашки Петри,
- подсчет выросших колоний.
Приготовление разведений. Чтобы получить изолированные колонии, культуру или материал, содержащий микроорганизмы, как правило, разводят – уменьшая концентрацию клеток в единице объёма. Обычно разведения проводят в стерильной водопроводной воде, пользуясь некоторым постоянным коэффициентом разведения, чаще всего равным 10. Таким образом, получают серию разведений, в которых концентрации клеток образуют геометрическую прогрессию. В ходе одного опыта целесообразно использовать один и тот же коэффициент разведения, так как в этом случае при большом числе подсчетов уменьшается вероятность ошибки. Для приготовления разведений стерильную водопроводную воду разливают по 9 мл. в стерильные сухие пробирки. Затем 1 мл. исходной суспензии, взятый стерильной пипеткой, переносят в пробирку с 9 мл. стерильной воды—это 1-е разведение, 1: 10. Полученную в 1-м разведении суспензию с помощью новой стерильной пипетки тщательно перемешивают, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3–5 раз, что обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой берут 1 мл. полученного разведения и переносят его во 2-ю пробирку—это 2-е разведение, 1: 100. Таким же образом готовят и последующие разведения. (Рис. 5.5) Если используется другой коэффициент разведения, например, 3, тогда 1-е разведение будет 1: 3, 2-е— 1: 9, 3-е—1: 27 и т. д. Степень разведения определяется концентрацией исходной суспензии микроорганизмов и соответственно число разведении тем больше, чем больше концентрация исходной суспензии. Для приготовления каждого разведения следует обязательно использовать отдельную пипетку. Пренебрежение этой предосторожностью может привести к получению ошибочного результата, иногда в 100 и более раз превышающего истинный. Ошибка связана с адсорбцией микроорганизмов на стенках пипетки, в результате чего не все клетки удаляются из пипетки при каждом разведении. Часть клеток, оставшаяся на стенках пипетки, может затем попасть в одно из последующих разведении, что и явится причиной получения завышенного результата.
Посев в чашки. Высевать суспензию можно поверхностным или глубинным способом (см. выше). Перед посевом суспензии поверхностным способом (рис.) в стерильные чашки Петри разливают расплавленную плотную, чаще всего агаризованную, питательную среду. Среду обычно разливают из большой колбы последовательно в ряд чашек Петри по 15—20 мл в каждую, и чашки оставляют на горизонтальной поверхности, пока агаризованная среда не застынет. Поверхность агаровых сред рекомендуется подсушивать, чтобы образующиеся колонии не расплывались по поверхности агара. Для этого чашки с застывшей средой помещают открытыми в сушильный шкаф, нагретый до 70—80°С. Шкаф предварительно необходимо простерилизовать. Среду подсушивают до появления на ее поверхности муаровой пленки. При этом с крышек чашки Петри удаляется конденсационная вода. В некоторых случаях агаризованную среду подсушивают, помещая чашки в термостат на 2—3 суток крышками вниз. Когда среда готова, на ее поверхность стерильно пипеткой наносят строго определенный объем (0, 05—0, 2 мл) соответствующего разведения.

Рис. 5.5. Схема приготовления последовательных разведений бактериальной суспензии.
Этот объем распределяют стерильным стеклянным шпателем по поверхности агаризованной среды в чашке Петри. Высевы на плотную среду производят обычно из трех последних разведении. Из каждого разведения делают 2—4 параллельных высева. Посевы из разведении можно делать одной пипеткой, но начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель.
Выросшие колонии подсчитывают, определяя концентрацию клеток в определенном объеме того или иного разведения. Трудно не заметить возможность использования этого метода и для выделения чистых культур микроорганизмов. Изолированные колонии – прекрасная возможность отсеять небольшое количество клеток на скошенный стерильный МПА.
В качестве исследуемого по такой схеме субстрата может быть не только вода или почва, но и воздух. Для этого на стерильный бумажный фильтр (предварительно взвешенный) осаждают клетки, прокачивая определенное количество воздуха. Затем фильтр помещают в стерильную воду или физиологический раствор, где клетки смывают готовя суспензию. Приготовленную суспензию исследуют, как было описано выше.
Метод секторных посевов
Для определения числа микробных клеток в 1 мл бактериальной суспензии (в частности мочи при клинических анализах) можно использовать метод секторных посевов. Платиновой петлей, диаметром 2 мм, емкостью 0,005 мл, производят посев суспензии (30-40 штрихов) на сектор А чашки Петри с питательным агаром. После этого петлю прожигают и производят 4 штриховых посева:
- из сектора А в сектор 1
- из сектора 1 в сектор 2
- и аналогичным образом - из сектора 2 в 3.
 |
Рис. 5.1 Схема секторных посевов
Количество колоний в секторах
Количество бактерий в 1 мл. суспензии
Метод секторных посевов позволяет не только определить степень загрязнённости суспензии, но и выделить чистые культуры микроорганизмов.
Важно отметить, что схема исследования суспензий в принципе одинакова для самых разных случаев, в том числе при изучении микрофлоры воздуха или смывов с любой поверхности.
5. 4 Метод "тампон-петля":
Смывы с поверхности можно исследовать методом “тампон – петля”. Материал, взятый ватным стерильным тампоном, засевают на плотную питательную среду (МПА). Посев на чашку с агаром производят методом “тампон – петля”.(См. рис. 5.2)
- тампоном проводится "дорожка" по диаметру чашки,
- затем другой стороной тампона в обратном направлении засевается еще одна "дорожка", параллельная первой,
- материал рассевают по чашке при помощи петли штрихами, перпендикулярными к "дорожкам".
 |
Рис.5.2 Схема посева “тампон-петля”
Схема посева при выполнении этого метода может быть и несколько иной. Тампоном делают не полоски а пятна – отпечатки, которые затем расштриховывают петлёй.
5.6 Транспортировка инфекционного материала
Доставка инфекционного материала в лабораторию осуществляется в специальном металлическом футляре, биксе и т.п. Не допускается перевозка инфекционного материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования. Распаковка материала, присланного в лабораторию для исследования, проводится с соблюдением мер предосторожности: банки и пробирки, содержащие материал, обтирают дезинфицирующим раствором и ставят на металлические подносы или штативы.
Перенос инфекционного материала из одной лаборатории в другую на территории учреждения осуществляется в специально приспособленной опломбированной металлической посуде (металлических баках, биксах). За пределы данного учреждения инфекционный материал выносится в запаянных ампулах, флаконах и пр., завернутых в лигнин или гигроскопическую вату и помещенных в металлический сосуд (пенал) с плотно закрывающейся крышкой, опломбированной или опечатанной сургучной печатью. Документация оформляется в соответствии с действующим Положением (см. пункт 1.5а).
Правила устройства, техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены при работе в лабораториях (отделениях, отделах) санитарно-эпидемиологических учреждений системы министерства здравоохранения СССР УТВЕРЖДЕНЫ Президиумом ЦК профсоюза медицинских работников 2 октября 1981 г., протокол N 58 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
Заместитель Министра здравоохранения СССР, Главный государственный санитарный врач СССР П.Н.БУРГАСОВ 20 октября 1981 г. N 2455-81
1. Блохина И.Н., Ладыгина Г.Н., Соколова К.Я., Залесских Н.В., Коровенков А.Н. Методы идентификации бактерий. Учебное пособие. Горький. Изд.ГГУ, 1986. 76 с.
2. Борисов Л. Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. Уч. пособие. М. Медицина. 1993. 240 с.
3. Звягинцев Д.Г. Почва и микроорганизмы. М. Изд. МГУ, 1987. 256 с.
4. Мейнелл Дж., Мейнелл Э. Экспериментальная микробиология. (Теория и практика). М. Мир. 1967. 348 с.
5. Пименова М.И., Гречушкина Н.Н., Азова Л.Г. Руководство к практическим занятиям по микробиологии (малый практикум). М. Изд. МГУ, 1971. 222 с.
6. Практикум по микробиологии.// учебное пособие. Под редакц. Н.С.Егорова. М. Изд-во моск. ун-та. 1976. 307 с.
7. Стейниер Р., Эдельберг Э., Ингрем ДЖ.. Мир микробов. в 3 т. М.Мир.1979. т.3. 486 с.)
8. Справочник по микробиологическим и вирусологическим методам исследования. Под ред. М.О. Биргера. М. Медицина. 1982. 464 с.
9. Утевский Н.Л. Элементы медицинской микробиологии и медицинской техники. М.Медгиз.1952. 303 с.
10. Никитин Д.П., Новиков Ю.В., Рощин А.В.Справочник помошника санитарного врача и помошника эпидемиолога. М. Медицина. 1990. С. 512. Изд-е второе. Под редакц. Д.П. Никитина, А.И. Заиченко
11. Определитель бактерий Берджи. В 2-х томах. Перев. С англ./ Под редакц. Дж. Хоулта, Н. Крига, П. Снита, Дж. Стейли, С. Уильямса. М. Мир. 1997. Т. 1. С. 432., т. 2. С. 368.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.011)
Читайте также:

