Посев уколом в столбик желатина используют для определения
Обновлено: 05.10.2024
Для этого бактериологической петлей производят посев исследуемой культуры уколом до дна пробирки с полужидкой питательной средой. Подвижная культура растет по всей питательной среде, образуя равномерное помутнение, а неподвижная - только по уколу в виде стержня, сохраняя прозрачность незасеянного участка среды.
3. ОВЛАДЕНИЕ НАВЫКАМИ ИЗУЧЕНИЯ КУЛЬТУРАЛЬНЫХ, БИОХИМИЧЕСКИХ ПРИЗНАКОВ МИКРООРГАНИЗМОВ И ФАГОЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ
Механические и биологические методы выделения чистых культур аэробных и факультативно-анаэробных бактерий
Механические методы выделения чистых культур аэробных ифакультативно-анаэробных бактерий основаны на механическом разобщении бактериальных клеток на поверхности твердых питательных сред (рис.7). Чистая культура — это популяция микроорганизмов одного вида. К механическим методам относятся:
1) метод Дригальского – это качественный метод, широко применяется для бактериологической диагностики инфекционных заболеваний;
2) метод пластинчатых разводок Коха – это количественный метод, применяется в санитарной микробиологии;
3) метод клонов – получение колоний из одной бактериальной клетки (клонирование).
Биологические методы – методы, основанные на биологических свойствах бактерий:
1)метод Щукевича. Исследумый материал засевают в конденсационную воду скошенного МПА. Данный метод культивирования применяется при подозрении на инфицирование бактериями рода Proteus (P. vulgaris). В случае роста P. vulgaris обнаруживается ползучий рост – рост по всей поверхности агара за счет выраженной подвижности (рис. 8).;
2) бактериостатический метод, основанный на различном действии некоторых химических веществ (например, 5% серная кислота быстро убивает большинство микробов, а микобактерии туберкулеза выживает в этих условиях) и антибиотиков на бактерии (например, небольшие концентрации пенициллина задерживает рост грамположительных бактерий и не влияет на грамотрицательные;
3) метод прогревания. При прогревании исследумого материала при 80°С в течение 10-15 минут вегетативные формы бактерий погибают, а споры сохраняются;
4) метод обогащения. Исследумый материал засевают на элективные питательные среды, способствующие росту определенного вида микроорганизмов. Например, культивирование стафилококков на желточно-солевом агаре.
5) культивирование в организме лабораторных животных, например, выделение чистой культуры возбудителя чумы (Y. рestis) из материала, загрязненного посторонней микрофлорой, возбудителя туляремии (Fr. tularensis). Бактериологическая диагностика туляремии имеет существенную особенность – выделить возбудителя от больного человека непосредственными высевами не удается, тат как накопление микроба в крови и тканях больных крайне незначительно, поэтому бактериологическое исследование начинают с заражения лабораторных животных, то есть с обогащения биологическим способом.
Метод Дригальского
Цель метода: Выделение чистой культуры аэробных и факультативно-анаэробных бактерий и их идентификации.
Исследуемыми материалами могут быть мокрота, гной, испражнение и др. в зависимости от локализации возбудителя инфекционного заболевания. Метод проводится в 4 этапа, при выделении гемокультуры – 5 этапов. Выделение чистой культуры аэробных и факультативно-анаэробных бактерий изучаем на примере выделения чистой культуры кишечной палочки (E coli) из ее смеси со стафилококком.
1-й этап.Получение изолированных колоний. Колонии – это размножившиеся особи одной бактериальной клетки, выросшие на поверхности твердой питательной среды в виде изолированного скопления.
а) приготовление мазков из данной смеси микробов и окраска по Граму. Под микроскопом видны грамотрицательные кишечные палочки и грамположительные стафилококки ;
б) рассев смеси на чашку с МПА шпетелем (рис.10). Мы засеваем несколько измененным методом Дригальского. Вместо 3-х чашек с МПА берем одну. На поверхность питательной среды в чашке наносят петлёй каплю исследуемого материала в 3-х точках: первые две точки – ближе к стенке чашки, а третью точку – в центре, которую растирают прокаленным и охлажденным шпателем сначала в одном направлении, затем перпендикулярно в другом направлении (рис.11). Чашку надписывают (фамилия студента, номер группы, дата) и ставят в специальный цилиндр вверх дном, чтобы образующиеся капельки паров воды, попадающие на крышу, не стекали на поверхность среды и не размазывали посева;


Рис.11.
2-й этап.Выделение чистой культуры, то есть культуры, содержащей одного вида бактерий.
а) макроскопическое изучение колоний по величине, форме, окраске, характеру поверхности и краев, консистенции, структуре и размеру.
Просматривают чашку (не открывая) со стороны дна в проходящем свете, держа ее на уровне глаз на расстоянии 20-30 см. Видно, что посев смеси дал рост неоднородных колоний. Колонии стафилококка выпуклые, гладкие, блестящие, с ровным краем, размером 1-4 мм в диаметре, прозрачные, золотистые или белого цвета (рис.12). Колонии кишечной палочки слабовыпуклые, полупрозрачные, сероватого цвета, с ровным краем и гладкой блестящей поверхностью, размером 2-3 мм в диаметре (рис.13).
Колонии можно просмотреть с помощью лупы или под микроскопом (при малом увеличении) при этом лучше видна разница в структуре колоний;
б) микроскопическое исследование колоний.
Выбирают изолированные колонии того и другого микроба, из части каждой колонии делают мазки, окрашивают их по Граму и микроскопируют. Убеждаются, что золотистого цвета колонии содержат стафилококки - кокки располагаются скоплениями, грамположительны (рис.14), а серого цвета колонии - кишечные палочки, беспорядочно расположенные, грамотрицательные (рис.15);
в) остатки колоний кишечной палочки и стафилококков пересевают в пробирки с косым агаром. К пробиркам прикрепляют этикетку с указанием даты посева, группы, фамилии студента;
3-й этап. Идентификация выделенной чистой культуры.
а) макроскопическое определение роста культуры на скошенном МПА. Стафилококк на скошенном агаре растет в виде прозрачного налета золотистого или белого цвета, кишечная палочка - в виде сочного, блестящего, полупрозрачного налёта серого цвета;
б) проверка чистоты культуры. Готовят мазок, окрашивают его по Граму и просматривают под микроскопом (не менее 10 полей зрения). Во всех полях зрения чистая культура должна быть однородной морфологически и тинкториально;
в) идентификация выделенной чистой культуры бактерий проводится по биохимическим, антигенным свойствам, фагочувствительности, токсигенности (вирулентности) и по генетической структуре.
Идентификация E.coli по биохимическим признакам:
б) идентификация по протеолитической активности.
Разложение микробами белка сопровождается образованием индола, сероводорода, аммиака.
Реакция на сероводород.Исследуемую культуру засевают в МПБ, под пробкой укрепляют полоску бумаги, пропитанной ацетатом свинца. Почернение бумаги после инкубации при 37 0 в течение 2-3 суток свидетельствует о наличии сероводорода. E.coli не образует сероводород в отличие от возбудителей брюшного тифа и паратифа В.
Проба на индол: Способ Эрлиха: в пробирку с культурой бактерий прибавляют 2-3 мл эфира, содержимое энергично перемешивают и добавляют несколько капель реактива Эрлиха (спиртовой раствор парадиметиламидобензальдегида с хлороводородной кислотой). В присутствии индола наблюдается розовое окрашивание; при осторожном наслаивании образуется розовое кольцо.
Идентификация стафилококков по биохимическим признакам:
а) определениекаталазной активности
На предметное стекло наносят каплю 1-3% раствора пероксида водорода и вносят в нее петлю с бактериальной культурой. Каталаза разлагает пероксид водорода на кислород и воду. Выделение пузырьков O2 свидетельствует о наличии у данного вида бактерий фермента каталазы. Каталазной активностью обладают стафилококки в отличие от стрептокков;
б) определение плазмокоагулазной активности.Плазмокоагулаза – фермент S.aureus сворачивающий фибрин за счет активации предшествующего в плазме крови протромбина, тем самым, защищая бактерии от клеточных и гуморальных факторов иммунитета.
В пробирку с цитратной плазмой вносят исследуемую культуру, помещают в термостат при (37 +/- 1) °С и через 1, 2, 3, 18 и 24 ч проверяют наличие свертывания плазмы. Реакция считается положительной независимо от степени свертывания плазмы. S.аureus обладает плазмокоагулазной активностью в отличие от других стафилококков.
4-й этап.Учет результатов идентификации и оформление заключения о виде.
Пробирку с агаром или желатиной держат дном кверху. Материал, подлежащий посеву, берут платиновой иглой, которую отвесно вкалывают в поверхность агара или желатины и продвигают по оси пробирки до самого дна. Иглу затем извлекают, обжигают и закрывают пробирку пробкой.(Рис. 5.3).

Рис. 5.3. Посев уколом в МПА
5.5. Посев в чашку Петри.
Посев в чашку осуществляют, как правило, для получения изолированных колоний микроорганизмов, что позволяет выделять чистые культуры бактерий. Чистой культурой называется совокупность клеток только одного определенного вида. Методов выделения чистых культур существует в основном три: а) посев на чашку Петри, б) посев на элективную (избирательную) среду, в) выделение культуры из организма животного, чувствительного к тому или иному микроорганизму.
Посев на плотную питательную среду можно производить разными методами: с помощью петли – штрихом, с помощью шпателя – рассевом и др.(Рис. 5.4)


Рис. 5.4. Методы посева на плотную среду в чашку Петри.
При посеве шпателем на поверхность агара наносят петлей одну каплю исследуемой бактериальной суспензии. Затем, приоткрыв чашку, прокаленным и остуженным стеклянным шпателем размазывают каплю по всей поверхности, производя легкие поглаживающие движения во все стороны по поверхности агара.
Если необходимо выделить чистые культуры из суспензии с высокой концентрацией бактерий посев можно сделать в несколько чашек не обжигая шпателя. Шпателем распределяют каплю бактериальной суспензии по поверхности среды, затем этим же шпателем протирают поверхность плотной среды последовательно во 2-й, 3-й и 4-й чашках. Обычно, в первых двух чашках наблюдают сплошной рост микроорганизмов, тогда как в последующих - изолированные колонии.
Для получения относительных количественных характеристик микрофлоры на поверхность среды наносят мерное количество бактериальной суспензии с определенной концентрацией клеток. Подсчитывая затем количество выросших колоний.
Рассевать культуру можно петлей методом истощающего штриха. В этом случае петлей берут каплю суспензиии, касаются ей поверхности плотной среды в углу чашки, давая капле стечь, а затем проводят штрихи в таком порядке, как указано на рисунке 5.4
При высокой концентрации клеток каплю суспензии рассевают сначала в первой чашке, а затем той же петлей, не набирая материала, вновь наносят штрихи на второй и третьей чашке с агаром. В первой чашке может получиться сплошной рост, тогда как во второй и третьей наблюдается рост единичных, изолированных колоний.
Каждая колония представляет обособленное скопление клеток – потомков исходной – клон бактерий одного вида. При последующем пересеве из колоний на скошенный агар или другую питательную среду получают чистую культуру.
После посева чашки помещают в термостат крышками вниз, чтобы конденсационная вода, образовавшаяся на крышке чашки Петри при застывании агара, не помешала получить изолированные колонии. Чашки выдерживают в термостате в течение 1-7 суток в зависимости от скорости роста микроорганизмов.
Исследования природных субстратов предполагает определение как видового разнообразия бактерий, так и количества их клеток, содержащихся в том или ином объеме субстрата. Число клеток в единице объема можно посчитать различными методами. Иногда, для определения абсолютного числа, проводят прямой счет клеток в исследуемой среде. Однако это отнимает много времени и сил. Часто достаточно относительной количественной оценки. Одним из методов такой оценки является метод высева на плотные среды.
5.6. Определение количества клеток методом высева на плотные среды (чашечный метод). Сущность метода заключается в высеве определенного объема исследуемой суспензии микроорганизмов на плотную среду в чашки Петри и последующем подсчете выросших колоний. При этом исходят из того, что каждая колония является результатом размножения одной клетки. Чашечный метод особенно широко используется для определения количества микроорганизмов в почве и других естественных субстратах. Однако следует учитывать, что для микроорганизмов, образующих цепочки или другие скопления клеток, результаты по определению их числа будут всегда несколько занижены. Поэтому в микробиологической практике часто используют понятие колониеобразующей единицы (КОЕ). Колониеобразующая единица это одна или несколько клеток, давших начало колонии.
Работа этим методом включает три этапа:
- посев на плотную среду в чашки Петри,
- подсчет выросших колоний.
Приготовление разведений. Чтобы получить изолированные колонии, культуру или материал, содержащий микроорганизмы, как правило, разводят – уменьшая концентрацию клеток в единице объёма. Обычно разведения проводят в стерильной водопроводной воде, пользуясь некоторым постоянным коэффициентом разведения, чаще всего равным 10. Таким образом, получают серию разведений, в которых концентрации клеток образуют геометрическую прогрессию. В ходе одного опыта целесообразно использовать один и тот же коэффициент разведения, так как в этом случае при большом числе подсчетов уменьшается вероятность ошибки. Для приготовления разведений стерильную водопроводную воду разливают по 9 мл. в стерильные сухие пробирки. Затем 1 мл. исходной суспензии, взятый стерильной пипеткой, переносят в пробирку с 9 мл. стерильной воды—это 1-е разведение, 1: 10. Полученную в 1-м разведении суспензию с помощью новой стерильной пипетки тщательно перемешивают, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3–5 раз, что обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой берут 1 мл. полученного разведения и переносят его во 2-ю пробирку—это 2-е разведение, 1: 100. Таким же образом готовят и последующие разведения. (Рис. 5.5) Если используется другой коэффициент разведения, например, 3, тогда 1-е разведение будет 1: 3, 2-е— 1: 9, 3-е—1: 27 и т. д. Степень разведения определяется концентрацией исходной суспензии микроорганизмов и соответственно число разведении тем больше, чем больше концентрация исходной суспензии. Для приготовления каждого разведения следует обязательно использовать отдельную пипетку. Пренебрежение этой предосторожностью может привести к получению ошибочного результата, иногда в 100 и более раз превышающего истинный. Ошибка связана с адсорбцией микроорганизмов на стенках пипетки, в результате чего не все клетки удаляются из пипетки при каждом разведении. Часть клеток, оставшаяся на стенках пипетки, может затем попасть в одно из последующих разведении, что и явится причиной получения завышенного результата.
Посев в чашки. Высевать суспензию можно поверхностным или глубинным способом (см. выше). Перед посевом суспензии поверхностным способом (рис.) в стерильные чашки Петри разливают расплавленную плотную, чаще всего агаризованную, питательную среду. Среду обычно разливают из большой колбы последовательно в ряд чашек Петри по 15—20 мл в каждую, и чашки оставляют на горизонтальной поверхности, пока агаризованная среда не застынет. Поверхность агаровых сред рекомендуется подсушивать, чтобы образующиеся колонии не расплывались по поверхности агара. Для этого чашки с застывшей средой помещают открытыми в сушильный шкаф, нагретый до 70—80°С. Шкаф предварительно необходимо простерилизовать. Среду подсушивают до появления на ее поверхности муаровой пленки. При этом с крышек чашки Петри удаляется конденсационная вода. В некоторых случаях агаризованную среду подсушивают, помещая чашки в термостат на 2—3 суток крышками вниз. Когда среда готова, на ее поверхность стерильно пипеткой наносят строго определенный объем (0, 05—0, 2 мл) соответствующего разведения.

Рис. 5.5. Схема приготовления последовательных разведений бактериальной суспензии.
Этот объем распределяют стерильным стеклянным шпателем по поверхности агаризованной среды в чашке Петри. Высевы на плотную среду производят обычно из трех последних разведении. Из каждого разведения делают 2—4 параллельных высева. Посевы из разведении можно делать одной пипеткой, но начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель.
Выросшие колонии подсчитывают, определяя концентрацию клеток в определенном объеме того или иного разведения. Трудно не заметить возможность использования этого метода и для выделения чистых культур микроорганизмов. Изолированные колонии – прекрасная возможность отсеять небольшое количество клеток на скошенный стерильный МПА.
В качестве исследуемого по такой схеме субстрата может быть не только вода или почва, но и воздух. Для этого на стерильный бумажный фильтр (предварительно взвешенный) осаждают клетки, прокачивая определенное количество воздуха. Затем фильтр помещают в стерильную воду или физиологический раствор, где клетки смывают готовя суспензию. Приготовленную суспензию исследуют, как было описано выше.
Метод секторных посевов
Для определения числа микробных клеток в 1 мл бактериальной суспензии (в частности мочи при клинических анализах) можно использовать метод секторных посевов. Платиновой петлей, диаметром 2 мм, емкостью 0,005 мл, производят посев суспензии (30-40 штрихов) на сектор А чашки Петри с питательным агаром. После этого петлю прожигают и производят 4 штриховых посева:
- из сектора А в сектор 1
- из сектора 1 в сектор 2
- и аналогичным образом - из сектора 2 в 3.
 |
Рис. 5.1 Схема секторных посевов
Количество колоний в секторах
Количество бактерий в 1 мл. суспензии
Метод секторных посевов позволяет не только определить степень загрязнённости суспензии, но и выделить чистые культуры микроорганизмов.
Важно отметить, что схема исследования суспензий в принципе одинакова для самых разных случаев, в том числе при изучении микрофлоры воздуха или смывов с любой поверхности.
5. 4 Метод "тампон-петля":
Смывы с поверхности можно исследовать методом “тампон – петля”. Материал, взятый ватным стерильным тампоном, засевают на плотную питательную среду (МПА). Посев на чашку с агаром производят методом “тампон – петля”.(См. рис. 5.2)
- тампоном проводится "дорожка" по диаметру чашки,
- затем другой стороной тампона в обратном направлении засевается еще одна "дорожка", параллельная первой,
- материал рассевают по чашке при помощи петли штрихами, перпендикулярными к "дорожкам".
 |
Рис.5.2 Схема посева “тампон-петля”
Схема посева при выполнении этого метода может быть и несколько иной. Тампоном делают не полоски а пятна – отпечатки, которые затем расштриховывают петлёй.
5.6 Транспортировка инфекционного материала
Доставка инфекционного материала в лабораторию осуществляется в специальном металлическом футляре, биксе и т.п. Не допускается перевозка инфекционного материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования. Распаковка материала, присланного в лабораторию для исследования, проводится с соблюдением мер предосторожности: банки и пробирки, содержащие материал, обтирают дезинфицирующим раствором и ставят на металлические подносы или штативы.
Перенос инфекционного материала из одной лаборатории в другую на территории учреждения осуществляется в специально приспособленной опломбированной металлической посуде (металлических баках, биксах). За пределы данного учреждения инфекционный материал выносится в запаянных ампулах, флаконах и пр., завернутых в лигнин или гигроскопическую вату и помещенных в металлический сосуд (пенал) с плотно закрывающейся крышкой, опломбированной или опечатанной сургучной печатью. Документация оформляется в соответствии с действующим Положением (см. пункт 1.5а).
Правила устройства, техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены при работе в лабораториях (отделениях, отделах) санитарно-эпидемиологических учреждений системы министерства здравоохранения СССР УТВЕРЖДЕНЫ Президиумом ЦК профсоюза медицинских работников 2 октября 1981 г., протокол N 58 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
Заместитель Министра здравоохранения СССР, Главный государственный санитарный врач СССР П.Н.БУРГАСОВ 20 октября 1981 г. N 2455-81
1. Блохина И.Н., Ладыгина Г.Н., Соколова К.Я., Залесских Н.В., Коровенков А.Н. Методы идентификации бактерий. Учебное пособие. Горький. Изд.ГГУ, 1986. 76 с.
2. Борисов Л. Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. Уч. пособие. М. Медицина. 1993. 240 с.
3. Звягинцев Д.Г. Почва и микроорганизмы. М. Изд. МГУ, 1987. 256 с.
4. Мейнелл Дж., Мейнелл Э. Экспериментальная микробиология. (Теория и практика). М. Мир. 1967. 348 с.
5. Пименова М.И., Гречушкина Н.Н., Азова Л.Г. Руководство к практическим занятиям по микробиологии (малый практикум). М. Изд. МГУ, 1971. 222 с.
6. Практикум по микробиологии.// учебное пособие. Под редакц. Н.С.Егорова. М. Изд-во моск. ун-та. 1976. 307 с.
7. Стейниер Р., Эдельберг Э., Ингрем ДЖ.. Мир микробов. в 3 т. М.Мир.1979. т.3. 486 с.)
8. Справочник по микробиологическим и вирусологическим методам исследования. Под ред. М.О. Биргера. М. Медицина. 1982. 464 с.
9. Утевский Н.Л. Элементы медицинской микробиологии и медицинской техники. М.Медгиз.1952. 303 с.
10. Никитин Д.П., Новиков Ю.В., Рощин А.В.Справочник помошника санитарного врача и помошника эпидемиолога. М. Медицина. 1990. С. 512. Изд-е второе. Под редакц. Д.П. Никитина, А.И. Заиченко
11. Определитель бактерий Берджи. В 2-х томах. Перев. С англ./ Под редакц. Дж. Хоулта, Н. Крига, П. Снита, Дж. Стейли, С. Уильямса. М. Мир. 1997. Т. 1. С. 432., т. 2. С. 368.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.011)






Для выделения, культивирования и идентификации микроорганизмов в лабораторных условиях используют различные искусственные питательные среды, которые в зависимости от назначения подразделяют на группы:
-обычные, или простые, - для выращивания большинства аэробов и факультативных анаэробов;
-специальные - для культивирования микробов, которые не растут или дают слабый рост на простых питательных средах;
-селективные - для выделения культур одною рода или вида, имеющих преимущество в размножении перед другими представителями микрофлоры;
-дифференциально-диагностические предназначенные для выявления культурально-биохимических особенностей бактерий,
-среды накопления (обогащения) - употребляемые для увеличения численности микробов, наличие которых в исследуемом материале незначительно, при подавлении роста посторонней микрофлоры.
Основой большинства питательных сред животного происхождения является мясная вода, для некоторых - печеночная вода.
Мясная вода. Свежую нежирную говядину или конину освобождают от костей, жира и сухожилий, пропускают через мясорубку или нарезают мелкими кусочками, заливают дистиллированной (водопроводной) водой в соотношении 1 : 2 (на 500 г мяса 1000 см3 воды) и выдерживают 15 - 18 ч в прохладном месте. Затем настой кипятят в течение 40 мин - 1 ч и снимают накипь. После кипения мясную воду остужают для застывания жира, который легко при этом удаляется, фильтруют через ватно-марлевый фильтр до полной прозрачности, затем доливают дистиллированной (водопроводной) водой до первоначального объема, разливают в бутыли и стерилизуют в течение 20 мин при температуре 120 °С и давлении;
Печеночная вода. Свежую говяжью печень, освобожденную от жира пленок, Измельчают на мясорубке и заливают водопроводной водой из расчета 1 : 2, настаивают в течение 1 ч и кипятят 30 мин при постоянно помешивании. После отстаивания фарш удаляют, доводят до первоначального объема дистиллированной водой и фильтруют через ватно-марлевый фильтр. Разлитую по колбам печеночную воду стерилизуют 30-40 мин при температуре 112 °С и давлении 0,05 МПа.
Основной раствор (перевар) Хоттингера. 1000 г мяса (говядины или конины), освобожденного от жира и сухожилий, нарезают кусками по 1-2 см, которые опускают небольшими порциями в кастрюлю с 2000 см3 кипящей водопроводной воды. Кипятят в течение 15-20 минут до свертывания белков (цвет мяса станет серым). Мясо вынимают шумовкой и пропускают через мясорубку, а оставшуюся жидкость фильтруют через бумажный фильтр и устанавливают pH 8,0. Затем фильтрат соединяют с фаршем, охлаждают до температуры 40 °С в открытой кастрюле и добавляют дважды измельченную поджелудочную железу, предварительно очищенную от жира, соединительной ткани, в количестве 10% к полученной взвеси (на 1000 см3 жидкости 100 г железы) или 0,9 -1,0 % сухого панкреатина (в зависимости от его активности).
Через 1-2 ч после добавления поджелудочной железы или панкреатина проверяют реакцию, устанавливают pH 7,4-7,6 и оставляют смесь для переваривания на 7 -16 сут при комнатной температуре до образования осадка. Первые 3-4 сут переваривания ежедневно встряхивают жидкость не менее трех раз в сутки, в дальнейшем встряхивать можно реже. За 1- 2 сут до окончания переваривания встряхивание прекращают, чтобы гидролизат отстоялся.
Можно ферментативное переваривание проводить в термостате при температуре 40-42 °С в течение 2 сут. Содержимое бутыли взбалтывают 2-3 раза в сутки с открыванием пробки. Конец переваривания характеризуется следующими признаками: жидкость над осадком просветляется и принимает соломенно-желтый цвет. Готовый перевар фильтруют через полотняный или бумажный фильтр, сливают в бутыль и стерилизуют в течение 30 мин при температуре 120 °С. Приготовленный гидролизат можно хранить пять месяцев. Перед употреблением жидкость вновь фильтруют.
Химические показатели готового перевара Хоттингера должны быть следующими: общего азота 900-1200 мг%, амииного азота 600- 750 мг%, триптофана 200-300 мг%
(Свободный триптофан можно обнаружить в качественной реакции, происходящей в кислой среде при взаимодействии его с препаратами хлора; с этой целью к 5 куб. см. питательной среды добавляют 2 капли уксусной кислоты, тщательно перемешивают и вносят несколько капель1%-го водного раствора хлорамина - появление розовой окраски свидетельствует о наличии триптофана.).
Пептонная вода. К 1000 см3 дистиллированной воды добавляют 10-20 г пептона и 5 г хлорида натрия, кипятят 30 мин до растворения пептона, устанавливают pH 7,2-7,4, фильтруют через бумажный фильтр до полной прозрачности, после чего стерилизуют 30 мин при давлении 0,1 МПа и температуре 120 °С.
Пептонная вода может быть использована взамен мясо-пептонного бульона.
Мясо-пептонный бульон (МПБ). К 1000 см3 мясной воды добавляют 10 г сухого пептона и 5 г хлорида натрия, кипятят в течение 30 мин, устанавливают необходимую реакцию, после чего добавляют воду до первоначального объема. Бульон фильтруют через бумажный фильтр, окончательно устанавливают насыщенным раствором гидрокарбоната натрия (питьевой соды) или 10 %-ным раствором гидроксида натрия требуемую реакцию, стерилизуют 15 -20 мин при температуре 120 °С и давлении 0,1 МПа.
Мясо-пептонный бульон предназначен для культивирования аэробных микроорганизмов и изучения показателей роста в жидкой питательной среде по помутнению среды, наличию и характеристике осадка, образованию пристеночного кольца, пленки.
Мясо-пептонный агар (МПА). К 1000 куб.см. мясо-пептонного бульона перед стерилизацией добавляют 20 г агара и кипятят на слабом огне при постоянном помешивании до полного его растворения.
Мясо-пептонный агар, охлажденный до температуры 50-55 °С, осветляют яичным белком (из расчета один белок на 1000 см3 мясо-пептонного агара), помещают в автоклав, не завинчивая крышку автоклава, или в кипящую водяную баню, чтобы белок свернулся. Горячий мясо-пептонный агар фильтруют через ватно-марлевый фильтр, устанавливают в нем pH 7,2-7,4, разливают в колбы или пробирки и 20 мин стерилизуют в автоклаве при температуре 120 °С.
Мясо-пептонный агар предназначен для культивирования аэробов и изучения характера роста микробов по величине и форме колоний, линии края, цвету, блеску, прозрачности, консистенции и некоторым другим признакам.
Полужидкий агар (ПЖА). К 1000 куб.см. мясо-пептонного бульона добавляют 3-4 г агара и на слабом огне расплавляют при постоянном помешивании, фильтруют через тканевый фильтр до полной прозрачности, разливают в пробирки по 5 см3 и стерилизуют в автоклаве при температуре 120 °С и давлении 0,1 МПа в течение 30 мин.
Готовый полужидкий агар охлаждают столбиком, среда должна быть совершенно прозрачной.
Полужидкий агар используют для определения подвижности микроорганизмов. С этой целью посев тест-культур проводят уколом в столбик среды, не прокалывая до дна 5-6 мм: подвижные культуры дают диффузный рост и вызывают помутнение всей питательной среды, неподвижные - растут по уколу, среда остается прозрачной, штаммы, обладающие слабой подвижностью, дают помутнение отдельных участков агара обычно вблизи укола.
Питательный желатин (МПЖ). К 1000 см3 мясо-пептонного бульона прибавляют 100 г пищевого желатина высшего сорта. После набухания желатина в течение 1-2 ч растворяют при медленном нагревании на водяной бане при температуре 40 - 50 °С до полного расплавления. Устанавливают pH 7,2 10 %-ным раствором бикарбоната натрия, фильтруют через бумажный фильтр в горячем виде. Если среда мутная, ее осветляют белком куриных яиц, после чего в горячем виде фильтруют через ватно-марлевый фильтр и разливают в пробирки по 7 -8 см3, стерилизуют дробно 3 дня по 30 мин текучим паром или однократно при температуре 110 °С и давлении 0,04 МПа в течение 30 мин. После стерилизации среду охлаждают столбиком.
Среда предназначена для определения протеолитической активности микробов по разжижению желатина. Являясь растворимым белком, полученным из нерастворимого коллагена, под влиянием фермента желатиназы подвергается гидролизу и теряет свои желирующие свойства, в результате при низких температурах остается жидким.
Бульон Хоттингера. К 1000 см3 основного раствора добавляют 500 см3 водопроводной или дистиллированной воды, 3 г хлорида натрия и 0,12 г двузамещенного фосфата калия. Полученный раствор кипятят в течение 15-20 мин, устанавливают pH 7,2-7,4 и фильтруют через ватно-марлевый или бумажный фильтр, затем разливают в колбы или пробирки и стерилизуют в течение 20-30 мин при температуре 120°С и давлении 0,1 МПа.
В бульоне Хоттингера изучают характер роста микроорганизмов в жидкой питательной среде.
Среда Мартена. Свежие свиные желудки освобождают от жира и содержимого и пропускают через мясорубку. На 250 г фарша добавляют 1000 см3 теплой (50 °С) кипяченой водопроводной воды и 10 см3 концентрированной соляной кислоты. Смесь выдерживают при температуре 45-50 °С в течение 24 ч, периодически взбалтывая, затем прогревают текучим паром 30 мин и оставляют в холодном месте на 5 сут. Надосадочную жидкость сливают, фильтруют через бумажный фильтр, разливают в колбы и стерилизуют при температуре 120 °С и давлении 0,1 МПа в течение 30 мин. Полученный пептон Мартена хранят до 3 мес.
Из мяса крупного рогатого скота, освобожденного от жира и сухожилий, готовят фарш. К 500 г фарша добавляют 1000 см3 дистиллированной воды. Полученную смесь выдерживают при 4-8 °С в течение 24 ч, после чего кипятят на слабом огне 2 ч, постоянно подливая воду до первоначального объема. Фарш отжимают и удаляют, мясную воду фильтруют через бумажный фильтр, разливают в колбы и стерилизуют при температуре 120 °С и давлении 0,1 МПа в течение 30-40 мин. Готовую среду хранят при температуре 4-8 °С до 3 мес.
Для приготовления жидкой среды смешивают равные объемы пептона Мартена и мясной воды, устанавливают pH 8,0-8,2, разливают в колбы и стерилизуют при температуре 120 °С и давлении 0,1 МПа в течение 30 мин. Бульон хранят не более одного месяца.
Агар Мартена. В среду Мартена (бульон Мартена), подогретый до 50-60 °С, добавляют мелко нарезанный промытый агар-агар из расчета 25 г на 1000 см3, периодически помешивая, доводят жидкость до кипения для полного растворения агара. Фильтруют через ватно-марлевый фильтр в горячем виде, разливают по колбам и стерилизуют в автоклаве при температуре 120 °С и давлении 0,1 МПа в течение 30 мин.
Бульон и агар Мартена предназначены для культивирования анаэробов и микоплазм.
Наиболее часто для обнаружения протеолитических ферментов производят посев чистой культуры бактерий уколом в столбик мясо-пептонного желатина. Посевы выдерживают при комнатной температуре (20-22 °С) в течение нескольких дней, при этом регистрируют не только наличие разжижения, но и его характер.
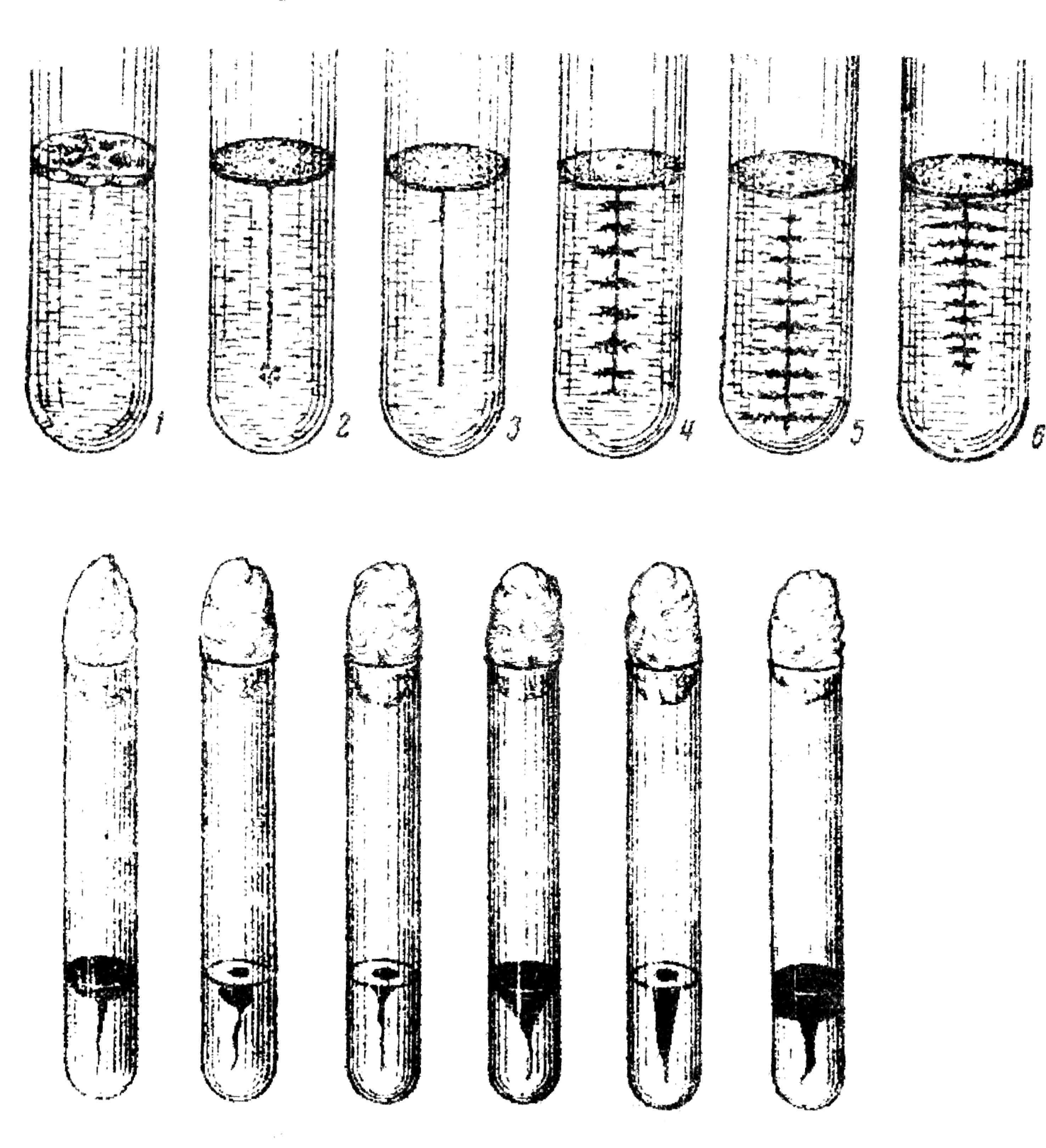
Рис. 30. Проявление роста (А) и характер разжижения (Б) мясо-пептонного желатина различными бактериями: протеолитический фермент отсутствует: 1 – аэроб; 2 – анаэроб; 3 – факультативный анаэроб; протеолитический фермент в незначительном количестве: 4 – факультативный анаэроб; 5 – анаэроб; 6 – аэроб
Протеолитическое действие микроорганизмов можно наблюдать при посевах на свернутую сыворотку крови, вокруг колоний появляются углубления и зоны разжижения.
В молоке наблюдается просветление или растворение образовавшегося вначале сгустка казеина, который расщепляется с образованием пептона, что придает молоку желтоватый цвет (пептонизация молока).
Показателями более глубокого расщепления белка являются его конечные продукты: индол, аммиак, сероводород и др. Для определения этих газообразных веществ производят посев чистой культуры бактерий в бульон или пептонную воду. В пробирки с засеянной средой между стенкой пробирки и пробкой помещают индикаторную бумагу (рис. 31). Посевы выращивают в термостате в течение 1 – 3 суток.
а) обнаружение индола производится несколькими методами. Наиболее прост и доступен способ Мореля. Узкие полоски фильтровальной бумаги смачивают горячим насыщенным раствором щавелевой кислоты (индикаторная бумага) и высушивают. При выделении индола на 1-3-й день нижняя часть полоски бумаги вследствие соединения индола с щавелевой кислотой приобретает розовый цвет.
б) обнаружение аммиака определяют по посинению розовой лакмусовой бумаги, помещенной в пробирку таким же образом, как и для определения индола.
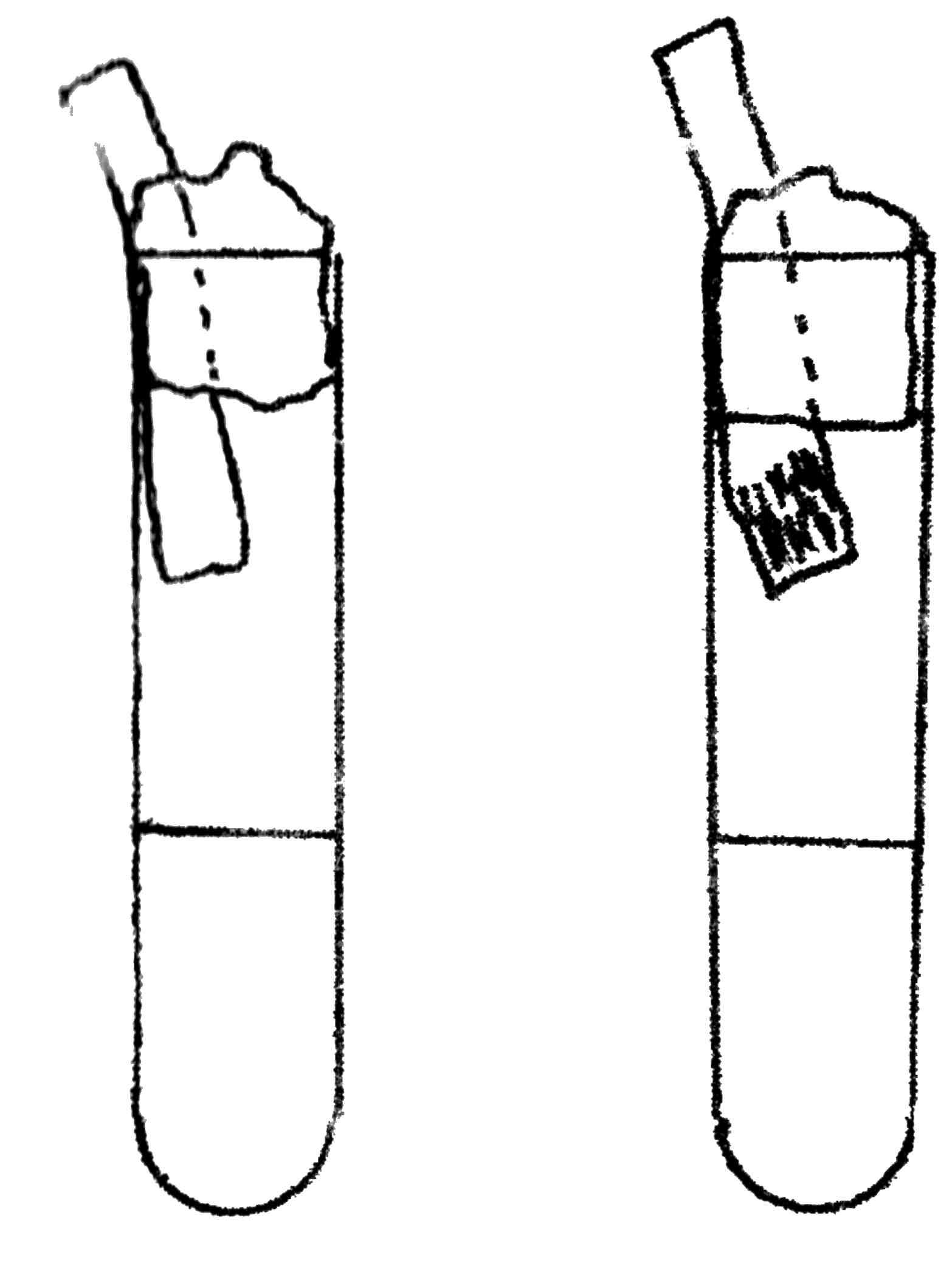
Рис. 31. Определение протеолитических свойств бактерий: изменение цвета индикаторной бумаги при образовании сероводорода, аммиака, индола – до посева (А), положительная реакция (Б)
в) обнаружение сероводорода. В пробирку с посевом помещают индикаторную полоску фильтровальной бумаги, смоченную раствором уксуснокислого свинца. При взаимодействии сероводорода и уксуснокислого свинца бумага чернеет за счет образования сернистого свинца.
3. Определение редуцирующей (восстанавливающей) способности
Для этой цели используют метиленовую синь, тионин, лакмус, нейтральный красный и др. К МПА и МПБ прибавляют раствор одного из указанных красителей. При наличии у бактерий редуцирующей способности среда обесцвечивается. Наиболее широкое применение имеет среда Ротбергера (МПА с 1% глюкозы и несколькими каплями насыщенного раствора нейтрального красного). При положительной реакции красный цвет среды переходит в желтый.
4 Определение фермента каталазы
Каталаза разлагает перекись водорода на воду и молекулярный кислород. Для обнаружения каталазы на поверхность 24-часовой культуры на скошенном МПА наливают 1-2 мл 1%-ного раствора перекиси водорода. Появление пузырьков газа при наклонном положении пробирки регистрируется как положительная реакция. В качестве контроля следует параллельно исследовать культуру, заведомо содержащую каталазу.
5. Определение плазмокоагуляции
Является одной из наиболее надежных проб для выявления пато-генности стафилококков. Для ее постановки разливают по 1-2 мл стерильной плазмы, вносят бактериологической петлей культуру бактерии и помещают в термостат. Проверяют результаты через 30 мин, 2, 4 часа и на другой день. При положительной реакции происходит коагуляция (свертывание плазмы).
6. Определение ДНК-азы
7. Определение гемолитической способности.
Исследуемую культуру засевают на поверхность кровяного МПА. Для приготовления этой среды к 2%-ному расплавленному и охлажденному до 45°С МПА вносят 5% дефибринированной крови лошади, барана или кролика.
Культивирование проводится при 37°С в течение 24 – 48 часов.
Вокруг колоний микробов, вырабатывающих гемолизин, образуются зоны просветления вследствие растворения эритроцитов. Различают -гемолиз, когда колонии окружены зоной, окрашенной в зеленый цвет, и β-гемолиз при бесцветной зоне.
Задания для самостоятельной работы
1. Освоить методы определения биохимических свойств бактерий на демонстрационных микробных культурах. Определить каталазообразование у бактерий (на предметном стекле с агаровой культурой, в пробирке – с бульонной).
2. Продолжить выделение чистой культуры бактерий (3-й день исследования). Из колоний выделенных бактерий (кишечной палочки, стафилококка, вакцинного штамма сибиреязвенной палочки) приготовить мазки и окрасить их по Граму. Провести микроскопию. Из этой же колонии сделать пересев на МПА и МПБ.
3. Все полученные результаты внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. Культуральными свойствами бактерий называют:
А. Способность их ферментировать углеводы.
Б. Характер роста их на питательных средах.
В. Вызывать гибель лабораторных животных.
2. При выращивании бактерий на питательной среде с добавлением 10 % крови вокруг колоний образовались прозрачные зоны. Какими ферментативными свойствами обладает данный вид бактерий?
3. В какую из нижеперечисленных питательных сред засевают микробную культуру для выявления сахаролитических свойств?
Б. Свернутая кровяная сыворотка.
Г. На среды Гисса (цветной ряд).
4. Как определить выделение сероводорода, образовавшегося при выращивании бактерий, обладающих протеолитическими ферментами?
Б. Полоской индикаторной бумаги, пропитанной раствором щавелевой кислоты.
В. Полоской индикаторной бумаги, пропитанной раствором уксуснокислого свинца.
Г. Полоской розовой лакмусовой бумаги.
5. В какую из перечисленных питательных сред высевают микробную культуру для выявления протеолитических ферментов?
А. Кровяной мясо-пептонный агар.
Д. На среды Гисса (цветной ряд).
6. Как определить наличие аммиака, образующегося при выращивании бактерий, обладающих протеолитическими ферментами?
Б. Полоской индикаторной бумаги, пропитанной раствором уксуснокислого свинца.
В. Полоской индикаторной бумаги, пропитанной раствором щавелевой кислоты.
Читайте также:

