Посев вируса на культуру клеток
Обновлено: 05.10.2024
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
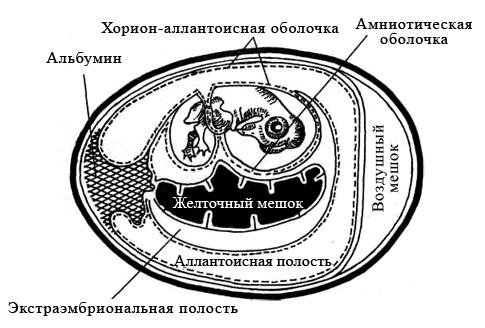
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
Посев на культуре клеток (ВПГ, ЦМВ) — не только выявляет вирус, но и даёт информацию о его активности (агрессивности). Анализ результатов посева на фоне лечения, позволяет делать заключение об эффективности проводимой терапии.
Вирус простого герпеса (ВПГ), или герпес, бывает двух видов: вирус простого герпеса первого типа (ВПГ-1) и вирус простого герпеса второго типа (ВПГ-2). Обе формы вируса — высококонтагиозны.
Основной путь передачи герпеса: воздушно-капельный, контактный, половой, внутриутробный, гемотрансфузионный, при пересадке органов. Первичная герпевирусная инфекция и реактивация инфекции (в гораздо меньшей степени) в период беременности могут вызывать патологию беременности или внутриутробное инфицирование плода. Причиной внутриутробного инфицирования плода чаще бывает ВПГ-2, но не исключено заражение и ВПГ-1. Кроме того, роженицы могут передать вирус новорождённому при родах, что может вызвать неонатальный герпес — редкое заболевание с летальным исходом.
- высыпание на губах и слизистой оболочке рта группы скученных мелких пузырьков (везикул), наполненных прозрачным содержимым;
- воспалённость, отёчность кожи и слизистой в области высыпаний.
ВПГ-2 — относится к числу инфекций, передаваемых половым путем, которые могут вызвать генитальный герпес.
Распространяется, главным образом, половым путём при кожном контакте.
Вирус генитального герпеса Herpes simplex 2 типа поражает, преимущественно, покровные ткани (эпителий) шейки матки у женщин и полового члена у мужчин, вызывая боль, зуд, появление прозрачных пузырьков (везикул) на месте которых образуются эрозии/язвочки. Однако при оральных контактах возможно поражение покровной ткани губ и ротовой полости.
HSV и беременность
У беременных: вирус может проникнуть через плаценту в плод и вызвать у него врождённые дефекты. Герпес может вызвать также самопроизвольный аборт или преждевременные роды. Но особенно вероятна опасность заражения плода в процессе родов, при прохождении через шейку матки и влагалище при первичной или рецидивирующей генитальной инфекции у матери. Такое заражение на 50% повышает смертность новорождённых или развитие у них тяжёлых повреждений головного мозга или глаз. При этом определённый риск инфицирования плода существует даже в тех случаях, когда у матери ко времени родов отсутствуют какие-либо симптомы генитального герпеса. Ребёнок может заразиться и после рождения, если у матери или у отца имеются поражения, во рту, или получить вирус с материнским молоком.
Цитомегаловирус (или ЦМВ) — это разновидность из группы герпесвирусов (Herpesvirus), относящаяся к роду Cytomegalovirus подсемейства 3-herpesviridae. Встречается везде. Статистика частоты встречаемости очень вариативна — вероятно, из-за того, что у значительной массы носителей вируса заболевание протекает бессимптомно. Способов полного излечения от герпеса пока нет, т.е. заражённый человек остается носителем возбудителя на всю жизнь.
ЦМВ — это инфекция, сходная с герпесом или ветрянкой, только с гораздо более серьёзными и неожиданными последствиями — от повреждения внутренних органов до необратимых изменений ЦНС. Определить данное заболевание на ранних стадиях проблематично, его точный инкубационный период пока неизвестен. Проявления инфекции могут быть приняты за воспаление органов мочеполовой системы, обычные недомогания типа ОРВИ (острая респираторная вирусная инфекция) и прочие обычные болезни. Весьма часто ЦМВ приводит к возникновению многочисленных воспалений сразу в нескольких внутренних органах.
При беременности вирус не всегда передаётся от больной матери к ребёнку. Но если инфицирование ЦМВ произошло в период беременности или болезнь усилилась, то вероятность передачи заболевания плоду значительно возрастает.
Цитомегаловирусная инфекция передаётся половым путем, через слюну, материнское молоко, при беременности (от матери к ребёнку), через общую мочалку, полотенце, посуду и т.д.
Наиболее часто цитомегаловирусная инфекция проявляется как острая респираторно-вирусная инфекция. От больных поступают жалобы на общее недомогание, насморк, быструю утомляемость. Происходит увеличение и воспаление слюнных желёз, сопровождающееся беловатым налётом на языке и дёснах, а так же обильным выделением слюны.
У женщин и мужчин поражение мочеполовой системы даёт симптомы хронического не специфического воспаления. В этом случае, если не обнаружена вирусная природа патологии, лечение заболевания при помощи антибиотиков будет малоэффективно.
Самые серьёзные и опасные осложнения цитомегаловируса — это патология беременности, плода и новорождённого. Если произошло инфицирование плода во время беременности, то риск развития этой патологии будет максимальным. Однако, не стоит забывать, что проблемы могут возникнуть так же у беременных при активации латентной ЦМВ-ифекции, когда вирус попадает в кровь, впоследствии заражая плод. Согласно статистике, ЦМВ является наиболее частой причиной не вынашивания беременности. Внутриутробная цитомегаловирусная инфекция является причиной поражений центральной нервной системы (тугоухость и отставание в умственном развитии). В 20–30% случаев заканчивается смертью ребёнка.
Преимущества посева на культуре клеток
Главным преимуществом посева на культуре клеток является высокая точность исследования в случае положительного результата. Кроме того, по культуре клеток можно определять, вирусом герпеса какого типа — первого, второго или ЦМВ, была вызвана инфекция. Если результат лабораторной диагностики на культуре клеток окажется у вас положительным, можете быть уверенным, что у вас вирус герпеса.
Основным недостатком посева на культуре клеток является высокий процент ложноотрицательных результатов. Поскольку для посева вирус должен находиться в активном состоянии, если герпетический пузырёк или язвочка маленького размера или уже начинает заживать, то для нормального исследования количества вируса может быть недостаточно. При проведении диагностики позднее, чем через 48 часов после появления симптомов, высока угроза ложноотрицательного результата. Посев вируса на культуре клеток бывает еще менее достоверным при диагностике во время рецидивов (положительные результаты получают лишь в 30% случаев повторных вспышек герпеса).
Подготовка
Специальная подготовка не требуется. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приёма пищи. Кровь берется в пробирку с ЭДТА.
Сбор мочи
Накануне сдачи анализа не рекомендуется употреблять в пищу овощи и фрукты, которые могут изменить цвет мочи (свёкла, морковь, клюква и т.п.), принимать диуретики.
Перед сбором мочи необходимо провести тщательный гигиенический туалет внешних половых органов. Собирают строго утреннюю порцию мочи, выделенную сразу же после сна. Женщинам не рекомендуется сдавать анализ мочи во время менструации; во избежание попадания в мочу выделений из влагалища, рекомендуется ввести во влагалище тампон.
За сутки до сдачи исключить приём алкоголя и половой акт.
Материал собирается в стерильный пластиковый контейнер. Собирается средняя порция утренней мочи. При первом утреннем мочеиспускании небольшое количество мочи (первые 3–5 сек) выпустить в унитаз, а затем, не прерывая мочеиспускания, собрать среднюю порцию мочи в чистую ёмкость. Продолжить мочеиспускание в унитаз. Ёмкость закрыть, промаркировать.
Нужно постараться максимально сократить срок доставки материала в лабораторию. Длительное хранение приводит к размножению бактерий.
Доставить контейнер с мочой в медицинский офис необходимо как можно скорее с момента взятия биоматериала. Моча в стерильном пластиковом контейнере для посева стабильна не более 2 часов при температуре 18–20°С, не более 6 часов при температуре хранения 4–8°С.
- желательно собирать утром;
- зубы не чистить, не есть как минимум 4 часа;
- слюна собирается в стерильный контейнер.
Сдача мазка не допускается в дни менструации. За трое суток до взятия необходимо отказаться от применения вагинальных свечей, тампонов, спермицидов, за сутки исключить половые контакты. Нельзя спринцеваться накануне проведения обследования. После УЗИ-исследования с применением вагинального датчика, кольпоскопии, биопсии должно пройти не менее 48 часов.
Мазок из урогенитального тракта мужчины
За 1–2 суток до взятия мазка, необходимо исключить половые контакты. Нельзя мочиться в течение 1,5–2 часов до процедуры.
Интерпретация результатов
Результат исследования выдаётся в процентах. В норме данные вирусы на культуре клеток не обнаруживаются.

- Анализы
- Беременность и роды
- Беременность обзор
- Бесплодие и репродуктивный статус
- Бессонница и расстройства сна
- Болезни желудочно-кишечного тракта
- Болезни легких и органов дыхания
- Болезни органов кровообращения
- Болезни щитовидной железы
- Боль в спине
- Восстановительная медицина
- Генитальный герпес
- Гинекология
- Головная боль
- Грипп
- Депрессия
- Детская онкология
- Детские болезни
- Детское развитие
- Заболевания молочных желез
- Здоровое питание. Диеты
- Здоровье и душевное равновесие
- Из истории болезни
- Иммунология
- Импотенция (эректильная дисфункция)
- Инфекции передаваемые половым путем
- Кардиология
- Кровеносная и лимфатическая система
- Лейкемии
- Лечение рака
- Лимфогранулематоз
- Маммология
- Медицина в спорте
- Менопауза
- Микробиология, вирусология
- Педиатрия (детские болезни)
- Проблемная кожа
- Путь к себе
- Рак желудка
- Рак молочной железы (рак груди)
- Рак ободочной, прямой кишки и анального канала
- Рак предстательной железы (рак простаты)
- Рак тела матки
- Рак шейки матки
- Рак яичников
- Сахарный диабет
- Сексология и психотерапия
- Сексуальная жизнь
- Современная контрацепция
- Урология
- Уход за кожей
- Факты о здоровом старении
- Химиoтерапия
- Школа здоровья
- Эндокринология
| Диагностика генитального герпеса |
| Автор: http://www.eurolab.ua/ |
| 27 Марта 2011 |
|
Диагностика при наличии симптомов: посев вируса на культуре клеток Симптомы герпеса у разных людей могут значительно отличаться. Если человек испытывает признаки инфекции, мы рекомендуем ему пройти посев на культуре клеток для выявления герпесвируса (мазок с высыпаний) на протяжении 48 часов с момента их возникновения. Результаты обычно бывают готовы через неделю. Главным преимуществом посева на культуре клеток является высокая точность исследования в случае положительного результата. Кроме того, по культуре клеток можно определять, вирусом простого герпеса какого типа – первого или второго, была вызвана инфекция. Если результат лабораторной диагностики на культуре клеток окажется у вас положительным, можете быть уверенным, что у вас вирус герпеса. Основным недостатком посева на культуре клеток является высокий процент ложноотрицательных результатов. Поскольку для посева вирус должен находиться в активном состоянии, если герпетический пузырек или язвочка маленького размера или уже начинает заживать, то для нормального исследования количества вируса может быть недостаточно. При проведении диагностики позднее, чем через 48 часов после появления симптомов, высока угроза ложноотрицательного результата. Посев вируса на культуре клеток бывает еще менее достоверным при диагностике во время рецидивов (положительные результаты получают лишь в 30% случаев повторных вспышек герпеса). Введение к анализам крови Анализы крови могут использоваться в случаях, когда человек не имеет видимых симптомов, но беспокоится о наличии у себя герпеса. Анализы крови выявляют не вирус непосредственно, а антитела к нему (иммунный ответ организма), которые могут находиться в крови. Существует множество доступных анализов крови, но большинство из них не достаточно точны, поскольку не могут отличить антитела к ВПГ 1-го типа и ВПГ 2-го типа. Поэтому достаточно высока вероятность ложноположительного результата, особенно для ВПГ-2. Когда человек контактирует с герпесом, его иммунная система реагирует на это, вырабатывая антитела для борьбы с вирусом: иммуноглобулины класса IgG и класса IgM. Анализы крови могут выявлять эти антитела, поскольку самого вируса в крови нет. IgG повышаются вскоре после инфицирования и остаются в крови на всю жизнь. IgM являются первыми иммуноглобулинами, которые возникают сразу после контакта с инфекцией, но через определенное время их уровень снижается. Тесты на IgM не рекомендуются по трем основным причинам: Многие полагают, что в случае выявления во время теста IgM, это будет говорить о том, что герпесом они заразились недавно. Тем не менее, исследование показывает, что IgM могут повышаться у трети тестируемых во время повторных вспышек герпеса, и одновременно отсутствовать у половины людей, которые недавно заразились герпесом, но выявили его во время посева вируса на культуре клеток. Таким образом, тесты на IgM могут давать ложные результаты, а также недостоверную информацию о том, как и когда человек заразился ВПГ. По этой причине мы не рекомендуем использовать анализы крови для определения сроков давности инфицирования. К сожалению, большинство людей с диагностированным герпесом не смогут выяснить, как давно они имеют эту инфекцию. Кроме того, тесты на IgM не могут точно дифференцировать антитела к ВПГ-1 и ВПГ-2, что легко приводит к ложноположительным результатам по ВПГ-2. Это важно в свете того, что большинство взрослого населения США имеют антитела к ВПГ-1, который является основной причиной простуды на губах. Человек, имеющий антитела к ВПГ-1, может получить ложноположительный результат теста на ВПГ-2. Точные анализы крови определяют антитела к иммуноглобулину IgG. В отличие от теста на IgM, этот тест может точно определить разницу между ВПГ-1 и ВПГ-2. Недавнее исследование подтверждает эту информацию: лаборатории, использовавшие для выявления герпеса тесты, не определяющие антитела к иммуноглобулину IgG, имели высокий процент ложноположительных результатов к антителам ВПГ-2 (от 14 до 88% тестов показывало, что проба крови была позитивной к ВПГ-2) в пробах, которые на самом деле были положительными только для антител к ВПГ-1. Однако все лаборатории, использующие тесты на иммуноглобулины класса G, в подобных случаях показывали, что пробы отрицательны к ВПГ-2. Проблема в данном случае заключается в том, что время, необходимое для того, чтобы антитела к IgG достигли количества, при котором они могли бы быть обнаружены, отличается для каждого отдельного человека. У одного это займет несколько недель, а у другого – несколько месяцев. Поэтому, даже если тест оказался точным, человек может получить ложноотрицательный результат, если анализы были проведены вскоре после его контакта с вирусом. Для наиболее точных результатов рекомендуется подождать 12-16 недель с момента последнего возможного контакта с вирусом, прежде чем сдавать анализы для определения типа ВПГ, чтобы антитела к IgG достигли количества, при котором они могли бы быть обнаружены. Точные анализы крови На данный момент существует 4 анализа крови на основании IgG, одобренные Управлением по контролю над продуктами и лекарствами (США). Они могут точно определять наличие герпеса. Как любой другой анализ крови, эти тесты не могут определить, является ли инфекция оральной или генитальной. Тем не менее, поскольку в большинстве случаев генитальный герпес вызывается ВПГ-2, положительный результат на антитела к вирусу герпеса 2-го типа зачастую свидетельствует о генитальном герпесе. Вы можете спросить об этих тестах у своего врача, указав их точное название. Точными анализами крови, определяющими тип вируса, являются: Другие виды лабораторной диагностики Тесты методом полимеразной цепной реакции (ПЦР) являются очень чувствительными (то есть они хорошо определяют вирус, если он присутствует в пробе). В будущем тесты методом ПЦР должны заменить посев вируса на культуре клеток, но на данный момент последние анализы более распространены, а ПЦР тесты недоступны широкому потребителю из-за своей высокой цены. Существуют и другие тесты на герпес, но они имеют серьезные ограничения. Некоторые из них, например, тесты на антигены к вирусу, хотя и являются достаточно точными, пока недоступны широкому потребителю, кроме того, их точность снижается, когда пузырьковые высыпания начинают заживать. Другие, например, проба Тцанка, требуют обязательного звонка в лабораторию для того, чтобы узнать результат анализа от врача или лаборанта.
Рис. 2. Заражение куриного эмбриона на ХАО через естественную воздушную камеру Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса. Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2-0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 4, а). В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 4, б).
, Рис. 4. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Рис. 5. Заражение куриного эмбриона в амниотическую полость (по Николау и др.) Первый вариант. Иногда путь заражения осуществляется на горизонтально укрепленном в штативе эмбрионе, при этом зародыш находится внизу, а желток - над ним. Отверстие в скорлупе закрывают каплей расплавленного парафина. Рис. 7. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)
Рис. 8. Отсасывание аллантоисной жидкости (по Николау) Для получения стенки желточного мешка как вируссодержащего материала желток извлекают на чашку Петри, стенку его разрезают ножницами и отполаскивают от содержимого в физиологическом растворе. Тело зародыша извлекают, удерживая его за шею (рис. 10). Читайте также:
|













