Презентация микроклональное размножение растений
Обновлено: 05.10.2024
Презентация на тему: " Лекция 6. Методы клонального микроразмножения 1. Клональное микроразмножение растений 2.Получение безвирусного посадочного материала Клональное микроразмножение." — Транскрипт:
1 Лекция 6. Методы клонального микроразмножения 1. Клональное микроразмножение растений 2. Получение безвирусного посадочного материала Клональное микроразмножение растений: Учебно-методическое пособие / О.А. Тимофеева, Ю.Ю. Невмержицкая. – Казань: Казанский университет, – 56 с.
2 1. Клональное микроразмножение растений Клональное микроразмножение – это использование техники in vitro для быстрого получения неполовым путем растений, идентичных исходному. По своей сути микроклональное размножение аналогично вегетативному типу размножения растений с той лишь разницей, что оно протекает в пробирке в условиях in vitro, где из клеток изолированных тканей в итоге можно получить достаточно большое количество растений. Важным условие успеха являются условия асептики и соответствующие питательные добавки. !
4 Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения: высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104 – для хвойных); возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала; получение генетически однородного посадочного материала; освобождение растений от вирусов за счет использования меристемной культуры; ускорение перехода растений от ювенильной к репродуктивной фазе развития; сокращение продолжительности селекционного процесса; получение растений, трудно размножаемых традиционными способами; возможность автоматизации процесса выращивания.
5 Области применения клонального микроразмножения в селекции для поддержания и размножения растений с уникальными генотипами; для быстрого размножения новых и уже существующих сортов; массового получения оздоровленного посадочного материала у растений, подверженных вирусным заболеваниям; для быстрого размножения некоторых гетерозиготных садовых культур, обычно размножающихся семенами и расщепляющихся при скрещивании; для быстрого клонального размножения in vitro лучших экземпляров взрослых древесных растений, разведение и селекция которых осуществляется медленно вследствие длительности процесса полового размножения; для сохранения редких и исчезающих видов.
6 Основное требование к объектам, которые используются для микроклонального размножения, это сохранение генетической стабильности на всех этапах онтогенеза. Этому требованию удовлетворяют апексы и пазушные почки стеблевого происхождения.
7 Для микроклонального размножения также могут быть использованы меристематические ткани и изолированные органы, способные давать адвентивные почки. Такие почки могут развиваться на корнях, побегах и листьях. Адвентивные побеги побеги, которые образуются на любом участке стебля, корня или листа. Адвентивные почки – почки, образующиеся на любой части растения, кроме пазухи листа.
8 Например, африканская фиалка (сенполия) размножается с помощью адвентивных почек, образующихся на листовых черешках. Разработан метод, с помощью которого in vitro в результате использования отрезков размером 2 мм, можно получить до проростков из каждого черешка.
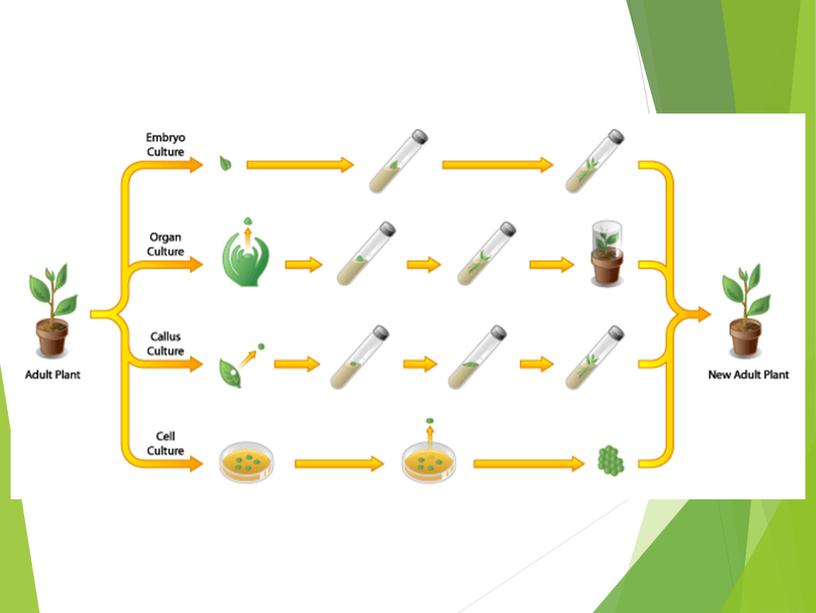
9 Методы клонального микроразмножения (в зависимости от автора, могут по-разному интерпретироваться). активация развития уже существующих в растении меристем (апекса стебля, пазушных и спящих почек, интеркалярных зон стебля); индукция адвентивных почек непосредственно тканями эксплантатттт; индукция соматического эмбриогенеза; дифференциация адвентивных почек в первичной и пересадочной каллусной тканях.
10 Схема клонального микроразмножения растений 1 – активация развития меристемы; 2 – образование адвентивных почек непосредственно на первичном экспланте; 3 – индукция соматического эмбриогенеза в каллусе и суспензионной культуре; 4 – образование адвентивных почек в каллусной ткани: а – получение стерильной культуры; б – формирование микро побегов и развитие соматических эмбриоидов; в – укоренение микро побегов и образование искусственных семян; г – перевод растений– регенератов в тепличные условия с последующей высадкой в поле
11 1. Основной метод, используемый при клональном микроразмножении растений, – это активация развития уже существующих в растении меристем. Он основан на снятии явления апикального доминирования, что может быть достигнуто следующими путями: а) удалением верхушечной меристемы стебля и последующим микро черенкованием побега на без гормональной среде; б) добавлением в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов. Для этого используют БАП или кинетин, а также 2- изопентениладенин и зеатин.
12 Полученные побеги отделяют от первичного материнского эксплантатттт и вновь культивируют на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков.
13 Схема клонального микроразмножения растений методом активации развития существующих меристем (I путь), индукции возникновения адвентивных почек на экспланте (II путь): 1 – выбор исходного эксплантатттт; 2 – получение стерильной культуры; 3 – образование адвентивных почек непосредственно на первичном экспланте; 4 – рост почек и формирование микро побегов; 5-6 – размножение микро побегов (черенкование); 7 – депонирование растений- регенератов при пониженной температуре; 8 – перевод растений в тепличные условия; 9 – высадка растений- регенератов в почву.
14 Схема размножения растений методом активации пазушных меристем: 1 – путем удаления верхушечной меристемы: 2 – добавлением гормонов в среду. 1 2
15 В настоящее время метод активации развития существующих в растении меристем широко используется в производстве безвирусного посадочного материала -технических (сахарная свекла, хмель, табак, топинамбур, стахис) и овощных культур (томаты, картофель, огурец, перец, тыква, спаржа и др.), а также для размножения культур промышленного цветоводства (гвоздика, хризантема, роза, гербера), тропических и субтропических растений (рододендрон, азалия, камелия, чай и др.), плодовых и ягодных культур (яблоня, слива, вишня, груша, виноград, малина, смородина, крыжовник и др.) и древесных растений (тополь, ива, ольха, береза, рябина, секвойя, туя, можжевельник и др.).
16 Для картофеля технология клонального микроразмножения поставлена на промышленную основу. Применение метода активации развития существующих в растении меристем позволяет получать из одной меристемы картофеля более 105 растений в год, причем технология предусматривает получение в пробирках микро клубней – ценного безвирусного семенного материала.
17 Микроклональное размножение картофеля: 1 - микро растение картофеля; 2 – размножение картофеля in vitro; 3 – микро клубни безвирусного картофеля
18 2 метод – индукция возникновения адвентивных почек непосредственно тканями эксплантатттт. Он основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и, таким образом, регенерировать целые растения. Образования адвентивных почек можно добиться почти из любых органов и тканей растения (изолированного зародыша, листа, стебля, семядолей, чешуек и донца луковицы, сегментов корней и зачатков соцветий).
19 Этот процесс, как правило, происходит на питательных средах, содержащих только цитокинины или цитокинины в сочетании с ауксинами в соотношении 10 : 1 или 100 : 1. В качестве ауксина наиболее часто используют ИУК или НУК.
20 Данным методом были размножены: -Многие луковичные цветочные растения (нарциссы, лилии, гиацинт, гладиолусы, тюльпаны). Из луковичных вычленяются чешуи, сегменты базальной части донца луковиц, экспланты листьев. -Овощные культуры: лук, чеснок – из верхушечной меристемы, ткани донца луковиц; томаты – из апикальных или пазушных меристем; -Представители рода Brassicа (капуста цветная, кочанная, брюссельская, листовая, брокколи ) из сегментов гипокотиля, семядолей, листьев); -Цветочные культуры: петуния– из сегментов корней; глоксиния, фиалки – из сегментов листовых пластинок; -Некоторые представители древесных растений – из изолированных зрелых и незрелых зародышей.
21 3 метод - индукция соматического эмбриогенеза Основывается на дифференциации зародыше подобных структур из соматических клеток, которые по своему внешнему виду напоминают зиготические зародыши. В настоящее время данное явление используется для размножения большинства растений из семейств орхидных и рутовых, некоторых представителей злаковых (пшеница, ячмень), люцерны, редиса, винограда, а также некоторых видов древесных пород (осина, эвкалипт, дуб, ель обыкновенная).
22 Соматический эмбриогенез Это единственный возможный способ размножения гвинейской масличной пальмы (Elaeis guineensis), масло которой широко используется при производстве маргарина и пищевого масла. Так же можно размножать и пшеницу Проросток пшеницы из соматического эмбриоида
23 Соматические зародыши проходят 3 стадии развития: глобулярную, сердцевидную, торпедо видную и в конечном итоге развиваются в проросток.
24 Недостатки метода Соматический эмбриогенез является достаточно трудоемкой операцией, так как не всегда удается реализовать свойственную клеткам тотипотентность (способность клетки путем деления дать начало любому клеточному типу организма). Преимущества метода Сокращение последнего этапа клонального микроразмножения, требующего подбора специальных условий укоренения и адаптации пробирочных растений, т.к. соматические зародыши представляют собой полностью сформировавшиеся растеньица. При использовании соответствующей техники капсулирования из этих эмбриоидов можно получить искусственные семена.
25 4 метод - дифференциация адвентивных почек в первичной и пересадочной каллусной ткани. Редко используется для получения посадочного материала in vitro. Это связано с тем, что при периодическом пересаживании каллусной ткани на питательную среду наблюдаются явления, нежелательные при микроразмножении: -изменение плоидности клеток, -структурные перестройки хромосом и накопление генных мутаций, -потеря морфогенетического потенциала культивируемыми клетками. Данный метод целесообразно применять лишь к тем растениям, для которых показана генетическая стабильность каллусной ткани, а вариабельность между растениями- регенерантами не превышает уровня естественной изменчивости. К таким растениям можно отнести амариллис, томаты, спаржу, некоторые древесные породы и другие культуры.
26 Дифференциация адвентивных почек в каллусной ткани Растение-регенерант твердой пшеницы Каллус - особая ткань, состоящая из недифференцированных клеток Каллус на питательной среде Образование побегов из каллусной ткани на питательной среде.
27 Процесс клонального микроразмножения можно разделить на несколько этапов: 1–й этап 2–й этап 3–й этап 4–й этап Выбор растения донора, изолирование и стерилизация эксплантатттт, создание условий для его роста на питательной среде in vitrо Собственно размножение, осуществляемое одним из четырех перечисленных ранее способов Укоренение размноженных побегов Высадка растений–регенератов в почву.
28 1–й этап Выбор растения донора, изолирование и стерилизация эксплантатттт, создание условий для его роста на питательной среде in vitrо Требования Получения хорошо растущей стерильной культуры. Используют среду МС, с различными биологически активными веществами и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. Продолжительность первого этапа – от 1 до 2 месяцев.
29 2–й этап Собственно размножение, осуществляем ое одним из четырех перечислен- ных ранее способов Требования Используют питательную среду МС с оптимальным соотношением и концентраций цитокининов (БАП мг/л) и ауксинов (ИУК и НУК - до 0,5 мг/л). Не допускается культивирование растительных тканей в питательных средах с повышенным содержанием цитокининов (10 мг/л), т.к. происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к формированию растений с измененной морфологией.
30 3–й этап Укоренение размножен- ных побегов Требования Замена основного состава среды. Уменьшение в 2-4 раза концентрации минеральных солей в среде МС, снижение концентрации сахара до 0,5–1 % и полное исключение цитокининов (оставляют лишь ауксины). В качестве стимулятора корнеобразования используют ИМК, ИУК или НУК. Укоренение микро побегов проводят двумя способами: - выдерживание микро побегов в течение 2–24 ч в стерильном концентрированном растворе ауксина (20–50 мг/л) с последующим их культивированием на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка); - культивирование микро побегов в течение 3–4 недель непосредственно на питательной среде, содержащей ауксин в невысоких концентрациях (1–5 мг/л).
31 В последнее время предложены методы укоренения пробирочных растений в условиях гидропоники и аэропоники. Эти методы позволяют значительно упростить этап укоренения и одновременно получать растения, адаптированные к естественным условиям. ; ;
32 4–й этап Высадка растений– регенератов в почву. Требования Время для пересадки пробирочных растений – весна или начало лета. Растения с двумя–тремя листьями и хорошо развитой корневой системой вынимают из колб или пробирок пинцетом. Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85–90 °С в течение 1–2 ч. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20–22 °С), освещенностью не более 5 тыс. лк и влажностью 65– 90 %. Для лучшего роста растений создают условия искусственного тумана или горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами.
33 Процесс адаптации пробирочных растений к почвенным условиям является наиболее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений в почву наблюдается остановка в росте, опадение листьев и их гибель. Это связано: 1. С нарушением деятельности устьичного аппарата, вследствие чего происходит потеря большого количества воды. 2. У некоторых растений в условиях in vitro не происходит образования корневых волосков, что приводит, в свою очередь, к нарушению поглощения воды и минеральных солей из почвы.
34 Пробирочные растения маклеи сердцевидной перед высадкой в рулоны Пробирочные растения маклеи сердцевидной высаженные в рулоны с торфом Растения маклеи сердцевидной высаженные в вегетационные сосуды Возможные варианты адаптации растений- регенератов
35 Целесообразно на третьем и четвертом этапах клонального микроразмножения применять искусственную микоризацию растений (для микотрофных). При разработке методов клонального микроразмножения растений необходимо учитывать влияние генетических, физиологических, гормональных и физических факторов. Методика, разработанная для определенного клона одного вида не всегда может быть применена для размножения других представителей этого вида и тем более растений другого вида !
36 Высокая регенерационная способность, морфогенетический потенциал Двудольные: пасленовые, крестоцветные, сложноцветные. Однодольные, хорошо размножающиеся вегетативно. Зрелые зародыши, 20–30- дневные проростки или различные их части (ювенильный материал). Ткани и органы, изолированные в момент вегетации растений. Низкая регенерационная способность, морфогенетический потенциал Однодольные: злаковые. Древесные: хвойные. Ткани взрослых растений. Ткани и органы, изолированные в период глубокого и вынужденного покоя. На успех клонального микроразмножения влияют: возраст первичного эксплантатттт, размер эксплантатттт; гормональный баланс питательной среды; рН среды; интенсивность освещения, спектральный состав света, температурный режим и др. Укоренение побегов, размноженных in vitro Возраст первичного эксплантатттт
37 Клональное микроразмножение рассматривается как перспективный метод вегетативного размножения растений. Во многих странах мира биоиндустрия микроклонального размножения поставлена на промышленную основу и представлена десятками активно функционирующих предприятий. Например, во Франции 94 % всей продукции цветочных культур получают методом культуры изолированных тканей. В США около 100 коммерческих предприятий получают посадочный материал декоративных, овощных, полевых, плодовых и лесных культур методом клонального микроразмножения. Ведущим производителем оздоровленного посадочного материала цветочных растений является Голландия, а подвоев яблони, сливы и персика Италия.
38 2. Получение безвирусного посадочного материала Вирусные болезни – причина потери от 10 до 50 % урожая сельскохозяйственных культур, размножающихся вегетативно. Установлено, что соя и некоторые другие важные бобовые растения передают вирусы потомству даже при семенном размножении, в результате чего сорта постепенно отягощаются грузом вирусных инфекций. Наиболее эффективный для оздоровления от вирусов, вироидов и микроплазм способ – культивирование меристем стебля или органов стеблевого происхождения.
39 В основе используемого на практике явления лежит специфика строения точки роста растений. Дистальная ее часть, представленная апикальной меристемой, у разных растений имеет средний диаметр до 200 мкм и высоту от 20 до 150 мкм.
40 Размеры меристемных эксплантов, используемых для получения безвирусных растений, могут значительно различаться. Предпочтительно использовать предельно малый размер эксплантатттт (0,075–0,1 мм) и разработать оптимальные условия для получения жизнеспособных пробирочных растений. Если это невозможно, то рекомендуется дополнять культуру меристем термо- и хемотерапией. В этом случае предварительная обработка исходных растений сухим горячим воздухом или химическими агентами позволяет добиться оздоровления от вирусов при использовании меристемных эксплантов размером 0,3–0,8 мм.
41 Растения, подвергающиеся термотерапии, помещают в специальные термокамеры, где в течение первой недели повышают температуру до 37 °С путем ежедневного ее увеличения на 2 °С. Продолжительность термотерапии всецело зависит от особенностей вирусов и их термочувствительности. Если, например, для получения безвирусной гвоздики достаточно 12- недельного воздействия теплом, то для освобождения хризантемы от Б-вируса этот период более продолжителен. Помимо эффекта термотерапии, выявлено положительное воздействие высоких температур на точку роста и процессы морфогенеза некоторых цветочных культур (гвоздики, хризантемы, фрезии) в условиях in vitro. Термотерапия позволяет увеличить коэффициент их размножения на 50-60%, повысить адаптацию пробирочных высокий процент безвирусных маточных растений.
42 Оздоровленные применением меристемной культуры растения размножают далее обычными методами клонального микроразмножения. Важное место в этой работе принадлежит диагностике зараженных растений. Наиболее часто применяются методы ИФА и ПЦР.
43 Этапы получения пробирочных растений картофеля Питатель ная среда Посадка апикальной меристемы Проросток из меристемы Пробирочное растение из меристемы Пробирочное растение из меристемы после черенкования
44 44 Этапы получения безвирусного картофеля Рост меристемы картофеля в пробирке Ростки картофеля перед вычленением меристемы Черенкование побегов картофеля Растения картофеля перед высадкой в открытый грунт Растения картофеля в открытом грунте Растения картофеля in vitro
Свидетельство и скидка на обучение каждому участнику

- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Описание презентации по отдельным слайдам:


ТЕКСТ ТЕКСТ ТЕКСТ ТЕКСТ ТЕКСТ ТЕКСТ ТЕКСТ ТЕКСТ Биотехнология – это дисциплина, изучающая использования живых организмов, их систем и продуктов их жизнедеятельности для решения технологических задач, а так же возможности создания живых организмов с необходимыми свойствами методом генной инженерии.

Биотехнология Современная биотехнология – это наука и отрасль, развивающаяся в трех основных направлениях: Молекулярная биология и генетическая инженерия; Микробиология и микробиологическая промышленность; Культура клеток и тканей in vitro.

Биотехнология Направления биотехнологии применительно растительных объектов: Биотехнология производства культуры клеток, тканей и органов растений; Биотехнология микроклонального размножения особей; Генная инженерия; Банк in vitro и криоконсервация (сохранение генофонда растений)

Суть метода Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения — клонального микроразмножения (получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру). В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, то есть под влиянием внешнего воздействий давать начало целому растительному организму.

Микроклональное размножение Культура in vitro – выращивание клеток, тканей, органов на искусственной питательной среде в стерильных условиях при контролируемых физических факторах (свет, температура, влажность).

Когда используются методы размножения in vitro: Размножение редких сортов и гибридов растений; Для сохранения в культуре новых перспективных сортов, особенно полученных in vitro; Быстрое получение большого количества безвирусного материала с дальнейшей посадкой в грунт; Сохранение редких и исчезающих видов растений; Ускорение размножения в селекции древесных растений Микроклональное размножение

Преимущества метода Получение генетически однородного посадочного материала; Оздоровление растений от грибковых и бактериальных патогенов; Освобождение растений от вирусов за счет использования меристемной культуры; Высокий коэффициент размножения; Размножение растений, трудно размножаемых традиционными способами; Возможность проведения работ в течение всего года; Массовое производство растений на базе единичных экземпляров; Занимает малые площади.

Этапы клонального микроразмножения Введение в культуру in vitro (выбор растения донора, изолирование и стерилизация, высадка на питательную среду) Собственно микроразмножение путем: Стимуляция развития пазушных почек экспланта Микрочеренкование побега Стимуляции образования микроклубней и микролуковичек 3) Укоренение микропобегов 4) Адаптация растений к условиям in vitro (перенос растений в субстрат и климокамеру или в условия теплицы в почву.

Этапы клонального микроразмножения

Эффективность введения в культуру зависит от многих факторов: Тип стерилизующего вещества и время обработки Видовые и сортовые особенности растений Тип используемого экспланта Возраст и качество растительного материала Сезон проведения работ Подготовка и введение в культуру in vitro растительных тканей

Меристемы или образовательные ткани — обобщающее название для тканей растений, состоящих из интенсивно делящихся и сохраняющих физиологическую активность на протяжении всей жизни клеток, обеспечивающих непрерывное нарастание массы растения и предоставляющих материал для образования различных специализированных тканей (проводящих, механических и т. п.) Виды меристем




Латеральные (вторичные) меристемы

Техника безопасности Рабочее место следует держать в чистоте. Нельзя загромождать его посудой, бумагой и ненужными материалами. При обращении со стеклянной химической посудой и приборами необходимо соблюдать меры предосторожности. Стеклянную посуду следует держать осторожно, не сжимаю ее сильно пальцами. Все работы следует проводить в белом халате, чтобы избежать порчи одежды химическими реактивами и для соблюдения стерильности во время работы в ламинарном шкафу. Необходимо быть предельно внимательным при работе с хирургическими инструментами, так как при неосторожном с ними обращениями можно пораниться самому и трамвировать находящихся рядом.

СПАСИБО ЗА ВНИМАНИЕ!
Краткое описание документа:
Микроклональное размножение
Слайд 2.
Биотехнология – это дисциплина, изучающая использования живых организмов, их систем и продуктов их жизнедеятельности для решения технологических задач, а так же возможности создания живых организмов с необходимыми свойствами методом генной инженерии.
Слайд 3.
Современная биотехнология – это наука и отрасль, развивающаяся в трех основных направлениях:
- Молекулярная биология и генетическая инженерия;
- Микробиология и микробиологическая промышленность;
- Культура клеток и тканей in vitro.
Слайд 4.
Направления биотехнологии применительно растительных объектов:
- Биотехнология производства культуры клеток, тканей и органов растений;
- Биотехнология микроклонального размножения особей;
- Генная инженерия;
- Банк in vitro и криоконсервация (сохранение генофонда растений)
Слайд 5. Суть метода
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения — клонального микроразмножения (получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру).
В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, то есть под влиянием внешнего воздействий давать начало целому растительному организму.
Слайд 6.
Культура in vitro – выращивание клеток, тканей, органов на искусственной питательной среде в стерильных условиях при контролируемых физических факторах (свет, температура, влажность).
Слайд 7.
Когда используются методы размножения in vitro:
- Размножение редких сортов и гибридов растений;
- Для сохранения в культуре новых перспективных сортов, особенно полученных in vitro;
- Быстрое получение большого количества безвирусного материала с дальнейшей посадкой в грунт;
- Сохранение редких и исчезающих видов растений;
- Ускорение размножения в селекции древесных растений
Слайд 8.
- Получение генетически однородного посадочного материала;
- Оздоровление растений от грибковых и бактериальных патогенов;
- Освобождение растений от вирусов за счет использования меристемной культуры;
- Высокий коэффициент размножения;
- Размножение растений, трудно размножаемых традиционными способами;
- Возможность проведения работ в течение всего года;
- Массовое производство растений на базе единичных экземпляров;
- Занимает малые площади.
Слайд 9.
- Введение в культуру in vitro (выбор растения донора, изолирование и стерилизация, высадка на питательную среду)
- Собственно микроразмножение путем:
- Стимуляция развития пазушных почек экспланта
- Микрочеренкование побега
- Стимуляции образования микроклубней и микролуковичек
3) Укоренение микропобегов
4) Адаптация растений к условиям in vitro (перенос растений в субстрат и климокамеру или в условия теплицы в почву.
Слайд 11.
Эффективность введения в культуру зависит от многих факторов:
- Тип стерилизующего вещества и время обработки
- Видовые и сортовые особенности растений
- Тип используемого экспланта
- Возраст и качество растительного материала
- Сезон проведения работ
Слайд 12.
Меристемы или образовательные ткани — обобщающее название для тканей растений, состоящих из интенсивно делящихся и сохраняющих физиологическую активность на протяжении всей жизни клеток, обеспечивающих непрерывное нарастание массы растения и предоставляющих материал для образования различных специализированных тканей (проводящих, механических и т. п.)
Слайд 13. Апикальные меристемы
Апикальная меристема — группа меристематических (образовательных) клеток, организованных в ростовой центр, занимающая терминальное положение в стебле и обеспечивающая образование всех органов и первичных тканей побега.
Слайд 16. Латеральные (вторичные) меристемы
Латеральная меристема — группа меристематических (образовательных) клеток, располагающихся параллельно боковой поверхности того органа, в котором они находятся.
В стеблях, корнях (так называемых осевых органах) латеральные меристемы располагаются цилиндрическими слоями, имеющими вид колец на поперечных срезах.
Слайд 17. Техника безопасности при работе с микроклональным размножением.

Микроклональное размножение растений

Микроклональное размножение растений
ЦО: описать методы микроклонального размножения растений
Эксплант Группа клеток, отделенная от материнского организма

Группа клеток, отделенная от материнского организма. Используется в биологических исследованиях, связанных с микроклональным размножением растений. У двудольных растений, эксплантами могут являться, например, части гипокотилей, стеблей, корней, семядоли, пыльники и прочее. При культивировании эксплантов на питательных средах различного состава, можно наблюдать каллусогенез или органогенез (образование корней, побегов и пр.)
Области применения клонального микроразмножения в селекции для поддержания и размножения растений с уникальными генотипами; для быстрого размножения новых и уже существующих сортов; массового получения оздоровленного…

Области применения клонального микроразмножения
в селекции для поддержания и размножения растений с уникальными генотипами;
для быстрого размножения новых и уже существующих сортов;
массового получения оздоровленного посадочного материала у растений, подверженных вирусным заболеваниям;
для быстрого размножения некоторых гетерозиготных садовых культур, обычно размножающихся семенами и расщепляющихся при скрещивании;
для быстрого клонального размножения in vitro лучших экземпляров взрослых древесных растений, разведение и селекция которых осуществляется медленно вследствие длительности процесса полового размножения;
для сохранения редких и исчезающих видов.
Каллус Недифференцированные клетки, являющиеся тотипотентными и способными поэтому дать начало целому растению

Недифференцированные клетки, являющиеся тотипотентными и способными поэтому дать начало целому растению. Являются объектом генетической инженерии.
Тотипотентность клетки Свойство клетки под влиянием экзогенных воздействий давать начало целому растительному организму

Свойство клетки под влиянием экзогенных воздействий давать начало целому растительному организму
Адвентивные побеги Адвентивные побеги — побеги, которые образуются на любом участке стебля, корня или листа
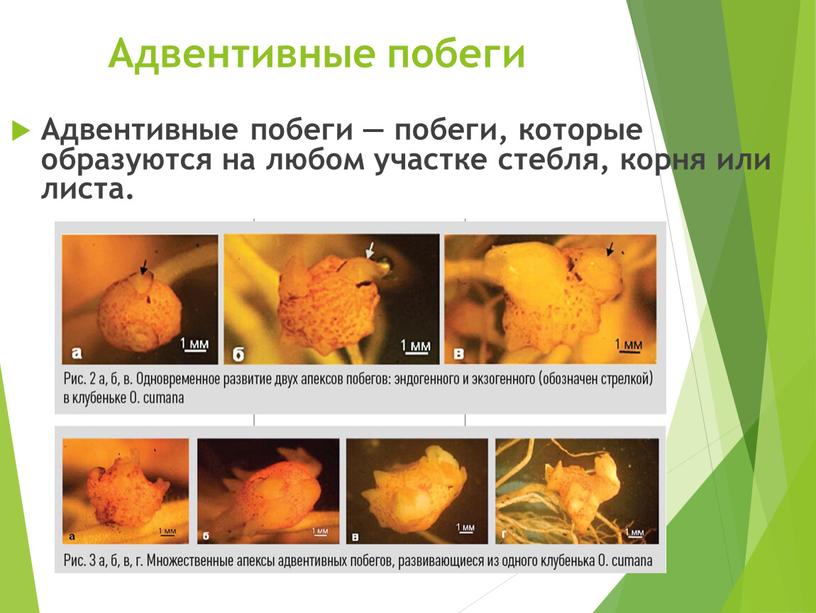
Адвентивные побеги — побеги, которые образуются на любом участке стебля, корня или листа.
Индукция соматического эмбриогенеза
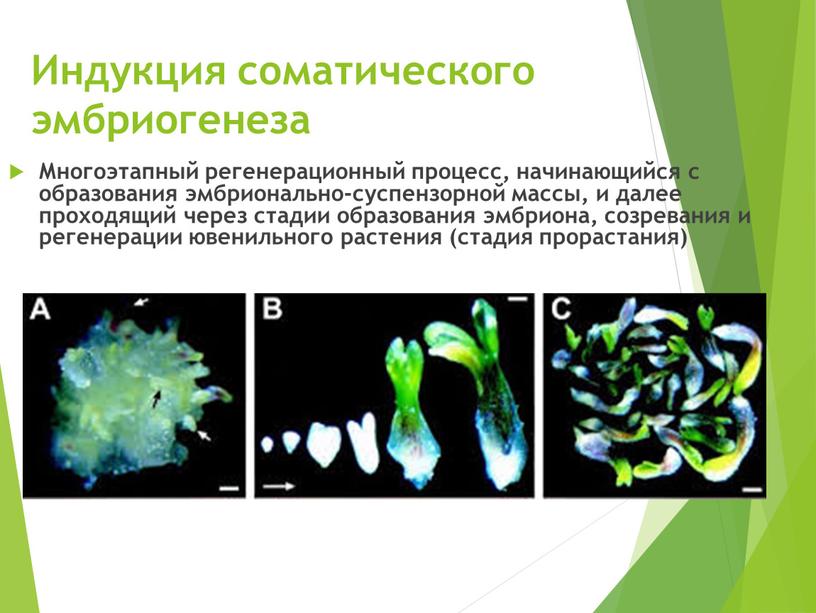
Индукция соматического эмбриогенеза
Многоэтапный регенерационный процесс, начинающийся с образования эмбрионально-суспензорной массы, и далее проходящий через стадии образования эмбриона, созревания и регенерации ювенильного растения (стадия прорастания)
Методы микроклонального размножения

Методы микроклонального размножения
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному.
В основе получения таких растений лежит способность соматических клеток растений полностью реализовать свой потенциал развития, т.е. свойство тотипотентности.
Первый и основной метод – активизация пазушных меристем
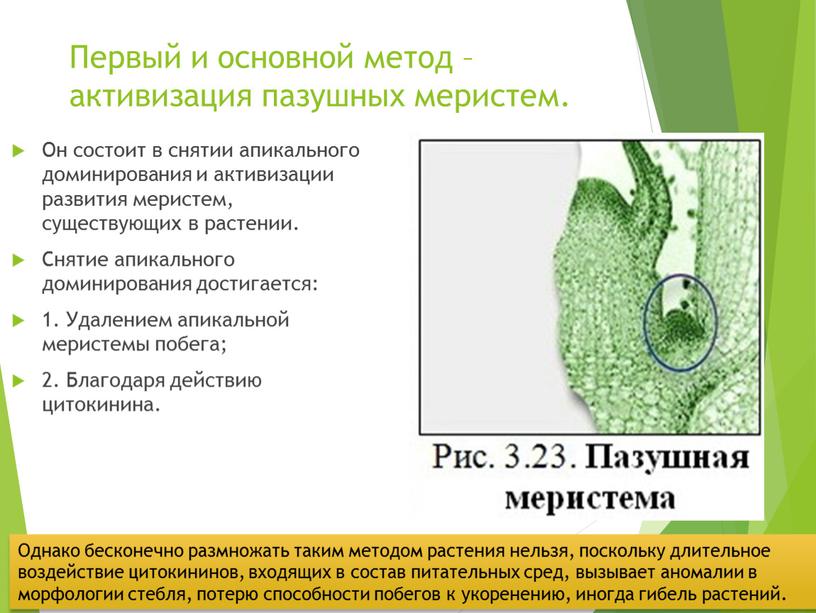
Первый и основной метод – активизация пазушных меристем.
Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении.
Снятие апикального доминирования достигается:
1. Удалением апикальной меристемы побега;
2. Благодаря действию цитокинина.
Однако бесконечно размножать таким методом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда гибель растений.
Метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис

Метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис. 3.24.
Презентация микроклональное размножение
Презентация микроклональное размножение
Преимущества получение генетически однородного посадочного материала; освобождение растений от вирусов за счет использования меристемной культуры; высокий коэффициент размножения сокращение продолжительности селекционного процесса; ускорение перехода растений…

получение генетически однородного посадочного материала;
освобождение растений от вирусов за счет использования меристемной культуры;
высокий коэффициент размножения
сокращение продолжительности селекционного процесса;
ускорение перехода растений от ювенильной к репродуктивной фазе развития;
размножение растений, трудно размножаемых традиционными способами;
возможность проведения работ в течение всего года;
возможность автоматизации процесса выращивания.
Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения: высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104…

Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения:
высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104 – для хвойных);
возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
получение генетически однородного посадочного материала;
освобождение растений от вирусов за счет использования меристемной культуры;
ускорение перехода растений от ювенильной к репродуктивной фазе развития;
сокращение продолжительности селекционного процесса;
получение растений, трудно размножаемых традиционными способами;
возможность автоматизации процесса выращивания.
Процесс клонального микроразмножения можно разделить на несколько этапов: 1 – й этап 2–й этап 3–й этап 4–й этап
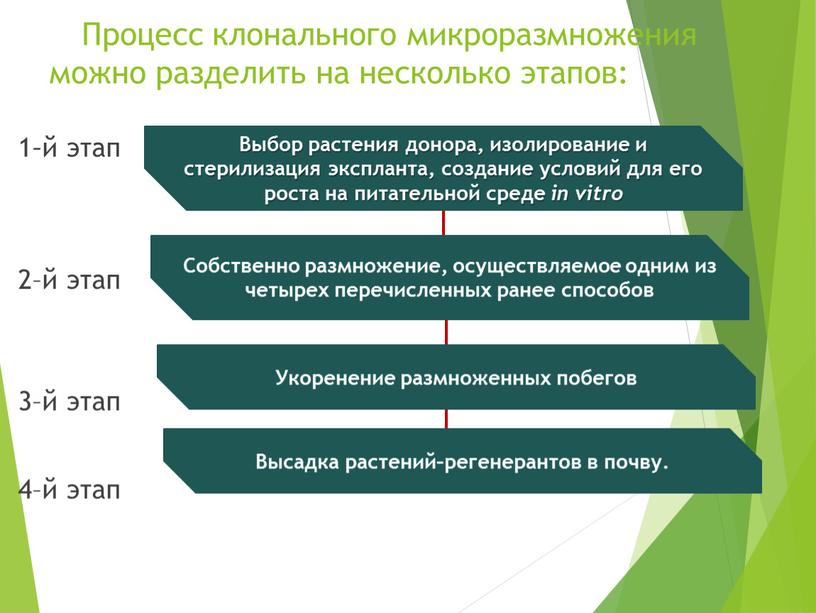
Процесс клонального микроразмножения можно разделить на несколько этапов:
Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо
Собственно размножение, осуществляемое одним из четырех перечисленных ранее способов
Укоренение размноженных побегов
Высадка растений–регенерантов в почву.
Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо

Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо
Требования
Получения хорошо растущей стерильной культуры.
Используют среду МС, с различными биологически активными веществами и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. Продолжительность первого этапа – от 1 до 2 месяцев.
Собственно размножение, осуществляемое одним из четырех перечислен-ных ранее способов

Собственно размножение, осуществляемое одним из четырех перечислен-ных ранее способов
Требования
Используют питательную среду МС с оптимальным соотношением и концентраций цитокининов (БАП - 1 - 10 мг/л) и ауксинов (ИУК и НУК - до 0,5 мг/л).
Не допускается культивирование растительных тканей в питательных средах с повышенным содержанием цитокининов (10 мг/л), т.к. происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к формированию растений с измененной морфологией.
Укоренение размножен-ных побегов

Укоренение размножен-ных побегов
Требования
Замена основного состава среды. Уменьшение в 2-4 раза концентрации минеральных солей в среде МС, снижение концентрации сахара до 0,5–1 % и полное исключение цитокининов (оставляют лишь ауксины). В качестве стимулятора корнеобразования используют ИМК, ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
- выдерживание микропобегов в течение 2–24 ч в стерильном концентрированном растворе ауксина (20–50 мг/л) с последующим их культивированием на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
- культивирование микропобегов в течение 3–4 недель непосредственно на питательной среде, содержащей ауксин в невысоких концентрациях (1–5 мг/л).
Высадка растений–регенерантов в почву

Высадка растений–регенерантов в почву.
Требования
Время для пересадки пробирочных растений – весна или начало лета. Растения с двумя–тремя листьями и хорошо развитой корневой системой вынимают из колб или пробирок пинцетом.
Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85–90 °С в течение 1–2 ч. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20–22 °С), освещенностью не более 5 тыс. лк и влажностью 65–90 %.
Для лучшего роста растений создают условия искусственного тумана или горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами.













Слайд 1

Слайд 2
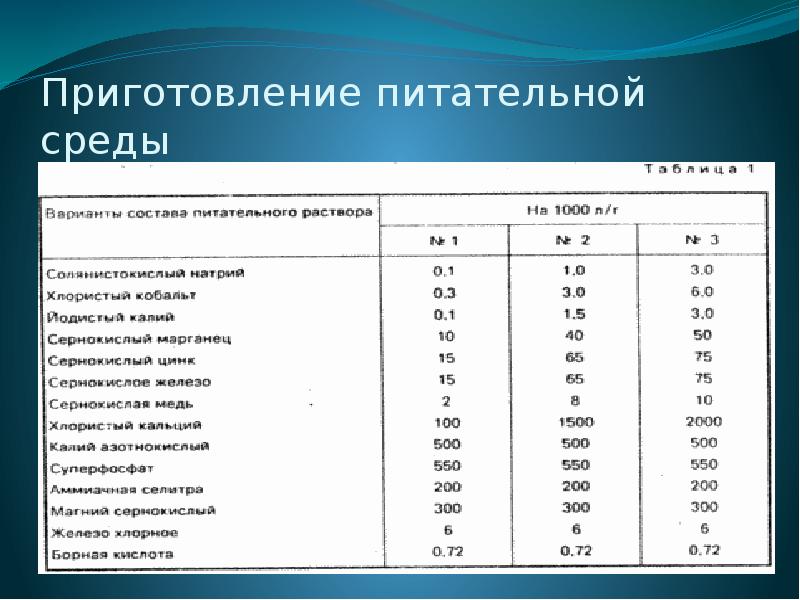
Этапы микроклонального размножения: Приготовление питательной среды. Уплотнение питательной среды с помощью экстракта водорослей Агар-Агар. Стерилизация донорского растения и питательной среды. Добавление, в питательную среду, стимуляторов роста. Пересадка фрагментов донорского растения в питательную среду.

Слайд 3
Далее полученные растения черенкуют и повторяют весь процесс заново, до получения нужного количества данного вида. Далее полученные растения черенкуют и повторяют весь процесс заново, до получения нужного количества данного вида. После нескольких недель, готовые растения сажают в подготовленный для них почву, предварительно смыв с растений остатки питательной среды. Через несколько недель растения высаживают в грунт городских улиц или выращивают на сельскохозяйственных угодьях.

Слайд 4

Слайд 5

Слайд 6

Слайд 7

Слайд 8

Слайд 9

Слайд 10

Слайд 11

Слайд 12
Список использованной литературы: Список использованной литературы: Мастерская садовых искусств 2012 год Интеллектуальное земледелие 2011 год

Слайд 13
Читайте также:

