При диагностике брюшного тифа для выделения гемокультуры посев крови проводят на среду
Обновлено: 04.10.2024
Изобретение относится к медицине, может быть использовано при бактериологическом исследовании крови на гемокультуру сальмонелл. Среда содержит агар и натрий углекислый, желчь бычью, питательный бульон из рыбы, маннит, феноловый красный. Среда обладает высоким накопительным эффектом и обеспечивает четкую дифференциацию паратифозных бактерий от тифозных по признаку газообразования. 1 табл.
Изобретение относится к медицине, а именно к клинической микробиологии, и может быть использовано при бактериологическом исследовании крови на гемокультуру.
Метод получения гемокультуры является наиболее ранним и надежным методом бактериологической диагностики сальмонелл брюшного тифа и паратифов.
Известны среды для выделения гемокультуры сальмонелл: желчный бульон, бульон с 1% глюкозой, стерильная дистиллированная вода (1). Недостатком желчного бульона является то, что он не позволяет дифференцировать сальмонеллы по признаку газо- и кислотообразования, так как в его составе отсутствует индикатор и углевод. Глюкозный бульон обладает низким накопительным эффектом, так как не подавляет бактерицидные свойства крови. Дистиллированная вода не обладает накопительным эффектом ввиду отсутствия питательных веществ, ей присущи также и все другие указанные выше недостатки.
Наиболее близким решением задачи того же назначения по совокупности признаков и достигаемому эффекту является среда Рапопорт, предназначенная для выделения и накопления гемокультуры сальмонелл (4). Среда содержит в качестве источника азота бульон мясопептонный или Хоттингера, в качестве источника углерода - глюкозу, в качестве компонента, препятствующего свертыванию крови и подавляющего ее бактерицидное действие, - желчь, в качестве индикатора кислотообразования - индикатор Андреде.
К причинам, препятствующим достижению указанного ниже технического результата при использовании известной среды, принятой за прототип, являются слабые накопительные и дифференцирующие свойства среды, что вызывает необходимость инкубации посевов в течение 6-10 суток (2, 3). По этой причине удлиняются сроки постановки диагноза.
Задача предлагаемого изобретения - повышение накопительных и дифференцирующих свойств среды.
Указанный технический результат при осуществлении изобретения достигается тем, что предлагаемая среда дополнительно содержит агар и натрий углекислый, в качестве источника азота содержит питательный бульон из рыбы, в качестве источника углерода - маннит, в качестве индикатора кислотообразования - феноловый красный при следующем соотношении компонентов, г/л: Питательный бульон из рыбы - 10 - 20 Желчь бычья - 10 - 20 Маннит - 10 -20 Агар - 1,0 - 2,0 Феноловый красный - 0,03 - 0,05 Натрий углекислый - 0,2 - 0,4 Вода дистиллированная - До 1 л Внесение в среду дополнительного агара, обладающего высокой сорбционной способностью, нейтрализует продукты метаболизма бактерий и предохраняет клетки от их токсического действия, а высокая питательность рыбного бульона способствует повышению накопительных свойств среды.
Введение в предлагаемую среду маннита вместо глюкозы и дополнительно натрия углекислого обеспечивает более интенсивное образование бактериями газа, а агар способствует удерживанию пузырьков газа на поверхности и в толще среды, что позволяет провести четкую дифференциацию паратифозных бактерий, продуцирующих газ, от тифозных, не обладающих этим признаком.
Использование в среде индикатора фенолового красного, обладающего высокой чувствительностью к изменению pH среды, происходящего в результате сбраживания маннита сальмонеллами, позволяет провести визуальную оценку изменения цветной реакции среды.
Среду получают следующим образом.
Качество среды оценивают также визуально по наличию газа и по изменению цвета среды.
Пример 2. Отличается от примера 1 тем, что в 0,5 л дистиллированной воды последовательно растворяют 15 г питательного бульона из рыбы, 15 г сухой желчи, 15 г маннита, 1,5 г агара, 0,3 г натрия углекислого, 0,04 г индикатора фенолового красного, объем смеси доводят дистиллированной водой до 1 л. Далее согласно примеру 1.
Пример 3. Отличается от примера 1,2 тем, что в 0,5 л дистиллированной воды последовательно растворяют 20 г питательного бульона из рыбы, 20 г сухой желчи, 20 г маннита, 2,0 г агара, 0,4 г натрия углекислого, 0,05 г индикатора фенолового красного, объем смеси доводят дистиллированной водой до 1 л. Далее согласно примеру 1.
Результаты бактериологического контроля предлагаемой и известной сред представлены в таблице.
Данные таблицы свидетельствуют о заметном превосходстве предлагаемой среды перед известной. Так, накопительный эффект предлагаемой среды более чем 100 раз превосходит известную среду, что делает возможным выявление сальмонелл при меньшем их исходном количестве в исследованном материале (крови).
Дифференцирующие свойства по признаку газообразования более выражены на предлагаемой среде.
Указанные преимущества предлагаемой среды повышают эффективность диагностики тифо-паратифозной инфекции при исследовании крови на гемокультуру.
Источники информации 1. Справочник по микробиологическим и вирусологическим методам исследования. Под ред. М.О. Биргера. М.: Медицина, 1982, стр. 5.
2. Ф. К. Черкес, Л.Б. Богоявленская, Н.А. Бельская. Микробиология. М.: Медицина, 1986, стр. 286.
3. Энтеробактерии. Руководство. Под ред. В.И. Покровского. М.: Медицина, 1985, стр. 31.
4. Там же, стр. 262 (прототип).
Питательная среда для выделения гемокультуры сальмонелл брюшного тифа и паратифов, содержащая источник азота, источник углерода, желчь бычью, индикатор, дистиллированную воду, отличающаяся тем, что она дополнительно содержит агар и натрий углекислый, в качестве источника азота содержит питательный бульон из рыбы, в качестве источника углерода - маннит, в качестве индикатора кислотообразования - феноловый красный при следующем соотношении компонентов, г/л:
Питательный бульон из рыбы - 10 - 20
Желчь бычья - 10 - 20
Маннит - 10 - 20
Агар - 1,0 - 2,0
Феноловый красный - 0,03 - 0,05
Натрий углекислый - 0,2 - 0,4
Вода дистиллированная - До 1 л
TK4A - Поправки к публикациям сведений об изобретениях в бюллетенях "Изобретения (заявки и патенты)" и "Изобретения. Полезные модели"
Напечатано: Адрес для переписки: 367025, г. Махачкала, ул. Леваневского, 24, НПО “Питательные среды”
Следует читать: Адрес для переписки: 119021, Москва, Зубовский б-р, 4, ФГУП “НПО “Микроген”, патентно-лицензионный отдел
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Бактериологическая диагностика брюшного тифа и паратифов А, В и С
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ФГУН Санкт-Петербургский НИИЭМ им. Пастера Роспотребнадзора (Л.А.Кафтырева, З.Н.Матвеева, Г.Ф.Трифонова); ГОУВПО "Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова" Федерального агентства по здравоохранению и социальному развитию (А.Г.Бойцов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Лабораторным Советом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24.12.07 N 11фц/5327).
3. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 29 декабря 2007 г. 0100/13745-07-34
4. ВВЕДЕНЫ В ДЕЙСТВИЕ с момента утверждения.
5. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. В методических рекомендациях изложены основные принципы и особенности бактериологической диагностики брюшного тифа и паратифов А, В и С; содержатся современные сведения о биологических свойствах возбудителей, резистентности к антибактериальным препаратам, о питательных средах для их выделения и особенностях дифференциации возбудителей брюшного тифа и паратифов от других серологических вариантов сальмонелл.
1.2. Методические рекомендации предназначены для специалистов микробиологических лабораторий, проводящих соответствующие исследования.
2. Список сокращений
АБП - антибактериальный препарат
ВСА - висмут-сульфит агар
ЛПУ - лечебно-профилактическое учреждение
МПК - минимальная подавляющая концентрация
РИФ - реакция иммунофлюоресценции
ЦНС - центральная нервная система
"+" - положительная реакция в первые сутки;
"-" - отрицательная реакция на 4-20 сутки;
"(+)" - замедленная положительная реакция на 2-20 сутки;
d - различные ферментативные реакции.
Возможна дифференциация на ферментативные варианты.
3. Общие положения
3.1. Брюшной тиф и паратифы А, В и С являются антропонозными кишечными инфекциями, вызываемыми микроорганизмами Salmonella Typhi, Salmonella Paratyphi A, Salmonella Paratyphi В и Salmonella Paratyphi С. В настоящее время чаще регистрируется брюшной тиф, реже - паратиф В, редко - паратиф А и крайне редко - паратиф С.
3.2. Заболевания характеризуются язвенным поражением лимфатической системы тонкой кишки, бактериемией, лихорадкой, циклическим клиническим течением с выраженной интоксикацией, розеолезной сыпью на кожных покровах туловища, гепато- и спленомегалией. Более характерен запор, нежели диарея. Изъязвление пейеровых бляшек подвздошной кишки примерно в 1% случаев приводит к кишечному кровотечению и прободению кишечника с самыми неблагоприятными последствиями для больного.
3.3. Диагноз брюшного тифа и паратифов А, В и С ставится на основании клинических признаков болезни с учетом эпидемиологического анамнеза и данных комплексного лабораторного обследования, которое включает классические бактериологический и серологический методы. Бактериологическая диагностика имеет приоритетное значение, т.к. в этом случае удается получить наиболее полную информацию о биологических свойствах возбудителя, включая его чувствительность к антибактериальным препаратам.
3.4. Применение антимикробных препаратов для этиотропной терапии брюшного тифа и паратифов позволило, с одной стороны, снизить летальность с 10-20% до уровня менее 1%, а с другой стороны - осложнило лабораторную диагностику, т.к. нередко забор материала для лабораторного исследования осуществляется уже после начала антибиотикотерапии. Этот факт заставляет более тщательно подходить к вопросу выбора материала для исследования, взятия исследуемого материала, техники исследования.
3.5. Современной особенностью эпидемиологии брюшного тифа является резкое увеличение частоты завоза (заноса) инфекции с эндемичных по этому заболеванию территорий, стран ближнего и дальнего зарубежья, а также заражение жителей России при выезде в эти страны и в процессе миграции внутри страны. Другой особенностью является наличие обширного контингента высокого эпидемиологического риска в виде лиц без определенного места жительства, среди которых регистрируется высокая заболеваемость брюшным тифом.
3.6. Данные методические рекомендации составлены с целью унификации методов бактериологической диагностики брюшного тифа и паратифов А, В и С, а также правильной интерпретации результатов лабораторного исследования с учетом современных особенностей клиники, лечения и эпидемиологической обстановки на конкретных территориях.
4. Показания к проведению бактериологической диагностики
Показанием к проведению бактериологического исследования биологического материала на наличие возбудителей брюшного тифа и паратифов А, В и С является необходимость обследования:
4.1) больных с подозрением на тифопаратифозное заболевание, а также с лихорадкой неясной этиологии, продолжающейся 5 и более дней;
4.2) лиц, общавшихся с больными брюшным тифом и паратифами А, В, С;
4.3) работников отдельных профессий, производств и организаций при поступлении на работу и по эпидемиологическим показаниям;
4.4) лиц перед поступлением в стационары и специализированные санатории по клиническим и эпидемиологическим показаниям;
4.5) лиц при оформлении на стационарное лечение в больницы (отделения) психоневрологического (психосоматического) профиля, дома престарелых, интернаты для лиц с хроническими психическими заболеваниями и поражениями ЦНС, в другие типы закрытых учреждений с круглосуточным пребыванием;
4.6) больных брюшным тифом и паратифами после исчезновения клинических симптомов перенесенного заболевания перед выпиской из стационара;
4.7) лиц, переболевших брюшным тифом и паратифами, во время диспансерного наблюдения;
4.8) хронических бактерионосителей, выявленных среди работников отдельных профессий, производств и организаций, при повторном поступлении на работу на указанные предприятия и объекты;
4.9) секционного материала при подозрении на заболевание брюшным тифом и паратифами.
5. Материально-техническое обеспечение метода
5.1. Стандартное испытательное и вспомогательное оборудование, средства измерения для микробиологических лабораторий.
5.2. Питательные среды, диагностические сыворотки и химические реагенты для культивирования, выделения, идентификации и определения чувствительности к антибактериальным препаратам возбудителей брюшного тифа и паратифов А, В и С.
5.3. Для лабораторной диагностики тифо-паратифозных заболеваний и выявления бактерионосителей должны использоваться питательные среды и реагенты, разрешенные к применению на территории Российской Федерации в установленном порядке.
6. Лабораторная диагностика брюшного тифа и паратифов
6.1. Принцип бактериологического метода основан на обнаружении живых микроорганизмов в различных биологических субстратах (кровь, моча, кал, желчь, костный мозг, розеолы) в зависимости от стадии заболевания. Для этого производят посев определенного количества биологического материала на специальные питательные среды с последующей инкубацией в термостате и идентификацией выросших колоний микроорганизмов, характерных для S. Typhi, S. Paratyphi A, S. Paratyphi В и S. Paratyphi С, по культурально-ферментативным свойствам и антигенной характеристике.
6.2. Только бактериологическое исследование может обеспечить точную постановку этиологического диагноза и контроль освобождения организма от возбудителя. В отношении дифференциальной диагностики брюшного тифа и паратифов единственным методом является лабораторное исследование биологического материала с выделением возбудителя и идентификация его до уровня серологического варианта, т.к. клиническое течение инфекционного процесса не всегда позволяет различить эти нозологические формы.
7. Бактериологическое исследование
7.1. Выделение возбудителей брюшного тифа и паратифов А, В и С проводят по одной и той же схеме бактериологического исследования биоматериалов.
7.2. Порядок сбора материала для лабораторных исследований на тифо-паратифозные заболевания определен СП 3.1.1.2137-06.
7.3. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории описана в МУ 4.2.2039-05.
7.4. Материалом для бактериологического исследования с целью диагностики брюшного тифа и паратифов являются:
желчь (дуоденальное содержимое).
Возбудители могут быть также выделены из:
Материалом для бактериологического исследования с целью выявления бактерионосителей, согласно СП 3.1.1.2137-06, являются:
желчь (дуоденальное содержимое).
7.5. Исследование секционного материала проводится с целью уточнения диагноза.
7.6. Сбор биологического материала для лабораторных исследований осуществляется до начала этиотропного лечения: медицинским работником, заподозрившим тифо-паратифозную инфекцию; при групповой и вспышечной заболеваемости - специалистами учреждений Роспотребнадзора и персоналом лечебно-профилактических учреждений. От госпитализируемых больных материал для бактериологического исследования забирается в приемном отделении стационара.
7.7. От лиц, общавшихся с больными или носителями (контактными), сбор материала проводится медицинскими работниками ЛПУ и других организаций и учреждений по месту выявления больных.
7.8. Биоматериал для лабораторного исследования сопровождают специальным направлением. Доставка материала самими обследуемыми не допускается. При невозможности своевременной доставки материала используют консерванты и транспортные среды (табл.1).
8. Бактериологическое исследование крови
Показанием к исследованию крови является подозрение на тифо-паратифозные заболевания или лихорадочное состояние невыясненного происхождения (лихорадка неясного генеза), наблюдающееся в течение 5 и более дней (СП 3.1.1.2137-06).
Соотношение кровь - питательная среда должно быть 1:10-1:60. Количество независимо отбираемых проб крови и время их взятия определяется лечащим врачом согласно МУ 4.2.2039-05 при лихорадке неясного генеза или согласно МУ 04-723/3 МЗ СССР (1984) при подозрении на тифо-паратифозные заболевания. У больных, получающих антибактериальные препараты, пробы необходимо собирать непосредственно перед введением (приемом) следующей дозы препарата.
При наличии лихорадки оптимальным является взятие крови на фоне повышения температуры тела (но не на пике температуры!). Посев на питательные среды проводят непосредственно у постели больного.
При подозрении на тифо-паратифозные заболевания для посева крови можно использовать среду Рапопорт, 20%-й желчный бульон, мясопептонный бульон с добавлением 1%-й глюкозы (во флаконах по 100 мл). Ранее использовали посев крови в стерильную дистиллированную (водопроводную) воду. Однако предпочтительнее использовать специальные среды для посева крови.
Количество засеваемой крови в разгар лихорадки может составлять 10 мл, в более поздние сроки - до 20 мл (у детей - до 5 мл).
При лихорадке неясного генеза продолжительностью более 5 дней, как правило, должны исследоваться несколько проб крови. Взятие крови из вены проводят согласно МУ 4.2.2039-05. Это необходимо для дифференциации истинной бактериемии от случайной контаминации крови при венопункции (вероятность загрязнения пробы вследствие случайного прокола сальной или потовой железы составляет 3%). Для посева крови в этом случае используют две среды: 1) среду для аэробов и факультативных анаэробов и 2) среду для облигатных анаэробов (например, "двойная" среда + тиогликолевая среда согласно приказу МЗ СССР от 12.04.85 N 535) или универсальную среду для аэробов и анаэробов.
Предпочтительно использовать промышленно произведенные среды, разрешенные к применению в России.
Посевы инкубируют при 37 °С в течение 10 суток с ежедневным просмотром. При этом флаконы с "двойной" средой наклоняют, омывая плотную часть среды.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с

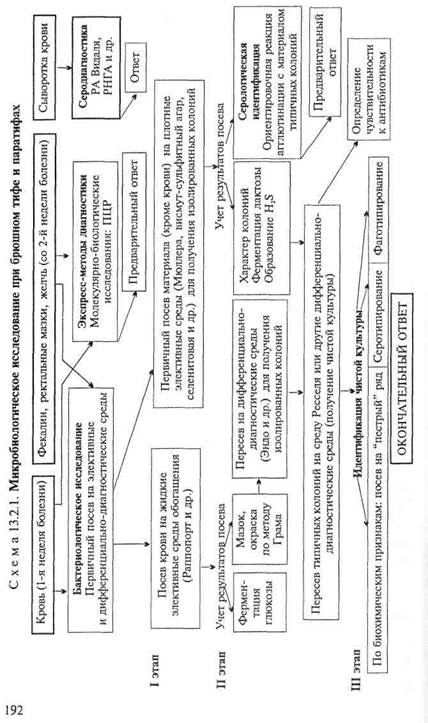 |
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Typhi - К К - К + -
Paratyphi А - КГ КГ - КГ - -
Schottmuelleri — КГ КГ - КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Salmonella ± К(-) К К К - - -
Citrobacter - К(-) К К К К(±) К(±) К
Hafnia + - - К К К(+) - К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz'-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-

тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10" 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Кокковые формы, % До 25
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
Грибы рода Candida Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Брюшной тиф: причины появления, симптомы, диагностика и способы лечения.
Определение
Брюшной тиф – это острое инфекционное заболевание, проявляющееся лихорадкой и симптомами интоксикации. Его возбудителями являются бактерии Salmonella Typhi, которые обнаруживаются в воде, мясных и молочных продуктах. В организме человека бактерии начинают выделять эндотоксин, который вызывает симптомы заболевания.
Бактерии чрезвычайно устойчивы к неблагоприятным факторам окружающей среды, резким перепадам температуры, но при этом они погибают при кипячении.
Причины появления брюшного тифа
Источниками инфекции чаще всего являются больные люди или носители бактерий.
Механизм передачи – фекально-оральный, возбудитель выделяется в окружающую среду с мочой, фекалиями, зачастую бактерии остаются на плохо вымытых руках и попадают через продукты питания в рот.
Редко и в основном среди детей болезнь может распространяться контактно-бытовым путем - через посуду и предметы гигиены. Значимую роль в распространении брюшного тифа играют мухи, которые разносят микрочастицы фекалий на лапках, поэтому пик заболеваемости приходится на летне-осенний период.
Брюшной тиф встречается повсеместно, но больше всего он распространен в странах с плохой санитарной обстановкой и низким уровнем гигиены, в перенаселенных городах с отсутствием доступа к чистой питьевой воде.
Классификация заболевания
Существует три формы течения болезни:
- Типичное течение. Характеризуется медленно нарастающей лихорадкой, тяжелыми симптомами интоксикации, типичными поражениями желудочно-кишечного тракта и кожных покровов.
- Атипичное течение:
- стертая форма (заболевание протекает легче, лихорадка может отсутствовать, симптомы поражения желудочно-кишечного тракта выражены слабо);
- бессимптомная форма (симптомов нет совсем, но в крови выявляются специфические антитела);
- носительство Salmonella Typhi.
- Редкие формы (пневмотиф, менинготиф, нефротиф, колотиф, аппендикотиф, холангиотиф, тифозный гастроэнтерит).
По характеру течения выделяют:
- Циклический брюшной тиф (наиболее часто встречающийся вариант) - характеризуется циклическими патологическими изменениями в кишечнике в среднем в течение 6 недель. Цикл проходит стадии от постепенного формирования язв на слизистой кишечника до полного их заживления и выздоровления больного.
- Рецидивирующий брюшной тиф (встречается в 10–15% случаев) - характеризуется возобновлением симптоматики после периода нормализации температуры в течение не менее 14 дней. В среднем наблюдается до 5 рецидивов, но протекают они легче первого проявления болезни.
Симптомы брюшного тифа
Симптомы брюшного тифа обычно развиваются через 1-2 недели после заражения человека бактериями Salmonella typhi.
При типичном течении заболевания выделяют начальный период, который длится около недели и характеризуется ежедневно нарастающей лихорадкой (температура тела до 40–40,5оС) и симптомами интоксикации.
К симптомам интоксикации относят головную боль, слабость и повышенную утомляемость, боль в мышцах, потливость, потерю аппетита и веса, нарушение сна.
В ряде случаев отмечается снижение артериального давления, появляются сухой кашель, болезненность в нижних отделах живота и запор.
В разгар болезни пациенты жалуются на заторможенность, сонливость, оглушенность. Характерными симптомами являются бледность кожи и одутловатость лица.
Поражение желудочно-кишечного тракта проявляется белым налетом и отечностью языка. В животе отмечается характерное урчание, болезненность, вздутие, стул становится жидким, зеленоватым.
На 8–10-й день болезни на коже груди, живота, реже на конечностях появляется красноватая сыпь.
Острая стадия заболевания продолжается около 1–2 недель.

В период выздоровления к больному возвращается аппетит, нормализуется сон. Однако остается выраженная слабость, эмоциональная неустойчивость. Длительное время может сохраняться субфебрильная температура тела (не выше 37,5оС).
Диагностика брюшного тифа
Установление диагноза начинается с осмотра больного, сбора жалоб, истории болезни, обязательного учета предыдущих поездок, контактов с заболевшими людьми, употребления зараженных продуктов питания.
Для подтверждения диагноза врач назначит лабораторные и инструментальные методы обследования:
-
Клинический анализ крови с развернутой лейкоцитарной формулой (помогает выявить воспалительные изменения).
Одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Читайте также:

