При посевах перитонеального экссудата чаще всего отмечается рост
Обновлено: 05.10.2024
Чаще всего микотический процесс бывает обусловлен грибами Candida spp., на долю которых приходится до 80% всех внутрибольничных грибковых инфекций.
Эпидемиология инвазивного кандидоза. Из дрожжевых грибов наиболее частыми патогенами являются Candida albicans. Однако имеется тенденция к снижению частоты их выделения с 80–90% (70–80–е годы) до 40–60% (90–е годы). Начиная с 90–х годов возрастает выделение Сandida non–albicans: С. tropicalis, C. krusei, C. glabrata, C. kefyr, C. parapsilosis и других [1]. На долю инфекций, вызванных C. glabrata, приходится от 5 до 35%, C. tropicalis – от 8 до 43%. C. lusitaniae, C. dubliniensis, С. guilliermondii относятся к редким патогенам.
Факторы риска в развитии инвазивного кандидоза. Факторы, определяющие возникновение инвазивного кандидоза у пациентов хирургического профиля, отличаются от факторов, индуцирующих микозы у пациентов иной категории. К основным факторам относят абдоминальные операции, особенно повторные, на долю которых приходится 75% всех случаев грибковых инфекций. Другим, не менее важным фактором является возраст (примерно 50% микозов в хирургической практике регистрируется у пациентов старше 60 лет). Вероятность развития кандидемии достоверно выше, если лечение инфекционных осложнений проводится тремя антибиотиками и более [4]. В ходе многофакторного анализа показано, что колонизация Candida spp. многих локусов (например, полость рта, кишечник, влагалище), предшествующий гемодиализ, парентеральное питание, наличие центрального венозного катетера, особенно трехходового, относятся также к достоверным факторам, оказывающим влияние на возникновение инвазивного кандидоза [5]. Инвазивный кандидоз регистрируется чаще у пациентов с обширными ожогами, имеющих мочевой катетер, получающих антациды, Н2–блокаторы или иные средства, подавляющие кислотность желудочного сока, глюкокортикоидные препараты, длительно применяющих антибактериальные препараты.
Патогенез. Кандидоз является, прежде всего, эндогенной инфекцией. Кандиды могут заселять кожу, слизистую ротоглотки, кишечник, и транслокация их происходит через эпителий кишечника [6]. При подобном варианте диссеминации, через кишечник, возникает инвазия кандидами, в первую очередь печени, селезенки, легких. Другие входные ворота для кандид – венозные катетеры [6]. Инфицирование катетеров происходит с кожи больного или через руки медперсонала. При этом пути диссеминации грибов органами–мишенями становятся, как правило, почки, сердце, легкие. Циркуляция кандид в крови проходит непродолжительное время, затем, повреждая эндотелий, они внедряются в органы, приводя к образованию небольших абсцессов.
Инвазивный кандидоз
Кандидемия – выделение грибов Candida spp. хотя бы в одном посеве крови всегда принимается во внимание и является основанием (при наличии симптомов инфекции) для проведения адекватной антимикотической терапии. Следует отметить, что у части больных обнаружение Candida spp. в крови клинически может никак не проявляться. Подобное течение инфекции встречается у пациентов с уремией, при лечении глюкокортикоидными средствами.
Острый диссеминированный кандидоз – это инвазия кандидами одного или нескольких органов гематогенным путем. Поражение дрожжевыми грибами может быть любого органа, но наиболее часто в процесс вовлекаются печень, почки, селезенка, сердце, органы зрения, легкие, головной мозг, кожа и подкожная клетчатка. В этих случаях грибы могут быть выявлены лишь при культивировании и/или гистологическом исследовании биоптатов органов.
Клинические симптомы кандидемии или острого диссеминированного кандидоза не специфичны. Наиболее частым симптомом является лихорадка, которая сохраняется или повторно возникает на фоне терапии антибиотиками широкого спектра действия. В 10–15% случаев отмечается поражение кожи (отсевы) в виде дискретных, мелких, размерами 0,3–0,6 см папулезных образований розовато–красноватого цвета или подкожных абсцессов. Другой признак, характерный для инвазивного кандидоза (кандидозного сепсиса) – довольно выраженные боли в мышцах, которые беспокоят больных в покое – регистрируется редко. Эндофтальмиты при кандидемии возникают у 9–15% больных. Клинические симптомы включают снижение остроты зрения вплоть до развития слепоты, на глазном дне выявляют белесоватые налеты. У всех больных с кандидемией следует проводить офтальмоскопию с расширением зрачка [7].
Летальность при кандидемии остается высокой, составляя 40%. Минимальная частота летальных исходов регистрируется при инфекциях, вызванных С. parapsilosis (7–8%), максимальная – при инфекциях, обусловленных C. glabrata (45%). При остром диссеминированном кандидозе погибает 70–80% больных.
Поражение кандидами легких происходит, в основном, вследствие гематогенной диссеминации грибов, крайне редко являясь первичным проявлением кандидозного процесса (аспирация кандид из глотки). Диагностика пневмокандидоза трудна. На рентгенограммах отмечается понижение прозрачности легочной ткани, создается впечатление наличия мелких множественных очагов. В этих случаях необходимо проведение компьютерной томографии легких. Для пневмокандидоза характерно наличие мелких множественных очагов, расположенных по периферии легочных полей. Клинические симптомы неспецифичны, иногда может беспокоить сухой кашель.
Инвазия дрожжевыми грибами центральной нервной системы протекает в виде поражения оболочек, вещества и сосудов головного мозга, нередко осложняя лечебный процесс у пациентов с вентрикуло–перитонеальными шунтами. Клинически проявляется менингитом, энцефалитом, абсцессами головного мозга, микотической аневризмой.
Кандидозный эндокардит чаще возникает у больных, подвергшихся протезированию клапанов сердца или имевших ранее повреждение (вегетации) на клапанах сердца иной инфекционной природы. Предрасполагающими факторами в развитии данной патологии является катетеризация центральных вен, внутривенное введение наркотических препаратов (у наркоманов). При кандидозном эндокардите наиболее часто, в 40% случаев, вовлекается аортальный клапан, затем – митральный, реже – трикуспидальный, у наркоманов чаще всего – трикуспидальный клапан. Клиническая картина кандидозного и бактериального эндокардита сходна. Для кандидозного эндокардита характерна лишь большая частота эмболий. Эмболия коронарных артерий грибами приводит к развитию ишемии или инфаркта миокарда. У 60% больных диагноз эндокардита устанавливается лишь на аутопсии. Примерно у 80% пациентов с эндокардитом выявляется положительный рост кандид в посевах крови.
Поражение кандидами суставов наблюдается при гематогенной диссеминации инфекции или при внутрисуставном введении глюкокортикоидов. Подобное инфицирование возникает прежде всего у больных с ревматоидными артритами и у пациентов с инородными внутрисуставными устройствами. Чаще поражается коленный сустав, признаки общего воспаления зачастую отсутствуют, инфекционный процесс в большинстве случаев проявляется локальными симптомами. Диагноз ставится на основании выделения грибов (посевы) из околосуставной жидкости. Своевременное диагностирование, оперативное лечение (удаление детрита, дренирование) и антимикотическая терапия могут предотвратить развитие деструкции хрящевой ткани.
Большинство случаев кандидозного остеомиелита, за исключением случаев грибкового поражения грудины, возникающих при ее оперативном рассечении (стернотомии), является следствием гематогенного распространения инфекции. Нередко в инфекционный процесс вовлекаются позвонки. Боли в спине, лихорадка, корешковый синдром возникают при этой патологии. Проводится дренирование очагов и назначается флуконазол.
Перитонит и итраабдоминальные абсцессы
Выделение Candida spp. из перитонеальной жидкости, полученной при аспирации или во время хирургической операции, у пациентов с интраабдоминальными абсцессами или перитонитом свидетельствует о перфорации кишечника или является следствием контаминации при несостоятельности анастомозов пищеварительного тракта [8]. Кандидозный перитонит чаще возникает при опухолях пищеварительного тракта, несостоятельности анастомозов, перфорациях кишечника, срочной релапаратомии, циррозе печени, панкреатите, панкреонекрозе [6,8]. Пациентам с кандидозным перитонитом или абцессами кандидозной этиологии, подтвержденными при микологическом исследовании (обнаружение элементов грибов при микроскопии и/или выделение культуры Candida spp.), наряду с хирургическим лечением проводится терапия системными противогрибковыми препаратами. Лечение антибактерильными препаратами продолжается ввиду полиэтиологичности абдоминальных инфекций. Клинические проявления кандидозного и бактерильного перитонита идентичны.
Кандидозный перитонит может возникать в ходе проведения амбулаторного перитонеального диализа [9,10]. В этих случаях инфекционный процесс является локальным, проявляется невысокой лихорадкой и болями или дискомфортом в животе. При этом перитонеальный диализат непрозрачный и содержит более 100 нейтрофилов в 1 мм 3 . Лечение включает удаление перитонеального катетера и назначение системных антимикотиков. Боли в животе могут возникать при добавлении амфотерицина В в диализат, поскольку препарат может вызывать химический перитонит. Концентрация флуконазола в перитонеальной жидкости высокая, данный антимикотик является препаратом выбора при лечении этих осложнений.
Кандиды могут вызывать холангит, абцессы в поджелудочной железе и печени [7]. Подобные осложнения возникают прежде всего у больных, имеющих дренажи в брюшной полости, после операций по поводу опухолей пищеварительного тракта.
Раневая инфекция
Диагностика и лечение кандидозной раневой инфекции весьма проблематичны. Выделение Candida spp. из дренажа или из раны не является веским доказательством кандидозной раневой инфекции. Candida spp. могут лишь колонизировать рану, не приводя к инвазивному процессу [11]. Однако в тех случаях, когда раневая инфекция сохраняется или прогрессирует на фоне терапии антибиотиками, особенно в случаях повторного выделения Candida spp. из раны, рекомендуется применять системные противогрибковые препараты [12].
Следует отметить необходимость назначения системных противогрибковых препаратов во всех случаях выделения Candida spp. из послеоперационной раны на грудине, используемой в качестве оперативного доступа при операциях на сердце, ввиду опасности развития остеомиелита.
Эмпирическая и превентивная терапия
Candida spp. относятся к патогенам, которые часто выявляют из нестерильных локусов при интраабдоминальных инфекциях. Терапию системными антимикотиками следует проводить больным, входящим в группу высокого риска развития инвазивного кандидоза. Такую группу составляют пациенты, у которых отмечается колонизация кандидами нескольких локусов. Длительное время они находятся в реанимации где им проводится терапия антибиотиками, ставится центральный венозный катетер, проводится парентеральное питание [12]. Если колонизация кандидами слизистых отсутствует, то пациенты входят в группу низкого риска возникновения инвазивного кандидоза и назначение системных антимикотиков следует отложить [12].
Пациенты с ожогами
Частота гематогенного кандидоза у этой категории больных составляет 2–14%. Колонизация дрожжевыми грибами, частота гематогенной диссеминации, летальность при кандидозной инфекции коррелируют с обширностью и интенсивностью ожога. Принципы лечения кандидоза у больных с ожогами идентичны используемым в хирургической практике.
Диагностика инвазивного кандидоза базируется на обнаружении дрожжевых клеток (грибы рода Candida могут формировать псевдомицелий или истинный мицелий) в биоптатах или аспиратах за исключением слизистых оболочек или выделении культуры из образцов, полученных в асептических условиях из стерильного в норме очага (кровь, содержимое абсцесса, перитонеальная жидкость, аспираты) [11,12]. Выделение дрожжевых грибов со слизистых, с поверхности ран свидетельствует о колонизации дрожжевыми грибами.
Лечение инвазивного кандидоза
В отношении кандид эффективны все системные антимикотики, применяемые на современном этапе: амфотерицин В, флуконазол, итраконазол, вориконазол, каспофунгин [13]. Итраконазол для перорального применения (в капсулах или в суспензии) не назначается в качестве стартовой терапии при инвазивном кандидозе, поскольку стабильная концентрация в крови достигается лишь через 1–2 недели приема препарата.
При инвазивном кандидозе выбор антимикотика и его дозирование определяются видовой принадлежностью выделенных грибов, его чувствительностью к противогрибковым препаратам, клиническим состоянием пациента. Во всех случаях кандидемии необходимо удалить венозный катетер.
Показанием для назначения флуконазола (Микосист) при инвазивном кандидозе являются: стабильное состояние пациента, отсутствие профилактического применения препаратов азолового ряда. Флуконазол назначается по 400 мг ежедневно, однократно в течение суток, внутривенно или в капсулах перорально. При выделении C. glabrata суточная доза удваивается до 800 мг в сутки, прием аналогичный. В двух рандомизированных исследованиях эффективность лечения кандидемий флуконазолом (400 мг/сутки) и амфотерицином В (0,5–0,6 мг/кг/сут) была сопоставимой [14,15]. Ввиду низкой токсичности дозирование флуконазола может быть увеличено до 1600 мг в сутки. В исследованиях продемонстрирован дозозависимый клинический эффект, однако достоверных отличий по эффективности терапии в случае эскалации дозы не было получено. Существенные токсические проявления (судороги, повышение уровня биохимических показателей крови) отмечены лишь при использовании флуконазола в суточной дозе 2000 мг.
Показаниями к назначению амфотерицина В являются нестабильное состояние больного при неидентифицированной видовой принадлежности выделенных дрожжевых грибов, инвазивный кандидоз, вызванный C. krusei. Суточная доза амфотерицина В составляет 0,7–0,8 мг/кг, при выделении C. krusei – 1 мг/кг. После стабилизации состояния и определения вида возбудителя амфотерицин В следует заменить на флуконазол.
При тяжелых состояниях или при выделении грибов, резистентных к флуконазолу, альтернативой амфотерицину В может быть липосомальная форма амфотерицина В или новые антимикотики – вориконазол и каспофунгин. Каспофунгин применяется только внутривенно, 70 мг в первый день с последующей поддерживающей дозой по 50 мг ежедневно. Вориконазол назначается внутривенно в первый день 6 мг/кг каждые 12 часов, в последующие дни – 4 мг/кг каждые 12 часов; пероральное применение составляет при массе тела больного более 40 кг – 400 мг каждые 12 часов в первые сутки, далее – по 200 мг каждые 12 часов, при массе тела менее 40 кг дозирование уменьшается в 2 раза.
Показаниями к назначению липосомальной формы амфотерицина В являются почечная недостаточность (уровень креатинина в сыворотке крови взрослых і221 мкмоль/л, детей – і133 мкмоль/л или клиренс креатинина Литература:
Перитонит – воспалительное поражение брюшины, серозной оболочки, покрывающей большинство внутренних органов и выстилающей стенки брюшной полости изнутри. В большинстве случаев оно протекает как осложнение инфекционно-воспалительных заболеваний или травм в области груди и живота. Состояние больного при этом часто тяжелое, с интенсивной абдоминальной болью, рвотой, повышением температуры тела и другими симптомами. Лечение направлено на борьбу с инфекционным патогеном, чаще всего бактериального происхождения, и всегда включает хирургическое вмешательство на органах брюшной полости.
- регулирует объем и состав жидкости, заполняющей брюшную полость;
- осуществляет механическую и иммунную защиту внутренних органов;
- ограничивает очаг инфекции за счет образования спаек, препятствуя распространению возбудителя по организму.
Ее воспаление приводит к нарушению работы жизненно важных органов и развитию неблагоприятных патофизиологических реакций, опасных для человека.
Причины
Как правило, воспаление брюшины вызвано бактериальной инфекцией. Часто это представители нормальной микрофлоры органов пищеварения – энтеробактерии, кишечная палочка, протей, кокки, клостридии и другие микроорганизмы. Реже возбудители гонореи, туберкулеза, гемолитический стрептококк либо пневмококк.
В зависимости от пути проникновения возбудителя в брюшную полость выделяют три вида патологии. Первичный перитонит развивается при миграции возбудителя из других очагов воспаления по кровяному руслу, фаллопиевым трубам у женщин или с током лимфы. Такое возможно при заболеваниях органов малого таза, включая гинекологические заболевания, воспаления в органах ЖКТ, инфекционных поражениях почек.
Вторичный перитонит – это не самостоятельная болезнь, а осложнение деструктивно-воспалительных поражений органов брюшной полости. Также причинами перитонита становятся проникающее ранение брюшной стенки или тупая травма живота с разрывом внутренних органов, послеоперационные осложнения и ошибки во время проведения хирургических вмешательств. Отдельно стоит отметить воспалительные поражения брюшины при злокачественных опухолях, глистной инвазии, гранулематозном и ревматоидном процессах в организме.
Третичный перитонит возникает спустя двое суток после удаления очага вторичного перитонита. Причина его появления в том, что организм больного не смог сформировать адекватную реакцию на инфекционный процесс.
Классификация
- бактериальный – обусловленный микробной флорой;
- абактериальный – при асептическом или токсико-химическом воспалении брюшины из-за ее раздражения агрессивными неинфицированными жидкостями (кровью, пищеварительными ферментами и секретами внутренних органов, мочой);
- особые формы – паразитарный, ревматоидный, канцероматозный и гранулематозный.
По площади пораженной брюшины воспаление может быть ограниченным, местным (при поражении 1-2 анатомических областей), разлитым (охватывающим три и более области) и общим (при тотальном воспалении).
В своем развитии заболевание проходит раннюю фазу (менее двенадцати часов), позднюю (менее пяти дней) и конечную (от одной до трех недель от начала воспаления).
Симптомы
Токсическая стадия развивается в промежутке от четырех до семидесяти восьми часов. Характерны нарастающая интоксикация вплоть до эндотоксического шока, усиление общих проявлений – снижается кровяное давление, учащается сердцебиение, повышается температура тела и появляются проблемы с дыханием. Боль носит разлитой характер, ее интенсивность снижается, так как начинается паралич нервных окончаний брюшины, отмечаются вздутие живота, запор.
В терминальной стадии, после семидесяти двух часов от начала воспаления брюшины, происходит грубое нарушение жизненно необходимых процессов внутри организма. Над симптомами перитонита преобладают проявления паралитической непроходимости кишечника – интенсивная боль в животе, сильная рвота, не приносящая облегчение, и выраженное вздутие. Состояние больного крайне тяжелое, черты лица заострены, артериальное давление резко снижено, моча не отходит, сознание спутано, конечности приобретают синюшный или желтый оттенок, характерны повышенная потливость и другие признаки полиорганной недостаточности.
- отсутствием аппетита и похудением;
- повышенной потливостью;
- стойким субфебрилитетом до 37,5 °С;
- нарушением стула;
- периодической болью в животе и вздутием.
Осложнения
- обезвоживание;
- почечная недостаточность;
- токсический шок;
- легочные патологии;
- печеночная недостаточность;
- вторичные воспалительные процессы.
Диагностика
Если в ходе беседы с пациентом и осмотра врач подозревает у взрослого или ребенка перитонит, больной экстренно госпитализируется в стационар больницы, где проводятся дальнейшие лабораторные и инструментальные исследования для уточнения диагноза.
-
. При гнойном процессе определяется увеличение количества лейкоцитов, ускоренное СОЭ, изменяется гематокрит. для определения таких показателей, как С-реактивный белок, аспартатаминотрансфераза, аланинаминотрансфераза, общий билирубин, сахар крови, креатинин, лактатдегидрогеназа, амилаза, липаза, прокальцитонин, интерлейкины 1, 6, 8, 10, фактор некроза опухоли, мочевина, общий белок и альбумины. , концентрация фибриногена, протромбиновое время, МНО, АЧТВ. . .
Лечение
Лечение перитонита всегда хирургическое, с обязательной предоперационной медикаментозной подготовкой. Последняя направлена на восполнение баланса жидкости, солей и нормализацию состояния пациента, а также адекватное обезболивание и нормализацию артериального давления.
Во время операции при перитоните устраняется очаг инфекции, удаляются гной и перитонеальный выпот, брюшная полость промывается антисептическими растворами и дренируется. Послеоперационное ведение больного включает курс мощной антибиотикотерапии, капельницы с детоксикационными растворами, препараты для поддержания работы органов сердечно-сосудистой системы, дыхания и нервной системы.
По степени распространенности воспалительного процесса в брюшной полости выделяют:
1. Отграниченный (местный) перитонит (занимает до 2-х из девяти анатомических областей брюшной полости).
2. Распространенный перитонит (занимает три и более анатомических области живота):
По характеру экссудата: серозный, серозно-фибринозный и гнойный перитонит.
Диагностика.
Диагноз перитонита должен быть установлен на основании первичного физикального обследования.
В ходе обследования пациента в приемном отделении на основании клинико-инструментального обследования следует установить возможные причины перитонита.
В приемном отделении в экстренном порядке производят общий клинический анализ крови, биохимический анализ крови, коагулограмму, общий анализ мочи; определяют группу крови и резус-фактор; выполняются ЭКГ, рентгенография грудной клетки в прямой проекции и обзорная рентгенография брюшной полости (у лежачих больных – в латеропозиции), УЗИ брюшной полости (оценка наличия газа и жидкости в брюшной полости, дилатация кишечных петель, перистальтика); по показаниям проводятся консультации врачами терапевтических специальностей.
Лечебная тактика.
Диагноз перитонита является показанием к экстренному оперативному вмешательству. Больной подлежит экстренному оперативному вмешательству в течение 1 часа с момента установления диагноза.
Больным с выраженными явлениями интоксикации, синдромными расстройствами и с тяжелыми сопутствующими заболеваниями показано проведение кратковременной (в течение 1,5-2 часов) предоперационной подготовки в условиях реанимационного отделения. Вопрос о необходимости и объеме предоперационной подготовки больного к хирургическому вмешательству решается совместно хирургом и анестезиологом.
Любое оперативное вмешательство по поводу перитонита необходимо выполнять под эндотрахеальным наркозом.
Доступ.
- при клинической картине отграниченного перитонита,
- при необходимости проведения дифференциального диагноза (острый панкреатит, мезентериальный тромбоз),
- в случае диагностированных до операции аппендицита, холецистита и перфоративной язвы.
- при клинической картине распространенного перитонита,
- при лапароскопической находке, исключающей возможность выполнения оперативного приема лапароскопическим доступом, показано выполнение конверсии к срединной лапаротомии.
Хирургическая тактика.
Обязательными этапами оперативного вмешательства при перитонита являются:
- Забор материала для микробиологического исследования;
- Полная и планомерная ревизия брюшной полости;
- Эвакуация экссудата;
- Устранение источника перитонита;
- Санация брюшной полости;
- Назо-интестинальная интубация – по показаниям;
- Дренирование брюшной полости;
- Формирование лапаростомы для последующих программных санаций – по показаниям.
Радикальное устранение источника перитонита предусматривает:
- удаление воспаленного органа (аппендэктомия, холецистэктомия);
- герметичное ушивание перфораций и свежих сквозных ранений полых органов;
- резекцию органа (при язве, опухоли, травмах или нарушении мезентериальногокровобращения); - формирование колостомы (илеостомы) для выключения из пассажа пораженных участков толстой кишки.
При отсутствии условий для радикальной ликвидации источникаинфицирования возможна его локализация (отграничение тампонами в брюшной полости), экстраабдоминизация органа.
Формирование межкишечных анастомозов на воспаленных участках кишечных петель при гнойном перитоните противопоказано. В таких случаях целесообразно выведение концевых кишечных стом, включая, при необходимости и тощую кишку.
При правосторонней гемиколэктомии вопрос о формировании первичного илеотрансверзоанастомоза или формировании илеостомы решается индивидуально в зависимости от состояния стенки подвздошной кишки.
При резекции левой половины толстой кишки формируется одноствольная колостома.
При выраженном парезе и расширении кишечных петель более 4-5 см показано проведение декомпрессии пищеварительной трубки путем назоинтестинальной интубации на всем протяжении тонкой кишки широким 2-х канальным (неприсасывающимся) силиконовым зондом.Одновременно с установкой назо-интестинального зонда устанавливается назо-гастральный зонд.
Введение тампонов в брюшную полость допустимо только при невозможности радикального устранения источника перитонита и в целях гемостаза.
Варианты завершения операции:
· распространенный фибринозно-гнойный или каловый перитонит;
· признаки анаэробного инфицирования брюшной полости;
· тяжелый абдоминальный сепсис, септический шок;
· основное заболевание (его осложнение), не позволяющее одномоментно ликвидировать или локализовать источник перитонита;
· сопутствующее заболевание или состояние, не позволяющее выполнить адекватный объем операции;
· синдром интраабдоминальной гипертензии;
· состояние лапаротомной раны (гнойно-некротический процесс), не позволяющее ушить брюшную полость.
· прогрессирование перитонита (неустраненный первичный источник, появление нового источника, недиагностированный источник, третичный перитонит);
· осложнение основного заболевания, требующее хирургической коррекции (абсцесс, флегмона, кровотечение в брюшную полость или ЖКТ, ранняя спаечная кишечная непроходимость);
· возникновение или осложнение в послеоперационном периоде конкурирующего заболевания, требующего хирургического вмешательства (кровотечение из гастродуоденальных язв, деструктивный панкреатит, перфорация острых и стресс-язв, острое нарушение мезентериального кровотечения);
· осложнения, связанные с нарушением техники хирургического вмешательства, манипуляции (ятрогенные повреждения, несостоятельность ЖКА, несостоятельность культи или кровотечение вследствиесоскальзывание лигатуры, клипсы, инородные тела брюшной полости).
- изоляция органов брюшной полости от париетальной брюшины и лапаротомной раны перфорированной полиэтиленовой пленкой;
- сведение краев операционной раны отдельными редкими кожными швами с оставлением диастаза краев раны в 5 – 10 см; после каждой санации швы накладывать в новых местах;
Критерии окончания режима программируемых санаций:
· гарантированная ликвидация или локализация источника перитонита;
· отсутствие неудалимых очагов некроза и гнойных очагов;
· прозрачный серозный экссудат;
· наличие перистальтики тонкой кишки;
· отсутствие распространенного гнойно-некротического поражения операционной раны или передней брюшной стенки, исключающее возможность одномоментной хирургической коррекции.
Антибактериальная терапия начинаться непосредственно после установления диагноза перитонита. Первая доза антибактериального препарата вводится перед оперативным вмешательством. До получения результатов микробиологического исследования экссудата брюшной полости применяется "эмпирическое" назначение антибиотиков со спектром действия, включающим грамотрицательные бактерии в сочетании с анаэробными микроорганизмами:
- цефалоспорины (цефоперазон 4 г/сутки) + аминогликозиды (тобрамицин, сизомицин, амикацин 150 мг - 2 г/сутки) + метронидазол (1500 мг/сутки);
- офлоксацины (ципрофлоксацин 800 мг/сут) + метронидазол (1500 мг/сутки);
- карбаценемы (меропенем 3-6 г/сутки) в виде монотерапии.
После получения результатов микробиологических исследований необходима коррекция антибиотикотерапии по чувствительности микрофлоры.
Патогенетическая посиндромная терапия.
1. Инфузионно-трансфузионная терапия проводится с целью ликвидации дефицита жидкости и электролитов, коррекции КЩС с учетом показателей гомеостаза, гемодинамики, темпа диуреза в режиме умеренной гемодилюции (Ht 27-32%), при необходимости - форсированный диурез. Суточный объем инфузии 3000-3500 мл/сутки при темпе диуреза 80-100 мл/час. При восполненном ОЦК в отсутствие гипопротеинемии и снижении диуреза - стимуляция фуросемидом до 2 мг/кг/сутки. Коррекция анемии препаратами крови - при снижении гемоглобина ниже 100 г/л.
2. Коррекция метаболических нарушений:
- нормализация белкового и углеводного обменов;
- использование энергетических материалов в виде растворов декстрозы, концентрированной глюкозы (с введением адекватного количества инсулина), солей калия, коферментов (витаминов);
- введение антигистаминных средств;
- введение ингибиторов протеаз.
3. Коррекция агрегатного состояния крови, профилактика ДВС-синдрома:
- улучшение реологии крови путем создания гемодилюции и применения дезагрегантов (трентал 30-50 мл/сутки, курантил 6-8 мл/сутки, ацетилсалициловая кислота 0,5 г/сутки);
- гепаринотерапия (наиболее рационально постоянно дозированное введение гепарина 20000-30000 ед./сутки под контролем АЧТВ и тромбинового времени);
- препараты крови, содержащие факторы свертывания и фибринолиза;
- профилактика цитотоксического эффекта, мембраностабилизирующий эффект - даларгин (0,6-0,8 мг/сутки), дексазон 16-32 мг/сутки.
4. Коррекция иммунологического статуса:
- пассивная иммунизация гипериммунными плазмами и сыворотками;
- использование иммуномодуляторов (т-активин, тималин, миелопид) и препаратов неспецифической иммунокоррекции (дибазол, аскорбиновая кислота);
- ультрафиолетовая и лазерная обработка крови.
5. Постоянная декомпрессия тонкого кишечника при малых цифрах разряжения (10-20 мм. вод. ст.) с проведением кишечного лаважа растворами электролитов (СЭР - солевым электролитным раствором) в объеме 1000-1500 мл/сутки.
6. Коррекция состояния сердечно-сосудистой системы:
7. Респираторная терапия, профилактика бронхолегочных осложнений:
8. Активные методы детоксикации следует использовать при II и III степени эндогенной интоксикации:
- методом выбора считать проведение плазмафереза с момента стабилизации гемодинамики (целесообразен забор плазмы 500-1000 мл с возмещением адекватным количеством донорской плазмы и альбумина);
- в случае выраженной нефропатии целесообразно проведение гемодиализа или гемодиафильтрации;
- УФО крови (объем облученной крови 300-500 мл).
9. Обезболивание в послеоперационном периоде:
- перидуральная анальгезия растворами анестетиков, наркотических анальгетиков;
- традиционное обезболивание: наркотические и ненаркотические анальгетики.
10. Коррекция энергетического потенциала путем:
- регуляции кислородного и углеводного обменов (адекватная функция дыхания, улучшение микроциркуляции, снятие инсулиновой резистентности);
Шапкина В.А. 1 Первова О.В. 1 Черданцев Д.В. 1 Трофимович Ю.Г. 1 Дятлов В.Ю. 2 Пирова А.Ш. 1 Тахтобин Е.Г. 1
В статье представлен клинический опыт успешного лечения тяжелого распространенного гнойного перитонита. Широко используемая традиционная техника выполнения лапаростомии при лечении распространенного гнойного перитонита имеет большое количество недостатков, часто ведущих к неблагоприятному исходу заболевания. Наряду с несовершенством хирургического пособия стоит отметить, что немаловажным фактором при прогрессировании распространенного гнойного перитонита и абдоминального сепсиса является патологическая реакция иммунной системы пациента, что также может привести к неблагоприятному исходу заболевания. Описанный случай иллюстрирует комплексный подход в лечении распространенного гнойного перитонита, включающий в себя усовершенствованную методику лапаростомии и санирующих операций брюшной полости с применением проточно-инстилляционной системы по оригинальной методике, а также ведение периоперационного периода с учетом иммунных нарушений пациента.

1. Багдасарова Е.А. Влияние интраабдоминальной гипертензии на выбор хирургической тактики при распространенном перитоните / Е.А. Багдасарова, В.В. Багдасаров, А.И. Чернооков и др. // Инфекции в хирургии. – 2010. – № 4. – С. 47–52.
2. Бузунов А. Ф. Лапаростомия: Лечение хирургических заболеваний живота методом открытого ведения брюшной полости / А.Ф. Бузунов. – М.: Практическая медицина, 2008. – 207 с.
3. Савельев С.В. 80 лекций по хирургии: учебно-практическое пособие / С.В. Савельев, М.М. Абакумов, А.А. Адамян. – М.: Литтерра, 2008. – 912 с.
4. Черданцев Д.В. Современные возможности санации брюшной полости при распространенном гнойном перитоните / Д.В. Черданцев, О.В. Первова, В.Ю. Дятлов и др. // Хирургия. Журнал им. Н.И. Пирогова. — 2013. — № 10. — С. 32–37.
5. Kirkpatrick AW, Roberts DJ, Faris PD. Active Negative Pressure Peritoneal Therapy After Abbreviated Laparotomy: The Intraperitoneal Vacuum Randomized Controlled Trial // Ann Surg. 2015. Vol. 262(1). P. 38–46.
6. Roberts DJ, Ball CG, Kirkpatrik A.W. Increased pressure within the abdominal compartment: intra-abdominal hypertension and the abdominal compartment syndrome // Curr Opin Crit Care. 2016. Vol. 22 (2).P. 174 – 185.
На современном этапе развития хирургии перитонит остается одним из наиболее тяжелых осложнений абдоминальной хирургии, сохраняя высокие показатели летальности, которые, по данным разных исследований, достигают 20–35% при вторичном перитоните, 60% и выше при третичном перитоните [3, 4, 2].
Несмотря на совершенствование методов диагностики и хирургической тактики, достижения анестезиологии и реаниматологии, расширение возможностей антибактериальной терапии, перитонит осложняет течение хирургических вмешательств в 0,5–8% случаев [3, 4, 2].
По материалам Красноярского краевого гнойно-септического центра (ККГСЦ), от острых хирургических заболеваний в 2015 г. погибли 350 человек. Из них у 18 пациентов причиной летального исхода были кровотечения, у 105 пациентов — острый панкреатит, у 227 пациентов причиной смерти стали перитонит и абдоминальный сепсис. Таким образом, проблема распространенного гнойного перитонита не теряет своей актуальности и представляет собой сложную задачу, требуя комплексного подхода к лечению, поиска хирургической тактики и путей ее модификации.
Применение вакуум-ассистированной лапаростомии представляется нам многообещающим методом, позволяющим решить многие задачи в лечении разлитого гнойного перитонита. На сегодняшний день существует много различных систем локального отрицательного давления, таких как Renasys Go, PICO, Vivano и др. В своем клиническом наблюдении мы использовали технологию VivanoTec® S 042 NPWT фирмы Hartmann.
Диагностический этап для объективизации состояния больного включал: развернутый анализ крови, биохимический анализ крови, общий анализ мочи, обзорную рентгенографию брюшной полости и грудной клетки, мультиспиральную компьютерную томографию (МСКТ) брюшной полости с внутривенным болюсным контрастным усилением.
По результатам лабораторных исследований отмечались нейтрофильный лейкоцитоз до 25,29*10*9/л, повышение СОЭ до 58 мм/ч, повышение уровня активности трасаминаз, щелочной фосфотазы, увеличение уровня фибриногена, септические изменения.
По данным УЗИ в брюшной полости и малом тазу определялась свободная жидкость.
На обзорной рентгенограмме брюшной полости определялись единичные горизонтальные уровни жидкости (рис. 1).
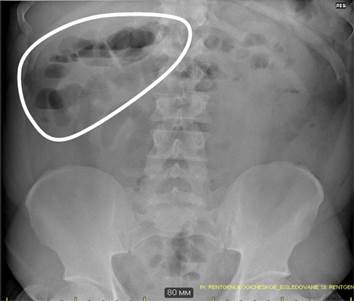
Рис. 1. Обзорная рентгенография органов брюшной полости (отмечаются расширенные петли кишечника в верхнем этаже брюшной полости с горизонтальными уровнями жидкости — чаши Клойбера)
По результатам МСКТ брюшной полости на уровне входа в малый таз, межпетельно, определялось ограниченное скопление содержимого высокой плотности, порядка 35 ед.Н (гной?), с большим содержанием газа, отграниченное от петель кишки тяжистыми уплотнениями (соединительнотканные тяжи), интимно прилежащее к сигмовидной кишке (рис. 2), общим размером 81х25х25 мм, что позволило заподозрить межпетельный абсцесс.

Рис. 2. МСКТ брюшной полости с внутривенным болюсным контрастным усилением (определяется ограниченное скопление содержимого высокой плотности, интимно прилежащее к сигмовидной кишке, — межпетельный абсцесс)
Таким образом, проведенные диагностические мероприятия позволили выявить острую хирургическую патологию органов брюшной полости, осложненную перитонитом. После минимальной предоперационной подготовки, в экстренном порядке пациент был оперирован. Выполнены лапаротомия, ревизия брюшной полости. Интраоперационно: в брюшной полости до 1000 мл фибринозно-гнойного экссудата, петли тонкой кишки делатированы до 4–4,5 см, перистальтика крайне вялая, париетальная и висцеральная брюшины инъецированы, с единичными нитями фибрина. Источник перитонита — перфорация дивертикула сигмовидной кишки. Мангеймский индекс перитонита (МИП) составил 28 баллов, индекс брюшной полости (ИБП) = 19 баллов. При оценке интегральных шкал тяжести степень полиорганной недостаточности (SOFA) составила 2 балла, тяжесть состояния (SAPS) — 11 баллов.
Выполнена обструктивная резекция сигмовидной кишки с последующим выведением сигмостомы на переднюю брюшную стенку. Брюшная полость санирована водным раствором антисептика, физиологическим раствором, осушена. Выполнена назоинтестинальная интубация тонкой кишки. Учитывая тяжесть перитонита и выраженность эндотоксикоза, было принято решение о завершении операции с наложением лапаростомы по традиционной методике.
В послеоперационном периоде пациент проходил лечение в условиях отделения реанимации ККГСЦ. На третьи сутки была выполнена программируемая санационная релапаротомия, в брюшную полость установлена вакуум-ассистированная лапаростома с использованием абдоминального набора VivanoMed® Abdominal Kit и аппарата отрицательного давления VivanoTec® (рис. 3).
На фоне многократно проводимых санирующих операций у пациента наблюдалась демедиализация мышц передней брюшной стенки с диастазом до 15 см. Во избежание формирования гигантской послеоперационной вентральной грыжи, значительно снижающей качество жизни пациента и приводящей к инвалидизации, потребовалось закрытие брюшной полости с помощью спиц Киршнера (рис. 7).
Регулярно производился посев перитонеального выпота с коррекцией антибактериальной терапии. На 7-й санации у пациента был установлен диагноз третичного перитонита. Из экссудата брюшной полости были высеяны Enterococcus faecalis ++, Proteus mirabilis ++. ++). Из инфицированной лапаротомной раны передней брюшной стенки был высеян Citrobacter species. Также были диагностированы выраженные нарушения иммунной системы. Для коррекции иммунного статуса был проведен курс иммунотропной терапии иммуноглобулином человека нормальным [IgG+ IgM+ IgA] в течение 3 суток.
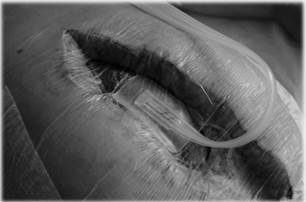
Рис. 3. Вакуум-ассистированная лапаростома

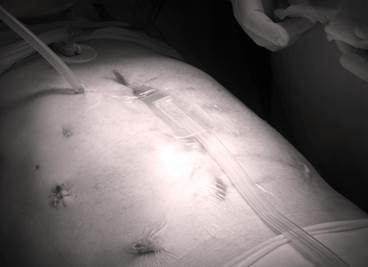
Рис. 5. Лапаростомия с применением проточно-аспирационной системы по оригинальной методике

Рис. 6. Закрытие брюшной полости при помощи спиц Киршнера
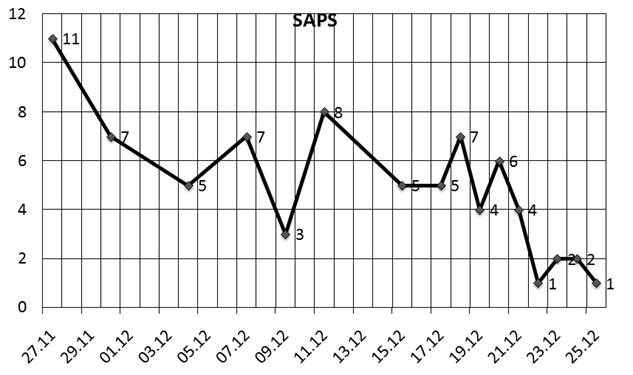
Рис. 7. Динамика изменения показателей интегральной шкалы оценки степени тяжести полиорганной недостаточности – SOFA
В результате комбинированного лечения, включающего в себя хирургические вмешательства с применением вакуум-ассистированной лапаростомы при помощи аппарата локального отрицательного давления VivanoTec®, технологии лапаростомии с применением проточно-аспирационной системы по оригинальной методике с использованием антисептика Лавасепт (рис. 5), массивную инфузионную, антибактериальную (Merexidi 6.0, Ampicillini — sulbactam 1.5 gr, Vancomicini 6,0), дезинтоксикационную терапию, коррекцию эндотоксикоза, у пациента был достигнут положительный результат. На 24-е сутки отмечались нормализация температуры, снижение лейкоцитоза до 10*9*10/л, нормализация уровня трансаминаз, отсутствие азотемии. На 27-е сутки после первичной операции пациент переведен из отделения реанимации в отделение хирургии ГСЦ.
Активизирован на 30-е сутки после первичной операции. Выписан в удовлетворительном состоянии. Общая продолжительность лечения составила 57 дней.
По истечении одного, трех месяцев и полугода после выписки пациент являлся на динамический осмотр в удовлетворительном состоянии.
Читайте также:

