Редукционную активность культуры определяют посевом в питательную среду с красителем
Обновлено: 19.09.2024
Окислительно-восстановительные реакции, лежащие в основе метаболических процессов, обеспечивающих жизнеспособность всех без исключения животных, растительных организмов и бактериальных клеток, протекают с участием двух субстратов (окисляемого и восстанавливаемого). Окисление характеризуется отщеплением атомов водорода (протонов) или электронов от субстрата-донора, восстановление-присоединением протонов или электронов к субстрату-акцептору. Ферменты, катализирующие окислительно-восстановительные реакции, объединяют в один класс оксидоредуктаз. Различают следующие основные оксидоредуктазы: аэробные оксидазы (гидрогеназы), анаэробные дегидрогеназы и цитохромоксидазы.
• Аэробные оксидазы катализируют перенос протонов или электронов с окисляемого субстрата непосредственно на конечный акцептор — кислород воздуха. Определение оксидазы используется в микробиологии для идентификации аэробных бактерий.
• Анаэробные дегидрогеназы участвуют в реакциях, в которых протоны или электроны переносятся с одного компонента окисляемой цепи на различные неорганические соединения — сульфиты, карбонаты, нитриты, нитраты, серу, железо (III) и пр.
• Цитохромоксидазы катализируют перенос только электронов. Последние на цитохромоксидазу передаются цитохромами — сложными железосодержащими белками, простетическая (небелковая) группа которых представлена гемом. Цитохромы содержатся в животных, растительных клетках, факультативно-анаэробных микроорганизмах.
В телах микробных клеток цитохромы локализуются в периплазматическом пространстве между внутренней поверхностью пептидогликанового слоя и плазматической мембраной. Все цитохромы способны принимать и отдавать электроны путем обратимого изменения валентности атомов железа, входящих в состав гема. Механизм переноса состоит в том, что электроны от субстрата воспринимаются окисленным ионом железа, содержащимся в простетической группе этого фермента. Железо восстанавливается (Fe → )Fe 2+ ), а затем электрон передается молекулярному кислороду, и при взаимодействии его с ионами водорода образуется молекула воды.
1. Оксидазные тесты. Оксидазные тесты используют для дифференциации представителей родов Neisseria, Alcaligenes, Aeromonas, Vibrio, Campylobacter, Pseudomonas, обладающих оксидазной активностью, и оксидазоотрицательных Enterobacteriaceae.
Тест основан на том, что у некоторых бактерий биологическое окисление в целях получения энергии осуществляется при помощи цитохромоксидазы либо индофенолоксидазы — железосодержащего белка гемопротеина, который катализирует перенос электронов от вещества-донора (например, НАД-Н) к веществам реципиентам (обычно к O2). Для того чтобы этот процесс получил визуальное выражение, пользуются методами Ковача или Gaby-Hadley, основанными на введении в питательную среду искусственных бесцветных реагентов в восстановленном состоянии, которые в присутствии микробной оксидазы окисляются и приобретают соответствующую им окраску.
Техника постановки теста. Оба метода могут быть воспроизведены в двух вариантах:
- в прямом с нанесением одного из реактивов непосредственно на колонии исследуемой культуры, помещенные в чашки Петри;
- в непрямом, при котором из материала исследуемой культуры платиновой петлей, запаянной пипеткой Пастера или заостренной стерильной палочкой делают мазок на полоске фильтровальной бумаги, пропитанной одним из реактивов.
P.S. *Здесь и далее рецепты красителей, индикаторов, буферных растворов, реактивов и питательных сред для постановки биохимических тестов см. в одноименном разделе, завершающем часть I.
При контакте с тетраметил-п-фенилендиамином (реактив Ковача) колонии, продуцирующие цитохромоксидазу, в ближайшие 10-30 с из бесцветных превращаются в темно-фиолетовые вследствие образования соединения вурстеровского синего.
Метод Ковача (вариант 2). Полоску фильтровальной бумаги помещают на дно чашки Петри с реактивом Ковача и пропитывают ее до влажного состояния. Затем на влажную бумагу платиновой петлей или запаянной пипеткой Пастера наносят исследуемую микробную культуру в виде мазка для микроскопии или штриха. Оксидазоположительные культуры через 20-30 с приобретают темно-синюю окраску, оксидазотрицательные — сохраняют исходный цвет.
Метод Gaby-Hadley. Техника постановки цитохромоксидазного теста методом Gaby-Hadley отличается от описанного выше метода Ковача только тем, что для выявления цитохромоксидазы используют реактив Gaby-Hadley, выполняющий роль искусственного акцептора электронов.
В присутствии цитохромоксидазы N, N-диметил-фенилендиамин с α-нафтолом (компонентом реактива Gaby-Hadley) образуют соединение индофенол синий. Цитохромоксидазные колонии и мазки, приготовленные из них, на фильтровальной бумаге в течение первой минуты окрашиваются в отчетливо синий цвет.
Примечание. При постановке теста на цитохромоксидазу посев исследуемых культур должен выполняться платиновыми, пластиковыми петлями или запаянными пастеровскими пипетками, так как на железной или нихромовой проволоке образуются окислы железа, которые могут привести к получению ложноположительных результатов. По этой же причине рекомендуется для получения дистиллированной воды пользоваться стеклянным дистиллятором.

2. Тест с лакмусовым молоком. Используется для выявления отдельных реакций метаболизма при дифференциальной диагностике и идентификации патогенных и условно-патогенных микроорганизмов.
При выращивании микроорганизмов в лакмусовом молоке выявляются различные ферментативные реакции:
— ферментация лактозы, сопровождающаяся образованием различных кислых продуктов реакции, ведущая к смещению pH в кислую зону с приобретением средой розового цвета;
— накопление достаточного количества кислоты в среде (связанное с расщеплением лактозы), сопровождающееся коагуляцией казеина с формированием казеинового сгустка;
— синтез протеолитических ферментов культивируемыми бактериями, приводящий к пептонизации казеина и превращению молока в соломенно-желтую мутную жидкость, напоминающую сыворотку;
— при активном образовании растущими бактериями декарбоксилаз, которые вступают в реакции с аминокислотами, образующими казеин, в среде накапливаются амины, pH смещается в щелочную зону с окрашиванием среды в выраженный голубовато-синий цвет;
— некоторые микроорганизмы, не вызывая существенного изменения pH среды, редуцируют лакмус, в результате чего среда обесцвечивается без изменений каких-либо других первоначальных ее свойств;
— при культивировании в лакмусовом молоке биохимически инертных бактерий никаких изменений в реакции среды и соответственно первоначального ее цвета не происходит.
Тест основан на комплексе ферментативных реакций, проявлению которых соответствуют характерные изменения первоначальных свойств питательной среды.
Учет результатов. Результаты изменения среды отмечают в протоколе исследования, пользуясь следующими обозначениями:
Н — рост бактерий, не сопровождающийся изменением реакции среды и, следовательно, изменением ее цвета;
К — кислотообразование в среде с четко выраженным ее порозовением;
НК — слабовыраженное кислотообразование, вызывающее изменение оттенка среды, улавливаемое только при сопоставлении опытной пробирки с контрольной (незасеянная среда);
Щ — щелочеобразование, сопровождающееся четко выраженным посинением среды;
НЩ —слабовыраженное щелочеобразование, вызывающее изменение оттенка среды, улавливаемое только при сопоставлении ее с цветом контрольной пробирки;
Р — редукция лакмуса, проявляющаяся полным обесцвечиванием лакмуса.
3. Тест на редукцию метиленового синего. В окисленном состоянии метиленовый синий используется при окраске микроскопических препаратов. При восстановлении краситель обесцвечивается, утрачивая свойства красящего вещества.
Редуцирующая активность в отношении метиленового синего используется в качестве дифференциально-диагностического теста при идентификации энтерококков и других видов условно-патогенных микроорганизмов.
Тест основан на способности молока, представляющего собой питательный субстрат для культивируемых микроорганизмов, при введении в него метиленового синего приобретать интенсивный голубой цвет и обесцвечиваться при росте в нем микроорганизмов с редуцирующей способностью в отношении метиленового синего.
Положительный контроль: Е. faecalis, Е. faecium.
Отрицательный контроль: Streptococcus spp.

4. Тест на редукцию ТТХ (2,3,5-трифенилтетразолия хлорида C19H15ClN4). Используется для дифференциальной диагностики энтерококков и других микроорганизмов.
Тест основан на восстановлении 2,3,5-трифенилтетразолия хлорида — бесцветного химического соединения, до трифенилформазана, который в органических растворителях и под действием продуктов жизнедеятельности некоторых видов микроорганизмов, в частности энтерококков, восстанавливается и приобретает вишневую окраску.
Учет результатов. Колонии микроорганизмов, восстанавливающих ТТХ (ТТХ+), имеют на чашке вишнево-красный цвет. Колонии (ТТХ-), не редуцирующие ТТХ или имеющие слабую редукционную активность, образуют бесцветные колонии или с неярко выраженным розоватым оттенком.
Положительный контроль: Е. faecalis.
Отрицательный контроль: Е. faecium.
5. Тест на каталазу. Каталаза (греч. katalisys — разрушение) — фермент, способствующий расщеплению перекиси водорода на воду и молекулярный кислород.
В клетках бактерий фермент образуется в процессе биохимического окисления, поэтому обнаружить его можно только в молодых жизнедеятельных культурах.
Тест на каталазу в практике микробиологических исследований используется очень широко для дифференциации и идентификации ряда патогенных и условно-патогенных бактерий.
Процесс образования каталазы может происходить в широком температурном диапазоне (+15. +40 °С) при значениях pH от 4,5 до 9,0. Тем не менее при постановке теста на определение каталазы инкубацию посевов проводят традиционно при 36(±1) °С, а каталазную активность принято определять при исходно нейтральном значении pH в условиях комнатной температуры (+20 . +22 °С).
Тест основан на том, что с первых же секунд контакта перекиси водорода с каталазой начинается ее расщепление, сопровождающееся более или менее интенсивным выделением пузырьков кислорода.
Посевы инкубируют при 36(±1)°С не более суток. Для выявления каталазы у выделенных культур предложено 2 способа:
Способ 1. На поверхность выращенной в чашке Петри или пробирке микробной культуры наносят тест-реактив — свежеприготовленный 3% раствор перекиси водорода с таким расчетом, чтобы он тонким слоем покрыл поверхность культуры.
Способ 2. На чистое, хорошо обезжиренное предметное стекло наносят каплю свежеприготовленного 3% раствора перекиси водорода и эмульгируют в ней 1 петлю исследуемой культуры.
При наличии каталазы в микробной культуре на поверхности среды или в капле раствора перекиси водорода на предметном стекле в первые же 2-3 с появляются пузырьки кислорода. Газообразование может быть бурным или умеренным. Независимо от его интенсивности реакция учитывается как положительная.
Появление единичных пузырьков или наступление газообразования в более отдаленные сроки (13-15 с) расценивается как реакция сомнительная, требующая повторной постановки.
Отсутствие газообразования или появление одиночных пузырьков газа через продолжительное время после добавления реактива определяется как реакция отрицательная.
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.
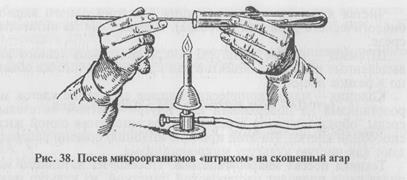
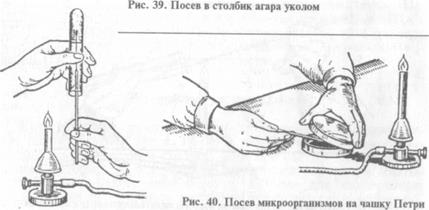
При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.
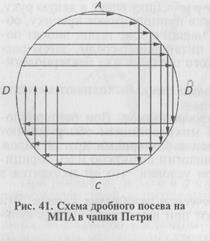
Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов. Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
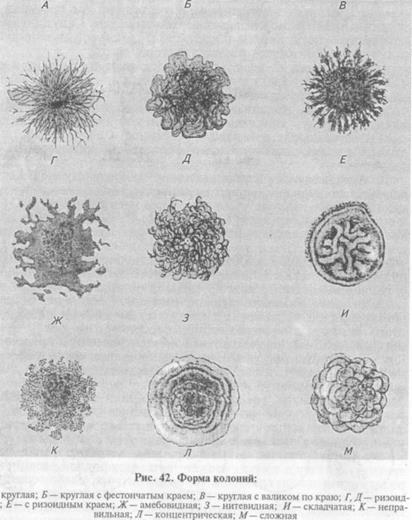
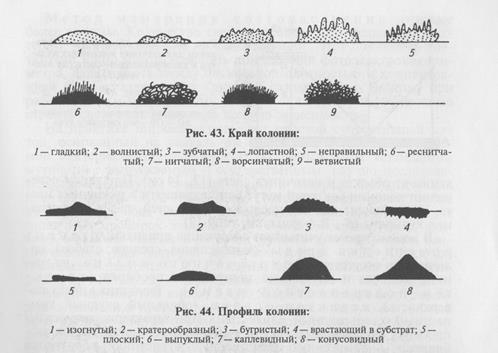
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.
Ценную дополнительную информацию об особенностях строения колоний дает их изучение в косопадающем пучке света (рис. 46). Культуры на прозрачной агаровой среде в чашках Петри помещают на предметный столик бинокулярной лупы. Между бинокулярной лупой и источником света помещают зеркало от микроскопа вогнутой стороной вверх таким образом, чтобы лучи, отраженные от него, попадали в плоскость изучаемого объекта под углом 40. 45°. Зеркало устанавливают на равном удалении от объекта и источника света (12. 14 см). При таком освещении колонии бактерий могут быть окрашены в различные цвета. Цвет зависит как от видовых особенностей, так и от состояния культуры (S-, R-формы, см. тему 12).
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1. Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2. Какие методы применяют для получения чистых культур микроорганизмов?
3. Какие культуральные признаки учитывают при идентификации бактерий?
4. Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
Дифференциально-диагностические питательные среды для культивирования бактерий. Среды содержащие белки. Среды содержащие углеводы. Среды для определения редуцирующей способности бактерий.
Дифференциально-диагностические среды (например, среды Хисса, Кларка) применяют для изучения и идентификации отдельных типов, видов и групп бактерий. В качестве основы применяют различные органические и неорганические соединения, гидролизаты казеина, пептонную воду, бульон Хоттингера-Мартена, дополненные углеводами, спиртами, мочевиной и другими веществами; при их расщеплении происходит сдвиг рН в кислую (углеводы, спирты, липиды) или щелочную (белки) сторону. Соответственно, выделяют среды с углеводами и спиртами, среды с мочевиной, среды для определения индолообразоваиия, среды для определения протеолитической активности и комбинированные (политропные) среды. В такие среды также часто вносят различные индикаторы (например, бромтимоловый синий, индикатор Андраде, бромкрезоловый пурпурный и крезоловый красный), помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андраде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании реактив Андраде и индикатор бром-тимоловый синий не меняют цвет среды. Все дифференциально-диагностические среды разделяют на четыре основные группы.
Среды, содержащие белки, дающие характерные изменения под действием бактериальных ферментов (кровь, желатина, молоко и др.), применяют для определения гемолитических или протеолитических свойств. Наиболее распространены мясопептонная желатина (МПЖ), свернувшаяся лошадиная сыворотка, молоко и кровяной агар (КА).

Среды, содержащие углеводы или многоатомные спирты. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды, а иногда и образованию газа. Наиболее распространены цветные среды с различными углеводами (например, с бромтимоловым синим, индикатором ВР), лакмусовое молоко (среда Минкевича) и среды Хисса. Из углеводов наиболее часто используют моносахариды (ксилозу, арабинозу, глюкозу, фруктозу, маннозу, галактозу), дисахариды (лактозу, мальтозу, сахарозу), полисахариды (крахмал, гликоген, инулин, декстрин), спирты (дульцит, маннит, сорбит, глицерин) и гликозиды (адонит, инозит, салицин, амигдалин).
Среды для определения редуцирующей способности. В эту группу входят среды с красками, обесцвечивающимися при восстановлении (например, метиленовый голубой, нейтральный красный, индигокармйн), а также среды с нитратами для определения денитрифицирующей активности бактерий (при положительном результате среды окрашиваются в синий цвет).
Среды, включающие вещества, ассимилируемые только определённой группой бактерий. Наиболее известны нитратный агар Симмонса и цитратная среда Козера.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Свидетельство и скидка на обучение каждому участнику
Питательная среда – это однокомпонентный или многокомпонентный субстрат, который применяют для культивирования микроорганизмов. Питательные среды являются не заменяемой составляющей для работы микробиологов.
Актуальность темы заключается в том, что не одно исследование в микробиологии не проходит без питательных сред. Все живые существа контактируют с микробами, являясь не только их распространителями, но и носителями. Самые первые среды были сконструированы и применены Пастером и Кохом. Особая роль в этом открытие принадлежит Роберту Коху. Постулировав необходимость выделения чистой культуры микроба, он определил необходимые условия решения этой задачи.
Важнейшим из них явился состав питательной среды, на которой можно было бы получить рост микроорганизмов. Внедрение в микробиологическую практику в 1881 г. плотных питательных сред позволило осуществить в контролируемых условиях рост колоний. Был предложен желатин как компонент твердой среды. Впоследствии стали использовать агар-агар[1].
В 19 – 20 веке разработки Роберта Коха по питательным средам интенсивное развитие. В 20 веке большое развитие получило конструирование питательных сред это развитие связано с развитий микробиологических технологий. Чтобы получить жизнеспособный посев микроорганизмов нужно правильно подобрать питательную среду.
Питательная среда нужна для жизнедеятельности и накопления, выделения и сохранения микроорганизмов и синтеза целевого продукта. Питательная среда должна состоять из макроэлементов и микроэлементов, которые должны входить в среду в легкоусвояемом для микроорганизмов виде.
Цель данной работы изучить питательные среды, их классификацию, и требования к ним.
Данная цель определила для изучения следующие задачи:
1. Изучить искусственные питательные среды;
2. Рассмотреть классификацию питательных сред, и способы их получения;
3. Изучить требования, предъявляемые к питательным средам.
Искусственные(синтетические)питательные среды - имеют определенный химический состав и точное количественное содержание питательных веществ. Они используются для изучения метаболизма, бактерий, исследования физиологии и биохимии микроорганизмов. К синтетическим среды могут служить среды Козера и Симмонса, используемые для изучения способности бактерий утилизировать цитраты. В состав этих сред, наряду с другими солями, входят цитрат натрия и индикатор.
Предназначена для приготовления жидких и плотных питательных сред, которые используются при проведении микробиологических исследований.
Среда Симмонса-питательная среда для распознавания энтеробактерий, сухая представляет собой некий мелкодисперсный гомогенный, гигроскопичный, светочувствительный порошок, который светло-бежевого цвета [5].
Состав (в пересчете на 1 л готовой среды):
•Аммоний фосфорнокислый - 2,0 г.
•Калия фосфат однозамещенный - 0,7 г.
•Магний сернокислый 7-водный - 0,8 г.
•Натрий лимоннокислый трехзамещенный 5,5-водный пищевой - 3,0 г.
•Агар микробиологический - 11,5 г.
•Бромтимоловый синий водорастворимый, индикатор - 0,04 г.

Рисунок 1. Среда Симмонса
Среда Козера(рис.2).
Предназначена для идентификации энтеробактерий по признаку утилизации цитрата натрия при санитарном обследовании пищевых продуктов и объектов внешней среды.
Представляет собой мелкодисперсный гигроскопичный порошок желтого цвета. Фасовка в пластиковые банки по 100 г.

И так, искусственные среды готовят по определенным рецептам из всевозможных настоев или отваров животного, а также растительного происхождения с добавлением неорганических солей, углеводов и азотистых веществ [4].
Например, в бактериологической практике в большинстве случаев применяют сухие питательные среды, которые чаще всего получают на основе достижений современной биотехнологии. Для их приготовления применяют экономически выгодное непищевое сырье: утратившие срок годности кровезаменители (гидролизин-кислотный гидролизат крови животных, аминопептид-ферментативный гидролизат крови; продукты биотехнологии (кормовые дрожжи, кормовой лизин, виноградная мука, белколизин). Сухие питательные среды имеют длительный срок годности, а так же удобны при транспортировке и могут иметь относительно стандартный состав.
Питательные среды имеют следующую классификацию:
1)по консистенции питательные среды бывают:
Плотные среды делают путем добавления к жидкой среде 1,5-2% агара, полужидкие - 0,3-0,7 % агара. Агар, как вам известно, представляет собой продукт переработки особого вида морских водорослей, он плавится при температуре 80-86 °С, затвердевает при температуре около 40 °С и в застывшем состоянии делает среду плотной. В тех или иных случаях для получения плотных питательных сред используют желатин (10-15%). Ряд естественных питательных сред (свернутая сыворотка крови, свернутый яичный белок) сами по себе являются плотными.
Следующим будет целевое назначение среды, и классифицируют их на:
К основным можно отнести среды, применяемые для выращивания многих бактерий. Это триптические гидролизаты мясных, рыбных продуктов, крови животных или казеина, из которых готовят жидкую среду - питательный бульон, а также плотную среду - питательный агар.
Такие среды являются основой для приготовления сложных питательных сред - сахарных, кровяных и др., удовлетворяющих пищевые потребности патогенных бактерий.
Элективные питательные среды нужны для выборочного выделения и накопления микроорганизмов определенного вида из материалов, которые содержат всевозможную постороннюю микрофлору. При создании элективных питательных сред исходят из биологических особенностей, которые отличают данные микроорганизмы от большинства других. К примеру, избирательный рост стафилококков может наблюдаться при повышенной концентрации хлорида натрия, холерного вибриона -- в щелочной среде.
Дифференциально-диагностические питательные среды обычно применяются для разграничения отдельных видов (или групп) микроорганизмов. Принцип построения этих сред основан на том, что разные виды бактерий имеют различие между собой по биохимической активности в результате разного набора ферментов.
Ну и наконец, особую группу составляют синтетические и полусинтетические питательные среды. В состав синтетических сред входят, как правило, химически чистые вещества, а именно: аминокислоты, минеральные соли, углеводы, витамины. В полусинтетические среды дополнительно включают пептон, дрожжевой экстракт и другие питательные вещества. Эти среды обычно применяют в научно-исследовательской работе и в микробиологической промышленности при получении антибиотиков, вакцин и других препаратов. В последние годы в целях экономии питательных сред и ускоренном распознавании некоторых микроорганизмов (энтеробактерии, стафилококки, стрептококки и др.) применяются так называемые микротест-системы (МТС). Они состоят из полистироловых пластин с лунками, в которых содержатся стерильные дифференциально-диагностические среды. Стерилизацию осуществляют обычно УФ-облучением.
К питательным средам предъявляют следующие основные требования:
1) питательными, они содержать в просто усвояемом виде все вещества, нужные для удовлетворения потребностей таких как пищевых и энергетических. Ими являются источники органогенов и минеральных (неорганических) веществ, в том числе микроэлементы. Минеральные вещества не только входят в структуру клетки и активизируют ферменты, но и определяют физико-химические свойства сред (осмотическое давление, рН и др.). При культивировании ряда микроорганизмов в среды вносят факторы роста - витамины, некоторые аминокислоты, которые клетка не может синтезировать;
Микроорганизмы, как все живые существа, нуждаются в большом количестве воды [3].
2) иметь лучшую сосредоточение водородных ионов - рН так, как при хорошей реакции среды, которая влияет на проницаемость оболочки, мельчайшие организмы могут усваивать питательные вещества. Для большинства патогенных бактерий оптимальна слабощелочная среда (рН 7,2-7,4). Исключение будет холерный вибрион - его оптимум находится в щелочной зоне (рН 8,5-9,0) и возбудитель туберкулеза, нуждающийся в слабокислой реакции (рН 6,2-6,8).
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили рН, среды должны обладать буферностью, т. е. содержать вещества, нейтрализующие продукты; обмена;
3) быть изотоничными для микробной клетки; т. е. осмотическое давление в среде должно быть аналогичным, как внутри клеточки. Для большей части микробов наилучшая среда, которая соответствует пол процента раствора натрия хлорида;
4) быть стерильными, в связи с тем, что посторонние бактерии препятствуют росту изучаемого микроорганизма, определению его параметров и изменяют характеристики среды (состав, рН и др.);
5) плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию;
6) обладать определенным окислительно-восстановительным потенциалом, т. е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH2. Этот потенциал показывает насыщение среды кислородом. Для одних микроорганизмов нужен высокий потенциал, для других - низкий. Например, анаэробы размножаются при RH2 не выше 5, а аэробы - при RH2 не ниже 10. Окислительно-восстановительный потенциал большинства сред удовлетворяет требованиям к нему аэробов и факультативных анаэробов [4];
Лучше, чтоб среды были прозрачными - удобнее смотреть за ростом культур, легче чтобы не было загрязнение среды сторонними микробами.
Заключение
И так, в заключение хотелось бы отметить, для выделения и культивирования микроорганизмов могут применяться разные питательные среды, состоящие из различного сырья.
Подбор и оптимизация питательных сред является одной из важнейших задач при культивировании микроорганизмов. При подборе сред необходимо учитывать не только компоненты, необходимые для роста биомассы, но также включать соединения, необходимые для роста микроорганизмов.
Микробиологию представить без питательных сред представить невозможно. Так как современные требования к микробиологии диктуют свои правила, и без питательных сред существовать сама наука не может. Что существенно помогает определяет информативность, и точность микробиологического анализа.
Также существует классификация питательных сред по их назначению. Вследствие этого среды делятся на общего назначения (универсальные) и специального. Общего назначения питательные среды используются для культивирования многих видов бактерий. К ним можно отнести, мясопептонный бульон, мясопептонный агар.
Специальные питательные среды используют для некоторых видов микроорганизмов, с целью изучения их свойств, хранения и определения видовой принадлежности. Питательные среды имеют разнообразный состав. Широко известным является среда агар-агар. Она состоит из самого агара – агара, представляющего собой полисахарид, выделяемый из морских водорослей. Особенностью агар-агара является образование в воде геля, который расплавляется при температуре 80-100 0С.
И твердеющую при температуре 37-400С. Бактерии не расщепляют агар ввиду отсутствия у них фермента целлюлозы. Устойчивость его к разжижающемуся действию большинства микроорганизмов, и также способность образовывать студни что поспобствовала широкому её распространению в науке бактериологии. Наличие в составе крови и сыворотки, обеспечивает абсорбирование продуктов метаболизма. Присутствие соли, буферной смеси обеспечивает нормальное развитие микроорганизмов. Восстанавливающие вещества применяют чтобы снизить окислительное - восстановительный потенциал. Углеводы, многоатомные спирты, индикаторы, красители и ингибиторы применяют для питания микроорганизмов, для выявления патогенных форм и окрашивания [5].
Подводя итог всего вышеизложенного, можно прийти к следующим выводам, что питательная среда должна отвечать следующим требованиям: содержать в себе все необходимые для размножения бактерий вещества в легкоусвояемой форме; иметь оптимальные влажность, вязкость, рН, быть изотоничной и по возможности прозрачной. Каждая питательная среда проходит стерилизацию определенным способом в зависимости от ее состава.
1. Воробьев А. А. Медицинская и санитарная микробиология / А. А. Воробьев, Ю. С. Кривошеин, В.П. Широбоков. - М.: Академия, 2017. - 17 c
2. Емцев В.Т. Микробиология / В В.Т..Т. Емцев, Е.Н. Мишустин. - М.: Дрофа, 2016. - 176 c.
3. Меджидов, М.М. Справочник по микробиологическим питательным средам. - М.: Медицина, 2003.- С.15-19
4. Поляк, М.С. Питательные среды для медицинской и санитарной микробиологии//Поляк М.С. В.И. Сухаревич, М.Э. Сухаревич. СПБ.:элби – СПБ.- 2008. С.19-23
5. Шепелин А.П., Дятлов И.А. Питательные среды для энтеробактерий М.; Издательство "Династия", 2017, - 232 ст.
Читайте также:

