Технология получения химерных животных и растений
Обновлено: 05.10.2024
Началом систематических исследований химер явилась работа А.Тарковского из Краковского университета, сообщившего в 1961 г. об успешном объединении делящихся мышиных эмбрионов. Соединенные в пару бластоцисты образовали при культивировании в питательной среде единую крупную бластоцисту. Самым трудным в создании химеры оказался первый шаг. При обычном развитии эмбрионы окружены специальной оболочкой, предохраняющей их от спонтанной агрегации. При первых экспериментах эту оболочку удаляли механическим путем, засасывая эмбрион в узкий капилляр, что было подлинным испытанием как для исследователей, так и для самих эмбрионов, нещадно повреждаемых при этом. Это было только начало – тогда дальше получения зародыша продвинуться не удалось.
Год спустя американская исследовательница Б.Минц вырастила знаменитых мышат, одним из “родителей” которых были клетки опухоли, ведущей происхождение от эмбриона. Минц предложила растворять оболочку ферментом проназой. Фермент обнажает эмбрионы, а затем их надо столкнуть друг с другом (здесь в ход идут стеклянные иглы, пинцеты, волосяные петли и требуется высокое искусство – надо вовремя остановить процесс растворения белка, чтобы не задеть то, что лежит под оболочкой). Можно использовать и растительный белок – фитогемагглютинин, который хорошо склеивает клетки. Соприкоснувшись, зародыши продолжают слипаться самопроизвольно. Так получают агрегационных химер. Эксперименты показали, что агрегация благополучно совершается между эмбрионами, находящимися на 8–16 или на 32 стадиях клеточного деления. Лучше всего, если соединяются эмбрионы одного возраста. Минц первой удалось не только объединить пару эмбрионов (у которых было таким образом четыре родителя), но даже по десять и более, формируя огромные бластоцисты.
Чтобы создать инъекционную химеру, бластоцисту закрепляют в пипетке и с помощью микроманипуляторов проделывают в ее оболочке отверстие, сквозь которое также пипеткой вводят донорскую клетку. Это более сложный способ, и к нему прибегают, если по каким-то причинам бластоцисты не могут объединиться или если надо получить межвидовые химеры. Во втором случае важно, чтобы оболочка бластоцисты оказалась “своей” для ткани матки и чтобы клетки введенной бластоцисты были надежно упрятаны под этой оболочкой.
На сегодня с химерами млекопитающих работают десятки лабораторий, где, в полном смысле слова, “лепят” животных. В дело идут кусочки крошечных эмбрионов, а точнее, фрагменты бластоцист или целые бластоцисты. Объединенные бластоцисты имплантируют в организм приемной матери. У новорожденных организм оказывается построенным из разных клеток, ведущих родословную не от двух, как обычно, а от четырех и более родителей. Поэтому химер называют иногда еще “четырехродительскими” животными (tetraparental animals).
Тарковский впервые ввел термин “химеры” для обозначения таких животных, а Минц использовала другой синоним – аллофенные мыши, что указывает на их происхождение в результате агрегации эмбрионов. Однако термин “аллофенные” не совсем удачен, и лучше его не использовать. По-видимому, также лучше не использовать термин “мозаичные” для обозначения животных, возникших в результате агрегации клеток двух зародышей, так как мозаичные особи образуются из одной оплодотворенной яйцеклетки. Различные клеточные популяции у мозаиков возникают в ходе развития, как результат мутаций, рекомбинаций или нерасхождения хромосом в соматических клетках. Итак,
Химера - организм-мозаик, сочетающий клетки, ткани, органы различных организмов.
Химера - организм, который состоит из тканей двух особей, имеющих соматические клетки с различными генотипами. Химеры возникают в результате соматических мутаций, генетических рекомбинаций, нарушений клеточного деления, а также при вегетативных прививках.
Были созданы и молекулярные химеры. Так в генной инженерии называют организм, имеющий составной геном, то есть объединяющий в одном ядре ДНК из разных организмов. Пример такой химеры – бактерия E. coli, в плазмиду которой включены куски ДНК другой бактерии или высшего организма.
Созданы комбинации, которые носят название химеропласты (РНК+ДНК), назначение которых – ремонт подпорченной ДНК. В качестве вектора в этом случае используется обыкновенный вирус простуды, а еще лучше липосомы.
Само существование химер есть иммунологический парадокс. У них не обнаружено каких-либо признаков иммунологической несовместимости клеточных популяций разного генотипа. Как может быть, что две разные популяции клеток уживаются в очевидной гармонии, ведь они отличаются и генетически, и своими антигенами? Наиболее очевидный ответ таков: между лимфоидными клетками двух клеточных популяций возникает взаимная иммунологическая толерантность, и эта взаимная терпимость скорее врожденная, чем приобретенная. Каков же механизм преодоления иммунного конфликта, похож ли он на терпимость к “своим” антигенам у обычного, не химерического животного?
У агрегационных химер были выделены клетки лимфатических узлов и им устроили специальную проверку. Неожиданно выявилась взаимная неуживчивость обоих типов, хотя в самом организме они благополучно сосуществуют. Лимфоциты разных линий атаковали друг друга. Далее лимфоциты разных линий были смешаны с фибробластами (клетками соединительной ткани тех же линий). В этом опыте решили посмотреть – выживут ли фибробласты? Если останутся живыми, значит лимфоциты воюют только друг с другом, не реагируя на ткань собственного организма. Если фибробласты погибнут, значит, и тут процветает вражда. Оказалось, что в результате мощной иммунной атаки (лимфоцит А против фибробласта В и наоборот) клетки тканей были разрушены. Так где же здесь, спрашивается, толерантность?
Самым неожиданным оказалось то, что иммунная атака лимфоцитов предотвращалась сывороткой, извлеченной из крови химер. Из этих экспериментов последовал ясный вывод, что обе иммунные системы химеры настроены друг к другу очень нетерпимо, но что в сыворотке организма есть особый блокирующий фактор, усмиряющий конфликт. Предполагается, что блокирующим фактором могут быть антитела и комплексы антиген-антитело. Если бы блокирующий фактор обнаруживался у всех химер, можно было бы говорить о какой-то универсальной закономерности. Все, однако, оказалось сложнее. При некоторых комбинациях клеток блокирующий фактор у химер почему-то не образуется. Возможно, сосуществование клеточных линий поддерживается особыми лимфоцитами, так называемыми Т-супрессорами. У этих лимфоцитов особая задача: не атаковать антиген, а, наоборот, охлаждение иммунного пыла атакующих Т-лимфоцитов.
В конечном счете, химеры позволили впервые наглядно убедиться в том, что каждая ткань организма, каждый организм ведут свое происхождение от определенных “начальных” клеток. Потомство единичной недифференцированной клетки называется клоном. В этом смысле любой обычный индивидуум есть клон от единственной оплодотворенной зиготы. Химера, созданная агрегацией двух зародышей, содержит два таких исходных клона.
Химеры убедили также, что все развитие индивидуального организма состоит из чередующихся периодов. В одних – преобладает активное движение клеток, когда они переползают с места на место, перемешиваются. В другие периоды идет активное размножение клеток. В это время в общей массе недифференцированных клеток обособливаются отдельные группы, превращающиеся в зачатки органов и тканей. Минц впервые составила такие подсчеты: две клетки дают начало печени; каждый позвонок ведет происхождение от четырех клеток; все волосяные фолликулы закладываются их трех клеток.
В современной медицине остро стоит проблема несовместимости, и химеры показывают, как решается проблема иммунного конфликта у генетически разнородных клеток. С иммунным статусом химер прямо связана степень их устойчивости к опухолевым заболеваниям.
Работа с химерами становится удобным методом в работе селекционеров. Часто хозяйственные показатели какой-то породы животных улучшают скрещиванием ее с другой породой. Но с какой именно скрещивать? Объединение двух или более типов клеток в одной химере позволит быстро увидеть, как сочетаются признаки разных линий друг с другом. Это позволит быстро проиграть ситуацию – стоит вести долгую селекционную работу по объединению признаков двух пород или нет.
Инъекционные химеры способны сослужить поистине бесценную службу. С их помощью можно законсервировать редкий генофонд. Если клетки животных вымирающего или очень редкого вида запрятать в бластоцисту другого вида, то в появившемся на свет химерическом животном будут сохранены гены исчезающего вида и со временем прогресс биотехнологии позволит восстановить и сами виды.
И, что очень важно, химеропласты позволили поставить на практическую основу разработку методов лечения генетических заболеваний.
Техника получения химерных, или, как их еще называют, аллофенных, зародышей сейчас лучше всего освоена на млекопитающих. Этому способствует отсутствие у них ооплазматической сегрегации и, следовательно, полное равенство всех клеток на ранних стадиях. Два зародыша на стадиях двух — восьми бластомеров, извлеченных из мышей разных генетических линий (часто используют линии с разной окраской шерсти), помещают в капельку питательной среды и сближают друг с другом, так что они сливаются в один зародыш. Затем химерный зародыш переносят в матку третьей мыши, в которой и происходит его развитие. В большом проценте случаев из таких составных зародышей развиваются и рождаются совершенно нормальные мышата, состоящие из клеток двух линий. Если эти линии различались по окраске шерсти (например, черные и белые), то шкурка этих мышат будет содержать полосы черного и белого цвета.
Другой способ получения химер называется инъекционным. В этом случае используют более поздний зародыш, содержащий около ста клеток и представляющий собой полый пузырек — бластоцисту, в которой только несколько клеток — зародышевый узелок или внутренняя клеточная масса — дадут начало самому эмбриону. В такую бластоцисту инъецируют клетки зародыша другой линии. Часть этих клеток прилипает к зародышевому узелку и включается в состав развивающегося эмбриона.
При обоих методах клетки двух линий мышей распределяются в зародыше совершенно случайно, и поэтому полосы разного цвета у химерных мышат располагаются также случайно. Тем не менее американской исследовательнице Минц удалось при изучении сотен таких мышат показать, что в распределении полос того или иного цвета по шкурке есть некоторая закономерность. Существенно уже то, что окраска образует полосы, а не пятна или точки. В черный или белый цвет может быть окрашена та или иная из 17 поперечных полос, причем отдельно для правой или левой стороны головы, для спины и хвоста, т. е. всего таких полос может быть 34. Каждая из этих полос может быть белой или черной с равной вероятностью. Легко подсчитать, что в этом случае из десятков аллофенных мышат трудно встретить двух одинаково окрашенных.
Из этих опытов Минц сделала важный вывод о том, что в тот момент развития, когда пигментные клетки детерминировались, их было всего 34. Далее каждая из них в результате ряда делений образовала популяцию пигментных клеток, которые перемещались очень ограниченно, только вдоль узкой зоны кожи, идущей от хребта к животу, и каждая из них определила окраску одной полосы. Однако провести такой же анализ клеток пигментного эпителия глаза оказалось невозможно: в ходе развития черные и неокрашенные клетки перемешиваются и группу пигментированных клеток нельзя считать потомством одной первично-детерминированной клетки. Опыты с химерами позволили получить и другие интересные данные, хотя их интерпретация не всегда может быть однозначной.
Пол восьмиклеточных зародышей в момент их слияния друг с другом неизвестен, и поэтому в 50 % случаев возникают химеры, состоящие из смеси женских клеток с двумя Х-хромосомами (XX) и мужских клеток с половыми хромосомами (XY). Оказалось, что чаще, хотя и не всегда, пол таких химер мужской, причем нередко возникают гермафродиты, у которых одна половая железа мужская, а другая — женская. Можно думать, что пол железы определяется случайно возникающим соотношением в ней клеток с XX- и XY-генотипами, причем XY-клетки оказывают более сильное влияние.
У химерных мышей в крови присутствуют эритроциты обеих линий, но оказалось, что доля эритроцитов одной из линий мышей (С57В1) всегда больше, чем другой (СЗН). Очевидно, способность кроветворных клеток к размножению у разных линий мышей различна. Зато в печени у этих химер преобладают клетки линии СЗН.
Очень интересны химеры в отношении их способности к образованию опухолей. Так, линия мышей АКР отличается высокой частотой опухолей лимфатической ткани — лимфом, а линия СЗН — опухолей печени — гепатом. У химер между этими линиями возникают и те и другие опухоли, причем лимфомы всегда образуются из клеток АКР, а гепатомы — из СЗН. Создается впечатление, что опухоли возникают совершенно автономно от остального организма и определяются только генотипом клеток. Однако если получать химеры различных высокораковых линий с низкораковой линией СВА, то частота образования опухолей заметно снижается. Механизм этого важного явления пока непонятен.
Особо следует остановиться на опытах с инъекционными химерами, когда в бластоцисту вводили клетки особой опухоли — тератокарциномы. Эту опухоль можно получить искусственно, если пересадить нормальный зародыш какой-либо линии мышей под кожу взрослой мыши и потом регулярно переносить растущий трансплантат от мыши к мыши. В результате возникает тератокарцинома — перевиваемая опухоль, в центре которой находятся быстро размножающиеся недифференцированные клетки, а по периферии образуются участки самых различных дифференцированных тканей. Но при инъекции в бластоцисту центральной части такой опухоли ее клетки входят в состав зародыша и перестают быть опухолевыми. Они ведут себя как обычные химеры, т. е. становятся нормальными клетками различных органов взрослой мыши. Вероятно, это первый пример того, как опухолевые клетки под влиянием эмбриональных тканей превращаются в нормальные клетки организма. Однако потомство с генотипом опухолевой линии от этих химерных мышей получить пока не удалось. Клетки тератокарциномы, являясь опухолевыми, сохраняют большие потенции и могут дифференцироваться во многих направлениях, но способность образовывать нормальные половые клетки ими, вероятно, все же утрачивается. Особые химеры были получены в нашей стране Н. Г. Хрущовым. Облученной мыши, чьи кроветворные клетки были убиты, в кровяное русло вводили клетки костного мозга или селезенки крысы. У мыши образовывались кроветворные колонии крысиных клеток. Их судьбу и дальнейшие превращения было легко проследить благодаря особенностям мышиных и крысиных клеток, легко различимым под микроскопом.
У дрозофилы химеры создаются при инъекции эмбриональных ядер одной линии мух в оплодотворенное яйцо другой линии, имеющее свои ядра. Судьба инъецированных ядер зависит от места их введения. На заднем конце яйца они становятся половыми клетками. В других частях яйца они попадают в ту или иную область поверхностной цитоплазмы и соответственно образуют клетки, входящие в состав тканей личинки или взрослой мухи. При этом они сохраняют отличительные особенности своей генетической линии. Сходный результат получают и при инъекции в яйцо ядер из некоторых многократно перевиваемых культур клеток дрозофилы, но половые клетки при этом не образуются. Очень важно, что при некоторых обстоятельствах клетки еще не теряют способности к дифференцировке, но уже не могут образовать половые клетки. Это заставляет взглянуть на зародышевый путь не как на полезную абстракцию, а как на определенную реальность.
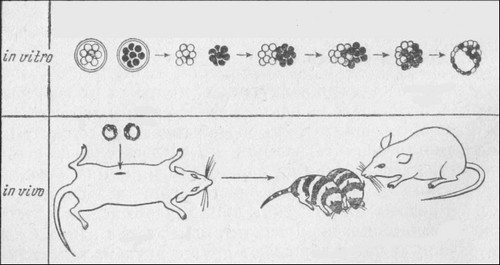
Слияние ранних зародышей приводит к появлению аллофенных мышей (химер)

Техника получения химерных, или, как их еще называют, аллофенных, зародышей сейчас лучше всего освоена на млекопитающих. Этому способствует отсутствие у них ооплазматической сегрегации и, следовательно, полное равенство всех клеток на ранних стадиях. Два зародыша на стадиях двух — восьми бластомеров, извлеченных из мышей разных генетических линий (часто используют линии с разной окраской шерсти), помещают в капельку питательной среды и сближают друг с другом, так что они сливаются в один зародыш. Затем химерный зародыш переносят в матку третьей мыши, в которой и происходит его развитие. В большом проценте случаев из таких составных зародышей развиваются и рождаются совершенно нормальные мышата, состоящие из клеток двух линий. Если эти линии различались по окраске шерсти (например, черные и белые), то шкурка этих мышат будет содержать полосы черного и белого цвета.
Другой способ получения химер называется инъекционным. В этом случае используют более поздний зародыш, содержащий около ста клеток и представляющий собой полый пузырек — бластоцисту, в которой только несколько клеток — зародышевый узелок или внутренняя клеточная масса — дадут начало самому эмбриону. В такую бластоцисту инъецируют клетки зародыша другой линии. Часть этих клеток прилипает к зародышевому узелку и включается в состав развивающегося эмбриона.
При обоих методах клетки двух линий мышей распределяются в зародыше совершенно случайно, и поэтому полосы разного цвета у химерных мышат располагаются также случайно. Тем не менее американской исследовательнице Минц удалось при изучении сотен таких мышат показать, что в распределении полос того или иного цвета по шкурке есть некоторая закономерность. Существенно уже то, что окраска образует полосы, а не пятна или точки. В черный или белый цвет может быть окрашена та или иная из 17 поперечных полос, причем отдельно для правой или левой стороны головы, для спины и хвоста, т. е. всего таких полос может быть 34. Каждая из этих полос может быть белой или черной с равной вероятностью. Легко подсчитать, что в этом случае из десятков аллофенных мышат трудно встретить двух одинаково окрашенных.
Из этих опытов Минц сделала важный вывод о том, что в тот момент развития, когда пигментные клетки детерминировались, их было всего 34. Далее каждая из них в результате ряда делений образовала популяцию пигментных клеток, которые перемещались очень ограниченно, только вдоль узкой зоны кожи, идущей от хребта к животу, и каждая из них определила окраску одной полосы. Однако провести такой же анализ клеток пигментного эпителия глаза оказалось невозможно: в ходе развития черные и неокрашенные клетки перемешиваются и группу пигментированных клеток нельзя считать потомством одной первично-детерминированной клетки. Опыты с химерами позволили получить и другие интересные данные, хотя их интерпретация не всегда может быть однозначной.
Пол восьмиклеточных зародышей в момент их слияния друг с другом неизвестен, и поэтому в 50 % случаев возникают химеры, состоящие из смеси женских клеток с двумя Х-хромосомами (XX) и мужских клеток с половыми хромосомами (XY). Оказалось, что чаще, хотя и не всегда, пол таких химер мужской, причем нередко возникают гермафродиты, у которых одна половая железа мужская, а другая — женская. Можно думать, что пол железы определяется случайно возникающим соотношением в ней клеток с XX- и XY-генотипами, причем XY-клетки оказывают более сильное влияние.
У химерных мышей в крови присутствуют эритроциты обеих линий, но оказалось, что доля эритроцитов одной из линий мышей (С57В1) всегда больше, чем другой (СЗН). Очевидно, способность кроветворных клеток к размножению у разных линий мышей различна. Зато в печени у этих химер преобладают клетки линии СЗН.
Очень интересны химеры в отношении их способности к образованию опухолей. Так, линия мышей АКР отличается высокой частотой опухолей лимфатической ткани — лимфом, а линия СЗН — опухолей печени — гепатом. У химер между этими линиями возникают и те и другие опухоли, причем лимфомы всегда образуются из клеток АКР, а гепатомы — из СЗН. Создается впечатление, что опухоли возникают совершенно автономно от остального организма и определяются только генотипом клеток. Однако если получать химеры различных высокораковых линий с низкораковой линией СВА, то частота образования опухолей заметно снижается. Механизм этого важного явления пока непонятен.
Особо следует остановиться на опытах с инъекционными химерами, когда в бластоцисту вводили клетки особой опухоли — тератокарциномы. Эту опухоль можно получить искусственно, если пересадить нормальный зародыш какой-либо линии мышей под кожу взрослой мыши и потом регулярно переносить растущий трансплантат от мыши к мыши. В результате возникает тератокарцинома — перевиваемая опухоль, в центре которой находятся быстро размножающиеся недифференцированные клетки, а по периферии образуются участки самых различных дифференцированных тканей. Но при инъекции в бластоцисту центральной части такой опухоли ее клетки входят в состав зародыша и перестают быть опухолевыми. Они ведут себя как обычные химеры, т. е. становятся нормальными клетками различных органов взрослой мыши. Вероятно, это первый пример того, как опухолевые клетки под влиянием эмбриональных тканей превращаются в нормальные клетки организма. Однако потомство с генотипом опухолевой линии от этих химерных мышей получить пока не удалось. Клетки тератокарциномы, являясь опухолевыми, сохраняют большие потенции и могут дифференцироваться во многих направлениях, но способность образовывать нормальные половые клетки ими, вероятно, все же утрачивается. Особые химеры были получены в нашей стране Н. Г. Хрущовым. Облученной мыши, чьи кроветворные клетки были убиты, в кровяное русло вводили клетки костного мозга или селезенки крысы. У мыши образовывались кроветворные колонии крысиных клеток. Их судьбу и дальнейшие превращения было легко проследить благодаря особенностям мышиных и крысиных клеток, легко различимым под микроскопом.
У дрозофилы химеры создаются при инъекции эмбриональных ядер одной линии мух в оплодотворенное яйцо другой линии, имеющее свои ядра. Судьба инъецированных ядер зависит от места их введения. На заднем конце яйца они становятся половыми клетками. В других частях яйца они попадают в ту или иную область поверхностной цитоплазмы и соответственно образуют клетки, входящие в состав тканей личинки или взрослой мухи. При этом они сохраняют отличительные особенности своей генетической линии. Сходный результат получают и при инъекции в яйцо ядер из некоторых многократно перевиваемых культур клеток дрозофилы, но половые клетки при этом не образуются. Очень важно, что при некоторых обстоятельствах клетки еще не теряют способности к дифференцировке, но уже не могут образовать половые клетки. Это заставляет взглянуть на зародышевый путь не как на полезную абстракцию, а как на определенную реальность.

Слияние ранних зародышей приводит к появлению аллофенных мышей (химер)

Продолжаем знакомить вас с тонкостями работы биотехнологов. Готовы поспорить, что каждый из чтецов этого текста слышал о генно-модифицированных организмах, сокращенно ГМО. Кто-то их боится, кто-то считает их спасением от глобальных проблем человечества, кому-то абсолютно все равно.
Однако мы готовы поспорить, что большая часть читателей даже не представляет, как на практике создают этих самых ГМО или, как их правильнее называть в среде ученых, трансгенных организмов и генетических химер.
Химера или химерный организм — организм, несущий в себе генетический материал, принадлежащий двум и более видам живых существ. Химерой может быть как многоклеточный организм, так и одноклеточный. Кроме того, различают химер по тому, насколько и в каком качестве присутствует чужеродный геном: заимствована ли часть генов, встроены ли они в хромосому реципиента, или же оба генома сохранены полностью, но располагаются в разных клетках. Впрочем, это тема для отдельного поста.
Итак, чтобы создать генетически модифицированный организм, надо изменить его геном. В научной среде изменение генома называется трансформацией.
Трансформация генов – это изменение генетического состава клеток путем привнесения извне чужеродного генетического материала, перенос чужеродных (природных или искусственно созданных) донорских генов в клетки-реципиенты растений, животных и микроорганизмов, и получение таким образом трансгенных организмов с новыми или усиленными свойствами и признаками.
Секундное отступление. Трансформация — не изобретение человека. Бактерии умели передавать друг другу ДНК, захватывать чужую и встраивать ее в свой геном еще задолго даже до появления вирусов. Более того, эти свойства не утрачены даже у более развитых организмов. И, что еще более интересно, природная трансформация, также известная как горизонтальный перенос генов, играет огромную роль в эволюционных механизмах. Но это весьма обширная тема.
Стоит отметить, что трансформация имеет свои особенности для растений и животных. Растительные клетки из-за плотной клеточной стенки поверх мембраны неспособны самостоятельно поглощать фрагменты чужеродной ДНК и воспроизводить их, тогда как клетки животных могут различными способами поглощать фрагменты ДНК, встраивая их в свой геном, или поддерживать их воспроизведение в цитоплазме.
Исходя из этого учеными было разработано два основных метода генетической трансформации растений и еще пять – для животных. Разумеется, на самом деле их гораздо больше, однако по большей части это модификации основных семи. Рассмотрим вкратце каждый из них.
Векторный
По сути является лабораторной адаптацией механизма, называемого трансдукцией — обмен генами у бактерий и некоторых простейших. Пожалуй, он так же заслуживает отдельной статьи, но постараемся кратко.
Вектор — трансформирующий фактор, основой которого является самостоятельный фрагмент ДНК, несущий все необходимое для синтеза РНК и белка. Обычно на основе ДНК или РНК вируса, плазмиды или космиды (свободные генетические элементы бактерий и простейших).
В промышленной и сельскохозяйственной биотехнологии обычно создают векторы с помощью Ti-плазмид бактерий, так как они небольшие по объему, и относительно устойчивые.
Как их создают? Из плазмид выделяют участки Т-ДНК (транспортной), ответственные за встраивание в молекулу ДНК клетки-мишени и создают векторные ДНК (векторы), способные переносить и встраивать нужные последовательности, включая части, кодирующие нужный признак и вещество, а также маркеры (репортерные гены — они нужны для проверки — встроился ли вектор в ДНК реципиента).

Модифицированные агробактерии (или освобожденные плазмиды) помещают в одну среду с растительными клетками-реципиентами, откуда с помощью антибиотиков удаляют нетрансформированные клетки.
К векторной трансформации также относят перенос ДНК с помощью ретровирусов. Векторный перенос можно осуществить только при отсутствии клеточной стенки (т.е. необходимо привести клетку-донор в состояние протопласта).
Трансформированные клетки помещают в питательную среду для культивации (образование каллуса), впоследствии регенерируя из них целое растение.
- Плюсы: адресность (можно сделать так, чтобы вектор встраивался только в определенные участки), возможность проконтролировать встраивание вектора и его сохранность в следующих поколениях клеток.
- Минусы: большая подготовительная работа по синтезу и созданию вектора и его размножению, опасность случайных встраиваний.
Биобаллистический (Генный пистолет)
Пожалуй, это самый фантастический способ трансформации. И самый страшный для людей, которые всерьез боятся стать жертвами генной модификации. Ведь его принцип действия полностью соответствует его названию. Да, именно так — это пистолет, стреляющий… генами.

В специальных установках микрочастицы золота или вольфрама с нанесенной на них ДНК ускоряют при помощи сжатого гелия, и они проникают в ДНК клеток-мишеней. Как вариант этого метода встречается магнетофекция – перенос с помощью намагниченных металлических частиц.
- Плюсы: мобильность (можно таскать с собой в поле) и массовость (обработка большого количества клеток разом или целого растения).
- Минусы: внесенная ДНК практически ничем не защищена и может быстро потерять активность, нельзя проконтролировать встраивание.
Векторный и биобаллистический методы универсальны и для растений, и для бактерий, и для животных. Теперь же переходим к методам, характерным для трансформации животных клеток. В принципе, их так же можно применить на растительных клетках, однако придется лишить их клеточной стенки, и знатно повозиться с подготовкой клетки.
Метод микроинъекций
Это самый простой способ внести ДНК в клетку. Вы часто видели его в научно-фантастических фильмах на тему утечки какого-нибудь патогена из секретной лаборатории.
Суть ее заключается во введении целевых генов непосредственно в ядро животной клетки при помощи микрокапиллярной пипетки. Под микроскопом в ядро клетки вводится 1 × 10^(−10)—1 × 10^(−12) л раствора трансформирующей ДНК (несколько тысяч копий генов).

- Плюс: главный плюс этого метода в том, что введенный ген сохраняется внутри клетки, а клеточные структуры почти не повреждаются.
- Минус: при делении клетки только одна из дочерних клеток наследует дополнительную ДНК
Электропорация
Впервые была разработана в лаборатории Е. Неймана в 1982 т. для введения чужеродных нуклеиновых кислот в эукариотические клетки.
В многочисленных опытах было показано, что обработка клеток животных электрическими импульсами с напряженностью поля 5-10 кВ/см в течение 5-10 мкс приводит к поглощению клетками молекул ДНК, находящихся в среде.

- Плюсы: простота использования (кладем клетки в ванну с электролитом, капаем ДНКу, врубаем ток, профит!).
- Минусы: плохая контролируемость встраивания, повреждения ДНК и клеточных мембран.
Липофекция
С чем-то подобным сталкиваются блюстители красоты, пользующиеся лосьонами с мицеллами и принимающие жирорастворимые витамины.
Липосомы (мицеллы, везикулы) — “пузырьки” из одного или двух слоев липидов, по свойствам схожих с естественной клеточной мембраной. В основном различают так: липосомы — двухслойные, содержат комплекс гликолипидов, мицеллы — однослойные, преимущественно липидные. Но это не точно:)
Липосомный (везикулярный) метод – пиноцитозное (захват раствора) поглощение метафазных хромосом, заключённых в синтетическую фосфолипидную оболочку (линохромосом или липоплекса). Изолированные метафазные хромосомы способны проникать в чужеродную клетку и функционировать в ней в течение некоторого времени.

Большая часть поглощенных хромосом деградирует, распадаясь на отдельные фрагменты, осуществляющие перенос содержащихся в них генов. Фрагменты могут существовать в свободном состоянии. Гены трансгенома функционируют наряду с другими своими хромосомными генами клетки. Такие популяции клеток называют нестабильными.
При постоянном действии генов трансгенома появляются стабильные популяции клеток (клоны) – когда сохранившийся фрагмент интегрируется с хромосомой клетки реципиента. Интеграция происходит не путем рекомбинаций через двойной кроссинговер, а через транслоцирование фрагментов на негомологичные участки генома реципиента.

Соматическая гибридизация
Слияние соматических клеток с объединением их геномов — образование гибридома. Производится электрическим, химическим и механическим путем. Частный случай гибридизации – использование микрокеток, иногда объединяют с липофекцией.

Введение с помощью микроклеток – клетки доноров обрабатываются таким образом, что часть хромосом или отдельные хромосомы оказываются заключенными в часть цитоплазмы. Слияние микроклетки донора с полноценной клеткой реципиента ведет к тому, что реципиент получает группу или отдельные хромосомы донора.
Это один из самых трудоемких методов создания трансформированных клеток. Однако он полностью оправдывает себя — так, например, производят антитела для лечения редких заболеваний, иммуноглобулины и создают из клеток больных раком пациентов индивидуальные лекарства.
Химическая преципитация
Метод несколько схож с генным пистолетом с той лишь разницей, что частицы ДНК не выстреливаются, а доставляются на соли.
Например, преципитация фосфатом кальция выглядит следующим образом. ДНК добавляют к смеси раствора СаСl2 и фосфатного буфера, ДНК адсорбируется на кристаллах фосфата кальция (Грэхем Ван дер Эб, 1973). Образуются частицы кальциевого преципитата. Они поглощаются клеткой путем фагоцитоза.
Основные методы трансформации закончились. Познакомимся с редкими, но все же встречающимися — некоторые из них весьма любопытны.
Органическая преципитация. Катионные полимеры
По сути, гибрид химической преципитации и фагоцитоза. В основном используют ДЕАЕ-декстран. Преципитация диэтиламиноэтил-декстраном (ДЕАЕ-декстраном) – использование положительно заряженных (катионных) водорастворимых полимеров, таких как ДЭАЭ-декстран, полиэтиленимин, поли-L-лизин или хитозан. Отрицательно заряженная ДНК связывает поликатионы, и образовавшийся положительно заряженный комплекс (полиплекс) взаимодействует с отрицательно заряженной мембраной клетки, что приводит к проникновению ДНК в клетку-мишень путем эндоцитоза. Метод считается малоэффективным из-за сложности с синтезом комплекса и слабом контроле доставки ДНК в ядро.

Фототрансфекция
Перенос фрагментов ДНК через поры, образованные в результате сверхкороткого облучения лазером. По сути, та же электропорация, только вместо тока — свет определенной длины волны.
Трансдукция
Вариация векторного метода для животных клеток. Имеет ряд отличий, например, в качестве вектора применяется фрагмент вирусной ДНК (ретровирусы, ДНК-вирусы, ВИЧ), чаще всего заключенный в реконструированную вирусную оболочку для облегчения проникновения в клетку и обеспечения тканеспецифичности.
Есть и еще менее популярные методы, как, например, трансформация тепловым шоком. Однако она сама по себе не привносит ДНК извне, лишь изменяя структуру существующей ДНК за счет температурных повреждений. Либо тепловой шок может служить тем же фактором повреждения мембраны, что и электрошок, открывая путь для проникновения ДНК. Но в таком случае, по сути он ничем не отличается от вышеназванных.
Итак, мы рассмотрели основные методы создания химерной (трансформированной) клетки или популяции клеток. Несмотря на то, что их характеристика по большей части уместилась в паре строк, каждый из них сопряжен с колоссальными усилиями как при подготовке, так и при исполнении, и тем более при контроле результата. Последнее особенно важно, так как любая клетка имеет свои механизмы защиты.
Мало трансформировать геном, надо еще обеспечить его сохранность и устойчивость — в противном случае, клетка быстро избавится от чужеродного фрагмента, вырезав его или растворив в лизосоме.
Для чего это делают?
На самом деле, трансформированные организмы давно уже нас окружают и служат нам. Стоит только подумать над тем, что первые научные работы на эту тему (на тему трансформации у бактерий) датированы до 1962 года, т.е. до подтверждения структуры ДНК! А сами бактериальные химеры стали применять аж в 1980-х.
Выше мы уже упоминали, что с помощью гибридов изготовляют лекарства от рака и редких заболеваний. Также с помощью трансформированных клеток производят гормоны (человеческий инсулин, ген которого перенесли в кишечную палочку), иммуноглобулины, белки, витамины (витамин С с помощью той же кишечной палочки, фитогормоны для растений с помощью сенной палочки), ферменты для пищевой, текстильной, химической промышленности, биоудобрения и биопрепараты для борьбы с паразитами и вредителями, антибиотики и даже очищают сахар (хотя это совсем уж редкий случай).

Биотехнология: учебник и практикум для вузов / под редакцией Н. В. Загоскиной, Л. В. Назаренко. — 3-е изд., испр. и доп. — Москва: Издательство Юрайт, 2020. — 381 с.
Биотехнология / Т. Г. Волова. – Новосибирск: Изд-во Сибирского отделения Российской Академии наук, 1999. – 252 с
Биотехнология. Принципы и применение / Под ред. И.Хиггенса.- М.: Мир, 1980
Чечина, О. Н. Общая биотехнология: учебное пособие для вузов / О. Н. Чечина. — 2-е изд., перераб. и доп. — Москва: Издательство Юрайт, 2019. — 231 с.
Clough SJ, Bent AF. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 1998 Dec;16(6):735-43.
Godfrey J, Leukam MJ, Smith SM. An update in treating transformed lymphoma. Best Pract Res Clin Haematol. 2018 Sep;31(3):251-261.
Alton, E. W. F. W., Armstrong, D. K., Ashby, D., Bayfield, K. J., Bilton, Diana, Bloomfield, E. V.,… Wolstenholme-Hogg, P. (2015). Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis: A randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Respiratory Medicine, 3(9), 684-691.
Читайте также:

