Замедленное созревание ворсинчатого дерева
Обновлено: 07.09.2024
Цель исследования. Изучение особенностей состояния фетоплацентарного комплекса при различных вариантах нарушений формирования ворсинчатого дерева.
Материал и методы. Обследовано 119 беременных. 1‑я группа (контроль) — 33 женщины с нормальным строением ворсинчатого дерева; 2‑я группа — 43 наблюдения с патологией формирования терминальных ворсин (подгруппа 2А — 27 пациенток с дефицитом терминальных ворсин при относительно нормальном развитии стромы и сосудов, подгруппа 2Б — 16 наблюдений с выраженным склерозом стромы и редукцией сосудов); 3‑я группа — 43 женщины с незрелостью ворсинчатого дерева (подгруппа 3А — 30 наблюдений с преобладанием дифференцированных промежуточных ворсин, подгруппа 3Б — 13 пациенток с преобладанием недифференцированных промежуточных ворсин). Проводили сравнительный анализ результатов ультразвукового исследования, допплерометрии и кардиотокографии.
Результаты исследования. Не выявлено статистически достоверных различий показателей контрольной группы и групп сравнения при оценке степени зрелости и толщины плаценты, количества околоплодных вод, кровотока в маточной артерии, средней мозговой артерии и аорте плода, а также при проведении кардиотокографии в III триместре. Обнаружено статистически достоверное снижение кровотока в артерии пуповины у женщин с преобладанием недифференцированных промежуточных ворсин.
Ключевой проблемой современного акушерства и неонатологии является плацентарная недостаточность — клинический синдром, обусловленный морфологическими и функциональными изменениями в плаценте и проявляющийся нарушением роста и развития плода, его гипоксией, которые возникают в результате сочетанной реакции плода и плаценты на различные нарушения состояния беременной [2, 4, 6]. В течение беременности взаимоотношения материнского организма и развивающегося зародыша опосредованы сложной системой мать-плацента-плод, все звенья которой тесно взаимосвязаны и в совокупности определяют нормальные рост и развитие плода [5, 10, 16]. Нарушение любого из звеньев данной системы может неблагоприятно отразиться на состоянии плода. При изучении проблемы плацентарной недостаточности как клиницисты, так и морфологи традиционно главное внимание уделяют изучению показателей маточного кровотока, который определяет поступление кислорода и питательных веществ от матери к плаценте, и изменениям в ней, непосредственно связанным с нарушениями материнского кровотока. В то же время следует понимать, что полноценное снабжение плода необходимыми субстанциями зависит не только от их поступления с кровью матери, но не в меньшей степени и от способности самой плаценты к адекватному транспорту этих веществ [1, 3, 9, 12].
В последние десятилетия внимание ученых стало привлекать изучение клинической значимости другого звена материнско-плацентарно-плодового кровотока — ворсинчатого дерева, содержащего фетальные кровеносные сосуды. Известно, что способность различных типов ворсин к транспорту
кислорода и питательных веществ существенно различается. В связи с этим очевидно, что нарушения формирования ворсинчатого дерева могут сопровождаться такими проявлениями плацентарной недостаточности, как внутриутробная гипоксия, задержка развития плода и др. [7, 8, 11].
Целью настоящего исследования явилось изучение особенностей состояния фетоплацентарного комплекса при различных вариантах нарушений формирования ворсинчатого дерева.
Материал и методы исследования
Проведено комплексное изучение основных показателей функции фетоплацентарной системы и вариантов строения ворсинчатого дерева, установленного на основании морфологического исследования последа у 119 беременных. Пациентки были разделены на следующие группы. 1-ю группу (контроль) составили 33 женщины, у которых строение ворсинчатого дерева соответствовало норме. Во 2-ю группу были включены 43 женщины с патологией формирования терминальных ворсин (подгруппа 2А — 27 пациенток, в плацентах которых отмечался дефицит терминальных ворсин при относительно нормальном развитии стромы и сосудов, подгруппа 2Б — 16 пациенток с выраженным склерозом стромы и редукцией сосудов — вариант хаотичных склерозированных ворсин).
В 3-ю группу вошли 43 женщины, в плацентах которых диагностирована незрелость ворсинчатого дерева (подгруппа 3А — 30 пациенток с преобладанием дифференцированных промежуточных ворсин, подгруппа 3Б — 13 пациенток с преобладанием недифференцированных промежуточных ворсин).
Необходимо подчеркнуть, что морфологическое исследование плаценты проводилось при сроке беременности более 37 нед, так как на более ранних сроках определение степени зрелости ворсинчатого дерева может быть неточным. Исследование последов проводили по методике, описанной А.П. Миловановым [5]. При макроскопическом исследовании оценивали форму плаценты, наличие по ее краю ободка или вали-ка, место прикрепления пуповины, количество и состояние сосудов в пуповине. Изучали состояние хориональной пластинки, отмечали наличие массивного отложения фибриноида, наличие гематом или кист. При исследовании материнской поверхности плаценты оценивали целостность ее ткани, наличие патологических очагов в паренхиме. Для гистологического исследования брали 6-8 кусочков плаценты из центральной и парацентральной зон. Фиксацию, проводку и приготовление парафиновых срезов проводили по общепринятой методике. Использовали окраску гематоксилином и эозином, пикрофуксином по Ван-Гизону, реактивом Шиффа. Степень васкуляризации определяли в промежуточных и термин.
Плацентарная недостаточность – синдром, при котором плацента не способна поддерживать адекватный обмен между организмом матери и плода. Она может быть первичной и вторичной.
Первичная плацентарная недостаточность возникает при формировании плаценты в период имплантации, раннего эмбриогенеза и плацентации под влиянием разнообразных факторов (генетические, эндокринные, инфекционные и др.), действующих на гаметы родителей, зиготу, бластоцисту, формирующуюся плаценту. Большое значение имеет ферментативная недостаточность децидуальной ткани, например, при дисфункции яичников. Первичная плацентарная недостаточность характеризуется анатомическими изменениями строения, расположения, прикрепления плаценты, дефектами васкуляризации и нарушением созревания хориона. Это способствует возникновению неразвивающейся беременности и врожденных пороков развития плода. Клинически она проявляется угрозой прерывания беременности или самопроизвольным абортом в ранние сроки беременности.
Вторичная плацентарная недостаточность обусловлена действием экзогенных факторов на сформировавшуюся плаценту, что, как правило, наблюдается во второй половине беременности. Она может развиться остро или хронически. К проявлениям острой относят преждевременную отслойку нормально расположенной плаценты с образованием ретроплацентарной гематомы, обширные циркуляторные нарушения в виде кровоизлияний в межворсинчатое пространство, децидуальную оболочку, строму ворсин; тромбы, свежие инфаркты, полнокровие, ангиоматоз ворсин. Плод нередко погибает и беременность прерывается.
Хроническая плацентарная недостаточность развивается рано, в начале второй половины беременности и протекает длительно. Она может быть относительной и абсолютной. При относительной – сохраняются и даже усиливаются компенсаторно–приспособительные процессы, беременность может закончиться своевременными родами жизнеспособным здоровым ребенком. Однако возможно отставание плода в развитии, а при неблагоприятных акушерских ситуациях развивается хроническая гипоксия плода и внутриутробная смерть.
Микроскопически: в плаценте отмечается сочетание компенсаторных (увеличение числа резорбционных и терминальных ворсин, капилляров, функционирующих синцитиальных узелков, синцитиокапиллярных мембран), инволютивно–дистрофических (увеличение количества фибриноида, сужение межворсинчатого пространства, фиброз ворсин, склероз сосудов, обызвествление узелков), воспалительных (не всегда), циркуляторных (инфаркты, тромбозы, гиперемия, снижение показателя васкуляризации ворсин, гиперплазия капилляров ворсин) изменений с нарушением процесса созревания хориона (ускоренное, замедленное, диссоциированное созревание) и нередко с гипоплазией плаценты и ее патологической незрелостью.
Ускоренное созревание ворсин хориона, которое обычно возникает на основе нормально развивающейся плаценты в последние 8–10 недель беременности, характеризуется удлинением ворсин, уменьшением их толщины с формированием типичного ворсинчатого дерева с большим количеством терминальных ворсин. Фиброз стромы старых, центрально расположенных ворсин и превращение их в стволовые отсутствует, образуются новые периферически расположенные незрелые ворсины, не образуются терминальные и резорбционные ворсины. Это бывает при поздних гестозах беременных, привычном невынашивании, длительной угрозе прерывания беременности, хроническом пиелонефрите и др.
При замедленном созревании ворсины остаются стромальными и продолжают расти и ветвиться за счет образования добавочных ветвей. Плацента большая, но терминальных ворсин мало. Это бывает в случаях изосенсибилизации по резус–фактору, при некоторых формах сахарного диабета и инфекционных заболеваниях (сифилис, токсоплазмоз и др.).
Диссоциированное созревание ворсин хориона характеризуется наличием ворсин разных размеров, различной степени зрелости и васкуляризации, что нередко сочетается с врожденными пороками развития плода, а также хроническим виллузитом.
Абсолютная плацентарная недостаточность – наиболее тяжелая форма, которая развивается на фоне нарушения созревания хориона. Характерно преобладание инволютивно–дистрофических процессов, резкое снижение показателя васкуляризации ворсин (большое количество аваскулярных ворсин). При этой патологии, как правило, возникают гипотрофия, хроническая гипоксия плода вплоть до его внутриутробной гибели, а беременность протекает на фоне угрожающего аборта или преждевременных родов.
Патология последа
В последе различают плаценту, пуповину и оболочки. В них возникают те же патологические процессы, что и в других органах: дистрофии, расстройства кровообращения, воспаление, ВПР, опухоли. К специфическим для этого органа процессам относится его недостаточность.Из перечисленных патологических процессов наибольшее влияние на плод оказывают воспаление, некоторые ВПР и плацентарная недостаточность.
Воспаление. Воспалительные изменения тканей последа отличаются известным своеобразием:
1. В межворсинчатом пространстве, в ворсинах и в хориальной пластинке экссудация и эмиграция лейкоцитов может происходить из двух источников – крови матери и крови плода;
-в базальной пластинке – только из крови матери, а в пуповине – только из крови плода.
Инфильтрация лейкоцитами пуповины с возникновением подэпителиальных абсцессов при интактных сосудах ее может идти за счет материнских лейкоцитов из околоплодных вод. Эмиграция лейкоцитов наблюдается лишь у зрелых плодов, однако описаны очаги гнойного воспаления (абсцессы) в тканях 4–5-месячного плода.
2. В межворсинчатом пространстве воспаление протекает внутри кровеносного русла матери, следовательно, говорить об экссудации в общепринятом смысле с выходом экссудата за пределы сосудистого русла не приходится.
3. Хориальная пластинка плаценты и пуповина лишены капилляров и содержат лишь крупные сосуды плода, способные, однако, осуществлять функцию капилляров при воспалении в смысле экссудации и эмиграции лейкоцитов.
4. Амнион и париетальный хорион в зрелом последе вовсе лишены сосудов, инфильтрация их лейкоцитами может происходить из сохранившихся кровеносных сосудов отпадающей оболочки или околоплодных вод.
Виды воспаления. По характеру воспаление в последе может быть экссудативным и пролиферативным, по течению – острым и хроническим. Чаще всего наблюдаются экссудативные формы воспаления, преимущественно серозно-гнойного характера, причем гнойное расплавление тканей встречается редко. По-видимому, возможны фибринозное воспаление и серозно-геморрагическое. Причины воспаления многообразны, чаще оно вызывается бактериальной флорой, реже вирусами, грибами, микоплазмой, хламидиями, токсоплазмой и др. Может быть асептическим, или стерильным. В последнем случае оно чаще вызывается действием мекония, изменением РН околоплодных вод и другими раздражителями.
Термин плацентит (воспаление плаценты) без указания локализации воспалительных изменений в ней следует избегать, применяя более конкретные наименования. По локализации в плаценте следует различать следующие формы воспаления:
Интервиллезит – воспаление, локализующееся в межворсинчатом пространстве. По локализации различают следующие формы интервиллезита:
1) субхориальный – расположенный под хориальной пластинкой в виде полосы обильного скопления лейкоцитов и фибрина;
2) центральный – в отдалении от хориальной и базальной пластинок;
3) базальный – локализующийся непосредственно над базальной пластинкой.
Виллузит (от villus – ворсина) – воспаление ворсины. Следует различать терминальный и стволовой виллузиты. При первом поражаются терминальные ворсины, при втором – стволовые.
Базальный децидуит – воспаление базальной пластинки. Проявляется лейкоцитарной инфильтрацией, дистрофическими и некротическими изменениями децидуальных клеток и стенок спиральных артерий и соответствующих вен, пролиферативными изменениями стенок сосудов.
Плацентарный хориоамнионит – воспаление хориальной пластинки. Часто сочетается с субхориальным интервиллезитом и ангитами ветвей сосудов пуповины. Могут поражаться как вены, так и артерии.
Воспаление пуповины носит название фуникулита. Макроскопически, за редким исключением, фуникулит не проявляется. Микроскопически он сказывается чаще всего флебитом, артериитом (причем последний наблюдается реже и только при наличии первого) и периваскулитом. Для этих воспалительных изменений наиболее характерна инфильтрация стенок сосудов и прилежащего к ним вартонова студня сегментоядерными лейкоцитами с небольшой примесью лимфоцитов, часто сочетающаяся с краевым стоянием лейкоцитов; причем в большинстве случаев лейкоцитарная инфильтрация не достигает эпителиального покрова пуповины.
Воспаление внеплацентарных оболочек называется мембранитом (париетальным амниохориодецидуитом), если в воспалительный процесс вовлечены все три слоя (амнион, гладкий хорион, истинная отпадающая оболочка);
-париетальным хориоамнионитом (хориодецидуитом) – если поражены два слоя;
-париетальным амнионитом или децидуитом при поражении лишь одного слоя.
Пути инфицирования.
Инфекция проникает в послед восходящим, гематогенным и нисходящим путями. Самым частым путем является в о с х о д я щ и й, когда возбудитель из влагалища через канал шейки матки проникает в полость амниона, чаще всего при раннем разрыве оболочек и отхождении вод. Однако и целые оболочки не являются неодолимым препятствием. Такое инфицирование обычно наступает интранатально, или в последние часы антенатального периода. Для восходящего пути со стороны последа наиболее характерны: амнионит (как париетальный, так и плацентарный), хорионит, хориоамнионит, интервиллезит, децидуит и фуникулит (т.н. амниотический тип воспаления). У плода при восходящем пути инфицирования могут поражаться: любые участки кожной поверхности и слизистых оболочек, соприкасающихся с инфицированными водами непосредственно, дыхательные пути, альвеолярные ходы, альвеолы (путем аспирации), а также пищеварительный тракт (при заглатывании). При г е м а т о г е н н о м инфицировании возбудитель заносится в плаценту из крови матери через спиральные артерии отпадающей оболочки плаценты или через сосуды эндометрия в истинной отпадающей оболочке. Такое инфицирование чаще наступает антенатально. Для этого пути наиболее характерны: виллузит, субхориальный интервиллезит (инфильтраты локализуются в интервиллезном пространстве под хориальной оболочкой), базальный децидуит и воспаление сосудов пуповины (т.н. паренхиматозный типа воспаления). Со стороны плода для гематогенного пути более характерно поражение органов, особенно богато снабжающихся кровью и не граничащих с внешней средой – прежде всего печени, надпочечников, почек, селезенки и др. Локализация воспаления при нисходящем пути инфицирования зависит от того, какой отдел плаценты прилежит к отверстию маточной трубы. Возможны смешанные пути инфицирования, при которых процесс часто начинается как восходящий или гематогенный.
Последствия для плода.
Инфицирование оболочек может быть причиной преждевременных родов, инфицирования плода с развитием местных и генерализованных гнойно–воспалительных заболеваний плода и новорожденного. При ограниченном хориоамнионите клинические проявления могут вообще отсутствовать. Перивиллузит может сопровождаться задержкой внутриутробного развития плода, виллузит – развитием инфекции у плода, поражением отдельных органов.

1. Catov J.M., Scifres C.M., Caritis S.N., Bertolet M., Larkin J., Parks W.T. Neonatal outcomes following preterm birth classified according to placental features. Am. J. Obstet. Gynecol. 2017. vol. 216. no. 4. Р. 411.e1-411.e14. doi: 10.1016/j.ajog.2016.12.022.
2. Nijman T.A., van Vliet E.O., Benders M.J., Mol B.W., Franx A., Nikkels P.G., Oudijk M.A. Placental histology in spontaneous and indicated preterm birth: A case control study. Placenta. 2016. vol. 48. Р. 56-62. DOI: 10.1016/j.placenta.2016.10.006.
3. Ismail K.I., Hannigan A., Kelehan P., Fitzgerald B., O'Donoghue K., Cotter A. Small for gestational age infants and the association with placental and umbilical cord morphometry: a digital imaging study. J. Matern. Fetal. Neonatal Med. 2019. vol. 27. P. 1-8. DOI: 10.1080/14767058.2019.1582628.
5. Ptacek I., Smith A., Garrod A., Bullough S., Bradley N., Batra G., Sibley C.P., Jones R.L., Brownbill P., Heazell A.E. Quantitative assessment of placental morphology may identify specific causes of stillbirth. BMC Clin. Pathol. 2016. vol. 9. no. 16. P. 1. DOI: 10.1186/s12907-016-0023-y.
6. Saha S., Biswas S., Mitra D., Adhikari A., Saha C. Histologic and morphometric study of human placenta in gestational diabetes mellitus. Ital J. Anat. Embryol. 2014. vol.119. no. 1. P. 1-9.
7. Милованов А.П., Ерофеева Л.М., Александрович Н.В., Золотухина И.А. Строение плаценты человека во II и III триместрах беременности // Морфология. 2012. Т. 142. №5. Р. 64-67.
8. Almasry S.M., Elfayomy A.K. Morphometric analysis of terminal villi and gross morphological changes in the placentae of term idiopathic intrauterine growth restriction. Tissue Cell. 2012. vol. 44. no. 4. P. 214-219. DOI: 10.1016/j.tice.2012.03.006.
9. Перепелица С.А., Голубев А.М., Смердова Е.Ф. Морфология плаценты при очень ранних преждевременных родах // Детская медицина Северо-Запада. 2018. Т. 7. № 1. С. 254-255.
11. Островская О.В., Кожарская О.В., Супрун С.В., Мусатов Д.В., Обухова В.Г., Ивахнишина Н.М., Нагоовицына Е.Б., Власова М.А., Лебедько О.А. Морфометрическая характеристика терминальных ворсин при инфицировании плаценты возбудителями внутриутробных инфекций // Тихоокеанский медицинский журнал. 2018. №4 (74). С. 29-33.
Преждевременные роды имеют непредсказуемые последствия для здоровья новорожденного, всегда вызывая опасения как у докторов, так и будущих родителей. Основные факторы плацентарной недостаточности, патофизиологический механизм, можно широко разделить на нарушения кровотока и обменную способность по синцитиокапиллярным мембранам ворсин плаценты плода. Плацентарная недостаточность имеет значительные связи с неблагоприятными исходами беременности (перинатальная смертность и заболеваемость). Несколько подходов были направлены на скрининговое обнаружение плацентарной недостаточности, например единообразное определение гипотрофии плода, использование ультразвуковых профилей доплера и использование траекторий роста с помощью ультразвуковой биометрии плода. Однако роль плацентарной морфометрии и морфологии, связь между структурными поражениями плаценты и неонатальными исходами не полностью понятна и заслуживает дальнейшего изучения [1; 3].
Цель исследования: изучить морфологические особенности плаценты человека во II и III триместре беременности в норме и при различной экстрагенитальной патологии.
Материал и методы исследования
Проанализировано 22 истории родов женщин, родоразрешившихся в сроках беременности 22-40 недель, с изучением акушерско-гинекологического анамнеза, экстрагенитальной патологии, особенностей течения беременности и родов. Материалом для исследования послужили центральные и краевые участки плаценты новорожденных (размером 1 см3) в различных сроках гестации. Использовали классический метод О.В. Волковой и Ю.К. Елецкого: фиксация в 10% нейтральном формалине, промывка органа, обезвоживание в батарее спиртов и заливка в парафин. На ротационном микротоме LEICA RM 2245 получили срезы плаценты толщиной 6 мкм, с последующей окраской гематоксилином и эозином. Серийные срезы изучали с помощью светового микроскопа LEICA с цифровой фотокамерой (увеличение х100, х200, х400, х1000), описывали структуру ворсинок плаценты и межворсинчатого пространства, объемную плотность ворсинчатой ткани, средний диаметр сосудов, состояние терминальных ворсин и синцитиокапиллярных мембран. Морфометрические параметры были оценены в 50 срезах каждой плаценты. Измерения проводили с использованием компьютеризированной системы анализа видеоизображений Image scop. С помощью программы Adobe Photoshop Cs3 Extendid определяли: 1) площадь сечения ворсин (мкм2) – по внешнему контуру эпителия ворсины, 2) площадь стромы ворсины (мкм2) – по внутреннему контуру эпителия ворсины, 3) площадь, занимаемую эпителием – по разнице первой и второй площади. Статистическая обработка данных проводилась с помощью программы Sigma Stat 3.5.
Результаты исследования и их обсуждение
Известно, что к 12-й неделе беременности ворсины плаценты достигают определенных, основных этапов развития и дифференцируются на опорные (рис. 1), промежуточные и терминальные. В последующие недели гестации ворсины претерпевают качественное изменение, появляются недифференцированные и дифференцированные промежуточные ворсины, а также терминальные специализированные ворсины, осуществляющие основные обменные процессы.
При физиологической беременности плацента во втором триместре характеризуется преобладанием промежуточных недифференцированных и дифференцированных ворсин, в последних увеличивается количество синцитиальных почек и узлов и появляются первые синцитиокапиллярные мембраны [4; 5]. Четверть всех ворсин даже при доношенной беременности составляют крупные стволовые ворсины, характеризующиеся плотной стромой, в центре которой находятся толстостенные сосуды, окруженные муфтами гладкомышечных клеток и адвентицией (рис. 1а).
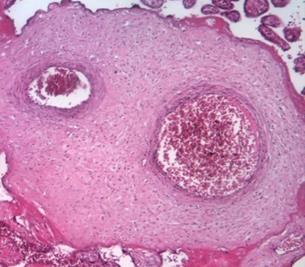

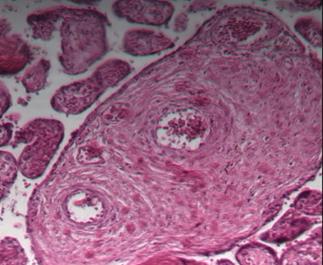

Рис. 1. Стволовые ворсины плаценты при физиологической (а) и патологической беременности (б) во II триместре. Окраска гематоксилином и эозином. Увеличение х100
Стволовые ворсины в основном осуществляют транспорт крови и в меньшей степени участвуют в диффузии газов и метаболитов. Морфометрия показала, что в данном периоде ворсины характеризуются большой площадью сечения стромы (17157±121 мкм2) и незначительной долей эндотелия по отношению к строме (около 17,9-18,6%).
Исследование плацент женщин с патологией крови, сосудов, железодефицитной анемией показало наличие псевдоинфарктов, некрозов ворсин, склероза стромы ворсин и их тромбоз 8. В тяжелых случаях данной экстрагенитальной патологии, при отсутствии должной терапии, плацента и в третьем триместре гестации сохраняет и усугубляет морфологические проявления, такие как облитерация сосудов ворсин, фибриноидные отложения и скопление (сладжирование) эритроцитов в межворсинчатом пространстве, микроинфаркты (рис. 2).
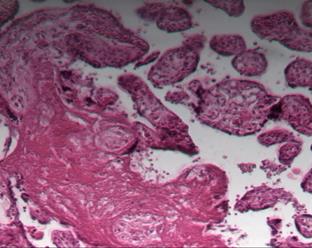

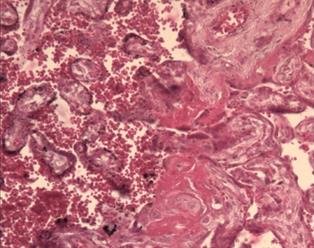

Рис. 2. Патологические изменения в плаценте в III триместре беременности: а – фибриноидные отложения в межворсинчатом пространстве, кистозная дегенерация некоторых ворсин; б – скопление эритроцитов, расширение межворсинчатого пространства, фибриноидные изменения и склерозирование ворсин. Окраска гематоксилином и эозином. Увеличение х100
Плацента при доношенной физиологической беременности характеризуется структурными признаками зрелости, включающими все компоненты ворсинчатой части и преобладание самых мелких терминальных дифференцированных ворсин (41-47%), являющихся дивергентным адаптивным механизмом в гемохориальной плаценте. Терминальные ворсины (рис. 3) являются основными в обеспечении трофики плода, с наличием типичных синцитиокапиллярных мембран: тончайшие участки плацентарного барьера, в которых капилляры ворсин приближены к истонченному синцитиотрофобласту [8; 9]. На продольных срезах терминальных дифференцированных ворсин хорошо видно, что синцитиокапиллярные мембраны занимают большую площадь поверхности ворсины (рис. 3б), часто встречаются несколько таких образований в пределах одной ворсины, тем самым увеличивая площадь плацентарного барьера. Морфометрические показатели позволяют говорить о многократном уменьшении стромального компонента ворсинчатого дерева к концу беременности (2921±152 мкм2) и, как следствие, увеличении доли эндотелия к строме ворсины до 88%. Морфологически большинство терминальных ворсин были специализированными, содержащими капилляры синусоидного типа, которые находились в тесном контакте с синцитиотрофобластом [9; 10]. Доля терминального ворсинчатого эндотелия по отношению к строме была значительно увеличена.
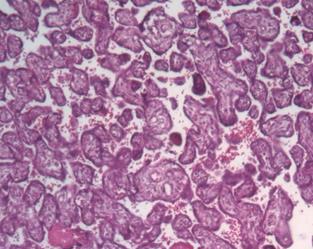



Рис. 3. Основной компонент зрелой плаценты – терминальные дифференцированные ворсины: а – поперечный срез, б – продольный срез, синцитиокапиллярные мембраны показаны стрелками. Окраска гематоксилином и эозином. Увеличение: а х100, б х400
Таким образом, во II и III триместрах физиологической беременности в плаценте происходят структурные изменения, в частности капилляры превращаются в тонкостенные синусоиды, которые сближаются и тесно взаимодействуют с синцитиотрофобластом, что приводит к образованию необходимых синцитиокапиллярных мембран для адекватного удовлетворения растущих потребностей плода. Синцитиокапиллярная мембрана состоит из общего бесклеточного слоя эндотелия и эпителия толщиной 4,31±0,18 мкм. Благодаря такому строению осуществляется прямая диффузия кислорода и метаболитов в течение последнего месяца беременности и родов.
Проводя исследование, мы обратили внимание на тот факт, что даже при наличии в клиническом диагнозе различной инфекционной патологии (хронический пиелонефрит, хроническая вирусная инфекция, включая гепатит С и ВИЧ), развитии гестационных осложнений в виде гестоза, наличия хронической фетоплацентарной недостаточности и хронической гипоксии плода компенсаторные возможности плаценты достаточно велики и вес плода при доношенной беременности страдает далеко не всегда, а чаще всего остается в пределах нормы [10; 11]. В одном из случаев, сопровождающемся достаточно неблагоприятной экстрагенитальной патологией и недостаточностью плаценты (по данным истории родов), масса плода была 5190 г. По данным микроскопии такой плаценты, результаты были крайне противоположными. Наряду с участками физиологической нормы наблюдались значительные повреждения микроструктуры плаценты, такие как интраплацентарный застой, тромбоз, очаги инфарктов, участки некроза и маляции, резкий отек дистальных ворсин и межворсинчатого пространства (рис. 4) [11]. Следовательно, плацента как основной провизорный орган, осуществляющий главные функции во внутриутробной жизни плода (газообменная, транспортная, метаболическая, защитная, гормональная), обладает практически безграничными возможностями и функциональным резервом в обеспечении возрастающих потребностей плода.
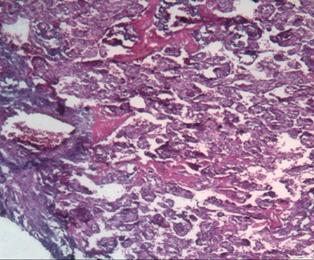

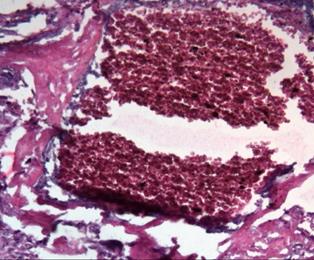

Рис. 4. Морфологические признаки плацентарной дисфункции: а – интраплацентарный застой, деструкция терминальных ворсин, аваскулярные участки ворсин, отложения фибриноида; б – микроинфаркт. Окраска гематоксилином и эозином. Увеличение: а, б х200
Ввиду критической роли плаценты в определении исхода беременности и роли плацентарной недостаточности в этиологии мертворождения послеродовая гистология плаценты является часто используемым исследованием, которое может предоставить важную информацию для клиницистов. Предварительные результаты нашего исследования показали, что добавление объективной оценки морфологии плаценты с использованием современной системы классификации и отработанных критериев, с качественными описаниями (аваскулярные ворсины, тромботическая васкулопатия, нарушение созревания плаценты, уменьшение доли синцитиокапиллярных мембран и другие), а также дополнительными комплексными исследованиями иммуногистохимии факторов роста сосудов, например, позволят достаточно точно диагностировать причины возникшего неблагоприятного перинатального исхода.
Московский областной НИИ акушерства и гинекологии
Патогенез антенатальной смерти: фенотипы плодовых потерь и танатогенез
Московский областной НИИ акушерства и гинекологии





Представлены результаты исследования патогенеза антенатальной гибели плодов, основанного на изучении 55 случаев антенатальной смерти плодов в сроки беременности 23—40 нед (55 плацент, 52 плода), а также 46 плацент при рождении живых новорожденных, перенесших во внутриутробном периоде угрожающие их жизни состояния. Для достоверной оценки разработаны перцентильные показатели массы плацент на основании исследования 2208 плацент после самопроизвольных абортов и родов у жительниц Московской области. Использованы морфологические, иммуногистохимические методы исследования, впервые для анализа пространственной организации плацент проведено рентгеномикротомографическое исследование. Клинико-анатомические сопоставления проводили с учетом результатов ультразвуковой биометрии, импульсной и 3D-энергетической динамической допплерометрии, кардиотокографии плода, гормонального профиля фетоплацентарного комплекса, показателей суточного мониторирования артериального давления и центральной гемодинамики беременной, данных лабораторных исследований (1537 исследований по 268 показателям). Установлено существование двух фенотипов антенатальных потерь плода, разных как по патогенезу, так и по танатогенезу. Каждый из них обладает своеобразным сочетанием плацентарных, плодовых и материнских факторов и оказывает влияние на клиническую ситуацию. Основные патогенетические факторы 1-го фенотипа антенатальных потерь — преждевременное созревание ворсинчатого дерева плаценты и дисфункция эндотелия с поражением сосудистой системы матери; 2-го фенотипа — замедленное созревание ворсинчатого дерева и дисфункция плодовой сосудистой системы ворсин. Зрелость и особенности строения ворсин плаценты определяются патологией беременной — заболеваниями матери и осложнениями беременности.
Московский областной НИИ акушерства и гинекологии
Непосредственной причиной внезапной смерти плода, как известно, считается нарушение кровотока и оксигенации тканей. Все остальные причины, которые могут быть в основе фатального нарушения кровообращения, — это заболевания или повреждения, инициирующие патогенетическую цепочку, приводящую к гибели плода: заболевания матери, патология плаценты, хромосомные аномалии, метаболические дефекты, врожденные мальформации, инфекции [1]. Иное мнение состоит в том, что гипоксия плода необязательно является причиной его гибели, а закономерным следствием другой (основной) причины антенатальной смерти [2]. Во внутриутробном периоде факторы танатогенеза ограничены основными вариантами: нарушением маточно-плацентарного и пуповинного кровообращения, недостаточностью в первую очередь сердечной деятельности плода, а также других органов, развитием анемии. Непосредственной причиной смерти при этом является асистолия — прекращение сердечных сокращений, поэтому для определения основного заболевания, повлекшего за собой антенатальную смерть плода, требуется тщательный клинико-морфологический анализ, направленный на выявление структурной патологии плаценты и пуповины [3]. Существуют различные мнения о значении исследования плаценты в установлении причины внутриутробной смерти плода, и это отражает противоречивые взгляды на роль патологии и аномалий плаценты в качестве основной или одной из причин смерти плода. Другими словами, в настоящее время весомость исследования плаценты в разъяснении причины внутриутробных потерь остается предметом обсуждения, поскольку трудно получить действительно фактическую, критически оцененную информацию, обладающую диагностической ценностью при аутопсии мертворожденного [1, 2, 17, 33, 40]. В связи с этим нами были проведены исследования с целью изучения патогенетических основ антенатальной гибели плода.
Проведенные нами клинико-морфологические исследования свидетельствуют о наличии 2 фенотипов антенатальных потерь, отличающихся патогенезом и танатогенезом. Каждый из фенотипов имеет характерное сочетание плацентарных, плодовых и материнских факторов с соответствующей клинической картиной. Основными патогенетическими факторами 1-го фенотипа антенатальных потерь являлись дисхрония ворсинчатого дерева плаценты с преждевременным его созреванием и дисфункция эндотелия с поражением сосудистой системы материнской части плаценты; для 2-го фенотипа было характерно замедленное созревание ворсинчатого дерева и дисфункция плодовой сосудистой системы ворсин. Зрелость и особенности строения ворсин плаценты определяются патологией беременности — заболеваниями матери и осложнениями беременности.
Плацентарные параметры 1-го фенотипа антенатальных потерь являются следствием маточно-плацентарной ишемии и нарушений маточно-плацентарного кровообращения. Они характеризуются комплексом морфологических изменений, а именно, материнской васкулопатией с патологией базальной пластинки — нарушением гестационной трансформации спиральных артерий, острым атерозом, тромбозом, кровоизлияниями и ретроплацентарной гематомой, массивными инфарктами, накоплением межворсинчатого фибриноида, преобладанием преждевременного созревания ворсин, множественными синцитиальными узлами, низкой массой плаценты (12-й перцентиль). Плаценты этой группы макроскопически отличаются множественными очагами инфарктов, межворсинчатого тромбоза и фибриноида крупных размеров, занимающими центральные, парацентральные и краевые отделы диска, захватывающими материнскую поверхность. Кроме того, только при данном фенотипе антенатальных потерь была отмечена центральная отслойка плаценты с ретроплацентарной гематомой. Материнская васкулопатия в плацентах 1-го фенотипа антенатальных потерь является частью генерализованной дисфункции эндотелия беременной. Локальная ишемия хориона вызывает развитие оксидантного стресса, активацию тромбоцитов и выброс вазоконстрикторных агентов, что соответствует стадии гиперактивации дисфункции эндотелия. Присоединение локального ДВС-синдрома и стойкой вазоконстрикции определяет стадию напряжения. Возникающие нарушения локального гемостаза приводят к тромбозу межворсинчатого пространства и стадии истощения дисфункции эндотелия. В результате происходят прогрессивное снижение маточно-плацентарного кровотока с напряжением, а в дальнейшем и истощением функциональных возможностей защитных систем в комплексе мать—плацента—плод, а также нарушения метаболической, трофической и гормональной функций плаценты [8]. Оксидантный и эндоплазматический ретикулярный стрессы тесно связаны, оба они провоцируются сосудистой мальперфузией и ишемической реперфузией. Эндоплазматический ретикулярный стресс представляет собой основной компонент патофизиологии преэклампсии и задержки роста плода, приводящий к снижению клеточной пролиферации и усилению апоптоза в плаценте. Результатом последнего являлось образование множественных синцитиальных узлов в плацентах 1-й группы, являющихся конечным результатом жизни ворсинчатого цитотрофобласта и известных как изменения Tenney—Parker в различных вариантах — компенсаторном, апоптотическом, некротическом. Данные морфологические варианты синцитиальных узлов, вероятно, являются последовательными стадиями их морфогенеза [9].
По нашим данным, параметры плода 2-го фенотипа антенатальных потерь отличаются от таковых 1-го фенотипа прежде всего значительно более высокими весоростовыми показателями с медианами массы и длины, соответствующими 12-му и 69-му перцентилям. Комплекс клинико-лабораторных признаков, предшествовавших антенатальной смерти, включал изменение гормональной функции ФПК с повышенными (по сравнению с 1-м фенотипом) уровнями плацентарного лактогена (23,65 перцентиля), эстриола (41,65 перцентиля) и кортизола (54,5 перцентиля) при нормальных уровнях прогестерона и α-фетопротеина. Повышение весоростовых показателей плода при 2-м фенотипе, по нашему мнению, определяется повышенным уровнем плацентарного лактогена, с одной стороны, действующего как гормон роста, а с другой — приводящего к гипергликемии беременной с увеличением массы и роста плода. Последнее в известной степени напоминает патогенез макросомии плода при сахарном диабете беременной, с разницей в этиологии гипергликемии матери. Однако независимо от причины гипергликемии беременной, кроме повышенных весоростовых показателей, у плода закономерно могут развиваться гиперплазия и гипертрофия островков Лангерганса и другие морфологические признаки, характерные для диабетической фетопатии, которые и были нами выявлены у 25% плодов 2-го фенотипа. Источником повышенного уровня плацентарного лактогена может являться избыточная по сравнению с 1-м фенотипом клеточная масса синцитиотрофобласта ворсин незрелой плаценты. Инициирующим моментом патогенеза 2-го фенотипа антенатальных потерь, возможно, является иммунный конфликт матери и плода, этиология которого может быть различной, а именно, любое взаимное антигенное воздействие как со стороны плода, так и со стороны беременной, включая антигены крови плода, антитела матери при аутоиммунных заболеваниях, при наличии у нее очагов гематогенной инфекции и др. Для развития иммунного конфликта характерны более поздние сроки антенатальных потерь (36 нед) с возрастающей вероятностью поступления в кровоток матери в поздние сроки беременности элементов крови плода с массированной ответной антигенной атакой. Вне зависимости от природы плодовых и материнских антигенов и антител патогенез в дальнейшем определяется биологической целесообразностью: антигены, антитела, их комплексы поглощаются иммунокомпетентными клетками Кащенко—Гофбауэра, которые подвергаются пролиферации и экспрессируют антигены главного комплекса гистосовместимости, факторы роста, провоспалительные факторы. Именно иммунной атакой и объясняется резкое увеличение количества клеток Кащенко—Гофбауэра в незрелых плацентах 2-го фенотипа, более значительное, чем их количество в физиологически незрелой плаценте при сроке беременности менее 36 нед. Экспрессия клетками Кащенко—Гофбауэра факторов роста и провоспалительных факторов препятствует физиологическому созреванию ворсин и способствует развитию в них дисфункции эндотелия. Последняя проявляется клинически достоверным повышением СД в артериях пуповины (Ме=3,29) по сравнению с таковым при наличии 1-го фенотипа. Данный допплерометрический признак оказался наиболее характерным для варианта недифференцированных промежуточных ворсин в сравнении с нормальным строением ворсин, дефицитом терминальных ворсин, вариантом хаотично склерозированных ворсин, преобладанием дифференцированных промежуточных ворсин [39]. Изменение пуповинного кровотока при инсулинзависимом сахарном диабете выявлено в 100% наблюдений: неблагоприятным признаком начальных нарушений состояния плода являлось повышение СД кровотока в артерии пуповины выше 2,8, при этом в 80% наблюдений имела место незрелость ворсинчатого дерева (В.А. Петрухин, 1098). Эпизоды повышения СД в аорте (СДmax 8,2) в сочетании с понижением СД в средней мозговой артерии (Ме=3,35) также могут отражать декомпенсацию кровообращения ФПК с резким снижением тонуса сосудов микроциркуляторного русла и секвестрацией в них крови, с шунтированием кровотока, что характерно для шоковых состояний. Компенсаторные реакции в форме перераспределения кровотока направлены прежде всего на поддержание жизненно важных функций головного мозга и проявляются в полной мере лишь при медленном умирании. Централизация кровотока в направлении головного мозга резко ухудшает условия микроциркуляции в других системах организма, что сопровождается нарастанием метаболического ацидоза и грубых нарушений структуры и функции клеток паренхиматозных органов. Антенатальная гибель плодов при наличии 2-го фенотипа наступала позже на 2,5 нед по сравнению с таковой при 1-м фенотипе и в каждом пятом случае не имела убедительных причин. Следует отметить, что и причины антенатальной гибели плода при сахарном диабете матери с присущими этой нозологической форме незрелостью ворсин, плацентомегалией и диабетической фетопатией до сих пор неясны. Характерно, что внутриутробная смерть, ассоциированная с незрелостью ворсинчатого дерева, обычно наступает внезапно, без предшествующих признаков внутриутробной гипоксии. Данный факт не считается противоречащим концепции о гипоксии как причине смерти, поскольку подобную акушерскую ситуацию можно сравнить с декомпенсацией других органов [38]. Терминальное состояние плодов при развитии 2-го фенотипа имеет ряд особе
Читайте также:

