Что такое чистые посевы
Обновлено: 07.07.2024
Чистый пар — поле севооборота, свободное от культур в течение вегетационного периода. Чистый пар в течение всего теплого периода года обрабатывают, поддерживая в рыхлом состоянии почву, проводят истребительные мероприятия против сорных растений, вредителей и возбудителей болезней культур, проводят мелиоративные работы. Паровое поле не дает сельскохозяйственной продукции, оно подготавливает почву под возделывание последующих культур.
Навигация
Роль чистых паров в севообороте
Чистые пары позволяет:
- накапливать влагу, сохранять и рационально использовать влагу почвы;
- мобилизовать питательные вещества в почве;
- проводить мероприятия по борьбе с сорными растениями, вредителями и возбудителями болезней культур.
Весь комплекс агротехнических приемов, позволяющих улучшить плодородие паровых почв и создать оптимальные условия для роста и развития растений, делает их ценнейшим предшественником для всех культур, прежде всего, наиболее требовательных зерновых — озимой и яровой пшеницы и озимой ржи.
Чистый пар, с одной стороны, приводит к интенсивному разложению органического вещества почвы, с другой обогащает её питательными веществами в доступной для растений формах, при условии отсутствия сорных растений, что особенно важно при дефицитном применении удобрений для получения высоких урожаев пшеницы, особенно фосфора, которым бедны каштановые и черноземные почвы степной зоны.
Чистые пары выполняют фитосанитарную функцию в борьбе с сорными растениями, вредителями и возбудителями болезней сельскохозяйственных культур (например, пораженность пшеницы корневыми гнилями снижается в несколько раз), повышают биологическую активность почв, ускоряющую процессы минерализации органического вещества.
Чистые пары благодаря положительной роли позволяют получать высокие устойчивые урожаи пшеницы (озимой и яровой) хорошего качества, особенно в степных районах: Поволжье, Северном Кавказе, Юго-Востоке России, где урожайность пшеницы после чистого пара увеличивается в 1,5-2 раза, по сравнению с другими предшественниками; а также в засушливых районах степи и лесостепи Южного Урала, Заволжья, Зауралья, Алтая и Западной Сибири — на 30-50%.
Виды чистых паров
Чистые пары могут быть:
Черный пар — чистый пар, глубокую основную обработку которого проводят осенью после уборки предшествующей культуры.
Ранний пар — чистый пар, основную обработку почвы которого проводят весной, в год парования. Его применяют в районах, где короткий осенний период или не остается времени на обработку почвы после уборки яровых культур, например, в Северном Казахстане и Сибири. Кроме того, оставление стерни, позволяет снизить эффект ветровой эрозии и увеличить снегонакопление.
Черные пары почти всегда имеют преимущество перед ранними, так как позволяет накапливать больше влаги за счет осенне-зимнего и весеннего периода, а также более длительного применение истребительных мероприятий.
Кулисный пар — черный или ранний пар, в котором кулисами (полосами) высаживаются высокорослые культуры: подсолнечник, кукуруза, горчица и другие растения с прочным стеблем. Чаще всего применяются в засушливых районах степей с сильными ветрами.
Кулисный пар выполняет три функции: снегозадержание, защита озимых культур от неблагоприятных условий в зимний период в малоснежных и засушливых районах, защита почв от ветровой эрозии.
Кулисы позволяют задерживать даже первый снег, тогда как снежные валы возможно сделать только при высоте снежного покрова 12-15 см. Увеличение толщины снежного покрова способствует накоплению влаги, защите озимых от вымерзания и резких колебаний температур в весенний период, предотвратить ветровую эрозию.
Поздний, или крестьянский, пар — чистый пар, который в трехпольной системе земледелия России использовался в весенне-летний период под выгон скота. В крестьянских хозяйствах, где не хватало сил и средств для одновременного выполнения весенне-летних полевых работ и обработки чистого пара, к обработке позднего пара приступали только во второй половине лета, перед посевом озимых зерновых. По этой причине его эффективность значительно ниже черного или раннего паров, и в современном земледелии он редко применяется.
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.
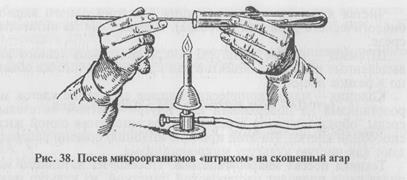
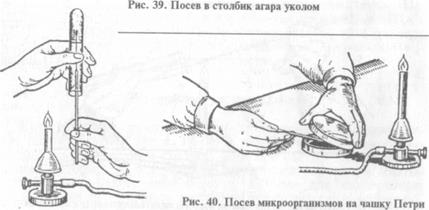
При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.
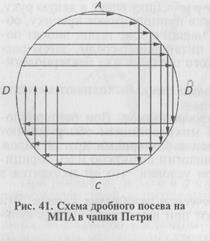
Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов. Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
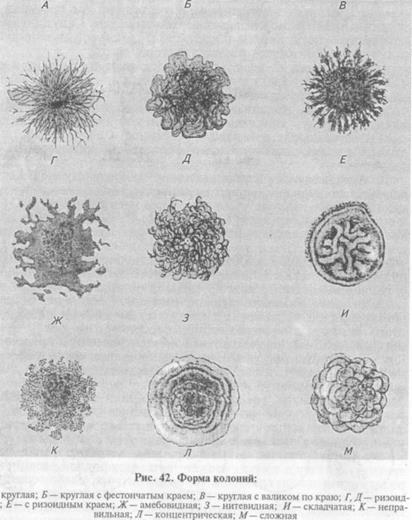
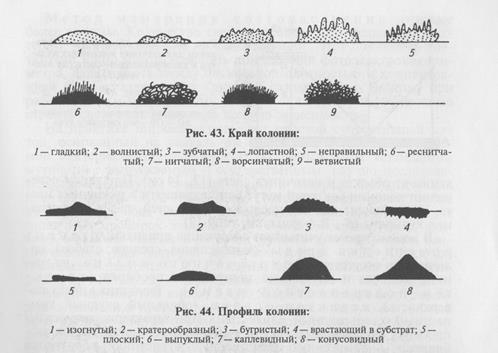
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.
Ценную дополнительную информацию об особенностях строения колоний дает их изучение в косопадающем пучке света (рис. 46). Культуры на прозрачной агаровой среде в чашках Петри помещают на предметный столик бинокулярной лупы. Между бинокулярной лупой и источником света помещают зеркало от микроскопа вогнутой стороной вверх таким образом, чтобы лучи, отраженные от него, попадали в плоскость изучаемого объекта под углом 40. 45°. Зеркало устанавливают на равном удалении от объекта и источника света (12. 14 см). При таком освещении колонии бактерий могут быть окрашены в различные цвета. Цвет зависит как от видовых особенностей, так и от состояния культуры (S-, R-формы, см. тему 12).
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1. Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2. Какие методы применяют для получения чистых культур микроорганизмов?
3. Какие культуральные признаки учитывают при идентификации бактерий?
4. Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
Способы посева лекарственных культур делятся по времени и срокам, по характеру распределения семян и по возможности одновременного высева семян одного вида или сорта — чистые посевы, или монокультуры, и одновременного высева семян разных видов и сортов — смешанные и совместные посевы, или культуры.
По характеру распределения семян по площади посевы делятся на рядовые и разбросные. Рядовые способы посева как наиболее совершенные и агрономически обоснованные получили самое широкое распространение. В свою очередь рядовые посевы подразделяют на сплошные, узкорядные, перекрестные, широкорядные, квадратные, гнездовые и квадратно-гнездовые. Рядовыми способами удается более равномерно распределить семена по площади, обеспечить растениям одинаковую площадь питания и равномерную глубину заделки семян.
Наибольшее распространение для посева сельскохозяйственных культур сплошного сева: зерновых, зернобобовых, крупяных и однолетних трав получили обычный рядовой способ сплошного сева с междурядьями 15 см, узкорядный — с междурядьями 7,5 см и перекрестный. Сплошные посевы проводятся тракторными прицепными и навесными сеялками СУ-24 и СЗН-24, зерновыми узкорядными СУБ-48, прицепными, зернотравяными СУТ-47 и зернотуковыми СУК-24А, а также льнозерновыми прицепными и навесными сеялками СУЛ-48 и СЛН-48 и другими сеялками, созданными на базе сеялок СУ-24 и СЗН-24.
Сплошные посевы лекарственных культур могут быть успешны лишь при возделывании некоторых однолетних растений, обеспеченных селективными гербицидами и имеющими ускоренное прохождение фаз онтогенеза. При высоком уровне агротехники возможны озимые, сплошные посевы ромашки аптечной, подзимние амми большой и амми зубной, подзимние и ранневесенние посевы мальвы лесной, пажитника сенного, расторопши пятнистой, укропа огородного и других однолетних культур. Из многолетних лекарственных культур возможны сплошные посевы пижмы обыкновенной и, вероятно, иван-чая.
В лекарственном растениеводстве наибольшее распространение получили чистые широкорядные посевы с междурядьями 45, 60 и 70 см. Такие посевы лучшим образом сохраняют почвенную влагу и обеспечивают самые благоприятные условия для роста и развития растений.
Широкорядным способом посева выращиваются практически все лекарственные культуры на сырье и семена.
Недостаточно изучены, но имеющие перспективу ленточные посевы лекарственных культур. Они представляют собой сочетание сплошного посева с междурядьями 15-22,5 см с широкорядным посевом с междурядьями 60 или 70 см.
С применением гербицида которан в 70-х годах XX в. практиковался способ посева подорожника большого с суженными междурядьями 22,5 см, обеспечивающий увеличение урожайности сырья почти в 2 раза по сравнению с его широкорядным посевом.
Квадратный и квадратно-гнездовой посевы лекарственных культур рекомендовал Д.М.Аксельрод. Однако научная проработка показала их более низкую урожайность по сравнению с рядовыми широкорядными посевами. Это объясняется тем, что на единице площади таких посевов размещается меньшое количество растений, имеющих невысокую продуктивность. Квадратный способ посева и квадратно-гнездовой посев можно использовать при выращивании многолетних лекарственных растений только при создании плантаций посадкой саженцев или частями корневищ, имеющих почки возобновления. Высокую урожайность сырья хорошего качества при таком способе выращивания можно получить таких лекарственных культур, как аралия Шмидта, заманиха высокая, горечавка желтая, подофилл щитовидный, ревень тангутский, родиола розовая и др.
Гребневой способ посева многолетних лекарственных растений можно применять в северных районах с достаточным и избыточным увлажнением, сырьем которых являются корни. Такой способ посева корневых лекарственных культур может понизить энергозатраты на уборке и потери корней, а также позволяет приступить к уходу за посевами до появления всходов и обозначения рядков высеянной культуры.
Гребневой посев лопуха большого мы испытали в процессе своих исследований.
По характеру распределения семян по площади и одновременному высеву одного вида или сорта, или двух и более видов или сортов посевы подразделяются на чистые, смешанные и совместные.
Понятие чистый посев или посадка трактуется растениеводами однозначно как возделывание одного вида или сорта от его посева до получения конечного урожая. По определению Г.В.Юрина чистые посевы лекарственных культур следует считать совместными одновидовыми посевами, так как разнообразие растений, введённых в культуру в последние десятилетия и даже века, не приобрели той однородности, которая присуща сельскохозяйственным культурам, возделываемым человеком не одно тысячелетие.
Смешанными посевами считаются посевы двух и более культур, семена которых перед посевом перемешиваются, или проводится двухкратный независимый посев культур на одной площади. При этом расположение рядков и ширина междурядий первой культуры не принимается в расчёт при посеве второй.
В кормопроизводстве смешанными посевами высеваются культуры, имеющие близкий ритм развития и совпадающие по срокам посева и уборки конечного урожая средствами механизации. Цель смешанных посевов – улучшить качество корма, повысить в нём содержание белка при высокой и стабильной урожайности. Смешанными посевами являются и посевы однолетних культур с двух- и многолетними культурами, когда в первую вегетацию получают урожай однолетней культуры а в последующие годы — двухлетней или многолетней. Посевы ромашки аптечной с зверобоем, амми большой и мака масличного, а также подпокровные посевы валерианы с гречихой, овсом, ячменём и горохоовсяной смесью на зерно являются также смешанными.
Викоовсяные и горохоовсяные смеси, смеси разных сортов кукурузы и злаковых и бобовых трав, козлятника восточного и люцерны синегибридной с овсом и ячменём, раннеспелых и позднеспелых сортов кукурузы, смеси кукурузы с подсолнечником, чиной, конскими бобами и горохом на силос и зеленый корм и т.п. являются смешанными посевами.
Смешанные посевы в кормопроизводстве дают наибольший урожай корма лучшего качества, если компоненты смесей подобраны по видовому и сортовому составу с учётом морфологической совместимости и с требованиями компонентов к почвенно-климатическим и гидрологическим условиям.
Смешанные посевы во многих случаях имеют преимущества по сравнению с чистыми посевами. В кормопроизводстве они позволяют получать высокий стабильный урожай кормов, обогащенных протеином. При выращивании лекарственных двух- и многолетних культур позволяют в первый год получить полноценный урожай однолетней культуры, а со второго года урожай лекарственной культуры.
Совместные посевы – это посевы двух или более видов растений на одном поле с чередующимися рядками или полосами культур. Перед высевом семена не смешиваются, а высеваются раздельно. К совместным посевам относят так же уплотнительные посевы, проводимые в междурядьях молодых садов, и посевы кормовых и овощных культур при выращивании гибридных семян на основе мужской стерильности материнских растений, в которых чередуются один или несколько рядков материнских растений с рядком сорта-опылителя. В кормопроизводстве в последнее время всё чаще стали применять совместные посевы кукурузы с соей.
Преимущество совместных посевов над смешанными посевами заключаются в том, что они позволяют дифференцировать приёмы удобрения и ухода за посевами. В совместных посевах культуры меньше оказывают негативное влияние друг на друга, значительно уменьшается затенение и конкуренция за воду и элементы питания, особенно в период появления и укоренения всходов.
Хорошие результаты со смешанными посевами лекарственных культур, особенно двухлетних и многолетних лекарственных растений были получены немецкими учёными в 30-40-х годах прошлого века. Особенно при возделывании таких видов, которые в первом году имели только слабое развитие. Через совместное выращивание можно достигнуть во многих случаях закрытого покрова быстрее, чем при одиночной культуре, что является большим преимуществом, прежде всего, для сухих, бедных гумусом почв. Ф.Липперт получал в совместных посевах однолетних бобовых культур с Аrtemissia abrotanum, Hyperiсum perforatum, Ruta graveolens, Lavandula angustifolia, Salvia officinalis, Thymus vulgaris и Hyssopus officinalis на бедных, каменистых, бесструктурных почвах экономически оправданные урожаи высококачественного лекарственного сырья. На опытных полях в Лейпциге он использовал преимущественно кустистые бобы, низкие сорта гороха, сою, козлятник и синюю люцерну. При совместном выращивании лука репчатого с алтеем лекарственным и штамбовых форм помидоров с валерианой лекарственной также получались хорошие урожаи корней.
Г.Геерклотц в совместных посевах валерианы (Valeriana officinalis) с соей (Glycine soja) получил урожай каждой культуры более высокий, чем в чистом посеве каждой отдельной культуры. Прибавка урожая по корню валерианы достигала 40%, а в совместном посеве с козлятником повышение продуктивности валерианы составляло 20% на каждое растение.
Смешанные посевы валерианы с маком масличным, амми большой, пажитником сенным, ячменём, викоовсяной и горохоовсяной смесями были изучены в ВИЛАРе в 70-х годах XX века. Особенно хорошие результаты были получены по смешанным посевам валерианы с маком.
В лекарственном растениеводстве возможно повышение урожайности через совместное выращивание приемлемых видов, но для действительно пригодных рекомендаций требуется еще большая целеустремлённая опытная работа по их проверке. В сельскохозяйственной практике Германии в этой области продвинулись несколько дальше. Совместное возделывание разных культур особенно широко проводилось в полевом кормопроизводстве.
В 40-50-х годах прошлого века в горной местности Германии нашли широкое применение смеси зимующей вики, клевера инкарнатного и пастбищных трав. При возделывании зерновых культур с зернобобовыми культурами чаще руководствуются целевой установкой получить хороший корм и достигнуть прибавки азота от посева бобовых (вики, полевого гороха, конских бобов), а также посевное зерно в собственном хозяйстве.
Если возделывание лекарственных и пряных растений проводится как подсев или как покровная культура к другим видам культур, то имеется на лицо также смешанное возделывание.
Г. Рютер сформулировал принципы, по которым должна подбираться однолетняя культура для смешанных и совместных посевов с двулетними и многолетними культурами. По Рютеру однолетние культуры должны отвечать следующим требованиям: 1) быть быстрорастущими; 2) своим скорым затенением подавлять сорняки; 3) отличаться раннеспелостью и быть легко убираемыми; 4) двулетние и многолетние культуры не должны лишаться света, питательных веществ и воды на слишком длительный срок; 5) подсевные культуры в молодости напротив не должны предъявлять слишком высокие требования к урожаю покровной культуры и не должны затруднять уход и уборку её урожая.
По Рютеру выбор способа посева лекарственных и ароматических растений в виде отдельной смешанной или совместной культуры должен производится в зависимости от конкретных условий каждого хозяйства. Результаты экспериментальных работ и обзоры многих исследований по лекарственным растениям могут помочь сделать правильный выбор.
В садоводстве Германии совместное возделывание лекарственных культур нашло особенно большое распространение. Какие лекарственные, ароматические и пряные растения можно выращивать в садах определяются непосредственно в каждом конкретном случае. При этом следует принимать расчёт отдельно как по чистой культуре, так и по смешанным культурам.
На основании собственных наблюдений К.Шиллинг рассматривал совместное возделывание лекарственных, ароматических и пряных растений как дополнение к традиционной технике в садоводстве.
Анализируя результаты исследований по видам растений, хорошо ударяющимся в смешанных и совместных посевах, он пришёл к выводу, что они в жизненном сообществе благоприятно отражаются на составе и содержании питательных веществ в почве, и в конечном итоге содействуют росту и развитию растений и увеличивают урожай. Так, например, он собирал хороший урожай в совместном посеве моркови (сорт ‘Nantaiser’) и майорана.
Выращивание лекарственных растений в междурядьях садов немецкие исследователи рассматривали так же как совместное возделывание. В качестве культуры для выращивания в междурядьях садов предлагали полынь высокую (Аrtemissia absinthium) и шалфей лекарственный (Salvia officinalis). Оба вида невзыскательны относительно места произрастания. Г.Фридрих в качестве культур для выращивания в междурядьях сада рекомендовал Majorana hortensis, Ocimum basilicuin, Satureja hortensis и Thymus vulgaris. В качестве подсевной культуры рекомендуется Plantago major и Plantago lanceolata. На влажных почвах или в саду, где возможно искусственное дополнительное орошение, Mentha piperita и Melissa officinalis очень хорошо подходят в качестве дополнительных культур. Культуры, дающие лекарственное сырьё в виде семян, меньше подходят для возделывания среди фруктовых деревьев, лишь пажитник сенной (Trigonella foenum-grciecum), оказался пригодным. Козлятник, являясь хорошим собирателем азота и относительно нетребовательным к водообеспечению, также должен подойти.
При совместных посевах однолетних культур с двух- и многолетними лекарственными растениями мы имеем случай, в котором имеет место не полностью заполненная экологическая ниша многолетней культуры, которую можно дополнить однолетней культурой. Со второго года вегетации совмещённая многолетняя культура становится чистой, то есть в посевах двух- и многолетних культур собираем урожай только лекарственного сырья, не засоренного однолетней культурой.
В совместных и совмещенных посевах большое значение имеет взаимное влияние выращиваемых культур. Ещё 30-е годы прошлого века Г. Молиш и Г. Мадаус установили влияние разных видов растений друг на друга через выделение активных веществ в почву при совместном произрастании. Мадаусом установлено влияние Achillea millefolium, Artemissia absinthium, Digitalis purpurea, Urtica-species и Sinapis alba на различные, в их непосредственной близости возделываемые другие виды растений. В этой связи особенно интересны исследования Г.Молиша по аллелопатии. Ганс Молиш обратил внимание на то, что растения могут влиять друг на друга посредством выделения в почву и воздух особых химических веществ, которые уже в самых малых дозах оказывают влияние на соседние растения.
Лекарственные растения особенно часто проявляют аллелопатическую активность, так как многие из них при массовом развитии во взрослом состоянии выделяют в окружающую среду значительные количества биологически активных веществ. Сильную аллелопатическую активность проявляют ландыш, щавель конский, валериана, горицвет, орхидные, толокнянка, пижма и другие лекарственные растения.
Вредоносность сорных растений часто связана с действием их химических выделений на культурные растения. Известна аллелопатическая агрессивность пырея ползучего, мари белой, росички реснитчатой на кукурузу. По нашим наблюдениям в посевах пижмы уже на второй год почти полностью вытесняются все сорняки, даже осот розовый испытывает сильное угнетение. Однако полынь обыкновенная нормально сосуществует с пижмой.
По мнению А.М.Гродзинского в среде любых посевов идёт непрерывное накопление и превращение тех или иных биогенных веществ за счёт образования и выделения растениями в среду: 1) веществ вторичного происхождения – органических кислот, эфирных масел, алкалоидов, гликозидов, флавоноидов, витаминов и др.; 2) веществ нормального гидролитического и автолитического распада белков, амидов кислот, имино- и аминопроизводных, индолилпроизводных и накопления аммиака; а также 3) веществ более или менее глубокой минерализации и гумификации растительного материала, так называемых гуминовых кислот и всего ряда их предшественников; сложных соединений часто полимерного строения, преимущественно ароматического ряда, нередко содержащих в гетероциклах азот. Накопление в почве активных веществ до токсического уровня обусловливает снижение её плодородия, выражаемое в почвоутомлении.
Носителями аллелопатического действия являются подвижные, легкопроникающие в растения химические соединения, в большинстве случаев почвоутомление связывают с накоплением подвижных фенольных соединений, прежде всего кислот. Вследствие накопления фенольных соединений затрудняется монокультура пшеницы. Под многолетней люцерной накапливаются сапонины. Довольно сильное почвоутомление вызывает люпин, который при бессменном выращивании полностью выпадает на третий – четвёртый год.
Токсичность почвы, возникающая в условиях обычного водно-воздушного режима, может быть обусловлена накоплением вредных продуктов (колинов) как результат совместной деятельности растений, микроорганизмов и животных. Накопление колинов в почве может не только препятствовать росту и развитию растений и снижать их продуктивность, но и, наоборот, оказывать на них благотворное воздействие, усиливать рост и повышать урожайность.
Это неплохо иллюстрируют результаты опытов Ф. Обердорфа, полученные при выращивании валерианы в совместном посеве с соей в среднегерманских климатических условиях. Совокупный доход от совместных посевов с валерианой получался более высокий, чем от посева одной сои. В этом случае соя являлась полноценным растением для совместного посева с валерианой.
Исследования Г.Боде по листовым выделениям полыни горькой показали, что они оказывали отрицательное влияние на другие лекарственные растения, что подтверждали неоднократно учёные Лейпцигского университета. По наблюдениям Фридриха кориандр посевной (Coriandrum sativum) оказался не пригодным для возделывания в междурядьях сада. При совместном возделывании кориандра в молодом саду наблюдались тяжелые повреждения у молодых деревьев. Выделяемое кориандром в атмосферу эфирное масло оказывало губительное влияние на молодые деревья сада.
Важную роль корневых выделений растений в посевах (агроценозах) показали многие исследователи. Корневые выделения одних видов растений в ряде случаев стимулируют рост и развитие других, активизируя некоторые физиологические процессы: фотосинтез, поглотительную способность корней, транспирацию и др., а в других – тормозят.
Созданием благоприятного воздушно-водного режима человек способствует более быстрому и полному разложению и минерализации органических остатков, и разрушению токсичных органических соединений. Сбалансированным внесением органических и минеральных удобрений и другими мероприятиями сельскохозяйственной мелиорации почв он не только повышает уровень питания растений, но и улучшает условия жизнедеятельности полезной микрофлоры, снижающей уровень колинов в почве, чем создаёт в почвенной среде некоторое биологическое равновесие.
Анализируя многочисленные данные по накоплению и выделению в среду большого класса биологически активных веществ лекарственными растениями, можно усомниться в возможностях их совместных посевов с однолетними культурами. Однако, в период совместного произрастания многолетних культур с однолетними культурами они задерживаются в развитии в начальных фазах онтогенеза: в фазах укоренённых всходов – ювенильных растений и их средообразующая роль чрезвычайно мала. Быстро растущим однолетним культурам, занимающим доминирующее положение в посевах, принадлежит определяющая средообразующая роль. Поэтому в совместных посевах они, как правило, имеют высокую продуктивность растений и формируют урожай по величине и качеству практически одинаковый со своими чистыми посевами.
Чистые посевы- одновидовые посевы. Они имеют ряд преимуществ:
они дают наибольший сбор продукции данного вида с единицы площади.
они дают более высококачественную продукцию.
обладают более высокой технологичностью, т.е. они более приспособлены к совершенным технологиям производства.
Для чистых посевов имеется наиболее широкий набор гербицидов. Чистые посевы более дружно и равномерно созревают, поэтому их легче убирать. Но не смотря на преимущества имеют и недостатки:
они не полностью используют основные факторы жизни для создания урожая.
низкое кормовое качество отдельных культур.
Смешанные посевы- это посевы 2-ух или нескольких культур семена, которых перед посевом перемешиваются или проводится двухкратный независимый посев культур на одной площади по диагонали или поперек друг друга. Чаще такие посевы возделывают при использовании кормовых культур: горохо овсяные, вико овсяные, клеверотимофеечные.
Значение смешанных посевов:
дают более устойчивые высокие по годам урожаи, т.к. различные компоненты полнее используют факторы внешней среды.
дают корм более высокой ценности сбалансированный по содержанию питательных веществ.
меньше полегают, что облегчает их уборку.
они меньше угнетаются сорняками, меньше повреждаются болезнями и вредителями.
в смешанных бобово- злаковых посевах экономятся минеральные азотные удобрения, т.к. бобовые частично снабжаются биологическим азотом злаковые компоненты.
Существуют разновидности смешанных посевов:
совместные посевы- посевы двух или нескольких культур на 1-ом поле, чередующимися рядками или полосами. Применяются для культур сильно различающихся по высоте и темпам развития в начальные фазы. Цель- снизить взаимное угнетение компонентов. Убирают на корм поперек рядков.
смеси сортов одной культуры но с различными биологическими особенностями. С различными требованиями к теплу, к влаге, к болезням. Цель обеспечить получение более стабильных урожаев по годам, т.к. метеорологические условия не предсказуемы.
Принципы подбора компонентов в смешанных посевах:
компоненты должны быть морфологически совместимы, т.е. если один компонент имеет полегающий стебель, то 2-ой прямостоячий. Если у одного компонента- мочковатая корневая система, то у 2-го- стержневая. Не должно сильно отличаться по высоте.
компоненты должны быть близкими по требованию, механическому составу почвы, рН, но с разной потребностью элементов питания.
должны быть близкими по темпам роста в начальные фазы.
компоненты должны быть близкими по времени наступления уборочной спелости, особенно при выращивании на семена.
компоненты должны быть близкими по долголетию и многостойкости.
компоненты смешанных посевах должны быть устойчивы к одному и тому же гербециду.
45 Промежуточные посевы, их виды. Принципы подбора культур для промежуточных посевов в Нечерноземной зоне.
Промежуточные посевы – это выращивание культуры в промежутке времени, когда поле свободно от основной культуры. Например, после уборки озимой ржи на з/к ( в начале июня), остается достаточно времени для получения урожая с этого поля (горох+овес, турнепс).
В промежуточных посевах НЗ выращивают в основном культуры, быстро формирующие урожай.
Значение промежуточных посевов.
более рациональное использование почвы, так как в год можно получать 2 урожая. Плодородие почвы увеличивается за счет растительных остатков, снижается засоренность почвы.
Кормовые культуры, посеянные в промежуточных посевах, летом дают корм более высокого качества, так как в летние месяцы накапливается больше сухого вещества и протеина.
Уборка и посев не совпадают с посевом и уборкой основной культуры.
Виды промежуточных посевов.
1.Поукосные посевы – это посевы промежуточных культур после уборки основной культуры на з/к. Основная культура – горох с овсом весеннего посева, который убирают на з/массу в начале июля. Поукосная культура – турнепс скороспелых сортов (сорт Московский), рапс яровой на з/массу.
2.Озимые промежуточные посевы. В южных районах после уборки основной культуры (озимая рожь или пшеница на з/м – убирают в середине мая). После этого сеют промежуточную культуру – гречиху, просо, горох, картофель
3.Занятый пар. Выращивают культуру, быстро формирующую урожай – озимые (пшеница, рожь на зерно), а в качестве их предшественника – горох с овсом, кукуруза на з/массу, подсолнечник на з/массу.
4.Подсевные посевы – это посев промежуточной культуры весной под основную культуру и после уборки основной уборки на з/м. Подсевные культуры быстро растут и дают 1-2 укоса. Основная культура – озимая рожь. Подсевная – озимая и яровая вика, горох с овсом на з/м, райграз однолетний..
5.Пожнивные посевы – это посев промежуточной культуры после уборки основной культуры на зерно. Их применяют лишь в южных районах с длинным теплым вегетационным периодом, где зерновые убирают рано ( в начале и в середине июля). Основная культура – озимой ячмень на зерно, пожнивная культура – горох, гречиха, кукуруза на силос.
Роль зерновых бобовых культур в решении проблемы растительного белка.
Относятся к семейству Бобовые-Fabaceae. В России они занимают 1,1 млн. га. Средний урожай зерна 16-18 ц/га. В РФ наибольшую площадь занимает горох, затем соя и люпин. Остальные зерновые бобовые культуры занимают незначительные площади. В нечерноземной зоне основные зерновые бобовые - горох, люпин однолетний, кормовые бобы. В нашей стране наблюдается дефицит растительного кормового белка, т. е. корма не сбалансированы по содержанию белка. Фактически на 1 кормовую единицу приходится около 80 г переваримого протеина. Необходимо по норме на 1 к. е. 100-110 г переваримого протеина. Это приводит к перерасходу кормов на производство единицы животноводческой продукции. Чтобы получить 1 кг молока, нужно больше израсходовать. Дефицит белка вызывает различные заболевания животных. Ведущая роль в решении проблемы растительного белка принадлежит зерновым бобовым культурам. Зерновые бобовые отличаются повышенным содержанием белка и в семенах, и в зеленой массе. В семенах в среднем содержится от 25 до 40% белка. Белок богат незаменимыми аминокислотами. Зерновые бобовые дают самый дешевый белок, т. к. большая часть его создается в результате усвоения атмосферного азота. В нашей стране фуражного зерна на долю зерновых бобовых приходится около 2 %, необходимо 10-12%.
Читайте также:

