Для определения содержания в продуктах микроорганизмов производят посев методом штриха
Обновлено: 05.10.2024
Микробиологическое исследование пищевых продуктов проводят с целью выявления КМАФАнМ путем высева на чашки Петри с питательной средой (мясопептонным агаром) или отдельных групп микроорганизмов путем высева на элективные питательные среды. Количество микроорганизмов определяют в 1 см 3 продукта жидкой консистенции или в 1 г продукта плотной консистенции.
Отбор средней пробы. При анализе партии продукта готовят среднюю пробу. Для разных пищевых продуктов установлены нормы отбираемых средних проб и правила их отбора. Однако во всех случаях необходимо соблюдать условия, исключающие контаминацию исследуемого продукта посторонними микроорганизмами.
При исследовании жидкие и полужидкие продукты (молоко, сметана, соусы и др.) тщательно перемешивают и затем отбирают в стерильную посуду простерилизованным черпаком емкостью 50-100 см3. Пробы плотных продуктов (мясо, колбаса, рыба, кулинарные изделия и др.) отбирают из толщи продукта в разных местах. Предварительно поверхность исследуемых участков прижигают раскаленным ножом и по ней делают глубокий разрез стерильным скальпелем. Края разреза раздвигают стерильным пинцетом и вырезают стерильными ножницами небольшие кусочки продукта. Отобранные таким образом из разных мест образцы измельчают, собирают в стерильную тару и составляют из них среднюю пробу.
При оборе средней пробы таких продуктов, как сливочное масло, творог, сыр используют стерильный щуп, который вводят в продукт с одного края и доводят до противоположного вглубь и наискосок. Затем стерильным скальпелем из нескольких мест отобранной пробы берут кусочки, измельчают их и помещают в стерильную посуду.
Подготовка пробы к анализу. При исследовании плотных продуктов из средней пробы берут навеску массой от 1 до 10 г, переносят ее в стерильную ступку и тщательно растирают. Если продукт очень плотный, то его растирают в ступке с предварительно прогретым кварцевым песком. Растертый продукт вносят в колбу, содержащую от 90 до 99 см 3 стерильного физиологического раствора (0,5 %-й раствор хлорида натрия). Содержимое колбы осторожно взбалтывают в течение 5 мин. В колбе получается первое разведение продукта (1:10), из которого готовят последующие разведения.
Навеску сливочного масла расплавляют на водяной бане при температуре не выше 45 °С, после чего в 9 см 3 физиологического раствора вносят стерильной пипеткой 1 см 3 продукта, получая разведение 1:10.
Для исследования жидких и полужидких продуктов из полученной средней пробы после тщательного перемешивания отбирают стерильной пипеткой 1 см 3 продукта и вносят его в пробирку, содержащую 9 см 3 стерильного физиологического раствора.
Приготовление разведений. Пищевые продукты могут содержать значительное количество микроорганизмов, поэтому, чтобы получить изолированные колонии, необходимо приготовить десятикратные разведения продукта.
Полученное 1-е разведение продукта тщательно перемешивают новой стерильной пипеткой, вбирая в нее и выпуская из нее полученную взвесь. Эту процедуру выполняют 3-5 раз, затем той же пипеткой отбирают 1 см 3 суспензии и переносят её во 2-ю пробирку с 9 см 3 стерильного физиологического раствора. Получают 2-е разведение (1:100). Пипетку нельзя погружать в жидкость во избежание смывания микроорганизмов с ее наружной поверхности. Новой стерильной пипеткой тщательно перемешивают содержимое 2-го разведения, набирают из него 1 см 3 и переносят в следующую пробирку с 9 см 3 стерильной воды, получая третье разведение (1:1000). Таким же образом готовят последующие разведения до получения необходимого результата.
Внимание! Для приготовления каждого разведения следует использовать отдельную стерильную пипетку. Пренебрежение этим правилом может привести к получению ошибочного результата.
Посев в чашки Петри. Для определения КМАФАнМ используют метод глубинного посева на плотные питательные среды. Схема посева приведена на рис. 15.1. На крышках чашек стеклографом отмечают исследуемый вариант и разведение. Каждое разведение высевают не менее чем в 2-3 параллельные чашки. Разведения выбирают с таким расчетом, чтобы на чашке выросло от 30 до 300 колоний. Стерильной пипеткой отбирают из пробирки по 1 см 3 соответствующего разведения суспензии и переносят его в 2-3 пустые стерильные чашки Петри. После внесения разведения суспензии чашки заливают питательной средой не позднее чем через 15 мин. Для этого над пламенем спиртовки вынимают пробку из пробирки или колбы с расплавленной и остуженной до 45-50 °С питательной средой и обжигают края. Затем приоткрывают крышку чашки так, чтобы только вошло горлышко колбы, и осторожно вливают 10-15 см 3 питательного агара, толщина слоя которого должна быть около 5 мм. Чашку закрывают крышкой и сразу же легкими вращательными движениями перемешивают питательную среду с посевным материалом, после чего оставляют на 10-15 мин в горизонтальном положении для застывания среды. Засеянные чашки переворачивают вверх дном и помещают на 24-48 ч в термостат с температурой 37±1 °С.
Рис. 15.1. Схема посева продукта для определения КМАФАнМ

Подсчет выросших колоний. После инкубации отбирают чашки, на которых выросло от 30 до 300 колоний, подсчитывают их визуально или с помощью специального прибора для подсчета колоний. При подсчете колоний чашки просматривают в проходящем свете и отмечают подсчитанные колонии чернилами или тушью. В случае, если на чашке с максимальным разведением выросло более 300 колоний, можно вести их подсчет при помощи лупы и сетки из оргстекла со стороной квадрата 1 см при боковом освещении. Подсчет колоний проводят не менее чем в 20 квадратах, определяют среднее их число на 1 см 2 и умножают на площадь поверхности среды в чашке.
Количество микроорганизмов в 1 см (или в 1 г) продукта (КМАФАнМ) определяют, как произведение количества выросших колоний (N) на показатель разведения (n):
КМАФАнМ = N •10 n КОЕ/см 3 .
Примечание. Анаэробные микроорганизмы не определяются чашечным методом, так как для их выращивания необходимо создать анаэробные условия. Культивирование анаэробов осуществляют в анаэростатах (см. рис. 4.1) или используют питательные среды с редуцирующими веществами.
15.2. Определение бактерий группы кишечных палочек (БГКП) в пищевых продуктах
Определение БГКП в пищевых продуктах проводят в соответствии с ГОСТ Р 50474-93. Продукты пищевые. Методы выявления и определения количества бактерий группы кишечной палочки (колиформных бактерий).
Метод определения БГКП основан на обнаружении образования газа и кислоты при высеве определенного количества продукта (или смыва с его поверхности) в жидкие питательные среды, содержащие лактозу (среда Кесслера) с последующим подтверждением принадлежности выросших микроорганизмов к группе кишечных палочек по морфологическим и культуральным признакам.
Исследование на наличие БГКП проводят в несколько этапов:
I этап - приготовление разведений продукта. Если продукт плотный (колбаса, сыр, масло, творог и др.), то результат выражают в отсутствии БГКП в определенной его массе (г). Если продукт жидкий (молоко, кисломолочные напитки, сок и т. д.), то БГКП должны отсутствовать в определенном его объеме (см 3 или дм 3 ).
II этап - посев определенного количества продукта или его разведений в среду Кесслера. Среду Кесслера разливают в пробирки или колбы, в которые помещают поплавок (стеклянная трубочка
с одним запаянным концом). После стерилизации поплавок должен быть заполнен средой.
В пробирки со средой Кесслера вносят по 1 см 3 соответствующего разведения продукта (10 -1 ;10 -2 ;10 -3 )и ставят в термостат при температуре (37±1) °С. Через 24 ч инкубации посевы просматривают и отмечают образование газа в поплавке и изменение цвета среды из фиолетового в желто-зеленый. Записывают, в каких разведениях произошло газообразование.
После инкубации чашки просматривают. Бактерии группы кишечной палочки образуют на среде Эндо красные или розовые блестящие колонии с металлическим блеском или без него. Такой характер роста на среде Эндо эти бактерии дают за счет сбраживания лактозы и образования кислоты, вызывающей восстановление индикатора фуксина, окрашивающего колонии в красный цвет.
Из типичных колоний на среде Эндо готовят препараты, окрашивают их по Граму и микроскопируют. Если в препарате обнаруживаются мелкие грамотрицательные неспорообразующие палочки, то одновременно ставят оксидазный тест. Заключение о том, что обнаруженные в продукте микроорганизмы относятся к БГКП, делают на основании выявления в посевах грамотрицательных, не образующих спор палочек, сбраживающих лактозу с образованием кислоты и газа при температуре 37±1 °С с отрицательным тестом на оксидазу. При этом указывают массу навески продукта (в г) или его объем (в см 3 ). В случае отсутствия на среде Эндо типичных для БГКП колоний продукт считают не загрязненным кишечными палочками.
15.3. Определение количества дрожжей и плесеней
Для определения количества дрожжей и плесеней в пищевых продуктах делают посев соответствующих разведений в чашки Петри, которые заливают расплавленным и остуженным до температуры 45-50 °С сусло-агаром (СА) или средой Сабуро. Содержимое чашек перемешивают вращательными движениями и оставляют для застывания на 10-15 мин, после чего ставят в термостат с температурой 30±2 °С на 2-3 сут. После инкубации в чашках подсчитывают отдельно количество выросших колоний плесеней и дрожжей. Результат выражают числом КОЕ/ см3 (или г).
Контрольные вопросы
1. Что такое КМАФАнМ?
2. Для чего делают разведения пищевого продукта при определении количества микроорганизмов?
3. Какие питательные среды используют для определения КМАФАнМ, дрожжей и плесеней?
4. Из каких этапов состоит определение БГКП в пищевых продуктах?
5. Какие среды используют для определения БГКП в пищевых продуктах?
6. По каким признакам устанавливают рост БГКП в среде Кесслера?
7. Как выглядят колонии БГКП на среде Эндо?
8. В каком случае дают положительный ответ на присутствие в пищевом продукте БГКП?



В Г Д
Рис. 6. Удобный метод посева штрихом в чашки для получения отдельных колоний. А. Для маркировки на обратной стороне чашки Петри карандашом наносят букву Т, разделяющую дно на 3 сектора. Б. Петлей с культурой зигзагом наносят штрихи на поверхности агара в секторе 1, как показано на рисунке. Для этого крышку чашки сначала приподнимают, а после нанесения штриха сразу закрывают. Петлю стерилизуют в пламени и дают ей остыть (15 с). В. Проводят петлей по поверхности среды в секторе 1, как показано на рисунке, и затем немедленно наносят ею зигзагом штрихи на поверхности среды в секторе 2. Прогревают петлю в пламени и дают ей остыть. Г. Проводят петлей по поверхности среды в секторе 2, как показано, и затем наносят ею зигзагом штрихи на поверхности среды в секторе 3. Д. Инкубируют опрокинутые вверх дном чашки, как показано на рисунке, для того, чтобы конденсирующаяся вода с крышки не попала на поверхность агара. В секторе 1 вырастает большое число колоний, тогда как в секторах 2 и 3 появляются отдельные хорошо изолированные колонии.
Получение чистой культуры методом рассева в глубине среды (по Коху)
Три пробирки, содержащие по 15 мл мясо-пептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43—45°С. В пробирку вносят одну бактериальную петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого прокаленной и остуженной петлей содержимое 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского
Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливающегося роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во вторую и третью чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 180°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся на петле, расходуется постепенно, и по линиям сетки, нанесенным в конце посева, вырастают изолированные колонии микробов.

Настоящий стандарт распространяется на пищевые продукты и устанавливает методы культивирования для выявления присутствия (отсутствия) или определения количества микроорганизмов соответствующих групп, семейств, родов или видов.
Методы основаны на посеве продукта, разведении навески продукта или осажденных на мембранном фильтре клеток микроорганизмов в питательные среды, с последующим культивированием посевов в условиях, благоприятных для роста микроорганизмов.
Требования стандарта являются обязательными.
1. МЕТОДЫ ОТБОРА И ПОДГОТОВКИ ПРОБ
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669.
2. АППАРАТУРА И ПИТАТЕЛЬНЫЕ СРЕДЫ
Аппаратура и питательные среды по нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
3. ПОДГОТОВКА К АНАЛИЗУ
3.1. Степень разведения навески продукта
3.1.1 Степень разведения навески продукта для посева на плотные среды выбирают так, чтобы общее количество колоний, выросших на чашке Петри, колебалось в пределах 15 - 300; количество колоний специфических групп бактерий (например, колиформных) – 15 - 150; плесеней 5 - 50.
3.1.2 Степень разведения навески продукта для посева в жидкие среды выбирают так, чтобы хотя бы в одной пробирке наибольшего разведения отсутствовали микроорганизмы.
3.1.3. Количество продукта, которое необходимо профильтровать для получения изолированных колоний на фильтре, должно быть указано в нормативно-технической документации на методы анализа соответствующих групп, семейств, родов или видов микроорганизмов.
3.2. Объем навески продукта или его разведения для посева
3.2.1. При посеве глубинным методом 1 см 3 жидкого продукта или разведения навески
продукта смешивают с расплавленной питательной средой.
3.2.2 При посеве поверхностным методом 0,1 или 0,2 см 3 жидкого продукта или разведения навески продукта вносят на поверхность плотной среды.
3.2.3. Для выявления присутствия (отсутствия) микроорганизмов и определения их таксономических свойств в жидкие среды вносят до 50 г (см 3 ) продукта; при определении количества микроорганизмов в жидкие среды вносят до 100 см 3 жидкого продукта или разведения навески.
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Глубинный метод посева в плотные среды
4.1.1. Жидкий продукт или разведение навески вносят параллельно в две чашки Петри и заливают не позднее чем через 15 мин расплавленной и охлажденной до температуры (45 ± 1) °С питательной средой. Высота слоя питательной среды должна быть 4 - 5 мм.
4.1.2. Среду немедленно равномерно перемешивают с посевным материалом круговыми движениями чашки так, чтобы среда не вытекла из чашки и не загрязняла крышку. После застывания среды чашки с посевами вверх дном помещают в термостат.
4.2. Поверхностный метод посева на плотные среды
4.2.2. На подсушенную среду наносят жидкий продукт или разведение навески и немедленно равномерно растирают по поверхности шпателем - изогнутой стеклянной палочкой.
4.2.3. Засеянную поверхность подсушивают, выдерживая чашки в горизонтальном положении в течение 15 мин.
4.3. Метод посева в жидкие среды
4.3.1. В колбу или пробирки с питательной средой вносят навеску продукта или разведение навески.
4.3.2. При определении наиболее вероятного числа (НВЧ) микроорганизмов из навески продукта готовят исходное и ряд десятикратных разведений до такой степени, чтобы можно было определить предполагаемое НВЧ микроорганизмов.
Самое низкое разведение и высеваемые объемы его инокулума выбирают в зависимости от предполагаемого количества микроорганизмов и чувствительности метода следующим образом:
по 1 см 3 из разведения 10 -1 и высших разведений, если надо определить количество микроорганизмов, превышающее 3 клетки в 1,0 г (см 3 ) продукта;
по 10 см 3 из разведения 10 -1 или 1 см 3 неразведенного продукта и по 1 см 3 из разведения 10 -1 и более высокого разведения, если надо определить количество микроорганизмов, превышающее 3 клетки в 10,0 г (см 3 ) продукта;
по 10 и 1 см 3 неразведенного продукта и ряда его разведений, если надо определить количество микроорганизмов, превышающее 3 клетки в 100 см 3 продукта.
4.3.3. Все разведения и неразведенный продукт высевают параллельно в три пробирки с питательной средой. Инокулум объемом 1 см 3 высевают в 10 см 3 среды нормальной концентрации, инокулумы объемом 10 см 3 - в 10 см 3 среды двойной концентрации.
4.4. Метод мембранных фильтров
Метод мембранных фильтров применяют для анализа легко фильтруемых жидких продуктов или продуктов, дающих растворы с высоким осмотическим давлением.
4.4.1. Подготовка фильтров
4.4.1.1. При работе с мембранными фильтрами следует соблюдать следующие условия:
выбирают фильтры, размеры пор которых позволяют осадить на нем основное количество микроорганизмов определенных видов или групп; для улавливания бактерий применяют фильтры со средним диаметром пор 0,3 мкм;
визуально контролируют отсутствие механических повреждений фильтров, и во избежание повреждений фильтры берут пинцетом, не имеющим рубчиков;
фильтры хранят в сухом состоянии;
перед использованием фильтры освобождают от остатков растворителей, пузырьков воздуха и загрязнений кипячением по ГОСТ 18963 в дистиллированной воде;
для фильтрации жидкостей применяют аппарат Зейтца, прибор Гробара и другие установки;
части установки для фильтрации, соприкасающиеся с фильтруемым раствором, стерилизуют или кипятят;
стерильный влажный фильтр осторожно помещают блестящей стороной вверх на подкладку из пористого материала или сетку фильтрующей аппаратуры.
Мембранные фильтры не применимы для фильтрации суспензий или гомогенатов продуктов, загрязняющих при фильтрации поры фильтров.
4.4.2. Проведение фильтрации
4.4.2.1. Для фильтрации раствора с высоким осмотическим давлением раствор предварительно разводят дистиллированной или пептонной водой в соотношении, позволяющем легко профильтровать разведенные растворы.
Жидкий продукт, содержащий небольшое число взвешенных частиц, фильтруют в два этапа. Для освобождения от взвешенных частиц его фильтруют через фильтр со средним диаметром пор 4 мкм, а затем - через фильтр, диаметр и размеры пор которого выбраны в соответствии с группой или видом выявляемых микроорганизмов. Оба фильтра культивируют в аналогичных условиях.
После осаждения микроорганизмов на фильтре из растворов с высоким осмотическим давлением или из растворов, содержащих антимикробные вещества, его промывают дистиллированной водой или пептонно-солевым раствором.
4.4.2.2. Фильтрацию заканчивают в момент исчезновения влаги на поверхности фильтра. Немедленно после окончания фильтрации фильтр переносят на плотные или в жидкие питательные среды. На плотную среду фильтр накладывают нижней стороной так, чтобы она полностью соприкасалась с поверхностью среды.
4.5. Посевы термостатируют в благоприятных для роста микроорганизмов условиях, указанных в нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. Подсчет микроорганизмов на плотных средах
5.1.1. В посевах на плотных питательных средах, полученных глубинным и поверхностным методами или методом мембранных фильтров:
для подсчета общего числа жизнеспособных микроорганизмов учитывают все выросшие колонии;
для подсчета количества микроорганизмов определенных таксономических групп на селективных средах учитывают колонии, характерные по морфологии для выявляемой группы;
для подсчета количества определенных групп или видов микроорганизмов на селективно-диагностических или диагностических средах учитывают колонии характерной морфологии, показавшие характерную цветную реакцию с присутствующим в среде индикатором.
Колонии подсчитывают невооруженным глазом или с помощью линзы с шестикратным увеличением, или с помощью специально предназначенного для подсчета колоний прибора.
5.2. Выявление и подсчет микроорганизмов в жидких средах
5.2.1. Живые микроорганизмы в жидких средах выявляют по помутнению среды, появлению осадка, пленки, газообразованию или по наличию роста микроорганизмов в пересевах на плотных питательных средах.
Микроорганизмы определенных физиологических или таксономических групп выявляют по изменению цвета индикаторов, образованию газа из определенных веществ и по другим признакам, специфическим для метаболизма выявляемой группы или видов микроорганизмов.
Для получения изолированных колоний внесенную каплю распределяют по поверхности среды петлей в виде штриха, как показано на чертеже.
5.3. Подтверждение характерных колоний
5.3.1. При необходимости подтверждения принадлежности характерных колоний к выявляемым микроорганизмам отбирают не менее 5 отдельных колоний для получения чистой культуры.
5.3.2. Каждую выбранную колонию микроорганизмов пересевают на неселективную питательную среду, для чего кончиком стерильной петли (диаметр до 2 мм) отбирают небольшое количество верхней части колонии микроорганизмов.
На питательную среду высеивают непосредственно отобранные микроорганизмы или из них готовят сначала суспензию, которую потом высевают петлей на поверхность среды в чашке Петри или на скошенную поверхность среды в пробирке.
Для приготовления суспензии микроорганизмы суспензируют в 1 - 2 см 3 пептонно-солевого раствора.
5.3.3. Посевы инкубируют в условиях, указанных в нормативно-технической документации, устанавливающей методы анализа соответствующих групп, семейств, родов или видов.
После инкубирования отмечают колонии одного типа. Затем из каждого пересева отбирают по одной колонии каждого типа по нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
Способ посева штрихом

5.3.4. Если при подтверждении характерных колоний обнаружено, что не менее 80 % колоний принадлежат к выявляемым микроорганизмам (т. е. не менее 4 из 5 колоний), то считают, что все характерные колонии, выросшие на чашках Петри, принадлежат к выявляемым микроорганизмам.
В остальных случаях количество выявляемых микроорганизмов определяют исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения.
5.3.5. Если при подтверждении колоний, полученных при пересеве с жидкой питательной среды по п. 5.2.2, хотя бы в 1 из 5 колоний подтверждено наличие выявляемых микроорганизмов, то считают, что в посеве на жидкой среде присутствуют выявляемые микроорганизмы и такие пробирки являются положительными.
5.4. Способы выражения результатов определения количества микроорганизмов подсчетом на чашках Петри
5.4.1. Колонии микроорганизмов на плотных средах подсчитывают в посевах того разведения, количество колоний в котором соответствует требованиям п. 3.1.1. По результатам подсчета вычисляют среднеарифметическое значение числа колоний из всех посевов одного разведения.
Если число колоний соответствует требованиям п 3.1.1 в посевах не одного, а двух следующих друг за другом разведениях, то вычисляют среднеарифметическое количество микроорганизмов в каждом из этих разведений отдельно.
Если полученные результаты отличаются друг от друга более чем в 2 раза, то оценку проводят по результатам посева наибольшего разведения.
5.4.2. Если в одном из параллельных посевов одного разведения число колоний не соответствует требованиям п. 3.1.1, эти результаты используют для подсчета среднеарифметического значения и при соответствии полученного значения п. 3.1.1 его используют для дальнейших расчетов.
5.4.3 Если число колоний в параллельных посевах ниже уровней, указанных в п. 3.1.1, то допускается определять суммарное число колоний, если результат соответствует требованиям п. 3.1.1, то его используют для дальнейших расчетов. При этом количество инокулята т будет равно суммарному количеству, внесенному на параллельные посевы.
5.4.4. Полученные среднеарифметические значения округляют до числа, кратного 5, если среднее арифметическое число микроорганизмов менее 100; до числа, кратного 20, если среднее арифметическое число микроорганизмов более 100 и оканчиваются цифрой 5; до числа, кратного 10, если среднеарифметическое число микроорганизмов более 100 и не оканчиваются цифрой 5.
5.4.5. Количество микроорганизмов в 1,0 г (см 3 ) продукта М вычисляют по формуле

где N - степень разведения навески;
т - количество инокулята, внесенное на чашку Петри, см 3 ;
С - округленное среднеарифметическое значение числа колоний.
Результат вычисления выражают числом от 1,0 до 9,9 ´ 10 n .
Для пересчета количества микроорганизмов на 1,0 г (см 3 ) продукта при анализе по методу мембранных фильтров число колоний, выросших на фильтре, умножают на степень разведения и делят на массу (объем) профильтрованной жидкости.
Допускается при использовании метода мембранных фильтров выражать количество микроорганизмов на 10 см 3 (10 г) или на 10 см 2 поверхности продукта и более.
5.4.6. Если среднеарифметическое значение числа колоний, выросших на чашках Петри, в посевах одного разведения или число подтвержденных колоний меньше числа, указанных в п. 3.1.1, результаты выражают следующим образом:

количество определяемых микроорганизмов в 1,0 г (см 3 ) продукта меньше 15 или 5, умноженных на
где N и т по п. 5.4.5.
Допускается для приблизительного подсчета учитывать чашки Петри, число колоний на которых меньше указанных в п. 3.1.1.
Доверительные интервалы для случаев с числом колоний меньше 15 указаны в табл. 2.
5.4.7. Если рост микроорганизмов на чашках Петри отсутствует или при подтверждении микроорганизмы определенных физиологических или таксономических групп, семейств, родов или видов не обнаружены, то результат выражают следующим образом:

количество определяемых микроорганизмов в 1,0 г (см 3 ) продукта меньше 1, умноженной на .
5.4.8. Если среднеарифметическое значение числа колоний, выросших на чашках Петри, в посевах одного разведения превышает количества, указанные в п. 3.1.1, то результат выражают следующим образом:

количество определяемых микроорганизмов в 1,0 г (см 3 ) продукта больше 150 или 300, или 50, умноженных на
5.5. Способы выражения результатов выявления присутствия (отсутствия) микроорганизмов. Результаты выявления микроорганизмов в определенной навеске (объеме или площади поверхности) выражают с указанием величины навески следующим образом:
5.6. Определение наиболее вероятного числа (НВЧ) микроорганизмов в 1,0 г (см 3 ) продукта
5.6.1. НВЧ микроорганизмов определяют, исходя из количества положительных пробирок с посевами по табл. 1.
5.6.2. Для определения выбирают три самых высоких последовательных разведения, в первом из которых все три пробирки являются положительными, а в последнем или последующем неоцениваемом разбавлении три пробирки отрицательные (например, 3, 2, 0 или 3, 2, 1, 0).
5.6.3. Если после разведения, в котором все три пробирки были отрицательными, одна из пробирок большего (т. е. следующего за ним) разведения окажется положительной (например, 3, 2, 0, 1), то для определения НВЧ учитывают три наивысшие разведения, начиная с того, в котором количество положительных пробирок было меньше трех (т. е. 2, 0, 1).
5.6.5. Если ни в одном из разведений не было трех положительных пробирок, то для определения НВЧ учитывают три последовательных разведения (например, 2, 2, 1 или 2, 1, 0).
5.6.6. Если все пробирки посеянных разведений окажутся отрицательными, т. е. 0, 0, 0, то НВЧ микроорганизмов ниже числа, выявляемого посеянными разведениями (например, ниже чем 3 в 10,0 г) и наоборот, если все пробирки посеянных разведений окажутся положительными, т. е. 3, 3, 3, то НВЧ микроорганизмов будет выше его максимального значения, определенного посеянными разведениями (например, выше чем 1100 в 1,0 г).
При необходимости определения конечного числа микроорганизмов исследование повторяют.
5.6.7. Если три десятикратных разведения были более низкими или более высокими по сравнению с приведенными в табл. 1 разведениями, то НВЧ микроорганизмов в пробе будет на столько разрядов ниже или выше, на сколько разрядов ниже или выше разведения, которые применялись для его подсчета, например, 10 см 3 основного разведения или 1 см 3 неразведенной пробы представляют собой разведение на один разряд ниже и 10 см 3 неразведенной пробы на два разряда ниже.
Например, при получении комбинации 3, 2, 1 НВЧ составляет 150 микроорганизмов в 1,0 г (см 3 ) в случае, если инокулированы по 1 см 3 разведения 10 -1 , 10 -2 , 10 3 . Если инокулированы разведения 10 -2 , 10 -3 , 10 -4 , то найденное НВЧ равно 150 ´ 10 = 1500 микроорганизмов в 1,0 г (см 3 ). Если инокулировано по 10 и 1 см 3 неразведенного продукта и 1 см 3 разведения 10 -1 , то НВЧ равно 150 : 100 = 1,5 в 1,0 г (см 3 ) или 15 микроорганизмов в 10 г (см 3 ) продукта.
5.6.8. Из значений НВЧ учитывают те, которые отвечают наиболее вероятным комбинациям трехзначного числа первой категории. Если НВЧ, соответствующее комбинации трехзначного числа первой категории, не получено, то его определяют комбинациями трехзначного числа, соответствующего второй категории.
5.6.9. Окончательный результат определения НВЧ выражают по п. 5.4.5.
Расчет наиболее вероятного числа (НВЧ) микроорганизмов
Количество положительных пробирок
Категория оценки НВЧ для одновременно
проанализированных проб в количестве
Посевом в микробиологической практике называется заражение стерильной питательной среды каким-либо исследуемым материалом (вода, пищевые продукты и т.д.) для выявления микроорганизмов. Пересев – это перенос выращенных микроорганизмов в свежую стерильную питательную среду.
В микробиологической практике используются следующие основные способы посевов (пересевов) микроорганизмов:
а) штрихом – осуществляется бактериологической петлей из пробирки в
пробирку или в чашку Петри;
б) уколом – проводится бактериологической иглой из пробирки в пробирку;
в) газоном – осуществляется шпателем Дригальского в чашке Петри;
При посевах (пересевах) культуры необходимо соблюдать стерильность, т.е. предотвращать возможность загрязнения исследуемого материала и питательных сред посторонними микроорганизмами.
4.3.1 Посев штрихом (уколом) из пробирки в пробирку
Техника посева по этапам показана на рис. 3.
а) зажечь спиртовку;
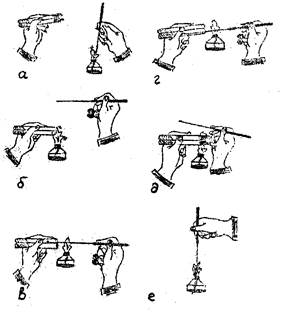
б) взять в левую руку две пробирки: одну, из которой будет проводиться пересев, и другую со свежей питательной средой (ближе к себе), (см. рис.3,а);
Рисунок 3 - Посев из пробирки в пробирку
в) прокалить бактериологическую петлю (иглу) в пламени (см. рис.3,а);
г) открыть пробирки, захватив одновременно обе ватные пробки мизинцем правой руки (см. рис.3,б);
д) обжечь края обеих пробирок (см. рис.3,б);
е) внести петлю в пробирку с микроорганизмами и, захватив немного микробной взвеси, перенести ее, не касаясь стенок пробирки, в пробирку со свежей питательной средой (см. рис.3, в,г), т.е произвести посев культуры.
Посев штрихом осуществляется на скошенный агар (агар-косячкок) – петлю осторожно вводят в пробирку до границы конденсационной воды и зигзагообразными движениями распределяют материал по поверхности агара снизу вверх.
Посев уколом осуществляется в агаровый столбик – среду прокалывают бактериологической иглой до дна пробирки.
Посев на жидкие среды – материал, взятый петлей, наносят на стенку пробирки у верхнего уровня среды, и слегка встряхивая пробирку, смывают его средой.
ж) обжечь обе пробирки и края пробирок и одновременно в пламени закрыть обе пробирки (см. рис. 3,д);
з) обжечь петлю в пламени (см. рис. 3,е).
Посев суспензии микроорганизмов можно производить с помощью пипетки. Для этого профламбированной пипеткой набирают жидкость, выпускают ее содержимое (при количественном посеве – определенный объем) в свежую питательную среду. После посева использованную пипетку опускают в сосуд с дезинфицирующим раствором.
4.3.2 Посев газоном
Посев газоном используется для изучения поверхностного роста культур. Исследуемый материал наносят петлей или пипеткой на поверхность застывшей питательной среды в чашке Петри и затем равномерно распределяют его по поверхности, пользуясь предварительно простерилизованным шпателем Дригальского.
Левой рукой слегка приподнимают крышку чашки Петри, стоящей на поверхности стола, а правой - вносят в чашку шпатель. Круговыми движениями шпателя распределяют культуру по всей поверхности плотной питательной среды.
4.3.3 Посев розливкой
Посев розливкой используют в случае необходимости вырастить микроорганизмы в толще среды (глубинный посев). Глубинный посев можно осуществить двумя способами:
1) Культуру микроорганизмов вносят в пробирки с расплавленной и охлажденной до 40-50 о С плотной питательной средой, а затем выливают эту смесь в чашки Петри;
2) Взвесь микроорганизмов вносят бактериологической петлей или пипеткой непосредственно на дно стерильной чашки Петри, слегка приоткрыв крышку, а затем заливают ее расплавленной и охлажденной до 40-50 о С плотной питательной средой. Среду с культурой тщательно перемешивают круговыми движениями чашки, не поднимая ее с поверхности стола. После этого чашку оставляют на столе до застывания агара.
Читайте также:

