Finegoldia magna в бак посеве
Обновлено: 05.10.2024
Смешанные анаэробно–аэробные инфекции занимают ведущее положение в хирургической патологии органов брюшной, грудной полостей и мягких тканей, а их удельный вес достигает 70–80 %. При этом видовой состав изолятов близок к нормальной микрофлоре пораженного органа или его области [1]. К числу анаэробных бактерий относятся разные по морфологии микроорганизмы (табл. 1), способные удовлетворять свои энергетические потребности в отсутствии кислорода (не более 0,5 % для строгих анаэробов и от 2 до 8 % для умеренно–облигатных анаэробов) [2]. Они формируют нормальную микрофлору человека, и в отдельных локусах (прямая кишка, ротовая полость) их количество на несколько порядков превышает число аэробных (Pseudomonas aeruginosa, Acinetobacter spp. и др.) и факультативно анаэробных (семейство Enterobacteriaceae, Staphylococcus spp., Streptococcus spp., Enterococcus spp. и др.) микроорганизмов (табл. 2).
Экзогенные анаэробные моноинфекции встречаются относительно редко и в основном связаны с клостридиями. Обычно это пищевые отравления, ботулизм, столбняк, гастроэнтерит и некротический энтерит, мионекроз. У больных с обструктивными или перфоративными повреждениями терминальных отделов подвздошной и толстой кишки Clostridium spp. (в первую очередь, C. perfringens и C. septicum) могут участвовать в развитии перитонита, интраабдоминального абсцесса и сепсиса. Бактериемия, обусловленная C. septicum, наблюдается у 70–85 % пациентов с карциномой толстой кишки, лейкемией или лимфомой [32]. Токсигенные штаммы C. difficile, колонизирующие толстый кишечник, вызывают псевдомембранозный колит, который лечится приемом внутрь метронидазола или ванкомицина. Бензилпенициллин остается препаратом выбора при клостридиальной инфекции. Редко возникающая к нему резистентность у C. perfringens связана с модификацией ПСБ 1 (пенициллинсвязывающего белка) [33]. Резистентность заметно выше у C. ramnosum, C. clostridiforme, C. butiricum, продуцирующих индуцибельные бета–лактамазы [34]. Высоко активны и другие бета–лактамы: пиперациллин, ампициллин/сульбактам, амоксициллин/клавуланат, карбапенемы; из препаратов других групп – метронидазол, хлорамфеникол.
Значение неспороносных грамположительных анаэробов в патологии человека часто недооценивается, так как они очень чувствительны к действию кислорода даже при использовании транспортных сред и в отличие от других анаэробов при посеве растут более 48 часов. Среди палочковидных бактерий Actinomyces spp. являются наиболее типичными условными патогенами. Они входят в состав микрофлоры ротовой полости, фекалий и могут вызывать гастроинтестинальные инфекции, а также актиномикозы разной локализации, чаще экзогенного происхождения [3, 4]. Bifidobacterium spp. и Lactobacillus spp. колонизируют толстый кишечник, где снижение их пороговой концентрации сопровождается явлениями дисбактериоза. Применительно к интраабдоминальной патологии они выделяются при абсцессах толстого и нижних отделов тонкого кишечника, встречаются при перитонитах, высеваются из крови при абдоминальном сепсисе [5, 6, 10, 11]. Абсцессы кишечника могут быть связаны с Eggerthella spp., Pseudoramibacter spp., Eubacterium spp., входящими в состав нормальной микрофлоры толстой кишки [8, 9, 12]. Turicibacter spp. были выделены из крови при остром аппендиците [13].
Большинство палочковидных анаэробов чувствительны к карбокси– и уреидопенициллинам, цефокситину, карбапенемам и хлорамфениколу. Метронидазол не активен против Actinomyces spp. (МПК90 варьирует от 25 до >125 мкг/мл и более), а 92 % культур Eubacterium spp. сохраняют к нему чувствительность [35].
Среди ГПАК в фекалиях 20–38 % приходится на долю изолятов Finegoldia magna (ранее – Peptostreptococcus magnum), удельный вес которых среди всех копрокультур анаэробов составляет 5–12 % [15]. Они могут вызывать интраабдоминальные абсцессы, так же как Micromonas micros и Anaerococcus prevotii (ранее принадлежали к Peptostreptococcus spp. [18, 19]), Peptostreptococcus anaerobius (единственный вид, представляющий в настоящее время одноименный род; составляет до 13–18 % от ГПАК в фекалиях [14, 16]) и Peptoniphilus spp. (ранее Peptostreptococcus spp. [14]), выделенные и при перитоните. Peptococcus niger и Ruminococcus spp., являясь частью нормофлоры толстого кишечника, выделяются при ректальных абсцессах, перитоните и абдоминальном сепсисе [14, 17].
До 96 % ГПКА чувствительны к бета–лактамам, несколько ниже их чувствительность к клиндамицину и метронидазолу (84 и 88 % соответственно) [36].
Грамотрицательные анаэробы выделяются более чем у 50 % больных при неспецифических инфекциях. Среди них основное место занимает группа Bacteroides fragilis, включающая разные виды, из которых наибольшее клиническое значение имеют B. fragilis и B. thetaiotaomicron, прежде всего при абдоминальных инфекциях, а также инфекциях других локализаций. Bacteroides fragilis превалируют среди нормальной микрофлоры желудочно–кишечного тракта, в незначительном количестве встречаются в нижних отделах генитального тракта и практически отсутствуют в ротовой полости и среди микрофлоры верхних дыхательных путей. Они продуцируют бета–лактамазы, что определяет профиль их антибиотикоустойчивости [19, 20].
Так называемые пигментированные грамотрицательные анаэробные палочки (прежде относились к группе Bacteroides melaninogenicus) подразделяются на сахаролитические виды, составляющие род Prevotrlla, и несахаролитические – род Porphyrpmonas. Часть видов этих бактерий представляют нормальную микрофлору кишечного тракта и могут вызывать интраабдоминальные инфекции, сопровождающиеся бактериемией. Из них P. bivia и P. distens представляют интерес в связи с устойчивостью к природным пенициллинам, аминопенициллинам, цефалоспоринам [37]. Fusobacterium spp. могут явиться причиной интраабдоминальных абсцессов, бактериемии [24]. Прочие грамотрицательные палочковидные анаэробы играют гораздо менее значительную роль при интраабдоминальных инфекциях (табл. 1).
Грамотрицательные кокки – Acidaminococcus spp., Megasphaera spp., Veillonella spp. – являются частью фекальной флоры и ротовой полости и очень редко вызывают интраабдоминальные инфекции [29, 30, 38].
Отличительной особенностью неспецифических анаэробных инфекций является их полимикробная этиология с участием аэробных и факультативно анаэробных бактерий – представителей нормальной микрофлоры. Это в значительной мере усугубляет и без того сложную проблему этиологической диагностики анаэробных инфекций. Без соблюдения специальных требований к взятию материала, условий его транспортировки и использования отработанной технологии изучения в лаборатории трудно оценить истинную роль анаэробов в патологии. Достаточно сказать, что удлинение сроков между получением материала и его посевом в анаэробных условиях губительно сказывается на жизнедеятельности микроорганизмов. Так как исследование на анаэробы требует дополнительных временных и материальных затрат, оно не всегда доступно в рутинной практике, поскольку нередко трудно соблюсти баланс между получением всеобъемлющей микробиологической информации в изучаемом образце и сроками проведения анализа, когда его результаты еще не утратили значение.
Поскольку антианаэробная терапия чаще всего проводится эмпирически, важно знать тенденции формирования резистентности клинических изолятов к антимикробным препаратам (табл. 3). Европейские данные по группе Bacteroides fragilis [40], как и результаты российских исследователей [39], свидетельствуют о неэффективности ампициллина и снижении активности цефокситина (антибиотик из группы цефамицинов, отличающихся антианаэробным спектром), более выраженном в нашей стране, несмотря на то, что этот препарат не применяется в отечественной практике. Обращает на себя внимание рост устойчивости бактероидов к клиндамицину, единичные штаммы резистентны к имипенему. Ингибиторозащищенные аминопенициллины (в данном случае ампициллин/сульбактам) и цефоперазон/сульбактам, а также метронидазол сохраняют свою активность против разных групп анаэробов (как указывалось выше, исключение составляют актиномицеты) и имеют целый ряд преимуществ по сравнению с другими антианаэробными препаратами.
Обладая бактерицидной активностью, метронидазол хорошо сочетается с бета–лактамами, аминогликозидами, фторхинолонами, макролидами, ванкомицином, сульфаниламидами, ко–тримоксазолом, что особенно важно при комбинированной терапии инфекций полимикробной этиологии, каковыми и являются интраабдоминальные инфекции. При тяжелых формах инфекций с участием анаэробов возможна ступенчатая терапия, хотя и изначальное проведение пероральной терапии достаточно эффективно ввиду высокой биодоступности метронидазола. Хорошее проникновение в органы и ткани (70–94 % от сывороточных концентраций [41]) выгодно отличает метронидазол от других антимикробных средств и позволяет применять его при любых формах интраабдоминальной инфекции, в т. ч. при панкреонекрозах, где в очаге воспаления создаются концентрации (наряду с уровнями фторхинолонов и карбапенемов), превышающие МПК для большинства возбудителей [42]. При многоцентровом рандомизированном двойном слепом исследовании эффективности лечения тяжелых интраабдоминальных инфекций комбинацией метронидазола с ципрофлоксацином при инфузионной и ступенчатой терапии в сравнении с имипенемом были получены одинаковые показатели исходов заболеваний (82–84 % излечения) [43], но фармакоэкономические преимущества были на стороне ступенчатой терапии [44]. Обычная практика применения метронидазола при тяжелых интраабдоминальных инфекциях подразумевает его комбинацию с ципрофлоксацином, либо с цефалоспоринами III–IV поколений, либо с аминогликозидами (амикацин, нетромицин).
Из других антианаэробных лекарственных средств наиболее часто используют ингибиторзащищенные аминопенициллины (амоксициллин/клавуланат и ампициллин/сульбактам), пиперациллин/тазобактам, линкосамиды в комбинации с антибиотиками широкого спектра, карбапенемы в качестве монотерапии. В целом ряде сравнительных рандомизированных исследований доказана высокая клиническая и бактериологическая эффективность цефоперазона/сульбактама в режиме монотерапии при разных формах интраабдоминальной инфекции, показаны его преимущества перед комбинацией аминогликозида с линкосамидом при сопоставимости результатов лечения с имипенемом (о чем мы писали ранее [45]).
Перспективным препаратом для проведения монотерапии смешанных анаэробно–аэробных инфекций является моксифлоксацин. При изучении его активности в отношении 350 аэробных и 550 анаэробных изолятов у пациентов с инфекциями органов брюшной полости антимикробный эффект был получен соответственно в 90,8 и 97,1 % случаях, что позволяет рассматривать этот препарат в качестве возможного эффективного средства для лечения хирургических инфекций, вызванных микробными ассоциациями [46]. В сравнительном рандомизированном исследовании показано, что лечение осложненных абдоминальных инфекций моксифлоксацином (сначала внутривенное, затем пероральное) сопровождалось частотой клинического излечения, сопоставимой с показателями, полученными при внутривенном введении пиперациллина/тазобактама с последующим переходом на пероральный прием амоксициллина/клавуланата [47].
Таким образом, особенностью интраабдоминальных хирургических инфекций является наличие анаэробного компонента в полимикробной этиологии, что требует обязательного применения препаратов с антианаэробной активностью в схемах комбинированной или монотерапии в ранние сроки независимо от получения результатов микробиологического исследования.
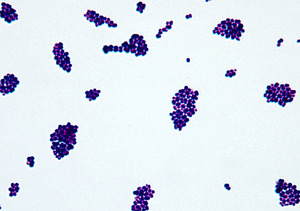
Finegoldia magna, ранее известная как Peptostreoptococcus magnus, является самым распространенным представителем анаэробных Грам-положительных кокков. Она входит в состав нормальной микрофлоры желудочно-кишечного и моче-полового трактов, также может быть обнаружена на коже и в ротовой полости. Часто выступает в роли загрязнителя в культуре. F.magna считается условно-патогенной: при определенных условиях вызывает моно- и полимикробные инфекции кожи и её производных, костей и суставов, инфекционный эндокардит, деструктивную пневмонию, медиастинит и менингит. Ключевым для понимания патогенеза F.magna является обнаружение факторов вирулентности, закодированных в геноме что послужило поводом для его полного секвенирования.
Источник: аннотация к статье
Finegoldia magna (formerly Peptostreptococcus magnus): an overlooked etiology for toxic shock syndrome?
Rosenthal ME, Rojtman AD, Frank E.
Ссылка на статью PubMed
PubMed
Найдена по запросу: Finegoldia magna
Здравствуйте,Александр! По при веденным результатам анализов лечиться не надо. А что Вы обследовали у уролога? Какие жалобы?

Лечить всегда следует больного .Когда есть диагноз .Понииание течения заболевания !В вашем сдучае - есть анализ , неплохой ! Анализ лечить не нужно . на предмет чего было обращение к урологу?!







Добрый день! Если нет жалоб, то анализ нормальный. Только он недостаточный- почему выявляли только анаэробы? И какие жалобы отправили вас к урологу?


Здравствуйте,в данный момент лечения не требуется.Но если задумайтесь о планировании-ребенка необходимо будет пройти курс антибиотикотерапии.

Напоминаем, что консультации специалистов сайта даются исключительно в справочных целях и не являются постановкой диагноза или основанием
для назначения лечения. Необходима очная консультация специалиста, в том числе для выявления возможных противопоказаний.

Бактериальный вагиноз у женщин с папилломавирусной инфекцией гениталий
Бактериальный вагиноз у женщин с папилломавирусной инфекцией гениталий
С.И.Роговская
Научный центр акушерства, гинекологии и перинатологии РАМН (дир. – акад. РАМН В.И.Кулаков), Москва
Число пациенток (n=50)
abc %
При этом только у 28 % женщин с нормоценозом микроэкология полностью соответствовала критериям нормы репродуктивного возраста: у остальных имелись те или иные отклонения, связанные либо с выраженной лейкоцитарной реакцией, либо с недостаточным титром лактобацилл, либо с нарастанием титра факультативно анаэробных УПМ на фоне высокого содержания лактобактерий. Наиболее часто, по данным бактериоскопии, при ПВИ был диагностирован БВ.
Известно, что нормальная вагинальная микроэкосистема характеризуется доминированием лактобацилл, вагинальным эпителием, поверхностные слои которого насыщены гликогеном, отсутствием лейкоцитарной воспалительной реакции. При БВ нарушается установившееся равновесие, снижается концентрация лактобацилл, повышается количество анаэробной и грамотрицательной флоры, в частности Gardnerella Vaginalis, Mycoplasma Hominis, Mobiluncus spp и др. [3].
Поскольку микроорганизмы, ассоциированные с БВ, не изменяют структуру влагалища настолько, чтобы вызвать ответную лейкоцитарную реакцию, данный синдром большинство авторов расценивают не как инфекционный, а как экологический дисбаланс. Крупные эпидемиологические исследования последних лет показали, что у женщин с нарушенной экосистемой влагалища чаще развиваются осложнения беременности и родов, повышается риск развития СПИДа и других инфекций, включая также ПВИ гениталий. Так, было показано, что нарушение в локальной иммунной системе, характеризующееся изменениями в выработке цитокинов, в частности, 1-бета-интерлейкинов, туморнекротизирующего фактора и др., выявляется как при БВ, так и при ПВИ [4].
Колонизирующие слизистую оболочку влагалища лактобациллы активно участвуют в обеспечении экологического барьера прежде всего за счет кислотообразования и продукции перекиси водорода, формируя и поддерживая кислую реакцию влагалища (pH 3,8–4,5). При этом молочная кислота метаболизируется лактобактериями в процессе деструкции гликогена, содержащегося в эпителиальных клетках. БВ характеризуется снижением количества пероксидпродуцирующих молочно-кислых бактерий и повышением количества других видов микроорганизмов. При этом процесс выработки молочной кислоты нарушается, формируется щелочная среда, происходит диссеминирование анаэробной флоры.
В настоящее время признано, что диагностика БВ должна основываться на 4 ведущих критериях: наличие жидких сероватых белей, повышение pH более 4,5–4,7, положительный аминный тест (появление или усиление запаха "гнилой рыбы" при смешивании влагалищного содержимого с 10% гидроокисью калия – КОН), появление в мазках характерных "ключевых клеток", которые представляют собой эпителиальные клетки с адгезированными на них микроорганизмами. Считается, что для правомочности постановки диагноза достаточно 3 из перечисленных признаков [5].
Терапия БВ остается нелегкой задачей ввиду частого рецидивирования или низкой эффективности ряда предложенных препаратов. Многочисленные работы последних лет свидетельстуют о том, что основными препаратами выбора в настоящее время считаются метронидазол и клиндамицин, которые обладают антианаэробными свойствами [6].
Метранидазол, который представляет собой антибактериальный препарат, содержащий имидазольное кольцо, широко применяется в различных схемах, причем описана эффективность препарата как при разовых схемах в дозе 2 г, так и при 5–7-дневных курсах лечения. Однако пероральные формы препарата способны вызвать иногда побочные реакции, ограничивающие его использование.
Среди местных форм лечения широкое применение при БВ нашел клиндамицин – антибиотик группы линкозамидов. Известно, что он обладает выраженной антибактериальной активностью, подавляя синтез белка в микробной клетке, взаимодействуя с 50S-субъединицами рибосом. Клиндамицин оказывает бактериостатическое действие, а в более высоких концентрациях в отношении некоторых микроорганизмов – бактерицидное. Препарат активен в отношении микроорганизмов, вызывающих вагинозы: Gardnerella vaginalis, Mobiluncus spp., Bacteroides spp., Peptostreptococcus spp. He активен в отношении Trichomonas vaginalis и Candida albicans.
Клиндамицин применяют как перорально, так и местно внутривлагалищно в виде кремов и овулей, причем для лечения БВ местное лечение является предпочтительным, поскольку за счет минимальной системной абсорбции (только 4% препарата резорбируется в системный кровоток) практически не вызывает побочных реакций. Среди неблагоприятных эффектов описаны аллергические реакции, рост дрожжеподобных грибов, поэтому некоторые авторы рекомендуют дополнительно к лечению клиндамицином добавлять антимикотики.
Несколько крупных рандомизированных плацебо-контролируемых исследований позволили установить высокую эффективность как 7-, так и 3-дневного курса лечения вагинальным кремом клиндамицина [6, 7].
Для лечения бактериального вагиноза у женщин с ПВИ мы применяли 2% далацин Ц – вагинальный крем, содержащий 100 мг клиндамицина фосфата, по стандартной 3-дневной схеме. Критерии наличия БВ устанавливали с помощью стандартных тестов (как минимум 3 признака из 4 указанных выше).
Под наблюдением находилось 22 пациентки с остроконечными и плоскими кондиломами влагалищной стенки и шейки матки, из которых 15 (68,2%) являлись носителями высокоонкогенных ВПЧ типов 16, 18, включая 6 (27,3%) женщин с сочетанием различных типов. У 7 (31,8%) пациенток были выявлены низкоонкогенные типы 6 и 11. У всех 22 женщин был обнаружен БВ, по поводу которого был рекомендован далацин Ц ежедневно однократно внутривлагалищно. В течение первой недели после окончания курса лечения пациентки подвергались контрольному осмотру. Было отмечено, что полная санация на основании перечисленных признаков наблюдалась у 17 (77,3%) женщин, у 4 (18,2%) – имелся частичный эффект, у 1 (4,5%) –эффект отсутствовал. При этом было отмечено, что после применения далацина у 4 (18,2%) пациенток развился кандидоз, по поводу чего было назначено соответствующее лечение антимикотическими препаратами. Тем пациенткам, у которых лечение было неэффективным, были рекомендованы другие средства. При частичном эффекте рекомендовали повторный курс терапии далацином. Затем для восстановления нормальной микрофлоры всем женщинам был назначен эубиотик ацилакт внутривлагалищно по 1 свече в течение 10 дней после получения отрицательных результатов исследования на грибы. Лечение заболеваний гениталий, обусловленных папилломавирусом, проводилось по индивидуальным схемам после полного курса лечения БВ.
Для коагуляции остроконечных кондилом влагалища применяли преимущественно солкодерм по 1 аппликации 1 раз в неделю, для лечения патологии шейки матки – лазервапоризацию. Эффективность лечения ПВИ в данной группе женщин сравнивали с эффективностью аналогичной терапии у 14 пациенток с ПВИ и БВ без предварительной терапии БВ и коррекции микробиоценоза, которые составили контрольную группу. Было отмечено, что эпителизация шейки матки после лазервапоризации происходила более быстрыми темпами у женщин после лечения далацином, при этом через 1 мес после процедуры участки аномального эпителия на шейке матки были обнаружены у 1 (4,5%) пациентки этой группы и у 3 (21%) пациенток контрольной группы, что свидетельствует о необходимости лечения БВ перед деструкцией очагов ПВИ, так как правильная подготовка больных к этим процедурам способствует более качественной и быстрой эпителизации тканей.
Таким образом, накопленный опыт показывает, что у большинства пациенток ПВИ сочетается с другими инфекциями нижних отделов гениталий. Патология влагалища может быть обусловлена БВ, вагинальным кандидозом, неспецифическим вагинитом и другими проявлениями вагинального дисбиоза, среди которых БВ занимает ведущее место. Полученные результаты свидетельствуют о целесообразности проведения микробиологического обследования пациенток с ПВИ влагалища и шейки матки, что позволяет в случае необходимости провести соответствующее лечение перед назначением терапии ПВИ гениталий, избежать возможных инфекционных осложнений и повысить эффективность лечения ПВИ. Препарат "Далацин Ц" является эффективным для лечения БВ у женщин с ПВИ гениталий.
В дооперационном периоде обследовано 52 пациента со свищевой формой хронического посттравматического остеомиелита нижних конечностей. Были проанализированы результаты микробиологического исследования патологического материала, фагоцитарно – метаболический статус нейтрофилов периферической крови. Показано, что основным возбудителем является S. aureus, который выделяется как в монокультуре, так и в ассоциации с другими микроорганизмами, а увеличение количества штаммов в микробных ассоциациях усиливает фагоцитарно – метаболическую активность нейтрофилов, а также способствует активации процесса образования нейтрофильных внеклеточных ловушек.

1. Бухарин О.В., Валышев А.В. Микробные ингибиторы лизоцима / О.В. Бухарин, А.В. Валышев // Журнал микробиологии, эпидемиологии и иммунологии. – 2006. – № 4. – С. 8–12.
2. Винник Ю.С. Хронический остеомиелит: диагностика, лечение, профилактика / Ю.С. Винник, Н.М. Маркелова, А.А. Шагеев // Сибирское медицинское обозрение. – 2009. – № 6. – С. 12–15.
3. Гайдаш И.С. Микробиологический спектр условно-патогенных бактерий – возбудителей посттравматических остеомиелитов / И.С. Гайдаш, В.В. Флегонтова, С.В. Бирюкова и др. // Ортопедия, травматология и протезирование. – 2000. – № 2. – С. 89–92.
4. Кузнецова Е.И. Функционально – метаболический статус нейтрофильных фагоцитов у пациентов с остеомиелитом длинных трубчатых костей / Е.И. Кузнецова, М.В. Чепелева, Н.М. Клюшин, С.И. Бурнашов // Сибирский научный медицинский журнал. – 2015. – № 1. – С. 65–70.
5. Науменко З.С. Динамика изменения лизоцимной активности и содержание лактоферрина у больных хроническим остеомиелитом / З.С. Науменко, И.В. Шипицина, Л.В. Розова // Клиническая лабораторная диагностика.– 2013. – № 6. – С. 16–18.
6. Пинегин Б.В. Нетрофилы: структура и функция / Б.В. Пинегин, А.Н. Маянский // Иммунология. – 2007. – № 6. – С. 374–382.
7. Розова Л.В. Изменение видового состава микрофлоры у больных хроническим остеомиелитом в процессе лечения // Гений ортопедии.- 2008. – № 2. – С. 92–95.
8. Слободчикова С.В. Влияние антител и цитокинов на эффективность фагоцитоза Staphylococcus aureus: Автореф. дис… канд. мед, наук. – Пермь, 2014. – 122 с.
9. Liu G.Y. Staphylococcus aureus golden pigment impairs neutrophil killing and promotes virulence through its antioxidant activity / G.Y. Liu, A. Essex, J.T. Buchanan, V. Datta, H.M. Hoffman, J.F. Bastian, J. Fierer, V. Nizet // The Journal of Experimental Medicine. – 2005. Vol. 202, № 2. – P. 209–215.
10. Wagner C. Post-traumatic osteomyelitis: analysis of inflammatory cells recruited into the site of infection / C. Wagner, K. Kondella, T. Bernschneider et al. // Shock. – 2003. – Vol. 20, № 6. – P. 503–510.
Проблема лечения ортопедо-травматологической патологии, осложненной хронической гнойной инфекцией, остается актуальной до настоящего времени.
Остеомиелит диагностируется после открытых переломов в 3–24 % наблюдений и в 1–7 % после оперативного лечения закрытых переломов. При этом рецидивы остеомиелита отмечаются у 20–30 % больных, что приводит к функциональной неполноценности конечности в 10,3–57 % наблюдений [2, 10].
Возникновение, развитие и течение гнойного процесса определяется сочетанием многих факторов, среди которых ведущим является взаимодействие защитных сил организма и проникших микробов. В настоящее время основными возбудителями хронического посттравматического остеомиелита являются монокультуры и ассоциации Staphylococcus aureus с грамотрицательными микроорганизмами [3].
Выявлена связь воспалительного процесса при остеомиелите с динамикой показателей естественной резистентности в тканях [5].
Влияние хронической инфекции на фагоцитарную активность нейтрофилов и лизоцимную активности сыворотки крови при лечении методом чрескостного остеосинтеза остается малоизученным.
Целью настоящей работы явилась оценка неспецифического звена иммунитета у больных с хроническим остеомиелитом нижних конечностей в зависимости от выявленной микрофлоры.
Материалы и методы исследования
Применялась стандартная методика изучения фагоцитарной активности нейтрофилов (ФАН), основанная на количественном определении поглотительной и переваривающей способности нейтрофилов по отношению к микробной тест – культуре (Staphylococcus epidermidis штамм № 9198 НИИЭМ). Рассчитывались следующие показатели ФАН: фагоцитарный показатель (ФП, %), фагоцитарное число (ФЧ, %); количество активных фагоцитов (КАФ,(109/л)); абсолютный фагоцитарный показатель (АФП, (109/л)). Кислородзависимую метаболическую активность нейтрофильных гранулоцитов оценивали в реакции восстановления нитросинего тетразолия (НСТ – тест) по методу Park, в двух вариантах: спонтанном и стимулированном. Лизосомальную активность нейтрофилов определяли, используя цитохимическое исследование клеток. Активность миелопероксидазы (МП) определялась по Грехему – Кнолю. Уровень лизосомальных катионных белков (КБ) цитоплазмы устанавливали в реакции с бромфеноловым синим. Уровень МП и КБ выражали в виде среднего цитохимического коэффициента (СЦК). Для подсчета нейтрофильных ловушек использовали мазки крови, окрашенные по Романовскому – Гимза. Учет ФАН производился при помощи световой микроскопии под иммерсией, исходя из 100 подсчитанных нейтрофилов.
Оценку лизоцимной активности сыворотки крови (ЛАСК) проводили по методике Стогний В. И. и соавт. Забор крови осуществлялся из локтевой вены натощак.
Полученные данные обрабатывались с помощью методов непараметрической статистики с использованием U-критерия Вилкоксона и были представлены в виде М ± m. Различия считались достоверными при p
Читайте также:

