Нужны ли асептические условия во время посева
Обновлено: 17.09.2024
Забор проб на стерильность проводит операционная сестра под руководством сотрудника бактериологической лаборатории, в стерильные ёмкости с соблюдением строжайших правил асептики непосредственно перед проведением операции.
Для контроля стерильности используют следующие питательные среды:
Сахарный бульон Хоттингера (0,5 и 1% глюкозы)
Одновременный посев изделий на 3 вышеуказанные среды обязателен. При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке должно быть достаточным для полного погружения изделия или его части.
Посевы в бульон Хоттингера и тиогликолевую среду выдерживают в термостате при температуре 37˚С, среду Сабуро – при температуре20-22˚С. Посевы инкубируют в термостате в течении 14 суток.
Мероприятия, обеспечивающие асептические условия при посевах
Требования к помещению для посева на стерильность.
Посев исследуемого материала желательно проводить в настольных боксах с ламинарным потоком воздуха. Эти боксы размещают в отдельных помещениях бактериологической лаборатории.
При отсутствии боксов с ламинарным потоком воздуха, контроль стерильности проводят в боксированных помещениях. Общая площадь бокса должна быть не менее 3 м 2 .
В боксированном помещении стены должны быть окрашены масляной краской и выложены кафельной плиткой, не должны иметь выступов, карнизов, трещин; пол в боксе и рабочий стол должны быть покрыты линолеумом, стенки и ножки стола покрашены масляной краской.
Боксы оборудуют приточно-вытяжной вентиляцией, в них подаётся стерильный воздух, проходящий через бактериальные фильтры с материалом Петрянова.
В боксе и предбокснике устанавливают настольные (БОН) и потолочные (ОБП) ультрафиолетовые облучатели из расчёта вт. удельной мощности ламп, создающих прямое излучение на 1 м 2 помещения. Облучатели размещают на высоте 2-2,5 м от пола.
Для тушения пожара в боксированном помещении должны быть в наличии противопожарные средства, углекислотные огнетушители типа ОУ-2 из расчёта один огнетушитель на предбоксник и бокс.
Подготовка бокса, инструментов и персонала к работе.
Ежедневно до проведения работы помещения бокса и предбоксника подвергают тщательной обработке. Стены, пол, поверхности инвентаря протирают раствором, содержащим 3% перекиси водорода и 0,5% моющего средства. В случае обнаружения в воздухе грибов или споровых форм микроорганизмов, влажную уборку проводят 6% раствором перекиси водорода с 0,5% моющего средства.
Внутреннюю поверхность настольного бокса обрабатывают также, как и помещение бокса. Через 45-60 минут после обработки в бокс вносят все необходимые для работы инструменты и материалы кроме образцов продукции.
Перед внесением материалов в настольном боксе включают вентиляцию на время, достаточное для обеспечения полного обмена воздуха в нём.
За 1,5-2 часа до начала работы в боксе включают бактерицидные лампы.
Инструменты, посуду и спецодежду, используемые в работе, предварительно стерилизуют, а тканевые изделия обрабатывают при следующем режиме: температура 132˚С±2˚С. время стерилизационной выдержки – 20мин., изделия из резины (перчатки и т.д.) – при температуре 120˚С±2˚С в течении 45 минут.
В процессе работы вспомогательный инструмент –2-3 раза заменяют новым стерильным комплектом.
Перед входом в бокс работники лаборатории тщательно моют руки тёплой водой с мылом и щёткой, вытирают стерильным полотенцем, одевают в предбокснике на ноги бахилы, стерильные халаты, 4-х слойные маски, шапочки, стерильные перчатки.
В процессе посева в боксе регулярно проверяют обсеменённость воздуха. Для этого на рабочий стол ставят 2 чашки с МПА, открывая их на 15 минут, затем чашки помещают в термостат при температуре 37˚С на 48 часов. Допускается рост на более трёх колоний неспорообразующих сапрофитов.
В случае роста на чашках более трёх колоний проведение дальнейших работ в данном боксе запрещается. В боксе дополнительно проводят тщательную уборку 6% раствором перекиси водорода с 0,5% моющего средства.
Контроль стерильности изделий проводят путём погружения в питательные среды. В исключительных случаях, когда необходимо проверить стерильность инструмента больших размеров, пробы забирают методом смыва, стерильной марлевой салфеткой размером 5х5 см2, предварительно увлажнённой стерильным физиологическим раствором или стерильной водой.
Перед посевом исследуемый материал вносят в предбоксник, предварительно снимая наружную мягкую упаковку. В пребокснике пакеты, биксы протирают снаружи с помощью стерильного пинцета стерильной салфеткой, обильно смоченной 65 раствором перекиси водорода, перекладывают на стерильный лоток и оставляют на 30 минут. При поступлении изделий в мягкой упаковке, первый слой снимают в предбокснике и изделия во внутренней упаковке сразу переносят в бокс.
Посевы на стерильность проводят бактериолог с помощью лаборанта.
Посевы на стерильность хирургического инструмента.
Хирургический инструментарий с помощью стерильного пинцета извлекают из бикса или мягкой упаковки и целиком погружают в пробирки с питательными средами. Как исключение, в отдельных случаях, если все простерилизованные инструменты в одной упаковке крупных размеров (иглодержатели, ранорасширители и т.д.), производят смыв с поверхности инструмента стерильной салфеткой, смоченной в стерильном физиологическом растворе или стерильной водопроводной воде, и погружают салфетку в пробирку с тиогликолевой средой. Аналогичные смывы с других инструментов засевают в пробирки со средой Хоттингера и Сабуро.
Методика посева на стерильность игл и шприцев.
Для контроля на стерильность отбирают шприцы малой ёмкости (1,0 или 2,0 мл) в условиях бактериологического бокса, с соблюдением правил асептики погружают в пробирки с питательными средами отдельно цилиндр, поршень и иглы.
При необходимости контроля шприцев большой ёмкости (10, 20 мл и более) исследование стерильности проводят методом смыва, при этом стерильной салфеткой смоченной в стерильном физиологическом растворе или водопроводной воде, протирают с помощью пинцета внутренние поверхности шприца и погружают салфетку в питательную среду.
Исследование на стерильность систем переливания крови многоразового использования.
От резинового шланга, ближе к игле, отрезают ножницами с помощью пинцета небольшие кусочки (1-2 см) и погружают в пробирки с питательными средами, иглу отдельно погружают в питательные среды.
Посев на стерильность катетеров, резиновых перчаток и др. изделий из резины и пластикатов.
Контроль стерильности зондов, катетеров, резиновых перчаток и других изделий из резины производят путём полного погружения мелких изделий в питательные среды, от более крупных с помощью стерильного пинцета и стерильных ножниц отрезают небольшие кусочки (1-2 см) и погружают в пробирки с питательными средами.
Посев на стерильность хирургического шовного материала.
Перед посевом ёмкость с отобранными образцами шовного материала в предбокснике протирают стерильной марлевой салфеткой обильно смоченной 6% раствором перекиси водорода и оставляют на 30 минут. Затем вносят в бокс.
Кетгут. Подготовленный к работе кетгут в операционном блоке хранят в спиртовом растворе йода. Кетгут перед посевом подвергают специальной обработке для нейтрализации и отмывания нейтрализующего раствора. Моток кетгута, подготовленный для исследования, перекладывают стерильный пинцетом в стерильный 10% раствор гипосульфита натрия. Раствор гипосульфита натрия готовят на дистиллированной воде, разливают в пробирки (колбы) по 20-30 мл, стерилизуют текучим паром по 30 минут в продолжении 3 дней. Кетгут выдерживают в растворе гипосульфита в течении 24 часов при комнатной температуре (возможно помутнение раствора за счёт выпадения серы), затем перекладывают в пробирки с 20-30 мл стерильной дистиллированной воды, где также выдерживают в течении 24 часов при комнатной температуре. Непосредственно перед посевом моток кетгута извлекают стерильным пинцетом и перекладывают в стерильную чашку Петри, с помощью пинцета и ножниц разрезают его на мелкие кусочки длиной 1-2 см и раздёргивают для прорастания микроорганизмов кетгута.
Посев производят в 2 пробирки с тиогликолевой средой, 2 пробирки со средой Сабуро и 2 пробирки со средой Хоттингера, помещая в каждую пробирку по 4-5 кусочков исследуемого материала.
Шёлк. Подготовленный к работе шёлк в операционном блоке хранят в спиртовом растворе, поэтому перед посевом шёлк (лавсан) помешают в стерильную дистиллированную воду при комнатной температуре. Перед посевом моток шёлка (лавсана) перекладывают в стерильную чашку Петри, разрезают на мелкие кусочки длиной 1-2 см. Посев шёлка производят как и посев кетгута.
Исследование на стерильность аппаратов экстракорпорального кровообращения.
Исследование на стерильность аппаратов искусственного кровообращения проводит бактериолог и лаборант ЛПУ в операционной после асептической сборки аппарата.
смыв из аппарата
перфузат до перфузии
кровь после перфузии.
Стерильный физиологический раствор в количестве не менее 250 мл прогоняют через аппарат, подготовленный для операции, отбирают 100 мл раствора и засевают на питательные среды. Аналогично производят посев перфузата до перфузии и крови после перфузии.
Посев на стерильность перевязочного материала.
Бинты, ватные шарики, марлевые салфетки, турунды и т.п. отбирают из разных мест бикса стерильным пинцетом. Мелкие изделия целиком погружают в пробирки с питательными средами. От бинтов и крупных марлевых салфеток с помощью стерильных ножниц отрезают кусочки и погружают в пробирки с питательными средами. На каждый вид перевязочного материала используют 2 пробирки каждой среды.
Посев на стерильность хирургического белья.
Простерилизованными и фламбированными ножницами (смоченными в спирте и проведёнными через пламя горелки) с помощью пинцета отрезают от хирургического белья небольшие кусочки ткани (завязки, швы) и погружают в пробирки с питательными средами, по возможности не касаясь стенок пробирки.
Учёт результатов.
Материал стерилен при отсутствии роста во все посевах.
Материал не стерилен при росте микрофлоры.
Бактериологический контроль эффективности обработки кожи операционного поля и рук хирургов.
Смывы с кожи операционного поля и рук хирургов производят стерильной марлевой салфеткой размером 5х5 см, смоченной в растворе нейтрализатора, если таковой имеется или стерильном физиологическом растворе. Марлевой салфеткой тщательно протирают ладони, околоногтевые и межпальцевые пространства обеих рук. После забора проб марлевую салфетку помещают в широкогорлые пробирки или колбы с раствором нейтрализатора и стеклянными бусами, встряхивают в течение 10 минут, производят отмыв марлевой салфетки. отмывную жидкость засевают глубинным способом по 0,5 мл на 2 чашки Петри с МПА, а марлевую салфетку – в 0,5% сахарный бульон. Посевы инкубируют при температуре 37°С в течении 48 часов.
Учёт результатов.
Кожа и руки стерильны при отсутствии роста микроорганизмов как на твёрдой, так и на жидкой питательной среде.
Посев исследуемого материала желательно проводить в настольных боксах с ламинарным потоком воздуха. Эти боксы размещают в отдельных помещениях бактериологической лаборатории.
При отсутствии боксов с ламинарным потоком воздуха, контроль стерильности проводят в боксированных помещениях. Общая площадь бокса должна быть не менее 3 м 2 .
В боксированном помещении стены должны быть окрашены масляной краской и выложены кафельной плиткой, не должны иметь выступов, карнизов, трещин; пол в боксе и рабочий стол должны быть покрыты линолеумом, стенки и ножки стола покрашены масляной краской.
Боксы оборудуют приточно-вытяжной вентиляцией, в них подаётся стерильный воздух, проходящий через бактериальные фильтры с материалом Петрянова.
В боксе и предбокснике устанавливают настольные (БОН) и потолочные (ОБП) ультрафиолетовые облучатели из расчёта вт. удельной мощности ламп, создающих прямое излучение на 1 м 2 помещения. Облучатели размещают на высоте 2-2,5 м от пола.
Для тушения пожара в боксированном помещении должны быть в наличии противопожарные средства, углекислотные огнетушители типа ОУ-2 из расчёта один огнетушитель на предбоксник и бокс.
Подготовка бокса, инструментов и персонала к работе.
Ежедневно до проведения работы помещения бокса и предбоксника подвергают тщательной обработке. Стены, пол, поверхности инвентаря протирают раствором, содержащим 3% перекиси водорода и 0,5% моющего средства. В случае обнаружения в воздухе грибов или споровых форм микроорганизмов, влажную уборку проводят 6% раствором перекиси водорода с 0,5% моющего средства.
Внутреннюю поверхность настольного бокса обрабатывают также, как и помещение бокса. Через 45-60 минут после обработки в бокс вносят все необходимые для работы инструменты и материалы кроме образцов продукции.
Перед внесением материалов в настольном боксе включают вентиляцию на время, достаточное для обеспечения полного обмена воздуха в нём.
За 1,5-2 часа до начала работы в боксе включают бактерицидные лампы.
Инструменту, посуду и спецодежду, используемые в работе, предварительно стерилизуют, а тканевые изделия обрабатывают при следующем режиме: температура 132˚С±2˚С. время стерилизационной выдержки – 20мин., изделия из резины (перчатки и т.д.) – при температуре 120˚С±2˚С в течении 45 минут.
В процессе работы вспомогательный инструмент –2-3 раза заменяют новым стерильным комплектом.
Перед входом в бокс работники лаборатории тщательно моют руки тёплой водой с мылом и щёткой, вытирают стерильным полотенцем, одевают в предбокснике на ноги бахилы, стерильные халаты, 4-х слойные маски, шапочки, стерильные перчатки.
В процессе посева в боксе регулярно проверяют обсеменённость воздуха. Для этого на рабочий стол ставят 2 чашки с МПА, открывая их на 15 минут, затем чашки помещают в термостат при температуре 37˚С на 48 часов. Допускается рост на более трёх колоний неспорообразующих сапрофитов.
В случае роста на чашках более трёх колоний проведение дальнейших работ в данном боксе запрещается. В боксе дополнительно проводят тщательную уборку 6% раствором перекиси водорода с 0,5% моющего средства.
Контроль стерильности изделий проводят путём погружения в питательные среды. В исключительных случаях, когда необходимо проверить стерильность инструмента больших размеров, пробы забирают методом смыва, стерильной марлевой салфеткой размером 5х5 см2, предварительно увлажнённой стерильным физиологическим раствором или стерильной водой.
Перед посевом исследуемый материал вносят в предбоксник, предварительно снимая наружную мягкую упаковку. В пребокснике пакеты, биксы протирают снаружи с помощью стерильного пинцета стерильной салфеткой, обильно смоченной 65 раствором перекиси водорода, перекладывают на стерильный лоток и оставляют на 30 минут. При поступлении изделий в мягкой упаковке, первый слой снимают в предбокснике и изделия во внутренней упаковке сразу переносят в бокс.
Заливка чашек
Заливка чашек один из самых основных микробиологических методов. Чашкой называют чашку Петри, содержащую питательный агар. Чашки Петри — специально изготовленные неглубокие круглые контейнеры, которые могут быть стеклянными или пластиковыми. Они используются для роста бактерий, грибов или культуры тканей на твердой питательной среде. Обычно чашки Петри имеют около 9 см в диаметре. Стеклянные чашки можно использовать повторно после автокла-вирования. Пластиковые чашки выбрасывают после использования; обычно их автоклавируют, чтобы уничтожить культуру. При этом они плавятся. Чашки покупают в запечатанных упаковках, которые стерилизованы гамма-облучением. Крышки препятствуют загрязнению чашки, однако молекулы газов могут диффундировать между внутренним объемом чашки и окружающей средой через микроскопические неровности в местах соприкосновения донышка с крышкой. Поэтому кислород имеет доступ к культуре, а двуокись углерода выводится наружу.

Методы инокуляции
Во избежание загрязнения при введении небольшого количества микроорганизмов в питательную среду — инокуляции (или посева) — необходимо использовать асептические методы.
Процедуры посева различаются в зависимости от типа среды (жидкой или твердой).
Посев на твердую среду
Посев штрихом, или посев разведением
Метод представлен на рисунке. Он применяется для выделения чистых колоний бактерий из смеси бактерий. Для посева используют проволочную петлю, которую сначала нужно прокалить, как показано на рис. 12.4,Л, чтобы про-стерилизовать. Затем с помощью петли берут тонкую пленку жидкой суспензии или небольшое количество твердого материала, содержащего исследуемые микроогранизмы, из предварительно выращенной культуры или другого источника микроорганизмов. Петлей мягко проводят по поверхности среды, делая серии штрихов. После каждой серии штрихов чашку немного поворачивают, так чтобы в каждой новой серии распределялись бактерии из предыдущей серии штрихов, истощая таким образом штрихи до отдельных бактерий. (Не надейтесь что-нибудь увидеть на финальных штрихах до окончания времени инкубации!) Когда метод отработан, штрихи можно делать очень быстро.
С помощью этого метода можно выделять бактерии из естественных мест обитания, например из почвы, молока, воды. Образцы твердых субстанций, таких как почва, лучше суспендировать в небольшом количестве воды, либо предварительно проинкубировать в жидкой среде. Безопасным источником для рутинной работы является пастеризованное молоко. Перед тем как проводить эксперименты с бактериями или грибами, следует ознакомиться с инструкциями и правилами безопасности, чтобы снизить до минимума риск культивирования вредных организмов.
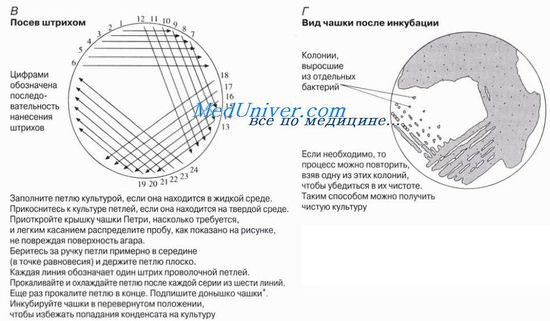
Посев на поверхность агара
Посев заливкой
Посев заливкой метод, альтернативный методу посева на поверхность агара, используется для инокуляции клеток из жидкой культуры, а также для подсчета жизнеспособных клеток. Поскольку клетки распределены по всей среде, а не только по поверхности агара, можно подсчитать гораздо большее их количество — до 1000 колоний на чашку. Однако размеры выросших колоний значительно меньше.
Определенный объем (до 0,5 см 3 ) клеточной суспензии вносят в подходящий объем (около 15—20 см 3 ) простерилизованного расплавленного в небольшом флаконе питательного агара, который предварительно был охлажден до 45—50 °С в водяной бане. Снимают крышку и перед добавлением клеточной суспензии прожигают горлышко флакона, как показано на рисунке. Суспензию клеток тщательно перемешивают с питательным агаром, поворачивая (не встряхивая) назад и вперед зажатый в ладонях флакон. Затем выливают смесь в стерильную чашку Петри, как показано на рисунке. Подписывают донышко чашки и инкубируют ее. После инкубации чашка выглядит, как показано на рисунке.
Посев уколом
Метод используют для культивирования анаэробных организмов или организмов, растущих при низкой концентрации кислорода (микроаэрофилов). Обычно используют пробирку с питательной агаризованной средой. Благодаря небольшой поверхности и достаточно большой глубине агара в пробирке по сравнению с чашкой доступ кислорода внутрь агара ограничивается. Посев производят прямой проволочкой (без петли), или бактериологической иглой. Небольшое количество культуры (твердой или жидкой) берут кончиком иглы и затем вертикально прокалывают ею агар. Культура растет в агаре во все стороны от линии прокола.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Для чего нужно проверять кровь на стерильность? Ответ на этот простой, казалось бы, вопроси обусловливает важность темы данного занятия не только для специалистов бактериологической службы больницы, но и для всего ее среднего медперсонала. А в преддверии сезонных респираторных заболеваний она особенно актуальна.
Дело в том, что в современной диагностической практике анализ крови на стерильность проводят для того, чтобы узнать о наличии бактериемии. Сдавать кровь на стерильность врачи рекомендуют непосредственно перед процессом терапии, остерегаясь получить неправильный результат.Показанием к проведению такого анализа может служить определение в крови патогенных микроорганизмов.
Примерами последних могут быть стрептококки, синегнойные палочки, золотистые стафилококки, дрожжевые грибы и энтеробактерии. Например, для обнаружения заражения эпидермальным стафилококком необходимо провести многократное тестирование.
Такие виды исследований очень важны для больных людей с низким иммунитетом. К примеру, зараженные ВИЧ-инфекцией пациенты могут быть обладателями микобактерий туберкулеза.
В большинстве случаях анализ делают в тех случаях, когда у пациента уже длительное время держится и не спадает высокая температура, причем происходит это без особых на то причин. Помимо всего, анализ назначают при подозрении на сепсис или менингит.
Проведение этого анализа помогает определить бактерии, содержащиеся в составе крови. Это могут быть как опасные, так и условно-патогенные бактерии, которые также могут оказаться причиной болезни. Помимо того, что проведением анализа можно установить наличие определенной бактерии, можно определить и стадию, на которой находится заболевание.
Если посев крови проводится с целью определения чувствительности организма к разнообразию антибиотиков, то анализ поможет установить тип возбудителя и назначить подходящие антибиотики для проведения лечения. В данном случае анализ поможет определить неэффективное использование предыдущих антибиотических препаратов; наличие менингита или сепсиса, а также гнойничковое поражение кожи.
Перед проведением анализа необходимо придерживаться самых стандартных правил – пару дней не пить алкоголь, не употреблять жирную пищу, постараться отказаться от курения, хотя бы за пару часов до проведения анализа. Прием лекарственных препаратов назначается после проведения анализа.
Во время проведения анализа отдельное внимание стоит обратить на тот факт, что в 3% случаях эпидермальный стафилококк (загрязненная микрофлора кожи) может выступить в качестве гемокультуры. Именно поэтому его клиническое значение определяется только после многократных исследований.
Во время исследования необходимо произвести забор крови из вены у локтевого сгиба. У детей младшего возраста забор крови производится из пальца, пятки, мочки уха в меньшем количестве. Кровь для проведения анализа берут только после тщательной обработки кожи, соблюдая все правила асептики, используя одноразовый стерильный шприц.
Посев на питательные среды стерильного материала (кровь или другие, содержащие микробов жидкости у здоровых лиц) также лучше делать у постели больного, либо помещать в стерильную посуду, содержащую вещества, препятствующие свертыванию крови 0,3% раствора цитрата натрия, 0,1% раствор оксалата натрия). Обычно берут 5-10мл крови и засевают во флакон, содержащий 50-100 мл среды. Для этого используют для флакона с питательной средой (один для аэробов, другой для анаэробов). Посев крови производится на жидкие питательные среды – 10% желчный бульон, 1% сахарный бульон, двухфазную среду, а также жидкие и полужидкие среды для культивирования анаэробов в разведении 1:10. Флаконы с питательной средой получают в лаборатории, переливание крови из шприца во флакон необходимо производить над пламенем спиртовки, предварительно сняв иглу. Флакон с посевом направляется в лабораторию, а в вечернее и ночное время помещают в термостат.
Важным моментом является тот факт, что чем раньше произвести посев от начала болезни, тем больше возможность получить положительный результат, и наоборот, чем позднее, тем меньше шансов. При нормальной температуре получения положительного результата бывает очень редко.
Техника посева позволяет увидеть, как растут колонии, а также провести с образцовыми цепочками микроорганизмов тесты, позволяющие окончательно определить их тип.
Кровь для бактериологического посева необходимо сдавать до начала лечения антибиотиками, поскольку употребление антибиотиков может отсрочить или предотвратить рост бактерий, что приведет к ложноотрицательному результату. У пациентов с периодическим повышением температуры тела кровь нужно брать в период, когда температура растет или сразу же после прохождения пика температуры. Именно в это время в крови находится максимальное количество бактерий. Во многих лабораториях специалисты рекомендуют сдать второй образец крови не позднее, чем через один час после первого, для того, чтобы увеличить шансы обнаружения бактерий.
При бактериологическом посеве нужно придерживаться асептической техники, чтобы исключить возможность бактериального загрязнения крови. Если образец взят согласно правилам, в бутылку с питательной средой попадут только те микроорганизмы, которые находится в крови больного.
Правила взятия крови для бактериологического посева:
Кровь следует брать из периферической вены, без использования катетера, чтобы исключить загрязнение.
Процедура выполняется в стерильных перчатках. Место венепункции смазывается антисептиком.
Также антисептиком дезинфицируется и крышка бутылки с питательной средой.
Кровь берется стерильным шприцем.
В бутылку кровь вносится через резиновую пробку. Снимать пробку с бутылки нельзя.
Культура крови снабжается этикеткой с данными о пациенте.
Результаты бактериологического посева крови делятся на следующие три группы:
– роста бактерий нет;
– чистый рост бактерий;
– смешанный рост бактерий.
Отсутствие роста бактерий: нормальный результат, означающий, что кровь пациента стерильна.
Чистый рост бактерий: результат, означающий, что имеется рост одного вида бактерий, который был выделен из культуры. Получения такого результата следует ожидать, когда у пациента сепсис.
Смешанный рост: результат указывает на то, что из культуры было выделено более одного вида бактерий. Такое инфицирование крови случается редко. Чаще всего, смешанный рост бактерий является подтверждением того, что питательная среда была загрязнена.
Слушателям школы практического мастерства был продемонстрирован и дипстрик – полуавтоматическое устройство, правильно пользоваться которым может даже неквалифицированный медицинский персонал или пациенты в амбулаториях, стационарах и даже домашних условиях. Применение Дипстрика позволяет повысить безопасность бактериологического анализа мочи, так как в лабораторию вместо них поступают посевы в закрытых контейнерах.
Стратификация, обеззараживание и замачивание — рассказываем, как эффективно подготовить семена перед посадкой в грунт.


В магазине для дачи и садоводства можно найти самые разнообразные семена. Многие производители не только предлагают качественные и правильно отобранные, но и проводят специальную обработку. Об этом они пишут на упаковке. Если нашлись такие, то дополнительные процедуры перед посадкой не нужны. Однако если вы покупаете материал у знакомых или собираете его сами, то обязательно нужна подготовка. Какие способы использовать — зависит от определенной культуры и ваших предпочтений. Рассказываем о самых популярных методах предпосевной обработки семян, которые используют в домашних условиях.
Все о предпосевной обработке семян
Особенности обработки семян перед посевом
В основном обработка семян нужна, чтобы улучшить рост растений, уберечь их от болезней и сделать более устойчивыми к холодным температурам и их перепадам. Эти процедуры позволят сохранить большую часть урожая, ведь обычно около половины гибнет из-за различных болезней.
Однако к обработке необходимо подходить с умом. Не стоит использовать все виды, перечисленные в статье, иначе даже самые здоровые семечки погибнут. Определитесь, что может повлиять на выращивание и препятствовать росту. Например, слишком твердая оболочка и низкая водопроницаемость или недоразвитость зародыша. Исходя их этого подбирайте нужные процедуры.


Виды обработки
1. Калибровка
Эта процедура необходима, чтобы отделить хороший посевной материал от плохого. Для этого понадобится обычная вода или раствор поваренной соли в концентрации 3-5%. Семечки опускают в емкость, заливают жидкостью и дают постоять около 5 минут. По истечении этого времени жидкость со всплывшими семенами сливают, а оставшиеся внизу оставляют — они годятся для проращивания. Их промывают в чистой воде, затем кладут сушиться в темное место. При этом не стоит размещать их около отопительных приборов, например, батареи.
Для мелких семечек используют другой метод калибровки. Для этого берут палочку из пластмассы и наэлектризовывают: достаточно хорошенько потереть ее о шерстяное изделие. Затем рассыпают посевной материал на чистый лист бумаги, проводят над ним палочкой. Расстояние между ними должно быть не меньше 2 см. К пластмассе прилипнут плохие семена, которые не годятся для проращивания.

2. Обеззараживание (протравливание)
Обеззараживание семян перед посевом — обязательная процедура, которую не стоит игнорировать. Больные семена от здоровых отличить довольно сложно, а ведь из-за них может погибнуть весь урожай. Чтобы обезопасить ростки от бактериальных и грибковых инфекций, нужно их протравить. В таком случае получится избавиться от возбудителей, которые могут находиться как на внешней части оболочки, так и на внутренней. Также процедура предохранит всходы от болезней, поджидающих их в земле.
Именно поэтому очень важно обеззаразить семена, которые куплены с рук на рынке и находились на уличном лотке. Проводить процедуру не стоит, если на упаковке указано, что материал уже был протравлен.
Для обработки можно использовать три простых метода. В первом случае вам понадобится раствор марганцовки. Необходимо взять 1 грамм перманганата калия и добавить его в 100 мл чистой воды комнатной температуры. Затем поместить в получившуюся жидкость семечки и оставить на 20 минут. При работе с марганцовкой стоит быть осторожными, так как это едкое вещество. Обязательно наденьте перчатки и старайтесь не просыпать препарат на рядом лежащие вещи, иначе он их окрасит.
Для второго метода понадобится 3% перекись водорода. Ее нужно нагреть до 40 градусов, затем поместить в раствор семена и подержать их там около 8 минут.
В третьем случае вам не нужны дополнительные ингредиенты, используется только вода. Подготовьте две емкости с горячей (около 50 градусов) и холодной жидкостью. Чередуйте обработку водой с разной температурой в течение 15 минут.
Читайте также:




