Оборудование для посева микроорганизмов
Обновлено: 05.10.2024
Для культивирования микроорганизмов (микробы, риккетсии, вирусы, грибы) необходимы и широко используются термостаты специального назначения, имеющие различные габариты и пределы регулирования температуры. Термостатирующие устройства могут быть как сухожаровыми, так и с водяным обогревом. В некоторых моделях термостатов предусмотрено устройство для подачи и равномерной циркуляции CО2 и воздуха, что позволяет использовать термостат как для аэробных, так и для анаэробных микробов [28].
Развитие исследований по микробиологическому синтезу ставит перед специалистами многочисленные задачи, одна из которых — разработка аппаратуры и систем непрерывного культивирования микроорганизмов.
Представляет несомненный интерес отечественный аппарат АК-10 для глубинного ферментирования микроорганизмов [4].
В ферментере рабочей емкостью 5 л осуществляется автоматическая стабилизация температуры питательной среды, ее аэрирование и перемешивание. Воздух, предварительно очищенный от механических примесей, подается к аппарату под давлением 1,4 кг/см 2 через регулирующий клапан, индикатор расхода и биофильтр. Ввод воздуха производится через форсунку с обратным клапаном, предотвращающим попадание клеточной суспензии в воздушный клапан при прекращении аэрации. Система ротаметров позволяет регулировать поток воздуха. На выходе отработанного воздуха имеется конденсационный сосуд с фильтром для предотвращения попадания клеток в рабочее помещение.
Перемешивание осуществляется турбинной мешалкой, насаженной на вал привода. На верхней части вала мешалки укреплен диск механического пеногашения, препятствующий подъему пены к выходным штуцерам.
Рис. 47. Сосуд для хранения и транспортировки питательных сред МЛ-100.
Система терморегуляции обеспечивает плавное регулирование и поддержание температуры в диапазоне от 20 до 60° С, с точностью ±5° С. Число оборотов мешалки — от 50 до 1500± ±10% об/мин. Масса прибора — 65 кг.
В качестве примера такого устройства может быть приведена контрольная панель ЛП-300 с ферментером (рис. 48) шведской фирмы [27].

Рис. 48. Контрольная панель ЛП-300 с ферментером.
Панель обеспечивает контроль и поддержание в заданных пределах скорости перемешивания питательной среды, температуры и подачи газа, дозирования компонентов питательной среды. Противопенные препараты вводятся с помощью перистальтического насоса, который автоматически включается, если пенный пробоотборник определяет наличие пены.
Рис. 49. Ферментер ФЛ-110.
Ферментеры изготовлены из пирексового стекла. Дно и крышка ферментера выполнены из нержавеющей стали. Лабораторные ферментеры установлены на металлических ножках, что облегчает снятие дна и крышки ферментера и дает возможность присоединять к штуцерам, вмонтированным в дно прибора, датчиков различных приборов (рН-метра, измерителя оптической плотности, газоанализатора и др.), а также для введения добавок, титрующих агентов, пеногасителей.
Рис. 50. Ферментер ФМ-100.
Основные достоинства этого типа ферментера: перемешивающее устройство, вмонтированное в дно сосуда, облегчает манипуляции, перемешиватель легко вынимается и может быть установлен на любой необходимой высоте над дном сосуда. Мощный электромотор перемешивающего устройства имеет электронный контроль скорости вращения. Заглушки и воздуховоды легко удаляются, если необходима вихревая аэрация. Введение различных препаратов обеспечивается наличием пяти вводных отверстий на крышке. Взятие проб и введение дополнительных компонентов под поверхность жидкости обеспечиваются через входные отверстия с мембранами. Контроль температуры осуществляется электронным устройством. Имеется устройство для противопенного контроля и измерения рН.
Оба автоклавируемых типа ферментера имеют цилиндрическую конструкцию из термостойкого стекла с двойной рубашкой, позволяющей проводить культивирование при необходимой температуре. Вдавленная крышка со стандартным шлифом снабжена пятью коническими шлифами, которые можно использовать для различных целей. Оба ферментера имеют водосливы, а на нижнем конце имеется устройство для отбора проб.
Внутри этого аппарата размещены вращающиеся титановые диски, увеличивающие площадь при данном объеме питательной среды, позволяя получать большие количества первичных клеток как для исследовательских, так и для промышленных целей, включая производство вакцин и сывороток. Выпускается в двух модификациях: на 4 л из стекла (рис. 51) и на 14 л из нержавеющей стали.

Рис. 51. Многодисковое устройство для получения тканевых культур.
Роллерные установки предназначены для культивирования тканевых культур при вирусологических исследованиях на внутренних стенках цилиндрических сосудов при вращении их на подвижных валиках (роликах) с различными скоростями. В этих условиях происходит орошение культуры, прикрепленной на внутренней стенке сосуда, а вместе с тем и более оптимальная аэрация, что способствует более эффективному размножению вируса.
Выпускаются роллеры различных моделей: от настольной, рассчитанной на 5—15 флаконов, до напольной с 7 полками, на каждой из которых можно разместить по 4 сосуда. Все модели оборудованы тахометрами, с погрешностью в пределах 1%, для контроля скорости вращения сосудов. Интервалы скоростей вращения могут изменяться от 0,1 до 4 об/мин. Аппараты оборудованы звуковой сигнализацией, включающейся при падении напряжения в сети или при отключении аппарата. На рис. 52, а, б, в представлены различные варианты роллерных устройств.
Рис. 52. Роллерные аппараты.
а, б — настольные варианты; в — напольный вариант
Замороженный биологический материал при помощи гидравлического пресса продавливается через узкое отверстие в специальную камеру. Манипуляция с продавливанием может быть повторена несколько раз, в результате чего образуется достаточно дезинтегрированная клеточная масса, которая для количественного учета может подвергаться нефелометрированию на колориметре - нефелометре. Дезинтеграции могут подвергаться как любые бактериальные, так и тканевые клетки.
Для аналогичных целей фирмой MSE (Англия) выпущена модель ультразвукового дезинтегратора клеток (рис. 53).
Рис. 53. Ультразвуковой дезинтегратор клеток.
Принцип работы дезинтегратора основан на кавитационном действии ультразвуковой волны, распространяемой в жидкости, содержащей клеточную массу, в результате чего происходит разрушение микроорганизмов, клеток тканей и других биологических материалов. Прибор снабжен саморегулируемой настройкой, что позволяет поддерживать выработанную оператором частоту, амплитуду колебаний и мощность. Прибор может быть также использован в качестве ультразвуковой моечной машины для мытья мелкой капиллярной посуды.

Рис. 54. Прибор для анализа и подсчета микробных колоний.
Аппараты для автоматизированного посева при микробиологическом исследовании - easySPIRAL® и easySPIRAL® PRO
Спиральный метод позволяет реализовать подсчет бактерий, пропуская все или некоторые этапы разбавления. Полученная суспензия распределяется по убывающей логарифмической спирали Архимеда на чашке Петри. Объем и количество суспензии запрограммированы заранее и известны в каждой точке чашки. Данный метод позволяет избежать поэтапные разбавления, засевы и
инкубацию 3-4 чашек Петри, концентрируя весь спектр результата на одной.
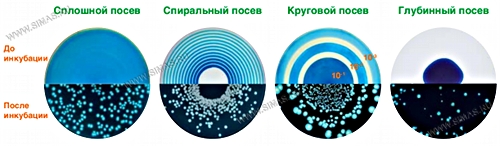
Когда по меньшей мере 3 разведения необходимы в ручном методе, все разведения с easySpiral® производятся за 25 сек в одной чашке Петри!
Преимущества:
- Экономия времени и расходных материалов: чашек Петри, агара, пипеток и т.д.
- Отсутствие риска контаминации образца
- Стандартизация и регулярность результатов
- Полностью автоматизированный cбор, дeзинфекция и промывание стержня
- Возможность автоматического, полуавтоматического и ручного управления
Функции и области применения:
Определение микробной обсемененности образцов:
- контроль качества пищевых продуктов и сырья
- контроль качества лекарственных препаратов, косметических средств и сырья
- проведение различных микробиологических исследований, где требуется определение численности бактерий
- изучение кинетики микробного роста при оценке антимикробных средств, антисептиков и дезинфектантов
Технические характеристики
- Микропроцессорное управление
- Встроенный вакуумный насос.
- Электропитание: 90V - 240V, 50 - 60 гц.
- Диаметр чашек: от 90 до 150 мм.
- Объем посевного материала: 50, 100 и 200 мкл.
- Диапазон определеяемых концентраций бактерий: 3 х 101 - 1 х 107 КОЕ/мл.
- Время посева: 8 сек.
- Размеры: 38 x 41 x 29 см, Вес 15,3 кг.
.jpg)
EasySpiral
Ускоренный посев за 25 секунд!
Код: 8.4A001
- Диаметр чашек Петри 90 мм
- Разовый сбор 500 μl для повторного заполнения 5 чашек Петри: 10 х 50 μl или 5 х 100 μl
- Объем распределенной суспензии 50 и 100 μl
- Чувствительность от 300 до 100 000 КОЕ / мл
- Режимы посева — сплошной, спиральный
- Время посева 8 секунд, весь цикл 25 секунд
EasySpiral Pro
Прослеживание и посев на любой чашке Петри
Код: 8.4A002
- 5 серийных разбавлений 1/10 и последующий посев
- Диаметр чашек Петри 55, 90 и 150 мм
- Разовый сбор 1000 μl
- USB программируемые объемы 10 - 1000 μl
- Чувствительность от 30 до 10 000 000 КОЕ / мл
- Режимы посева — сплошной, круговой, спиральныйи глубинный
- Время посева 25 секунд, полного цикла разбавления 100 сек
EasySpiral Dilute
Одновременное серийное разбавление и посев
Код: 8.4A003
- 5 серийных разбавлений 1/10 и последующий посев
- Диаметр чашек Петри 55, 90 и 150 мм
- Разовый сбор 1000 μl
- USB программируемые объемы 10 - 1000 μl
- Чувствительность от 30 до 10 000 000 КОЕ / мл
- Режимы посева — сплошной, круговой, спиральныйи глубинный
- Время посева 25 секунд, полного цикла разбавления 100 сек
Дилютеры микробиологические осуществляют автоматическую первичную подготовку пробы (первичное разведение исходной суспензии) и посев пробы на чашку Петри. Данные приборы совмещают в себе дилютер и устройство для спирального посева. Микробиологические дилютеры используются для жидких образцов, не требующих гомогенизации.
Дилютер автоматический микробиологический для посева клеточных суспензий, диапазон 30 - 1х10¹² КОЕ/мл, на чашки Петри 55, 90, 150 мм, EasySpiral Dilute
Автоматический микробиологический дилютер EasySpiral Dilute позволяет проводить разведение и последующий автоматический посев суспензий на твердые среды.
Разведение и посев полностью автоматизированы и количество суспензии известно в каждой точке чашки Петри. Это повышает точность подсчета колоний, освобождает от дополнительных разведений образца, значительно сокращает время проведения анализа и затраты на расходные материалы.
EasySpiral Dilute оборудован уникальной системой дезинфекции, которая обеспечивает стерилизацию устройства с отсутствием риска кросс-контаминации образцов.
EasySpiral Dilute с успехом применяется для контроля качества при производстве пищевых продуктов, лекарственных препаратов и сырья, а также для контроля и изучения кинетики микробного роста при различных микробиологических исследованиях.
EasySpiral Dilute используется для стандартизации и упрощения процесса посева. Последующий подсчет клеток удобно проводить с помощью полуавтоматических или автоматических счетчиков колоний.
Технические характеристики:
- диаметр чашек Петри, мм – 55, 90 и 150;
- USB программируемые объемы, мкл - от 10 до 1000;
- диапазон, КОЕ/мл – 30-1x10 12 ;
- режимы посева – сплошной газон, циркулярный, спиральный с разбавлением;
- перемешивание образцов перед разбавлением/посевом;
- 5 десятикратных разведений для одного цикла;
- время полного цикла (дезинфекция + 5 разбавлений + высев на чашку Петри) – 2 мин 13 сек;
- время полного цикла (дезинфекция + 5 разбавлений + высев на 6 чашкек Петри) — 4 мин 4 сек;
- автономная дезинфекция, цикл – 600 (2 л бутыль);
- сигнализация при нехватке измеряемой жидкости;
- встроенный вакуумный насос;
- экспорт данных в формате Excel;
- материал корпуса – нержавеющая сталь;
- габариты, ГхШхВ, см – 39 х 42 х 29;
- вес, кг – 15,6.
Преимущества:
- постановка одного исследования на 1 чашке Петри вместо 5-6 чашек;
- автоматизированный отбор пробы;
- автоматическое приготовление до 6 разведений;
- отсутствие кросс-контаминации за счет запатентованной системы дезинфекции;
- точно откалиброванный стандартизированный объем засеваемой пробы;
- высокая воспроизводимость результатов;
- возможность работать только в режиме разведения;
- экономия рабочего времени персонала и расходных материалов.
После последовательных автоматических разведений полученная суспензия распределяется на чашку Петри одним из способов: сплошной газон, в форме убывающей логарифмической спирали или круговым методом.

Комплект поставки: стерильные стаканчики (1000 шт.), голубой краситель для тестирования, жидкий детергент, 3 набора для соединения бутылок GL45, сетка для подсчета колоний на 90 мм и 150 мм чашках Петри, адаптер для 55 мм, 90 мм и 150 мм чашек Петри, ПО, USB-кабель, кабель питания, инструкция.
Устройство для спирального посева клеточной суспензии, диапазон 300 - 1,3х10⁵ КОЕ/мл, на чашки Петри 90 мм, EasySpiral
Прибор для посева EasySpiral с предустановленным объемом распределения бактериальной суспензии 50 и 100 мкл имеет интервал подсчета от 300 до 1,3×10⁵ КОЕ/мл и совмещает в себе два типа посева — спиральный и круговой. При круговом посеве образец наносится по кругу в виде трех или шести последовательных разведений.
Время полного цикла посева у EasySpiral, включающего в себя дезинфекцию дозирующего капилляра для исключения перекрестной контаминации, забор образца и высев на чашку Петри, составляет 25 с. За счет автоматизации процесса происходит снижение затрат на анализ до 75 %.
- Диаметр чашек Петри, мм — 90;
- тип посева — экспоненциальный, круговой;
- общий объем шприца, мл — 1000;
- объем распределяющей суспензии, мкл — 50, 100;
- диапазон, КОЕ/мл — от 300 до 1,3×10⁵;
- время посева, с — 8;
- время полного цикла (дезинфекция + забор образца + высев на чашку Петри), с — 25;
- объем единовременного посева одного образца – до 20 чашек Петри по 50 мкл;
- встроенный вакуумный насос;
- автоклавируемый стилус;
- автономная дезинфекция, цикл — 1000 (2 л бутыль);
- сигнализация при нехватке или отсутствии дезинфектанта;
- автономная подача дистиллированной воды, цикл — 600 (2 л бутыль);
- материал корпуса — нержавеющая сталь;
- габариты, Г × Ш × В, см — 41,5 × 40 × 29;
- вес нетто, кг — 16,4.
Устройство для спирального посева клеточной суспензии, диапазон 100 - 1х10⁷ КОЕ/мл, на чашки Петри 90, 150 мм, EasySpiral Pro
Прибор для посева EasySpiral Pro с предустановленным объемом распределения бактериальной суспензии 50, 100 и 200 мкл имеет интервал подсчета от 100 до 1×10⁷ КОЕ/мл и совмещает в себе три типа посева — спиральный, круговой и равномерный по всей чашке Петри. В EasySpiral Pro все операции по посеву и расчету объема образцов можно выполнять с помощью специальной программы управления с выводом результатов на экран ПК.
Время полного цикла посева у EasySpiral Pro, включающего в себя дезинфекцию дозирующего капилляра для исключения перекрестной контаминации, забор образца и высев на чашку Петри, составляет 25 с. За счет автоматизации процесса происходит снижение затрат на анализ до 75 %.
- Диаметр чашек Петри, мм — 90, 150;
- тип посева — экспоненциальный, круговой, равномерный;
- общий объем шприца, мл — 1000;
- объем распределяющей суспензии, мкл — 50, 100, 200;
- программируемый объем через USB, мкл — 10-1000;
- диапазон, КОЕ/мл — от 100 до 1×10⁷;
- время посева, с — 8;
- время полного цикла (дезинфекция + забор образца + высев на чашку Петри), с — 25;
- объем единовременного посева одного образца – до 20 чашек Петри по 50 мкл;
- встроенный вакуумный насос;
- автоклавируемый стилус;
- автономная дезинфекция, цикл — 1000 (2 л бутыль);
- сигнализация при нехватке или отсутствии дезинфектанта;
- автономная подача дистиллированной воды, цикл — 600 (2 л бутыль);
- интерфейс — USB;
- ПО для подсчета колоний;
- отслеживаемость — Exсel, Lims;
- совместимость с системой отслеживания dataLink;
- материал корпуса — нержавеющая сталь;
- габариты, Г × Ш × В, см — 41,5 × 40 × 29;
- вес нетто, кг — 16,4.
Дилютеры микробиологические осуществляют автоматическую первичную подготовку пробы (первичное разведение исходной суспензии) и посев пробы на чашку Петри. Данные приборы совмещают в себе дилютер и устройство для спирального посева. Микробиологические дилютеры используются для жидких образцов, не требующих гомогенизации.
Устройство для спирального посева (спиральный дозатор) — аппарат, который распределяет предварительно установленный объем пробы по поверхности вращающихся чашки Петри с агаром. Дозирующая игла движется от центра чашки к наружному ее краю по траектории, называемой спиралью Архимеда. Распределяемый объем уменьшается по мере движения иглы от центра к краю таким образом, чтобы существовала обратно пропорциональная зависимость между выливаемым объемом и радиусом спирали. Объем пробы, распределенной на любой конкретный сегмент, известен и постоянен. Устройство для спирального посева применяют для разливки жидкой пробы и гомогенной пробы на чашки Петри для подсчета колоний. После посева на устройстве чашки Петри закрывают крышкой и дают посевному материалу абсорбироваться в течение 15 мин при комнатной температуре, после чего инкубируют в термостате. После инкубации можно проводить подсчет количества микроорганизмов с помощью счетчика колоний.
Подготовка образца имеет очень важное значение в дальнейшем анализе. Подготовка пробы требует аккуратности и соблюдения максимальных требований стерильности, чтобы все манипуляции исключали возможность перекрестной контаминации. Поэтому желательно максимально автоматизировать процесс подготовки образца перед посевом на чашки Петри.
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.
Читайте также:

