Посев в среду китта тароцци
Обновлено: 05.10.2024
В 975 см 3 среды из сухого питательного агара непосредственно перед применением асептически добавляют 25 см 3 стерильного раствора глюкозы концентрации 200 г/дм 3 .
К 700 см 3 воды добавляют 300 см 3 томатного сока, 2 г дрожжевого экстракта или 10 см 3 раствора дрожжевого экстракта, 10 г глюкозы, доводят рН 5,5-5,6, фильтруют, разливают по 100 см 3 в стерильные колбы и стерилизуют в автоклаве при температуре (117±1) °С в течение 20 мин. Отдельно в 500 см 3 дистиллированной воды растворяют при нагревании 20 г агара, разливают по 100 см 3 в колбы и стерилизуют в автоклаве при температуре (121±1) °С в течение 20 мин. Перед посевом в асептических условиях смешивают 100 см 3 жидкой среды со 100 см 3 расплавленногоагара. Агаризованную среду вносят в чашки, содержащие 0,25 г стерильного углекислого кальция.
Для приготовления среды Китт-Тароцци стерильные пробирки заполняют на 1,0-1,5 см кусочками печени, мяса или рыбы и заливают приготовленным мясо-пептонным бульоном с глюкозой и агаром. В 1 дм 3 мясо-пептонного, рыбо-пептонного или печеночного бульона вносят 10 г глюкозы и 1,5 г агара, который при нагревании постепенно расплавляют (высота слоя бульона в обычных пробирках 12-13 см, в высоких 15-18 см) и стерилизуют 20 мин при температуре (121±1) °С. Требуемую величину рН проверяют до и после стерилизации.рН среды после стерилизации должно быть (7,1±0,1).
При приготовлении среды впрок вместо добавления к ней агара на поверхность среды перед стерилизацией в пробирки наслаивают 0,5-1,0 см вазелинового масла.
При применении среды Китт-Тароцци без добавления в нее агара или вазелинового масла на поверхность среды после окончания посева наслаивают голодный агар или парафиновую смесь высотой 1,0-1,5 см.
При посевах в свежеприготовленную среду Китт-Тароцци (не более 3 сут с момента приготовления) добавлять агар, вазелиновое масло или наслаивать на ее поверхность голодный агар не обязательно.
После кипячения устанавливают рН 7,7-7,8. Кусочки мяса фасуют в пробирки до 2,5 г и заливают 10 см вышеприготовленной жидкости. Стерилизуют при температуре (121±1) °Св течение 20 мин. После стерилизации среда должна иметь рН 7,4-7,5. Для выделения С. botulinum и сахаролитических анаэробных микроорганизмов в среду добавляют раствор глюкозы из расчета содержания ее в среде 0,5-1,0%. На поверхность среды наслаивают голодный агар, вазелиновое масло или парафиновую смесь.
50 г порошка сухого питательного агара высыпают в 1 дм холодной водопроводной воды, тщательно перемешивают и кипятят на слабом огне 1-2 мин при помешивании до полного расплавления агара, не допуская пригорания в закрытом сосуде. Устанавливают рН среды 7,0-7,2. Расплавленный раствор фильтруют через вату, разливают в пробирки, флаконы или колбы и стерилизуют 20 мин при температуре (121±1) °С.
В 975 см среды из сухого питательного агара непосредственно перед применением асептически добавляют 25 см стерильного раствора глюкозы концентрации 200 г/дм.
К 700 см воды добавляют 300 см томатного сока, 2 г дрожжевого экстракта или 10 смраствора дрожжевого экстракта, 10 г глюкозы, доводят рН 5,5-5,6, фильтруют, разливают по 100 см в стерильные колбы и стерилизуют в автоклаве при температуре (117±1) °С в течение 20 мин. Отдельно в 500 см дистиллированной воды растворяют при нагревании 20 г агара, разливают по 100 см в колбы и стерилизуют в автоклаве при температуре (121±1) °Св течение 20 мин. Перед посевом в асептических условиях смешивают 100 см жидкой среды со 100 см расплавленного агара. Агаризованную среду вносят в чашки, содержащие 0,25 г стерильного углекислого кальция.
Для приготовления среды Китт-Тароцци стерильные пробирки заполняют на 1,0-1,5 см кусочками печени, мяса или рыбы и заливают приготовленным мясо-пептонным бульоном с глюкозой и агаром. В 1 дм мясо-пептонного, рыбо-пептонного или печеночного бульона вносят 10 г глюкозы и 1,5 г агара, который при нагревании постепенно расплавляют (высота слоя бульона в обычных пробирках 12-13 см, в высоких 15-18 см) и стерилизуют 20 мин при температуре (121±1) °С. Требуемую величину рН проверяют до и после стерилизации.рН среды после стерилизации должно быть (7,1±0,1).
При приготовлении среды впрок вместо добавления к ней агара на поверхность среды перед стерилизацией в пробирки наслаивают 0,5-1,0 см вазелинового масла.
При применении среды Китт-Тароцци без добавления в нее агара или вазелинового масла на поверхность среды после окончания посева наслаивают голодный агар или парафиновую смесь высотой 1,0-1,5 см.
При посевах в свежеприготовленную среду Китт-Тароцци (не более 3 сут с момента приготовления) добавлять агар, вазелиновое масло или наслаивать на ее поверхность голодный агар не обязательно.
Готовят среду Китт-Тароцци с углекислым кальцием, но в мясо-пептонный бульон перед фасовкой вносят 2 г дрожжевого экстракта или 10 см 3 раствора дрожжевого экстракта. Перед анализом в регенерированную среду Китт-Тароцци с углекислым кальцием и дрожжевым экстрактом асептически вносят аскорбиновую кислоту из расчета 100 мкг на 1 дм 3 среды.
Для внесения аскорбиновой кислоты в среду раствор, приготовленный по п.4.10, разводят в стерильной дистиллированной воде в 100 раз и 0,2 см 3 приготовленного раствора вносят на 1 дм 3 среды.
В 1 дм 3 водопроводной воды добавляют 20 г порошкообразной печени, при отсутствии сухой порошкообразной печени применяют печеночную воду - 1 дм 3 , но в этом случае водопроводная вода из среды исключается, 50 г кукурузной муки (белой или желтой), все хорошо размешивают, чтобы не было комков. Нагревают в течение 1 ч в текучем паре до полного растворения всех компонентов. Устанавливают рН 7,0-7,2, разливают и стерилизуют 1 ч при (121±1) °С.
Применяют для выявления мезофильных анаэробных и микроорганизмов при анализе консервов с рН 4,4 и ниже.
10 г пептона растворяют в небольшом количестве водопроводной воды, добавляют 5 г растворимого крахмала, предварительно растворенного в 50 см 3 воды, и доводят объем водопроводной водой до 1 дм 3 , устанавливают рН 6,7-6,8. Фильтруют через бумажный фильтр, добавляют 500 мкг триптофана, 5 г глюкозы, 20 г агара, нагревают до полного растворения агара и добавляют индикатор бромкрезол-пурпур и бромтимоловый синий (пп.4.7, 4.8). Разливают в стерильную посуду и стерилизуют 20 мин при температуре (116±1) °С.
В 1 дм 3 дистиллированной воды вносят 2 г азотнокислого калия, 2 г двузамещенного фосфорнокислого калия, 1 г агара, 30 г желатина, дают набухнуть желатину и нагревают на водяной бане до полного растворения желатина и агара, добавляют 25 см 3 стерильного мясо-пептонного бульона и 10 см 3 раствора 2, 3, 5-трифенилтетразолиум хлорида концентрации 10 г/дм 3 , устанавливают рН (7,1±0,1), стерилизуют 3 сут подряд при температуре (100±1) °Св течение 20 мин или однократно при температуре (110±1) °С в течение 15 мин. Среда должна быть бесцветной.
В 1 дм 3 горячей дистиллированной воды растворяют 10 г пептона и 40 г глюкозы или мальтозы, разливают в стерильную посуду и стерилизуют 20 мин при температуре (112±1) °С.
5 г глюкозы, 10 г пептона или триптона, или триптозы (Дифко), 20 г агара растворяют при подогревании в 950 см 3 воды; отдельно 5 г растворимого крахмала растворяют в 50 см 3 воды и раствор вносят в среду, устанавливают рН (7,1±0,1) и стерилизуют при температуре (117±1) °С в течение 20 мин.
Применяют для культивирования аэробных и факультативно-анаэробных кислотообразующих термофильных микроорганизмов.
10 г пептона растворяют в небольшом количестве воды, добавляют 5 г растворимого крахмала, предварительно растворенного в 50 см 3 воды, доводят объем водой до 1 дм 3 , устанавливают рН (6,2±0,1). Фильтруют через бумажный фильтр, добавляют 500 мкг триптофана, 5 г глюкозы, 20 г агара, нагревают до полного растворения агара и добавляют 10 см 3 раствора бромкрезолпурпура концентрации 0,4 г/дм 3 , разливают в стерильную посуду и стерилизуют при температуре (116±1) °С в течение 20 мин.
Бактерии четко разделяют по отношению к содержанию кислорода в атмосфере культивирования.
Посев аэробных бактерий
Посевы аэробных бактерий культивируют в простых термостатах. Некоторые факультативно анаэробные виды также можно культивировать при атмосферном воздухе, но более оптимально помещение посевов в термостаты с дозированной подачей кислорода. На практике их чаще помещают в эксикаторы, куда вносят горящую свечу; после её выгорания в атмосфере снижается содержание кислорода и повышается содержание С02.
Посев анаэробных бактерий
Посевы анаэробных бактерий в жидких средах заливают вазелиновым или другим маслом. При использовании плотных сред посевы культивируют в специальных устройствах — анаэростатах (откуда откачивают воздух) либо заливают посевы тонким слоем агара. Анаэробные условия можно создать химическим путём, поместив посевы в эксикаторы, на дно которых заливают щелочной раствор пирогаллола, поглощающего кислород. Также можно использовать методы Фортнера, Цейсслера и Вейнберга.
Метод Фортнера
Посевы проводят на чашку Петри с толстым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. На одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробов, а затем (после поглощения кислорода) — рост анаэробов.
Метод Цейсслера
Метод Цейсслера используют для выделения чистых культур спорообразующих анаэробов. Для этого проводят посев на среду Китта-Тароцци, прогревают 15 мин при 80 °С (для уничтожения вегетативных форм), заливают вазелиновым маслом и инкубируют 24 ч. Затем проводят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования подозрительные колонии изучают и отсевают на среду Китта-Тароци (с последующим контролем чистоты выделенной культуры).
Метод Вейнберга
Метод Вейнберга используют для получения чистых культур строгих анаэробов. Культуры, выращенные на среде Китта-Тароцци, вносят в сахарный бульон. Затем пастеровской пипеткой с запаянным концом материал переносят в узкие пробирки (трубки Виньяля) с сахарным МПА, погружая пастерку до дна пробирки. Засеянные пробирки быстро охлаждают холодной водой, что позволяет зафиксировать отдельные бактериальные клетки в толще затвердевшего агара. Пробирки инкубируют, и изучают выросшие колонии. При обнаружении подозрительной колонии на сё месте делают распил, колонию быстро отбирают и засевают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:
1. Облигатные аэробные бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост плёнкой на поверхности из-за восколипидной мембраны).
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является более выгодным, чем гликолиз), однако они могут быть найдены на всём протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Анаэробы — организмы, получающие энергию при отсутствии доступа кислорода путём субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ в присутствии конечного акцептора протонов организмами, осуществляющими окислительное фосфорилирование.
Анаэробы — обширная группа организмов, как микро-, так и макроуровня:
- анаэробные микроорганизмы — обширная группа прокариотов и некоторые простейшие.
- макроорганизмы — грибы, водоросли, растения и некоторые животные (класс фораминиферы, большинство гельминтов (класс сосальщики, ленточные черви, круглые черви (например, аскарида).
Помимо этого, анаэробное окисление глюкозы играет важную роль в работе поперечнополосатой мускулатуры животных и человека (особенно в состоянии тканевой гипоксии).
Содержание
Степень аэробности среды

Для измерения потенциала среды М. Кларк предложил использовать величину pH2 0 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале 17, факультативные анаэробы 15, а облигатные — при наиболее низком 5.
Классификация анаэробов
Согласно устоявшейся в микробиологии классификации, различают:
- Факультативные анаэробы
- Капнеистические анаэробы и микроаэрофилы
- Аэротолерантные анаэробы
- Умеренно-строгие анаэробы
- Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам.
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus).
Умеренно-строгий анаэробный организм выживает в среде с молекулярным O2, однако не размножается. Микроаэрофилы способны выживать и размножаться в среде с низким парциальным давлением O2.
Облигатные анаэробы в присутствии молекулярного кислорода O2 гибнут — например, представители рода бактерий и архей: Bacteroides, Fusobacterium, Butyrivibrio, Methanobacterium). Такие анаэробы постоянно живут в лишённой кислорода среде. К облигатным анаэробам относятся некоторые бактерии, дрожжи, жгутиковые и инфузории.
Токсичность кислорода и его форм для анаэробных организмов
Среда с содержанием кислорода является агрессивной по отношению к органическим формам жизни. Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода — наличие у него функциональной антиоксидантной системы, способной к элиминации: супероксид-аниона(O2 − ), пероксида водорода(H2O2), синглетного кислорода( 1 O2), а также молекулярного кислорода (O2) из внутренней среды организма. Наиболее часто подобная защита обеспечивается одним или несколькими ферментами:
- супероксиддисмутаза, элиминирующая супероксид-анион(O2 − ) без энергетической выгоды для организма
- каталаза, элиминирующая перекись водорода(H2O2) без энергетической выгоды для организма
- цитохром — фермент, отвечающий за перенос электронов от NAD•H к O2. Этот процесс обеспечивает существенную энергетическую выгоду организму.
Аэробные организмы содержат чаще всего три цитохрома, факультативные анаэробы — один или два, облигатные анаэробы не содержат цитохромов.
Анаэробные микроорганизмы могут активно воздействовать на среду , создавая подходящий окислительно-восстановительный потенциал среды (например, Clostridium perfringens). Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH2 0 с величины 24 до 2, ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH2 0 .
Дополнительная антиоксидантная защита может обеспечиваться синтезом или накоплением низкомолекулярных антиоксидантов: витамина С, А, E, лимонной и других кислот.
Получение энергии путём субстратного фосфорилирования. Брожение. Гниение

- Также анаэробные организмы могут получать энергию путём катаболизма аминокислот и их соединений (пептидов, белков). Такие процессы именуют гниением, а микрофлору в энергетическом обмене которой преобладают процессы катаболизма аминокислот называют гнилостной.
- Анаэробные микроорганизмы расщепляют гексозы (например, глюкозу) разными путями:
- Гликолиз (Путь Эмдена-Мейергофа) после которого продукт подвергается брожению
- окислительный пентозофосфатный путь (другие названия: Фосфогликонатный путь, иначе гексозомонофосфатный(ГКМ), иначе путь Варбурга — Диккенса — Хореккера)
- Путь Энтнера — Дудорова (особенно значимый, когда субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные)
В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis. Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу.
При этом характерным только для анаэробов является гликолиз, который в зависимости от конечных продуктов реакции разделяют на несколько типов брожения:
- молочнокислое брожение — род Lactobacillus,Streptococcus, Bifidobacterium, а также некоторые ткани многоклеточных животных и человека.
- спиртовое брожение — сахаромицеты, кандида (организмы царства грибов)
- муравьинокислое — семейство энтеробактерий
- маслянокислое — некоторые виды клостридий
- пропионовокислое — пропионобактерии(например, Propionibacterium acnes)
- брожение с выделением молекулярного водорода — некоторые виды клостридий, ферментация Stickland
- метановое брожение — например, Methanobacterium
В результате расщепления глюкозы расходуется 2 молекулы, а синтезируется 4 молекулы АТФ. Таким образом общий выход АТФ составляет 2 молекулы АТФ и 2 молекулы НАД·Н2. Полученный в ходе реакции пируват утилизируется клеткой по-разному в зависимости от того, какому типу брожения она следует.
Антагонизм брожения и гниения
В процессе эволюции сформировался и закрепился биологический антагонизм бродильной и гнилостной микрофлоры:
Расщепление микроорганизмами углеводов сопровождается значительным снижением pH среды, в то время как расщепление белков и аминокислот — повышением (защелачиванием). Приспособление каждого из организмов к определённой реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Культивирование анаэробных организмов
![]()
Культивирование анаэробных организмов в основном является задачей микробиологии.
Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах.
Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление редуцирующих веществ (глюкозу, муравьинокислый натрий, казеин, сульфат натрия, тиосульфат, цистеин, тиогликолят натрия и др.), связывающих токсичные для анаэробов перикисные соединения.
Общие питательные среды для анаэробных организмов
Для общей среды Вильсона-Блера базой является агар-агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счёт восстановления сульфита до сульфид-аниона, который, соединяясь с катионами железа (II), даёт соль чёрного цвета. Как правило, чёрные на этой среде образования колонии появляются в глубине агарового столбика.
Среда Китта-Тароцци состоит из мясопептонного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20—30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Общие методы культивирования для анаэробных организмов
GasPak — система химическим путём обеспечивает постоянство газовой смеси, приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор.
Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
![]()
Метод Фортнера — посевы производят на чашку Петри с утолщённым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
![]()
Метод Перетца — в расплавленный и охлаждённый сахарный агар-агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надежен из всех, но достаточно прост в применении.
Дифференциально — диагностические питательные среды
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определённого углевода (глюкоза, лактоза, мальтоза, маннит, сахароза и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя (Рассела) применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий). Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности.
Среда Плоскирева (бактоагар Ж) — дифференциально-диагностическая и селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли желчных кислот, минеральные соли, индикатор (нейтральный красный).
Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута. Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Метаболизм анаэробных организмов
Метаболизм анаэробных организмов имеет несколько различных подгрупп:
- Организмы способные использовать анаэробное дыхание (другие окислители — серу, азот (см. Анаэробное дыхание), хлораты, перхлораты, хроматы и перманганаты);
- Использующие циклическое фотосинтетическое фосфорилирование (лучевую энергию (чаще всего Солнца)) — фототрофные анаэробы (см. также Аноксигенный фотосинтез);
- Организмы, энергетический обмен которых опирается на катаболизм высокомолекулярных/высокоэнергетических соединений (например, гликолиз).
Анаэробный энергетический обмен в тканях человека и животных
![]()
Некоторые ткани животных и человека отличаются повышенной устойчивостью к гипоксии (особенно мышечная ткань). В обычных условиях синтез АТФ идет аэробным путём, а при напряжённой мышечной деятельности, когда доставка кислорода к мышцам затруднена, в состоянии гипоксии, а также при воспалительных реакциях в тканях доминируют анаэробные механизмы регенерации АТФ. В скелетных мышцах выявлены 3 вида анаэробных и только один аэробный путь регенерации АТФ.
![]()
К анаэробным относятся:
Необходимо отметить, что прямым следствием гликолиза является критическое снижение рН тканей — ацидоз. Это ведёт к снижению эффективного транспорта кислорода гемоглобином, и формирует положительную обратную связь.
Каждый механизм имеет своё время удержания максимальной мощности и оптимум энергообеспечения тканей. Наибольшая мощность и наименьшее время удержания:
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
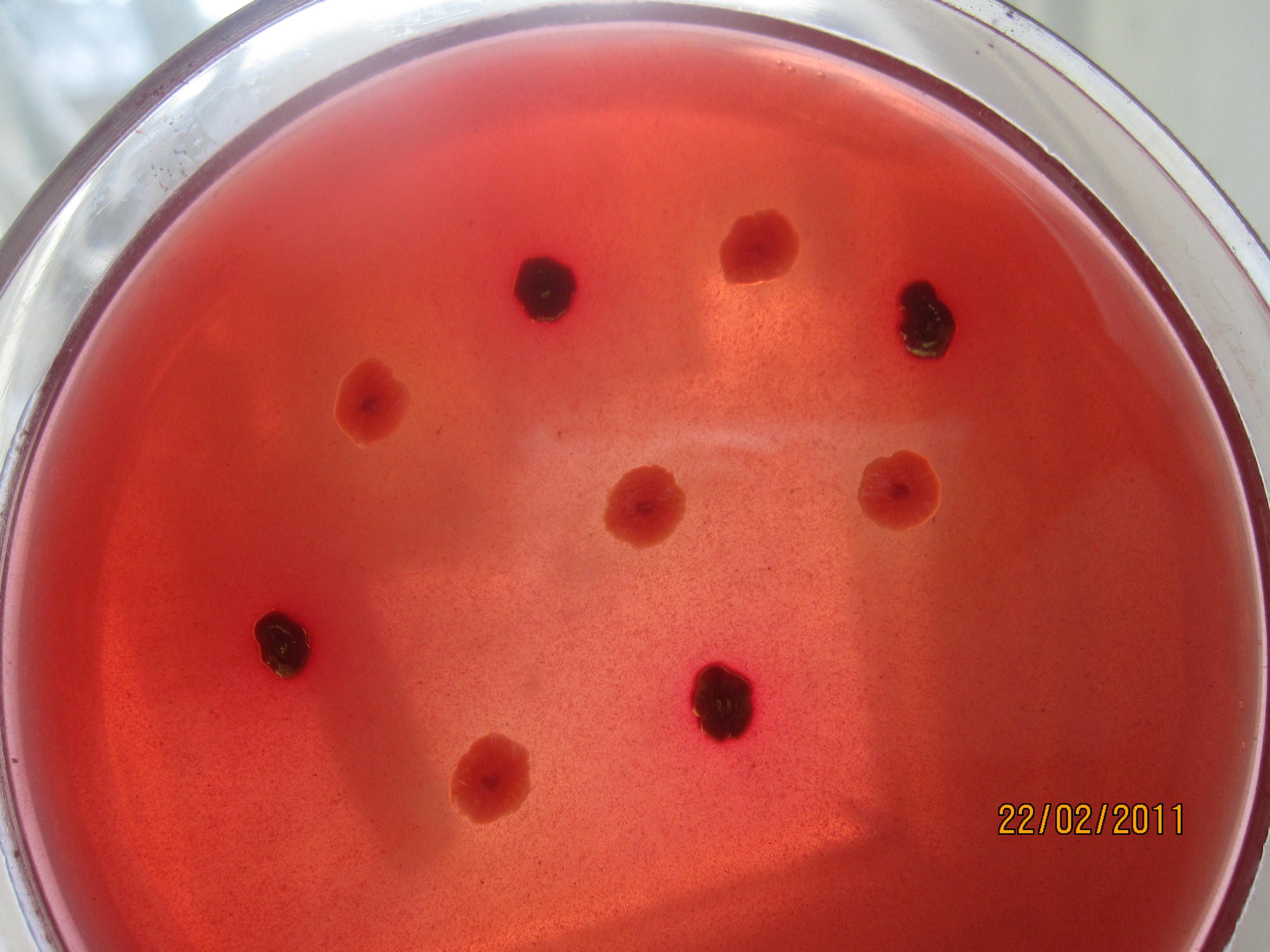
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
![]()
![]()
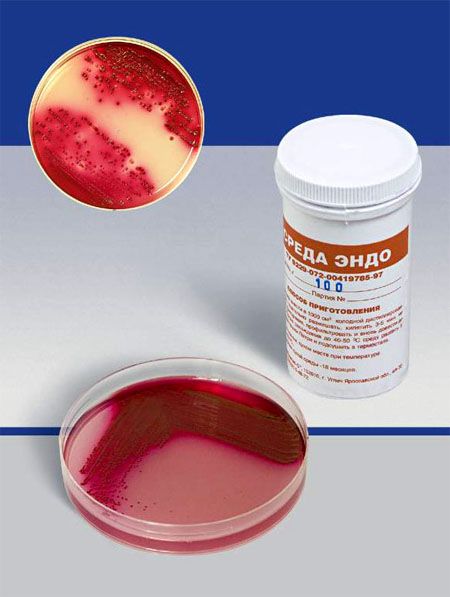
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
![]()
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
![]()
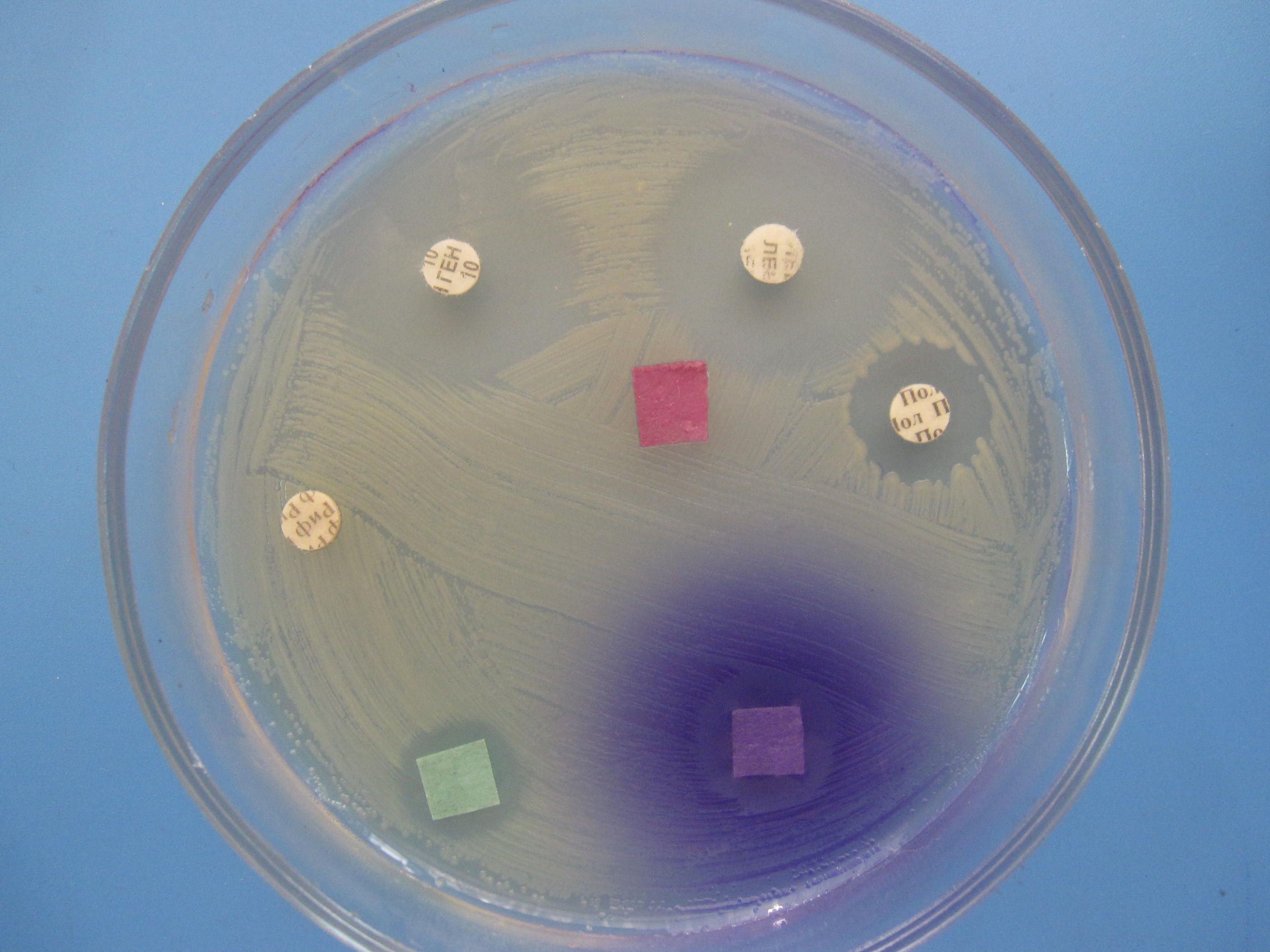
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.
Питательная среда Китта-Тароцци предназначена для культивирования облигатно-анаэробных бактерий, преимущественно клостридий, в том числе возбудителей анаэробной газовой инфекции (C.perfringens, C.novyi (oedematiens), C.septicum и др.).
Среда выпускается в герметично укупоренных флаконах по 200 мл.
В стерильные пробирки опускают кусочки проваренной печени или проваренного мяса весом около 1 г. Разливают бульон Китта-Тароцци по пробиркам таким образом, чтобы столбик жидкости составлял не менее половины высоты пробирки. Поверх бульона наслаивают вазелиновое масло, слой которого должен быть около 1 см. Пробирки закрывают ватно-марлевой пробкой и автоклавируют при 0,5 атм. в течение 30-35 мин.
Производят глубинный посев культуры или биологического материала (под вазелин).
УСЛОВИЯ И СРОК ХРАНЕНИЯ:
Хранить в прохладном, защищённом от света месте.
Срок годности среды в герметично укупоренных флаконах - 6 месяцев.
Похожие документы:
Питательные среды для медицинской микробиологии
. буферный растворы. Инструкция по лабораторной диагностике . среды, разрывы среды) такая же, как при применении среды Клиглера. Отдельную группу составляют питательные среды . рН 7,2 – 7,4 (* см.среду Китт-Тароцци) Среда используется при выделении и, что .
Научно-методический центр пищевых инфекций методы частной бактериологии
. В соответствии с действующей инструкцией при лабораторной диагностике злокачественного . . Питательные среды для культивирования клостридий Среда Китта-Тароцци. Мясо . По Граму часто окрашивается биполярно. Выделение требует применения селективных сред; .
Материалы для самостоятельной изучения по курсу ветеринарно санитарной экспертизе
. САМОСТОЯТЕЛЬНОЙ ИЗУЧЕНИЯ ПО КУРСУ ВЕТЕРИНАРНО . технические условия, инструкции и др.). . копченостей отмечается при применении сырья (шпика) . Китта-Тароцци. Подлежащие бактериологическому исследованию банки консервов выдерживают 5 сут. в термостате. Среды .
Читайте также: