Посевы методами механического разобщения используют для
Обновлено: 05.10.2024
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.


При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.

Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов.Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.


Ценную дополнительную информацию об особенностях строения колоний дает их изучение в косопадающем пучке света (рис. 46). Культуры на прозрачной агаровой среде в чашках Петри помещают на предметный столик бинокулярной лупы. Между бинокулярной лупой и источником света помещают зеркало от микроскопа вогнутой стороной вверх таким образом, чтобы лучи, отраженные от него, попадали в плоскость изучаемого объекта под углом 40. 45°. Зеркало устанавливают на равном уда
лении от объекта и источника света (12. 14 см). При таком освещении колонии бактерий могут быть окрашены в различные цвета. Цвет зависит как от видовых особенностей, так и от состояния культуры (S-, R-формы, см. тему 12).
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1.Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2.Какие методы применяют для получения чистых культур микроорганизмов?
3.Какие культуральные признаки учитывают при идентификации бактерий?
4.Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
В бактериологии широко применяются сухие питательные среды промышленного производства, которые представляют собой гигроскопические порошки, содержащие все компоненты среды, кроме воды. Для их приготовления используются триптические перевары дешевых непищевых продуктов (рыбные отходы, мясокостная мука, технический казеин). Они удобны при транспортировке, могут длительно храниться, избавляют лаборатории от громадного процесса приготовления сред, приближают к разрешению вопроса о стандартизации сред. Медицинская промышленность производит сухие среды Эндо, Левина, Плоскирева, висмутсульфит агар, питательный агар, углеводы с индикатором ВР и другие.
Для культивирования микроорганизмов используют термостаты.
Термостат – это аппарат, в котором поддерживают постоянную температуру. Прибор состоит из нагревателя, камеры, двойных стенок, между которыми циркулирует воздух или вода. Температура регулируется терморегулятором. Оптимальная температура для размножения большинства микроорганизмов 37°С.
ТЕМА: МЕТОДЫ ВЫДЕЛЕНИЯ ЧИСТОЙ КУЛЬТУРЫ АЭРОБОВ. ЭТАПЫ ВЫДЕЛЕНИЯ ЧИСТОЙ КУЛЬТУРЫ АЭРОБНЫХ БАКТЕРИЙ МЕТОДОМ МЕХАНИЧЕСКОГО РАЗОБЩЕНИЯ
План занятия
2. Методы выделения чистых культур путем механического разобщения
3. Биологические методы выделения чистых культур
4. Методы идентификации бактерий
Цель занятия: Ознакомить студентов с различными методами выделения чистых культур, научить делать посевы петлей, штрихами, уколом
Методические указания к демонстрации
В естественной среде обитания бактерии находятся в ассоциациях. С целью определения свойств микробов, их роли в развитии патологического процесса необходимо иметь бактерии в виде однородных популяций (чистых культур). Чистая культура - это совокупность бактериальных особей одного вида, выращенная на питательной среде.
Методы выделения чистых культур аэробных бактерий
Механического разобщения Биологические
Метод Пастера Метод Коха Биологический Физический
(имеет историческое (пластинчатых разводок)
Посев петлей Посев шпателем
Методы выделения чистых культур:
1. Методы механического разобщения, основаны на разъединении микробов путем последовательного растирания исследуемого материала по поверхности агара.
а) Метод Пастера – имеет историческое значение, предусматривает последовательное разведение исследуемого материала в жидкой питательной среде методом переката
б) Метод Коха – метод пластинчатых разводок – основан на последовательном разведении исследуемого материала мясопептонным агаром с последующей разливкой пробирок с разведенным материалом в чашки Петри.
в) Метод Дригальского – при посеве материала, обильно обсемененного микрофлорой, используют 2-3 чашки для последовательного посева шпателем.
г) Посев петлей параллельными штрихами.
2. Биологические методы основаны на биологических свойствах возбудителей.
а) Биологический – заражение высокочувствительных животных, где микробы быстро размножаются и накапливаются. В одних случаях, этот метод является единственным, позволяющим выделить культуру возбудителя от больного человека (например, при туляремии), в других случаях - он более чувствителен (например, выделение пневмококка на белых мышах или возбудителя туберкулеза на морских свинках).
б) Химический – основан на кислотоустойчивости микобактерий. Для освобождения материала от сопутствующей флоры, его
обрабатывают раствором кислоты. Вырастут только туберкулезные палочки, так как кислотоподатливые микробы погибли под действием кислоты.
в) Физический метод основан на устойчивости спор к нагреванию. Для выделения культуры спорообразующих бактерий из
смеси материал прогревают при 80°С и засевают на питательную среду. Вырастут только споровые бактерии, так как споры их остались живыми и дали рост.
г) Метод Щукевича – основан на высокой подвижности вульгарного протея, способного давать ползучий рост.
Методика приготовления пластинчатого агара
МПА расплавляют на водяной бане, затем остужают до 50-55°С. Горлышко флакона обжигают в пламени спиртовки, открывают чашки Петри так, чтобы вошло горлышко флаконы, не прикасаясь к краям чашки, выливают 10-15 мл МПА, закрыв крышку, покачивают чашку, чтобы среда равномерно распределилась, оставляют на горизонтальной поверхности до застывания. После подсушивания чашки с пластинчатым агаром хранят на холоде.
Посев петлей
Стерильной остуженной петлей берут каплю материала, левой рукой приоткрывают один край чашки, вносят петлю внутрь и у противоположного края делают петлей несколько штрихов на одном месте, затем петлю отрывают и засевают материал параллельными штрихами от одного края чашки к другому с интервалом 5-6 мм. В начале посева, когда микробов на петле будет много, они дадут сливной рост, но с каждым штрихом микробов на петле остается все меньше, и они будут оставаться одиночными и давать изолированные колонии.
Посев по методу Дригальского
Этот метод используется при посеве материала, обильно обсемененного микрофлорой (гной, испражнения, мокрота). Для посева по методу Дригальского берут шпатель и несколько чашек (3-4). Шпатель – это инструмент, изготовленный из металлической проволоки или стеклянного дрота, загнутого в виде треугольника или Г-образно. Материал петлей или пипеткой вносят в первую чашку и равномерно распределяют шпателем по поверхности среды, этим же шпателем, не прожигая его, втирают материал в питательную среду во второй чашке, а затем в третьей. При таком посеве в первой чашке будет сливной рост, а в последующих чашках вырастают изолированные колонии.
Тесты онлайн по различным предметам и дисциплинам. Большая подборка полезных тестов онлайн включающая экзамен охранника, мигранта, по охране труда, в ГИМС, по русскому языку, литературе, а также для получения лицензии на оружие, психологические тесты и тесты для проведения профессионального отбора (профотбора) поступающих на службу в силовые структуры - такие как вооруженные силы РФ, в том числе в военные училища (проводят военкоматы), органы внутренних дел (полицию), в том числе институты МВД РФ, министерство по чрезвычайным ситуациям (МЧС).
Тесты онлайн разработаны специально для повышения своего уровня знаний, и подходят для людей различных профессий, а также учащихся различных учебных заведений, как средних так и высших. Многие учащиеся школ, СПТУ, колледжей, институтов, академий воспользовались нашими тестами онлайн, для подготовки к успешной сдачи экзаменов. Грамотно и удобно разработанный интерфейс тестов позволяет отлично подготовится и успешно сдать экзамены.
Посевы проводят как с целью выделение возбудителей из исследуемого материала от больных, так и для накопления чистых культур с целью последующего их изучения и идентификации.
Техника посевов в жидких и на плотные питательные среды имеет свои особенности.
В левую руку берут две пробирки. В одной находится питательная среда (плотная или жидкая), в другой – исследуемый материал. Пробирки зажимают большим и указательным пальцами. Для того, чтобы можно было наблюдать за содержанием пробирок, их держат сверху кисти руки.
Пробирки должны быть наклоненными. Нужно следить, чтобы при открытии их материал не был инфицирован.
Пробки из пробирок вынимают, держа их 4 и 5 пальцами правой руки. Тремя другими пальцами правой руки, как карандаш, держат бактериологическую петлю или пипетку, которыми распределяют исследуемый материал.
Сначала стерилизуют петлю в верхней части пламени газовой горелки. Пробирки открывают и край их проносят через пламя горелки. Петлю опускают в пробирку, где есть исследуемый материал, и, осторожно касаясь стенки, охлаждают. В последующем петлю опускают в пробирку и набирают материал. Если он находится в жидком состоянии, для посева достаточно капли жидкости, которая задерживается в бактериологической петле. Когда используют микроорганизмы, которые выросли на поверхности среды, осторожно плавным движением набирают небольшое количество их, следя, чтобы не повредить питательную среду. Петлю медленно вынимают из пробирки, не касаясь ее стенок, и переносят в ч. Петри
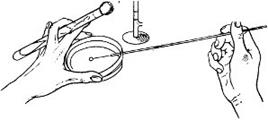

Посев петлей
После этого петлю стерилизуют в пламени, чтобы уничтожить избыток материала.
Метод штриховых посевов сегодня используется в микробиологических лабораториях чаще всего. Материал, который содержит микроорганизмы, набирают бактериологической петлей и наносят на поверхность питательной среды возле края чашки (снимают избыток материала). Проводят посев параллельными штрихами от края к краю чашки.
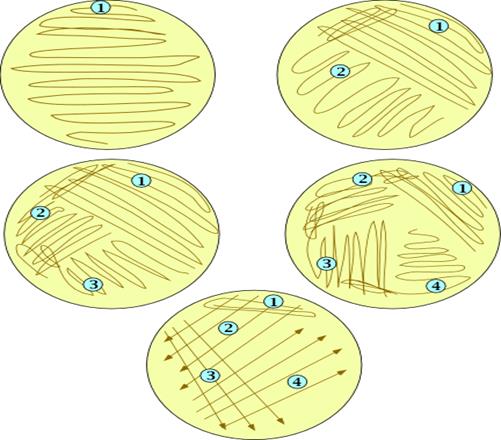
Метод поверхностных штрихов.
Спустя сутки инкубации посевов при оптимальной температуре на поверхности чашки вырастают изолированные колонии микробов.

Метод штрихов
Для получения изолированных колоний можно использовать тампон, которым проводили забор исследуемого материала. Несколько приоткрывают чашку Петри с питательной средой, вносят туда тампон и осторожными движениями втирают материал в поверхность чашки, вращая постепенно тампон и чашку.
Посев шпателем и тампоном в чашки Петри. Материал предварительно наносят на поверхность питательной среды возле края чашки петлей или пипеткой. Стерильный шпатель проносят через пламя, охлаждают, касаясь стенки чашки. Осторожными круговыми движениями, держа чашку полузакрытой, распределяют материал равномерно по поверхности среды.

Посев шпателем
При посеве тампоном чашку открывают одной рукой, тампоном касаются поверхности агара возле края чашки и начинают проводить штрихами от края к краю чашки, втирая осторожно материал в поверхность среды, не повреждая его, постепенно вращая тампон. После проведения посева чашку вращают на 90° и повторяют перпендикулярно к предыдущему.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.003)

Свойства микроорганизмов, учитываемые при выделении культуры
Принципы биологического разъединения бактерий подразумевают учет особенностей жизнедеятельности микробов с целью выбрать наиболее оптимальные методы исследования. Выбранные методы должны соответствовать возбудителю по определенным параметрам.
- Тип дыхания. Среди бактерий выделяют группы аэробных и анаэробных представителей. Для получения анаэробных микробов материал для исследования прогревают. Следующий этап – культивирование микроба в анаэробных условиях. Методики получения аэробных и анаэробных бактерий различны.
- Спорообразование. Способность некоторых бактерий к спорообразованию обеспечивает защиту и сохранность микроорганизмов.
- Устойчивость бактерий к агрессивному воздействию щелочей и кислот. Устойчивость некоторых видов бактерий к данным веществам обеспечивает максимальное очищение исследуемого материала от примеси других бактерий с применением растворов щелочи либо кислоты.
- Подвижность бактериальных организмов. Для отделения чистой культуры подвижных микроорганизмов используются методы отделения культур микробов в капле конденсата.
- Чувствительность микроорганизмов к антибиотикам, некоторым химическим веществам и другим антимикробным средствам. Для некоторых возбудителей наиболее предпочтительны методы выделения культур с применением селективных (специфических) питательных сред.
- Антибиотики. Очищают материал от дополнительных микроорганизмов.
- Способность бактерий проникать сквозь неповрежденные кожные покровы. Это свойство присуще некоторым разновидностям, которые обладают факторами агрессии.
- Чувствительность животных к некоторым болезням инфекционного генеза.
Особенности бактериального посева мочи
Анализ, подразумевающий бактериальный посев мочи, предназначается для выявления, идентификации различных микроорганизмов, а также позволяет определить точную их концентрацию. Чтобы провести данную процедуру, мочу, которая является в данном случае основным биоматериалом, помещают в специальную среду питания, которая окажется для нее максимально благоприятной. Если после этого микроорганизмы не начнут расти, результат анализа является отрицательным.
Если же после проведения такого анализа концентрация микроорганизмов в моче окажется достаточно высокой для их размножения, то его результат, бесспорно, положителен.

Методики проведения оценки возбудителя
Для получения чистых культур бактериальных клеток применяется ряд методов. Каждый из них применяется в той или иной ситуации и имеет последовательные четкие этапы получения колоний возбудителя заболевания. Рассмотрим наиболее популярные.
Методика Пастера
Представляет собой разведение чистых культур в среде для бактериального роста (жидкой консистенции) до получения концентрации с 1 клеткой на объем жидкости. Данный метод выделения имеет важнейшее историческое значение.
Методика Коха
Посевы обычно проводят с 3-4 последних разведений, так как бактерий там уже мало. Таким образом, при росте микробов на питательной среде проявляются обособленные колонии микроорганизмов, которые рождаются из единственной материнской клетки. Затем из глубины агара можно выбрать изолированную колонию, и пересеять ее на свежую питательную среду. Следующий этап – идентификация и выделение возбудителя.
Методика Шукевича
Методика Дригальского
Способ Дригальского довольно широко используется в исследовании биологического материала путем разведения культур в пробирке с бульоном либо с физиологическим раствором.

Следующий этап: одну каплю полученного раствора при помощи стерильного шпателя из стекла распределяют равномерно по поверхности среды питания в 1-ой чашке. Потом, не прожигая шпатель на огне, делают им же посев на 2-ой и 3-ей чаше. Суть метода Дригальского заключается в том, что с каждым последующим посевом культур концентрация бактерий (аэробов) все меньше. На 3-ей чашке они распределяются довольно обособленно, каждая бактериальная клетка при этом дает клональные клетки (в виде изолированной колонии). Их пересевают на скошенный агар для накопления возбудителей.
Методика Вейнберга
Определенные затруднения вызывает выделение чистых культур анаэробных возбудителей, если микроорганизмы не гибнут при контакте с кислородными молекулами. Суть методики заключается в выведении анаэробных микробов (в составе материала) в слегка остывшей (45-50°С) расплавленной среде питания (агарозированной). Проводят 6-10 разведений. Затем идет следующий этап: необходимо быстро охладить состав в пробирке и залить ее поверхность смесью из масла вазелина и парафина, что препятствует проникновению воздуха и способствует развитию анаэробных условий.
При благоприятном посеве прорастают изолированные колонии на второй день, которые можно извлечь из пробирки путем ее нагревания при помощи горелки. Из разрезанного агарового столбика петлей набирают культуры для дальнейшего исследования. Полученные колонии размещают в жидкую питательную среду, на чем этапы выделения колонии анаэробных возбудителей можно завершить.
Методика Хангейта
Ее часто применяют для выделения аэробных микробов, обладающих высокой кислородочувствительностью. В проведении такого выделения культуры аэробов применяется методика вращения пробирок.
Методы засевания аэробных бактерий предполагают выведение их на агаризированной расплавленной среде. Наличие инертного газа в пробирке дает возможность вырастить изолированные колонны аэробных бактерий таким образом, что выделенные культуры аэробов хорошо можно увидеть даже невооруженным глазом на 2-3 день.
Микроманипулятор
Это методика выделения отдельных бактериальных клеток путем применения микроманипулятора. Микроманипулятор представляет собой специальный прибор, которым можно выловить из суспензии одну клетку, а также обеспечить возможность посева культуры в пробирку.
Дальнейшая идентификация возбудителя проводится с учетом всех перечисленных свойств возбудителя (аэробов и анаэробов), а также особенностей их взаимодействия с различными веществами.
Метод Дригальского: этапы выделения чистой культуры и ее идентификации
Методы выделения чистых культур аэробных бактерий
Механического разобщения Биологические
Метод Пастера Метод Коха Биологический Физический
(имеет историческое (пластинчатых
значение) разводок) Химический Метод Щукевича
Посев петлей Посев шпателем
Методы выделения чистых культур (схема 11):
Методы механического разобщения основаны на разъединении микробов путем последовательного растирания исследуемого материала по поверхности агара.
а) Метод Пастера – имеет историческое значение, предусматривает последовательное разведение исследуемого материала в жидкой питательной среде методом переката
б) Метод Коха – метод пластинчатых разводок – основан на последовательном разведении исследуемого материала мясо-пептонным агаром с последующей разливкой пробирок с разведенным материалом в чашки Петри
в) Метод Дригальского – при посеве материала, обильно обсемененного микрофлорой, используют 2–3 чашки для последовательного посева шпателем.
г) Посев петлей параллельными штрихами.
Биологические методы основаны на биологических свойствах возбудителей.
а) Биологический – заражение высокочувствительных животных, где микробы быстро размножаются и накапливаются.
В одних случаях, этот метод является единственным, позволяющим выделить культуру возбудителя от больного человека (например, при туляремии),в других случаях – он более чувствителен (например, выделение пневмококка на белых мышах или возбудителя туберкулеза на морских свинках).
б) Химический – основан на кислотоустойчивости микобактерий. Для освобождения материала от сопутствующей флоры, его обрабатывают раствором кислоты.
Вырастут только туберкулезные палочки, так как кислотоподатливые микробы погибли под действием кислоты.
в) Физический метод основан на устойчивости спор к нагреванию. Для выделения культуры спорообразующих бактерий из смеси материал прогревают при 80°С и засевают на питательную среду. Вырастут только споровые бактерии, так как споры их остались живыми и дали рост.
г) Метод Щукевича – основан на высокой подвижности вульгарного протея, способного давать ползучий рост.
Методика пересева из колоний на скошенный агар и МПБ:
а) Пересев из колоний на скошенный агар
Приоткрывают крышку чашки, прокаленной остуженной петлей снимают часть отдельной колонии, открывают пробирку со стерильным скошенным агаром, держа ее в левой руке в наклонном положении, так, чтобы можно было наблюдать поверхность среды.
Переносят петлю с культурой в пробирку, не прикасаясь к стенкам, растирают по питательной среде, скользя по поверхности от одного края пробирки к другому, поднимая штрихи до верхушки среды – посев штрихом. Пробирку закрывают и, не выпуская из рук, подписывают название посеянного микроба и дату посева.
б) Пересев из колонии на мясо-пептонный бульон
Техника пересева на МПБ в основном такая же, как и при посеве на плотную среду.
При посеве на МПБ петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый стерильной пастеровской или градуированной пипеткой, вливают в питательную среду.
В результате самостоятельной работы студент должен знать:
Методы выделения чистой культуры микроорганизмов
2. Методы культивирования микроорганизмов
1. Навыки соблюдения правил противоэпидемического режима и техники безопасности
Обеззараживать материал, проводить обработку рук
3. Приготовить препараты из колоний бактерий
4. Микроскопировать колоний
5. Окрашивать по Граму микроорганизмы
Методы выделения чистых культур (продолжение). Ферментативная активность бактерий и методы ее изучения.
Коварная кишечная палочка
Наглядным примером использования бактериальных культур в медицине может стать кишечная палочка. С одной стороны, микроорганизмы группы кишечной палочки постоянно присутствуют в организме человека и животных, т.е. являются частью нормальной микрофлоры кишечника. С другой стороны, некоторые штаммы могут не только представлять опасность для здоровья, но и привести к смертельному исходу у людей с ослабленным иммунитетом (старики, маленькие дети).

- тяжелых пищевых отравлений;
- диареи;
- перитонита (при попадании в брюшную полость через разрыв в кишечнике);
- бактериального простатита;
- менингита у новорожденных и т.д.
Важной задачей является определение типа кишечной палочки и количества этих бактерий в организме человека. Для этого берутся анализы мочи, кала, мазок из влагалища, гноя, рвотных масс
Кроме того, микробиология научилась использовать свойства кишечной палочки для определения загрязнения окружающей среды. Дело в том, что кишечная палочка выводится из организма человека и животных вместе с фекальными массами. В случае попадания стоков в водоемы есть риск появления патогенных бактерий в обычной водопроводной воде, что может привести к серьезным эпидемиям.

Бактериальные культуры: чистые против смешанных
В микробиологии культурой бактерий называют популяцию микроорганизмов, растущую на питательной среде, которая используется в научных и медицинских целях. Различают:

Чистая культура используется:
- в научных исследованиях;
- при диагностике инфекционных заболеваний;
- как исходный материал для производства вакцин, ферментов, антибиотиков, витаминов, гормонов и др.;
- в промышленном производстве (молочнокислые закваски, пивные и обычные дрожжи и т.д.).
Несмотря на то что выведение чистых культур стало мощным толчком в развитии микробиологии (и до сих пор является ее основным инструментом), смешанные культуры дают более полную картину окружающего мира, так как в природе скопления бактерий одного и того же вида обязательно контактируют с различными микроорганизмами, находящимися по соседству
Особую важность определение смешанной культуры приобретает в медицине, при исследовании взаимодействия различных инфекций с микрофлорой организма

То есть определение заболевания основано на выведении чистых культур, а для полного изучения болезни в развитии необходимо исследовать смешанные культуры.
Читайте также:

