При посеве бактерий в глубь среды образуются колонии поверхностные глубинные донные
Обновлено: 07.07.2024
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы культивирования микроорганизмов
Food products.
Methods for cultivation of microorganisms
Дата введения 1993-01-01
1. РАЗРАБОТАН И ВНЕСЕН Всесоюзным научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП)
Техническим комитетом по стандартизации 93 "Продукты переработки плодов и овощей"
В.И.Рогачев, д-р техн. наук; Б.И.Голод, канд. биолог. наук
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Комитета стандартизации и метрологии СССР от 25.12.91 N 2117
3. Срок проверки - 1997 г., периодичность проверки - 5 лет
5. Взамен ГОСТ 26670-85
6. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Настоящий стандарт распространяется на пищевые продукты и устанавливает методы культивирования для выявления присутствия (отсутствия) или определения количества микроорганизмов соответствующих групп, семейств, родов или видов.
Методы основаны на посеве продукта, разведении навески продукта или осажденных на мембранном фильтре клеток микроорганизмов в питательные среды, с последующим культивированием посевов в условиях, благоприятных для роста микроорганизмов.
Требования стандарта являются обязательными.
1. МЕТОДЫ ОТБОРА И ПОДГОТОВКИ ПРОБ
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669.
2. АППАРАТУРА И ПИТАТЕЛЬНЫЕ СРЕДЫ
Аппаратура и питательные среды по нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
3. ПОДГОТОВКА К АНАЛИЗУ
3.1. Степень разведения навески продукта
3.1.1. Степень разведения навески продукта для посева на плотные среды выбирают так, чтобы общее количество колоний, выросших на чашке Петри, колебалось в пределах 15-300; количество колоний специфических групп бактерий (например, колиформных) - 15-150; плесеней 5-50.
3.1.2. Степень разведения навески продукта для посева в жидкие среды выбирают так, чтобы хотя бы в одной пробирке наибольшего разведения отсутствовали микроорганизмы.
3.1.3. Количество продукта, которое необходимо профильтровать для получения изолированных колоний на фильтре, должно быть указано в нормативно-технической документации на методы анализа соответствующих групп, семейств, родов или видов микроорганизмов.
3.2. Объем навески продукта или его разведения для посева
3.2.1. При посеве глубинным методом 1 см жидкого продукта или разведения навески продукта смешивают с расплавленной питательной средой.
3.2.2. При посеве поверхностным методом 0,1 или 0,2 см жидкого продукта или разведения навески продукта вносят на поверхность плотной среды.
3.2.3. Для выявления присутствия (отсутствия) микроорганизмов и определения их таксономических свойств в жидкие среды вносят до 50 г (см) продукта; при определении количества микроорганизмов в жидкие среды вносят до 100 см жидкого продукта или разведения навески.
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Глубинный метод посева в плотные среды
4.1.1. Жидкий продукт или разведение навески вносят параллельно в две чашки Петри и заливают не позднее чем через 15 мин расплавленной и охлажденной до температуры (45±1) °С питательной средой. Высота слоя питательной среды должна быть 4-5 мм.
4.1.2. Среду немедленно равномерно перемешивают с посевным материалом круговыми движениями чашки так, чтобы среда не вытекла из чашки и не загрязняла крышку. После застывания среды чашки с посевами вверх дном помещают в термостат.
4.2. Поверхностный метод посева на плотные среды
4.2.2. На подсушенную среду наносят жидкий продукт или разведение навески и немедленно равномерно растирают по поверхности шпателем - изогнутой стеклянной палочкой.
4.2.3. Засеянную поверхность подсушивают, выдерживая чашки в горизонтальном положении в течение 15 мин.
4.3. Метод посева в жидкие среды
4.3.1. В колбу или пробирки с питательной средой вносят навеску продукта или разведение навески.
4.3.2. При определении наиболее вероятного числа (НВЧ) микроорганизмов из навески продукта готовят исходное и ряд десятикратных разведений до такой степени, чтобы можно было определить предполагаемое НВЧ микроорганизмов.
Самое низкое разведение и высеваемые объемы его инокулума выбирают в зависимости от предполагаемого количества микроорганизмов и чувствительности метода следующим образом:
по 1 см из разведения 10 и высших разведений, если надо определить количество микроорганизмов, превышающее 3 клетки в 1,0 г (см) продукта;
по 10 см из разведения 10 или 1 см неразведенного продукта и по 1 см из разведения 10 и более высокого разведения, если надо определить количество микроорганизмов, превышающее 3 клетки в 10,0 г (см) продукта;
по 10 и 1 смнеразведенного продукта и ряда его разведений, если надо определить количество микроорганизмов, превышающее 3 клетки в 100 см прод
4.3.3. Все разведения и неразведенный продукт высевают параллельно в три пробирки с питательной средой. Инокулум объемом 1 см высевают в 10 см среды нормальной концентрации, инокулумы объемом 10 см - в 10 см среды двойной концентрации.
4.4. Метод мембранных фильтров
Метод мембранных фильтров применяют для анализа легко фильтруемых жидких продуктов или продуктов, дающих растворы с высоким осмотическим давлением.
4.4.1. Подготовка фильтров
4.4.1.1. При работе с мембранными фильтрами следует соблюдать следующие условия:
выбирают фильтры, размеры пор которых позволяют осадить на нем основное количество микроорганизмов определенных видов или групп; для улавливания бактерий применяют фильтры со средним диаметром пор 0,3 мкм;
визуально контролируют отсутствие механических повреждений фильтров, и во избежание повреждений фильтры берут пинцетом, не имеющим рубчиков;
фильтры хранят в сухом состоянии;
перед использованием фильтры освобождают от остатков растворителей, пузырьков воздуха и загрязнений кипячением по ГОСТ 18963 в дистиллированной воде;
для фильтрации жидкостей применяют аппарат Зейтца, прибор Гробара и другие установки;
части установки для фильтрации, соприкасающиеся с фильтруемым раствором, стерилизуют или кипятят;
стерильный влажный фильтр осторожно помещают блестящей стороной вверх на подкладку из пористого материала или сетку фильтрующей аппаратуры.
Мембранные фильтры не применимы для фильтрации суспензий или гомогенатов продуктов, загрязняющих при фильтрации поры фильтров.
4.4.2. Проведение фильтрации
4.4.2.1. Для фильтрации раствора с высоким осмотическим давлением раствор предварительно разводят дистиллированной или пептонной водой в соотношении, позволяющем легко профильтровать разведенные растворы.
Жидкий продукт, содержащий небольшое число взвешенных частиц, фильтруют в два этапа. Для освобождения от взвешенных частиц его фильтруют через фильтр со средним диаметром пор 4 мкм, а затем - через фильтр, диаметр и размеры пор которого выбраны в соответствии с группой или видом выявляемых микроорганизмов. Оба фильтра культивируют в аналогичных условиях.
После осаждения микроорганизмов на фильтре из растворов с высоким осмотическим давлением или из растворов, содержащих антимикробные вещества, его промывают дистиллированной водой или пептонно-солевым раствором.
4.4.2.2. Фильтрацию заканчивают в момент исчезновения влаги на поверхности фильтра. Немедленно после окончания фильтрации фильтр переносят на плотные или в жидкие питательные среды. На плотную среду фильтр накладывают нижней стороной так, чтобы она полностью соприкасалась с поверхностью среды.
4.5. Посевы термостатируют в благоприятных для роста микроорганизмов условиях, указанных в нормативно-технической документации, устанавливающей методы анализа соответствующей группы, семейства, рода или вида микроорганизмов.
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. Подсчет микроорганизмов на плотных средах
5.1.1. В посевах на плотных питательных средах, полученных глубинным, поверхностным методами или методом мембранных фильтров:
для подсчета общего числа жизнеспособных микроорганизмов учитывают все выросшие колонии;
для подсчета количества микроорганизмов определенных таксономических групп на селективных средах учитывают колонии, характерные по морфологии для выявляемой группы;
для подсчета количества определенных групп или видов микроорганизмов на селективно-диагностических или диагностических средах учитывают колонии характерной морфологии, показавшие характерную цветную реакцию с присутствующим в среде индикатором.
Колонии подсчитывают невооруженным глазом или с помощью линзы с шестикратным увеличением, или с помощью специально предназначенного для подсчета колоний прибора.
5.2. Выявление и подсчет микроорганизмов в жидких средах
5.2.1. Живые микроорганизмы в жидких средах выявляют по помутнению среды, появлению осадка, пленки, газообразованию или по наличию роста микроорганизмов в пересевах на плотных питательных средах.
Микроорганизмы определенных физиологических или таксономических групп выявляют по изменению цвета индикаторов, образованию газа из определенных веществ и по другим признакам, специфическим для метаболизма выявляемой группы или видов микроорганизмов.
Посев бактерий. Посев бактерий на плотные питательные среды. Получение изолированных колоний бактерий. Температура культивирования бактерий.
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.).
Для выделения прихотливых видов бактерий в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также поглотители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
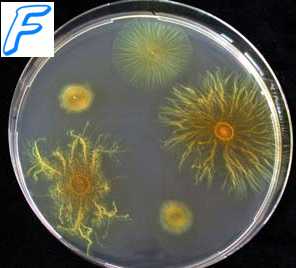
Получение изолированных колоний бактерий
Исключение составляет техника посева при бактериологическом исследовании мочи (техника штрихового засева показана на рис. 11-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.
Температура культивирования бактерий
Патогенные бактерии вариабельны в отношении температур, оптимальных для их роста, но большинство из них неплохо развивается при 35-37 °С. Исключение составляют некоторые атипичные микобактерии, возбудитель чумы, листерии и лептоспиры (температурный оптимум 20-30 °С), а также Campylobacter jejuni (температурный оптимум 42 °С).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Описывая разновидности бактерий, ученые указывают их морфологические, биохимические, культуральные и серологические свойства.
- Морфология бактериальных клеток изучается при исследовании мазков или висячих капель под микроскопом. Она обычно не позволяет однозначно идентифицировать вид бактерий, только их морфологические признаки – размер, окраску по Граму, наличие капсулы, спор, ворсинок и жгутиков, геометрическую форму. В зависимости от того, какие свойства описывает морфология, она может быть микро- или макро-морфологией. Первая занимается описанием клеток, вторая – описанием внешнего вида колоний.
- Культуральные свойства. К культуральным свойствам относятся внешний вид и форма колоний (это называется морфологией колоний), способ роста на плотной и жидкой питательной среде, требования к ее составу, характеризующие потребность бактериальных колоний в субстратах и витаминах, аэробных или анаэробных условиях.
- Биохимические свойства бактерий. Это ферментативные особенности (способность превращать одни вещества в другие при помощи характерных для данного представителя ферментов), а также их состав с точки зрения присутствия уникальных для конкретного вида или группы веществ.
- Серологические свойства. Изучение их позволяет поставить окончательную точку в определении видовой и штаммовой принадлежности колонии. Применяемые для серологической идентификации методы позволяют обнаружить характерные поверхностные антигены и по ним классифицировать бактериальную культуру.

Культуральные характеристики
Культуральную характеристику роста бактериальных колоний на питательной среде дают после их визуального осмотра. Они могут иметь массу морфологических и культуральных различий, кроме того, способны меняться с течением времени. Молодые и старые колонии бактерий всегда описывают по культуральным свойствам отдельно:
- Форма. Бактериальные колонии по этой культуральной характеристике могут быть плоскими, округлыми, ризоидными (напоминать переплетение корней) или гирозными, напоминающими по форме головной мозг, иметь ровные, хорошо очерченные или рваные края.
- Размер. Важная характеристика морфологии колоний. Различают мелкие колонии диаметром 1-3 мм, средние размером от 2 до 4 мм и крупные, размер которых составляет 4 мм и более.
- Пропускание света. Бывают просвечивающие, или прозрачные, и непрозрачные бактериальные колонии.
- Поверхность. Может быть шероховатой или гладкой, морщинистой, блестящей, влажной, тусклой, слизистой или сухой.
- Структура. При изучении под микроскопом можно увидеть колонии различной морфологии – однородные, нитевидные или зернистые. Методы определения – микроскопия или исследование при помощи лупы.
- Цвет. Эта культуральная характеристика выявляется при наличии в бактериальных клетках пигментов. Цвет колоний иногда является видовым признаком и входит в название. Например, золотистый стафилококк, цианобактерии, пурпурные бактерии, синегнойная палочка и другие получили свои названия из-за характерной окраски их колоний, выращенных на питательной среде. Иногда пигменты бактерий выделяются в субстрат и окрашивают ее.
- Консистенция. Определяется при непосредственном контакте с колонией специального инструмента. Различают слизистые, мягкие, плотные и врастающие в агар.
- Профиль колонии может быть выпуклым или плоским, кратерообразным или конусовидным.
- Степень погружения в среду. Большинство колоний живут на поверхности субстрата. Однако существуют также глубинные, в виде чечевичек, погруженных в толщу среды, и донные бактерии, образующие пленки на дне сосудов с питательной средой.
- Люминесценция. Известны также несколько видов аэробных бактерий, способные к фосфоресценции (люминесценции). Их колонии способны до суток светиться желтоватым или зеленоватым цветом. Фотобактерии – жители различных водоемов, встречаются на чешуе и мясе рыбы. Их морфология может быть различной – среди светящихся видов встречаются кокки, вибрионы, палочки.
- В жидком субстрате морфология бактериальных колоний характеризуется образованием равномерной мути, пленки или осадка. В полужидких при посеве уколами подвижные бактерии вызывают помутнение в толще среды вокруг места посева, а неподвижные – только в самом месте укола. Некоторые бактерии в аэробных и анаэробных условиях выделяют различные газы (индол, скатол, меркаптан, сероводород, масляная кислота, диэтиловый эфир и тому подобное).

Для чего используют колонии
Обычно они используются для получения чистых культур. Чистая культура – это популяция микроорганизмов одного вида, выращенная с использованием благоприятной среды. Много видов микроорганизмов различают по какому-то специфическому признаку. Их объединяют по разным критериям на биовары (то есть биологические варианты). На фото, сделанном с применением электронного микроскопа, возможно определение многих видов микробов:
- Хемовары – это варианты, которые различаются по биохимическим особенностям.
- Серовары – их отличают по генетическому признаку.
- Фаговары отличаются по чувствительности к фагам.
Все разновидности таких микроорганизмов можно рассмотреть на фото.
Общие критерии для определения колоний
Современная микробиология использует такие общие критерии для определения той или иной бактериальной совокупности, оценки ее структуры:
- Величина. Крупные культуры могут иметь величину 6 мм и более, а мелкие – меньше, чем 1 мм.
- Форма. Как правило, различают правильную, то есть круглую, форму, эллипсоидную, розеточную, ризоидную.
- Окраска. Разные их виды могут быть белыми либо иметь всевозможную окраску.
- Прозрачность.
- Рельефность. Различают плоские, плосковыпуклые, куполообразные с возвышенной серединкой, с вдавлением формы.
- Поверхность. Она может быть гладкой, с морщинками, сухой, слизистой, хрупкой, мучнистой.
По всем этим признакам все совокупности микроорганизмов подлежат всестороннему исследованию. Такие признаки хорошо видны на фото, которые сделаны с использованием электронного микроскопа и других приборов.
Изучение микрофлоры молока
Определение бактерий имеет значение в практической деятельности человека, например, в пищевой промышленности. Так, бактериальная обсемененность молока является основным показателем санитарных условий его получения. В случае превышения порогового количества микроорганизмов в молоке, сортность продукта снижается.
С 1987 г. страны ЕЭС приняли единые стандарты по степени бактериальной обсемененности молока, подразделяя продукт на три категории:
- А – 20 тыс./мл;
- В – 100 тыс./мл;
- С – свыше 100 тыс./мл.

В данном случае числа указывают на максимально возможное количество микроорганизмов в 1 мл молока (обсемененность).
Наличие в молоке соматических клеток является важным критерием качества. Эти клетки являются частичками биомассы животного. Они образуются в вымени и отражают естественные процессы старения и обновления организма.
Число соматических клеток в молоке возрастает при наличии у животных травм, заболеваний ЖКТ или других патологий, что приводит к росту показателя бактериальной обсемененности молока.
Как получают культуры
В любой микробиологической лаборатории проводится выделение культур микробов. Их необходимо иметь для правильного определения возбудителя инфекционного заболевания больного и выбрать соответствующее лечение. Врачи должны правильно определить название возбудителей, вызвавших болезнь. Без колоний от бактерий сделать это очень трудно, а иногда и невозможно.
Получить нужный штамм микробов можно при помощи посевов. Их обычно делают на жидкие питательные составы. Посев лучше всего делать в чашке Петри. Чашка Петри – это прозрачная стеклянная посуда в виде цилиндра невысокого размера. Он закрывается крышкой таких же размеров. Чашка Петри широко используется в микробиологии. Микроорганизмы, получаемые в таких сосудах, хорошо видны на фото. В чашку Петри добавляют питательное вещество и опускают биоматериал.

В чашке Петри можно также производить посев на плотную среду. В таком случае биологический материал размещают возле ее краев.
Как происходит посев в чашке Петри
Очень осторожно биоматериал распределяется по всей поверхности чашки
В чашке Петри возможен также посев при помощи укола в толщу питательного состава. При этом получается чистая совокупность микробов, и это хорошо видно на фото, сделанном с использованием микроскопа.
В прибор для получения колоний от бактерий можно также производить посев в толщу питательного раствора.
Другие способы получения бактериальных колоний
Возможно разведение колоний микробов по Коху. При этом материал, необходимый для определения, последовательно разводят (как правило, счет разведений доходит до четырех). На последнем этапе размножения в приборе, используемом для инкубации бактерий, появляются изолированные группы микробов, хорошо заметные на фото. Все такие колонии происходят из материнской клетки.

Подобная форма получения штаммов используется тогда, когда материал, подготовленный для определения, разводится в пробирке при помощи стерильного питательного бульона. Одна капля материала вносится в первую по счету чашку. Ее распределяют по всему сосуду. Далее по нему проводят стерильным шпателем, и в такой же форме делается посев во второй чашке. Эта форма существования колоний микроорганизмов позволяет получить самые чистые их штаммы, хорошо заметные на фото.
Выделение колоний в специальных приборах
Иногда для получения чистых совокупностей бактерий применяют специальные приборы. Они облегчают определение анаэробных бактерий. В таких приборах можно создать все необходимые условия для их развития.
Виды сред для выращивания бактерий
Методы выращивания бактерий с целью выявления их культуральных свойств часто требуют применения субстратов различной плотности. Различают жидкие, полужидкие и плотные питательные среды:
- Жидкие. Готовятся на основе растворов или гидролизатов.
- Полужидкие. Требуют обязательного добавления веществ-уплотнителей в относительно небольшой концентрации. Так, агар-агар (малайское желе) в них добавляют в концентрации от 0,3 до 0,7%.
- Плотные. Содержат большое количество веществ-уплотнителей. Чаще всего это агар-агар в концентрации от 1,5 до 3%, реже – желатин в концентрации от 10 до 20%. Последний уплотнитель применяется относительно редко, так как плавится при температуре гораздо меньшей чем нормальная температура культивирования.
В зависимости от состава их делят на среды с определенным составом или синтетические, приготовленные в промышленных или лабораторных условиях из известных компонентов и те, состав которых не может быть определен точно – это растительные и животные природные субстраты (например, картофель, морковь, молоко или экстракты, полученные из них).

С точки зрения целей использования различают общие (общеупотребительные), селективные, обогащенные, специальные и дифференциально-диагностические среды:
- Общие. Применяются для культивирования неприхотливых культур. Это например, мясная вода, перевар Хоттингера или мясо-пептонный бульон, гидролизаты кормовых дрожжей или кильки и плотные среды, полученные при добавлении к данным бульонам агара.
- Обогащенные. Содержат добавки – кровь, ее сыворотку, специально подобранные углеводы.
- Специальные. Подобранные по составу для конкретного вида бактерий. Например, для возбудителя туляремии используется среда Мак-Коя с добавлением специально подготовленных яиц, а для лептоспир – среда Терских на основе фосфатов.
- Селективные (еще их называют элективными) – предназначены для отбора из смешанной популяции бактерий одного вида. Такие субстраты могут содержать компоненты, усиливающие рост искомого микроорганизма либо подавляющие рост остальной микрофлоры. Например, молочно-солевой агар, предназначенный для отбора стафилококков или среды Шустова, Раппопорт и Мюллера для выращивания сальмонелл.
- Дифференциально-диагностические позволяют определять наличие различных ферментов у бактерий. Могут быть различной консистенции. Наиболее известны среды Гисса, Левина, Эндо, содержащие различные субстраты для бактериальных ферментов – лактозу, галактозу, тиосульфат натрия и цветные индикаторы.
Кипячение субстратов позволяет удалить из них кислород. Часто применяется метод выращивания анаэробов в толще питательных сред, что необходимо для выявления культуральных свойств бактерий.

3. Михеев П.В. Санитарно-микробиологическое состояние почв береговой полосы водоемов в местах рекреации // Международный журнал прикладных и фундаментальных исследований. 2018. № 12–2. С. 59–64.
4. Михеев В.П., Михеева И.В., Михеев П.В. Некоторые биоэкологические особенности водных объектов с разными формами рыбного хозяйства // Вопросы рыболовства. 2014. Т. 15. № 1. С. 66–83.
5. Михеев П.В., Намсараев Б.Б., Борзенков И.А., Горленко В.М. Метаногенез в рыбоводных прудах и его роль в деструкции органического вещества // Микробиология. 1994. Т. 63. № 1. С. 172–174.
6. Нечаева И.А., Акатова Е.В. Оценка микроaбного состояния рек Тульской области // Известия Тульского государственного университета. Естественные науки. Биология. 2014. Вып. 2. С. 270–281.
9. Дзюбан А.Н. Функционирование микробных сообществ донных отложений водоемов как фактор формирования качества водной среды // Вода: химия и экология. 2013. № 6. С. 57–62.
Изучение микроорганизмов и геохимических процессов их деятельности в пресноводных водоемах дало обширные знания об участии донных осадков в функционировании водной экосистемы [1]. Для исследования численности микроорганизмов и потоков веществ (в первую очередь – круговорот органического вещества) в пресноводных системах использовали различные методы микроскопических исследований, в том числе на стеклах обрастания и пелоскопах, на селективных питательных средах с идентификацией колоний микроорганизмов, методы оценки ферментативной активности. Применяли современные методы радиоизотопных, молекулярно-биологических исследований, изучали химические продукты метаболизма бактерий. Донные осадки уже не рассматриваются как инертное образование или депо химических элементов, так как существует непрерывный обмен веществ между ними и водной толщей.
Существует принципиальное отличие по распределению микроорганизмов в донных осадках озер, рек, водохранилищ в сравнении с почвами, окружающими эти водоемы. Критическими областями в почвенном профиле являются подстилка и область опада, затем – аэрируемый слой почвы с развитой корневой системой растений, и области ниже уровня почвенных вод [2]. Основными группами микроорганизмов, участвующих в разложении остатков растений, являются эукариотные мицелиальные организмы, аэробные и анаэробные бактерии. Отличительной особенностью иловых отложений является тонкая стратификация физико-химических условий в верхних слоях, граничащих с водной толщей. Доступность кислорода в современных осадках ограничивается слоем в несколько миллиметров или несколько сантиметров в речных песках. В поверхностных слоях иловых осадков преобладают аэробные бактерии, прикрепленные к субстрату, или обладающие скользящим движением. Ниже находятся экологические ниши денитрифицирующих бактерий, Mn- и Fe-редукторов, сульфатредукторов и метаногенов.
Представляется значимой роль донных осадков в самоочищении водной среды небольших мелководных водоемов, подвергающихся интенсивному эвтрофированию вследствие загрязнения ливневыми, хозяйственно-бытовыми водами и стоками с полей. Особенно важно изучение микробиологических процессов в осадках для рекреационных водоемов, используемых как место отдыха на воде (лодочный, байдарочный, парусный спорт, туризм и прогулки) и на берегах с купанием в них или без него.
Учет бактерий в донных осадках позволит не только спрогнозировать экологическое состояние водоема, но также оценить его санитарное состояние и возможный риск здоровью населению. В настоящее время отсутствуют санитарно-микробиологические нормативы для донных осадков поверхностных водоемов питьевого назначения, а также для донных осадков водоемов в местах массового отдыха населения.
Цель исследования: дать микробиологическую характеристику донных осадков небольших водохранилищ, прудов, рек, находящихся в условиях антропогенного загрязнения. Оценить роль донного микробного сообщества в формировании качества водной среды с санитарных и экологических позиций.
Материалы и методы исследования
Объектом исследований являлись донные, в основном песчаные осадки мелководий небольших водохранилищ, прудов и рек, используемых населением для купания, рыбной ловли и отдыха. Отбор проб проводили в летний период в 2015–2019 гг. в Московской, Курской и Белгородской областях.
Точечные пробы поверхностного (0–5 см) слоя осадков отбирали у берега с глубины 0,5 м, или с лодки специальным пробоотборником с глубины 1,0–1,5 м в стерильные емкости и в охлажденном виде (сумка-холодильник) доставляли в лабораторию. Максимальное время от отбора до проведения анализа составило трое суток для проб донных осадков из Курской и Белгородской областей. Численность быстрорастущих сапрофитных и потенциально патогенных бактерий определяли на питательном агаре при 37 °С в течение суток, численность актиномицетов – на крахмало-аммиачном агаре, численность плесневых грибов – на среде Чапека, численность колиформных бактерий – на среде Эндо, численность E. coli – по характерному росту на хромогенном агаре, образованию кислоты и газа на лактозной среде при 44 °С, численность энтерококков – на агаре с канамицином, эскулином и азидом натрия. Численность патогенных бактерий родов Salmonella, Shigella выявляли в 10 г навеске донного осадка методом обогащения с высевом на висмут сульфит агар и SS – агар с идентификацией до рода. Споры аэробных бактерий и сульфитредуцирующих клостридий (Clostridium perfringens) выявляли из прогретых при 75 °С в течение 20 мин разведений донных осадков. Воду для микробиологического анализа отбирали одновременно с донными осадками из водоисточников, где была возможность быстрой доставки пробы в лабораторию для анализа по показателям ОМЧ и ОКБ/ТКБ.
Результаты исследования и их обсуждение
Количественные показатели численности активно растущих на питательных средах микроорганизмов приведены в таблице.
Несмотря на принципиально иную структуру донных осадков по сравнению с почвами, в них была высока численность споровых аэробных бактерий и актиномицетов. Численность плесневых грибов была низкой (1-8х102 КОЕ/г) по сравнению с почвами береговой полосы, в которых микромицеты отвечают за минерализацию растительного опада [3]. Общая численность сапрофитных и потенциально патогенных бактерий в донных осадках была повышенной в р. Москва и Яуза в черте города, а также в рыбоводном пруду, используемом для купания (без кормления рыбы).
Следует учесть некоторые особенности донных осадков, которые отмечены ранее в наших исследованиях.
Численность микроорганизмов в донных осадков водоемов
Споры Cl. perfrin gens
Диапазон численности, кл./г
Примечание. * – Место отбора проб донных осадков. Не обн. – не обнаружено – означает отсутствие данных: 1. Москва, пруд Путяевский; 2. Московская область, Пяловское водохранилище; 3. Московская область, Жестылевское водохранилище; 4. Московская область, рыбоводный пруд ВНИИПРХ с экстенсивной формой рыбоводства; 5. Губкинский городской округ, пруд Попов Верх; 6. Губкинское водохранилище; 7. Старооскольское водохранилище; 8. Льгов, старица р. Сейм; 9. Река – Москва, Серебряный бор; 10. Река – Яуза, Лосиный остров; 11. Река – Яуза, Москва; 12. Река – Песочная, Железногорск, 13. Река – Чернь, Железногорск; 14. Река – Речица, Железногорск.
В литоральной зоне стоячих мелководных водоемов, в которых свет и растворенный кислород проникают до дна, в толще воды и на поверхности дна в летний период вегетируют фитопланктон, фитобентос и высшая водная растительность. В поверхностном слое донных осадков формируется экранирующая ниша аэробных микроорганизмов, осуществляющих деструкцию аллохтонного и автохтонного органического вещества за счет растворенного в воде кислорода.
Донные отложения рек образуются в результате аллювиального литогенеза, сноса химических элементов в растворенном и взвешенном состоянии с прилегающих территорий, а также в продукционных биологических процессах. Течение воды удерживает в толще мельчайшие минеральные частицы, микроколонии бактерии и водорослей, детрит. Поверхностный слой донных осадков – это одна из нескольких микробиологических ниш рек и других водотоков. Бактериобентос размещается на поверхности и внутри органоминерального комплекса в аэробных, микроаэрофильных и анаэробных условиях.
Строение донных отложений и интенсивность микробиологических процессов были подробно изучены на примере рыбоводных прудов [5]. В поверхностных слоях донных осадков фиксируется высокая численность сапрофитных бактерий – 5–30 млн кл/г сырого ила. Установлено, что наряду с процессами аэробной деструкции, приводящей к снижению уровня растворенного кислорода в воде, в поверхностном 0–2 см слое ила происходили анаэробные процессы сульфат- и сероредукции (при Eh от –10 до + 130 мВ), а в слое ила 6–8 см – процессы метаногенеза и ацетогенеза. С 1 м2 поверхности дна прудов в сутки выделялось от 0,9 до 2,3 л газа, имеющего преимущественно метаново-азотный состав. Пузырьки газа транспортировали со дна в водную толщу микрочастицы ила с ассоциированной микрофлорой.
В экосистеме прудов сестон имел особое значение как экониша, связывающая водную толщу и донные отложения. Основу сестона составляли детрит и минеральные частицы, биомасса живых организмов составляла 6 %, в органическом веществе сестона достигая 50 %. Численность бактерий в осадке сестона была одного порядка с илами прудов. В течение всего сезона в воде прудов преобладали одиночные бактерии, на частицах детрита они составляли 18–52 %, в микроколониях 2–6 %. т.е. в агрегированном состоянии в среднем в прудах находилось примерно 35 % бактерий от количества одиночных клеток и примерно 26 % от общего количества бактерий в воде прудов. Количество микроколоний 4,4–12,2 тыс. шт/мл, количество частиц детрита – от 15,8 до 29,2 тыс. шт/мл, преобладали частицы детрита с числом бактерий более 30 шт./частица. В воде реки Якоть, вытекающей из Жестылевского водохранилища, число частиц детрита составляло 6 тыс. шт/мл, детритные фракции были в основном мелкие с преобладанием до 30 бактерий на частице. Детритные частицы размером 4–5 мкм составляли 17–32 %, 9–10 мкм – 27–44 %, 17–20 мкм – 39–48 % Часто встречались частицы размером около 30 мкм.
Исходя из означенных выше особенностей функционирования микробного сообщества донных осадков, можно предположить, что частицы поверхностного слоя осадков могли попадать в водную толщу в результате процессов эрлифта с пузырьками газа, взмучивания потоком воды в реке, а также механическим взмучиванием осадков купающимися людьми. Водные объекты всегда имели внешний источник фекального загрязнения. Однако могли также проходить процессы вторичного загрязнения водной толщи микроорганизмами из донных осадков. Для рек описаны также противоположные случаи обнаружения значительных количеств колиформных бактерий в донных осадках при практическом отсутствии в воде [6].
Микробиологические требования к составу и свойству воды водных объектов устанавливают по численности общих и термотолерантных колиформных бактерий [7]. Сопоставление численности ОКБ в воде исследованных водоемов и численности колиформных бактерий в донных осадках дало следующие результаты.
Чистые водоемы, пригодные для рекреационного водопользования, а также в черте населенных мест: Жестылевское водохранилище, р. Москва в районе Серебряного бора, рыбоводный пруд. Численность ОКБ в воде этих водоемов значительно ниже 500 КОЕ/100 мл воды, численность колиформных бактерий в илах – до 10 КОЕ/г.
Сильно загрязненный водоток, постоянно подпитываемый ливневыми и хозяйственно-бытовыми водами: р. Яуза в черте г. Мытищи и Москва. Численность ОКБ в воде составляла 8000–10000 КОЕ/100 мл, численность колиформных бактерий в илах – 104 КОЕ/г.
Для оценки эпидемической опасности донных осадков пригодны те же индикаторные бактерии, которые используют для оценки почв [8]. Однако количественные критерии оценки требуют изучения и дальнейшего уточнения.
Колиформные бактерии в высоких количествах присутствовали в донных осадках водоемов, для которых визуально отмечены источники загрязнения. Пруд Попов Верх отличался тем, что на дальнем его берегу была гусиная ферма. Птицы могли подходить к водоему и плавать на ограниченной территории. Река Яуза в верховье в национальном парке заселена чайками и утками, в черте Москвы – принимает в себя огромное количество ливневых стоков. Малые реки в Курской области также загрязнены стоками из сельских населенных пунктов и г. Железногорска.
Сульфитредуцирующие клостридии, среди которых с большой вероятностью присутствует Clostridium perfringens, также позволяют оценить степень загрязненности донных осадков за продолжительный период времени в связи с высокой устойчивостью спор этого анаэробного микроорганизма. Они были выявлены во всех образцах донных осадков в численности от 10 до 104 кл/г сырого ила. По этому показателю наиболее сильно загрязнены старица на р. Сейм, реки Яуза в Национальном парке и Чернь, что не вполне соотносится с другими данными.
Таким образом, в донных осадках нескольких водоемов в разных регионах изучена численность активно делящихся, растущих на питательных средах микроорганизмов, очевидно, принимающих участие в функционировании водной экосистемы. Полученные данные позволяют дать оценку водоемам с санитарно-микробиологических и экологических позиций, которая не всегда совпадает.
Читайте также:

