При выделении mrsa штаммов при посеве на неонатальную инфекцию препаратом выбора будет
Обновлено: 08.07.2024
Эта информация позволит вам узнать, что представляет собой метициллин-резистентный золотистый стафилококк (МРЗС), как он распространяется и как лечатся вызываемые МРЗС инфекции.
Что представляет собой метициллин-резистентный золотистый стафилококк?
Стафилококк (Staphylococcus) — это вид бактерий, обитающих в окружающей среде, в том числе и на поверхности кожи человека. Метициллин-резистентный золотистый стафилококк (МРЗС) — это стойкий к определенным антибиотикам вид стафилококка. Это означает, что некоторые методы лечения не справятся с ним или будут менее эффективными.
МРЗС может вызывать различные заболевания, например:
- инфекции мочеполовой системы (ИМС);
- воспаление легких;
- кровяные инфекции;
- раневые или кожные инфекции.
В чем состоит разница между колонизацией и инфицированием МРЗС?
Человек может быть либо колонизирован, либо инфицирован МРЗС. Колонизация означает наличие бактерий на коже или в организме человека при отсутствии каких-либо симптомов. Инфицирование означает наличие бактерий на коже или в организме, приводящее к появлению симптомов.
Как распространяется МРЗС?
Большинство инфекций, вызываемых МРЗС, распространяется через прямой контакт с физиологическими жидкостями инфицированного человека, такими как кровь, выделения из раны, моча, стул или мокрота (флегма). Также они могут распространяться через контакт с оборудованием или поверхностями, на которых могут находиться эти бактерии. МРЗС не распространяются при простом контакте, например через прикосновение или объятие.
Кто подвержен риску инфицирования МРЗС?
Заразиться инфекцией, вызываемой МРЗС, с большей вероятностью могут лица:
- старшего возраста;
- с ослабленной иммунной системой;
- страдающие хроническими заболеваниями, такими как рак или диабет;
- ранее принимавшие антибиотики;
- недавно перенесшие операцию;
- лежавшие в больнице много раз или длительное время;
- с открытыми ранами или язвами;
- с установленными трубками или дренажами.
Каковы симптомы инфекции МРЗС?
Ваши симптомы будут зависеть от места возникновения инфекции и от типа инфекции.
Каковы методы лечения инфекции, вызываемой МРЗС?
Инфекции, вызываемые МРЗС, лечатся антибиотиками, к которым у вызвавших их бактерий нет устойчивости.
Какие меры по изоляции принимаются в больнице, если у меня обнаружена инфекция, вызываемая МРЗС?
Меры по изоляции - это мероприятия, которые мы проводим, чтобы предотвратить распространение инфекции среди пациентов. Если во время пребывания в больнице у вас диагностировали инфекцию, вызываемую МРЗС, или вы подверглись риску заражения этой инфекцией:
- Вас поместят в отдельную палату.
- На вашей двери повесят табличку с информацией о том, что весь персонал и посетители должны вымыть руки с мылом или протереть их спиртосодержащим антисептиком для рук перед входом и после выхода из вашей палаты.
- Весь персонал и все посетители, входящие в вашу палату, должны надеть желтый халат и перчатки. Они выдаются за пределами вашей палаты и могут быть утилизированы в вашей палате.
- Если вы выходите из палаты для проведения исследований, вам следует надеть желтый халат и перчатки или покрыться чистой простыней.
- Если вы выходите из своей палаты, чтобы прогуляться по отделению, вам следует надеть желтый халат и перчатки.
- Вам запрещен доступ в следующие зоны больницы:
- кладовая для продуктов в вашем отделении;
- центр отдыха в M15;
- детские зоны отдыха в M9;
- кафетерий;
- основной вестибюль;
- любые другие зоны общего пользования на территории больницы.
Врач скажет вам, когда можно будет прекратить соблюдать эти меры предосторожности. Это произойдет после того, как вы пройдете курс лечения и у вас исчезнут все симптомы.
Какие меры по изоляции мне следует принять дома, если у меня обнаружится инфекция, вызываемая МРЗС?
Дома обязательно делайте следующее:
- Часто мойте руки водой с мылом, особенно после посещения туалета.
- Мойте руки после контакта с кровью, мочой или выделениями из раны.
- Пользуйтесь дезинфицирующим средством (например Clorox ® или Lysol ® ) для очистки поверхностей, которые могли быть заражены бактериями, например дверной ручки.
Где я могу получить дополнительную информацию о МРЗС?
Если у вас есть вопросы, обратитесь к своему врачу или медсестре/медбрату. Кроме того, для получения дополнительной информации вы можете посетить веб-сайты:
Methicillin-resistantStaphylococcusaureus (MRSA) – являются ведущими возбудителями госпитальных инфекций, они впервые были описаны в 1961 г. в Англии, а в настоящее время распространены по всему миру. Важнейшая особенность MRSA – это устойчивость к большинству β-лактамных антибиотиков, а также высокая частота ассоциированной устойчивости к антибиотикам других групп. Особую тревогу вызывает появление и распространение MRSA со сниженной чувствительностью к ванкомицину и изолятов, устойчивых к даптомицину, линезолиду, тигециклину и цефтаролину. Изоляты со сниженной чувствительностью к этим препаратам уже регистрируются и в Российской Федерации. В обзоре представлены современные данные о распространении, антибиотикорезистентности, молекулярной эпидемиологии MRSA. Обсуждаются современные средства лечения и перспективы терапии MRSA-инфекций.
Введение
Золотистый стафилококк (Staphy-lococcus aureus) – наиболее частый патоген человека, вызывающий различные гнойные процессы: инфекции кожи и мягких тканей (ИКМТ), остеомиелиты, пневмонии, бактериемии. Кроме того, S. aureus является представителем нормальной микробиоты человека, считается, что он встречается у 30–60% человеческой популяции и бессимптомно колонизирует слизистые крыльев носа, крылья носа, подмышечные впадины, пах, подколенную область. Как известно, внедрение первых β-лактамов почти полностью решало проблему стафилококковых инфекций, связанных с хирургическим вмешательством. Однако у стафилококков достаточно быстро появилась устойчивость к пенициллину за счет приобретения плазмидной β-лактамазы.
В 1960-х гг. вскоре после внедрения в практику пенициллиназостабильных β-лактамов (метициллин) были описаны первые S. aureus, устойчивые к этим антибиотикам (Methicillin-resistant Staphylococcus aureus, MRSA) [1]. Достаточно быстро было установлено, что устойчивость к метициллину является маркером устойчивости ко всем β-лактамам, известным в то время. Впервые появившись в Англии, MRSA теперь циркулируют на всей планете. По количеству летальных исходов MRSA лидируют среди других мультирезистентных бактерий; так, в последнем (2013) опубликованном отчете CDC morrigan сообщается, что в США от инфекций, обусловленных мультирезистентными бактериями, погибают около 23 тыс. американцев в год, из них 11 тыс. приходится на MRSA [2]. Долгое время MRSA считался исключительно госпитальной инфекцией, но с 1990-х гг. стали описывать случаи тяжелых инфекций среди людей, не связанных с учреждениями здравоохранения (внебольничные MRSA) [3]. Позже, в середине 2000-х, появились MRSA, ассоциированные с инфекциями у животных, которые могут передаваться и человеку. Основным препаратом для лечения MRSA-инфекций длительное время оставались гликопептиды, однако в середине 1990-х впервые были описаны изоляты со сниженной чувствительностью к ванкомицину [4], а с 2002 г. – абсолютно резистентные фенотипы [5]. Появление изолятов, устойчивых к гликопептидам, послужило стимулом для разработки и внедрения новых антибиотиков и даже принципиально новых классов препаратов: оксазолидинонов, глицилциклинов, липопептидов, цефалоспоринов с анти-MRSA-активностью. Однако уже описаны клинические изоляты, проявляющие устойчивость и к этим антибиотикам. Биологические особенности основных генотипов MRSA кратко представлены в табл. 1.
![]()
Распространение и молекулярная эпидемиология MRSA в мире
В 1970–1980 гг. MRSA стали абсолютным лидером в структуре внутригоспитальных инфекций. Тем не менее частота регистрации случаев таких инфекций в разных странах колеблется в очень широком диапазоне. На рисунке представлены данные Европейской системы по надзору за распространением резистентности (European Antimicrobial Resistance Surveillance Network – EARS-Net), где показана доля выявляемых MRSA в разных странах за 2013 г. [9]. В таких странах, как Румыния, Италия, Греция, Португалия, Мальта, частота выявления MRSA очень высока (35–65%), напротив, в скандинавских странах эта доля не превышает 5%.
Азия – один из неблагоприятных регионов, где соотношение CA-MRSA и HA-MRSA составляет 25 и 75%. Особенно неблагоприятна ситуация в Корее, Шри-Ланке и Вьетнаме. Вместе с тем в некоторых странах отмечается появление и распространение клонов со сниженной чувствительностью к гликопептидам. На территории всего азиатского региона циркулирует ST239, который является ведущим нозокомиальным патогеном. Среди CA-MRSA преобладают клоны ST8, ST30, ST59, ST22, ST772 и ST72 [11].
![]()
В Австралии инфекции, вызванные MRSA, не превышают 30%, но остро стоит проблема CA-MRSA, с 2000-х гг. периодически описываются вспышки в местах повышенной скученности людей. К числу основных клонов CA-MRSA относятся ST93, ST75, ST30, ST1, ST45, ST78 и ST5 [13].
В связи с крайне высокой значимостью негативных клинических факторов, ассоциированных с MRSA, в США, Австралии и ряде стран Европы были приняты жесткие противоэпидемические меры по сдерживанию этой инфекции, что способствовало существенному снижению распространения MRSA [15]. В частности, в Европе удалось снизить частоту выделения c 24% в 2005 г. до 16% в 2013-м (см. рисунок).
Проблема снижения чувствительности к гликопептидам
![]()
В 2002 г. в Мичигане (США) был описан первый клинический изолят ванкомицинустойчивого S. aureus (VRSA-1). У этого изолята был обнаружен мобильный генетический элемент, полученный от ванкомицинрезистентного энтерококка [23]. С 2002 по 2009 г. в США было выявлено 11 изолятов VRSA: 7 – из Мичигана (VRSA-1, VRSA-5-10), изоляты из Пенсильвании (VRSA-2), Нью-Йорка (VRSA-3), а также из Индии и Ирана. По всему миру к 2013 г. всего было описано 33 клинических изолята VRSA [24–26]. Очевидно, что подобные фенотипы не распространяются и элиминируют из стафилококковой популяции.
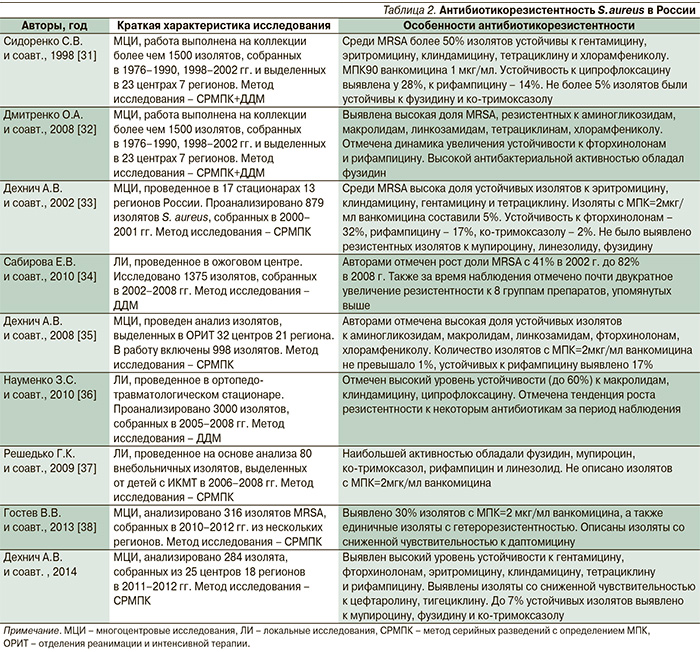
Проблема MRSA в России
В России ситуацию с распространением MRSA, c одной стороны, нельзя оценить в силу отсутствия централизованной системы по сбору данных о циркуляции госпитальных и внегоспитальных патогенов, с другой – имеющиеся исследования показывают крайнюю неравномерность их распространения. Так, частота встречаемости MRSA может колебаться от 0 до 80% в зависимости от стационара и географического региона. Анализ популяционной структуры MRSA еще раз подчеркивает ее высокую клональность. Другая особенность – в России циркулируют только HA-MRSA. Изолят CA-MRSA, несущий токсин PVL, был обнаружен только в одном случае во Владивостоке [27]. Среди HA-MRSA доминируют два клона – ST8 и ST239, при этом первый превалирует [28, 29]. Проведенные авторами исследования показывают, что среди изолятов ST239 преобладают фенотипы с устойчивостью более чем к трем не-β-лактамным антибиотикам. Кроме того, ST239 встречается только среди больных инвазивными формами стафилококковых инфекций. Клон ST8, напротив, более гетерогенен по спектру антибиотикоустойчивости, а также может встречаться среди носителей. В работах О.А. Дмитренко было показано, что эти клоны циркулируют на территории России с 1990-х гг. [30]. По нашим данным, в Санкт-Петербурге и Москве с 2011 г. стал регистрироваться не характерный для России клон ST228, который характеризуется множеством различных детерминант устойчивости к не-β-лактамам, а также сниженной чувствительностью к новому цефалоспорину – цефтаролину. Помимо вышеперечисленных клонов гораздо реже, но встречаются ST1, ST5 и ST22.
Диагностика инфекций, вызываемых MRSA, детекция метициллинрезистентности
В современную диагностику инфекций, вызываемых MRSA, как и в другие области микробиологической диагностики, происходит постепенное внедрение молекулярных методов. На сегодняшний день существуют коммерческие тест-системы, основанные в основном на ПЦР, позволяющие выявлять MRSA непосредственно в биологических образцах, не выделяя чистую культуру возбудителя. Шире всего молекулярные методы применяются при диагностике бактериемии (сепсиса) и при скрининге на носительство MRSA, т.е. в тех ситуациях, когда скорость ответа имеет существенное значение. В случае бактериемии (сепсиса) быстрый ответ необходим для принятия решения об антибактериальной терапии, а в случае скрининга – для принятия решения о необходимости изоляции пациента. Скрининг на носительство широко распространен в Европе и США, где это исследование применяется в системе инфекционного контроля для предотвращения импорта MRSA в стационары.
![]()
При всей перспективности молекулярной диагностики классические методы вряд ли утратят свое значение в обозримом будущем. Если классическая микробиологическая диагностика инфекций, вызываемых MRSA, ничем не отличается от диагностики других стафилококковых инфекций, то детекция метициллинрезистентности имеет некоторые особенности. Прежде всего метициллин уже давно не применяется не только в клинической медицине, но и в лабораторной диагностике. На протяжении многих лет метициллинрезистентность выявляли ДДМ-использованием диска с оксациллином. Однако сравнительно недавно было показано, что использование диска с цефокситином обеспечивает большую чувствительность и специфичность детекции метициллинрезистентности. На основании этих данных CLSI и EUCAST рекомендуют использовать для детекции метициллинрезистентности только диски с цефокситином. Здесь же уместно еще раз напомнить, что, согласно рекомендациям CLSI и EUCAST, оценивать чувствительность стафилококков к другим β-лактамам, кроме цефтаролина и цефтобипрола, нецелесообразно из-за высокой вероятности получения ложной чувствительности. Для прогноза чувствительности к β-лактамам необходимо использовать результаты, получаемые при оценке чувствительности культуры к цефокситину.
Гораздо более серьезную проблему из-за невозможности использовать ДДМ представляет определение чувствительности стафилококков к ванкомицину (выявление фенотипов VISA и hVISA). Молекулярные тесты также отсутствуют, поскольку точный механизм формирования устойчивости не известен. Для выявления снижения чувствительности необходимо использовать фенотипические методы определения МПК в серийных разведениях или разные варианты эпсилометрических тестов. Однако перечисленные методы недостаточно стандартизованы и не обладают необходимой специфичностью и чувствительностью. Наиболее достоверным методом служит популяционный анализ (PAP), требующий для своей постановки специальной аппаратуры [39]. Естественно, что такой метод достаточно трудоемок и может быть выполнен только в специализированных референс-лабораториях. В отличие от детекции hVISA/VISA фенотип VRSA легко можно определять даже ДДМ.
Лечение инфекций, вызываемых MRSA
Наиболее детальные рекомендации по тактике терапии MRSA-инфекций изложены в двух обновляемых протоколах: Американского общества инфекционистов – IDSA (Infectious Diseases Society of America) [40] и Британского общества по микробной химиотерапии BSAC (British Society for Antimicrobial Chemotherapy) [41]. Описываемые ниже возможности лечения MRSA-инфекций основаны на этих протоколах.
Прежде всего это касается режимов дозирования антибиотика, наиболее современные рекомендации по этому вопросу приведены в консенсусном документе, принятом рядом профессиональных сообществ [42]. Основу этих рекомендаций составляют клинические наблюдения, а также анализ фармакокинетических и фармакодинамических закономерностей. Показано, что предиктором эффективности ванкомицина является отношение площади под фармакокинетической кривой ванкомицина (area under the curve – AUC) к минимальной подавляющей концентрации (minimal inhibitory concentration – MIC) антибиотика в отношении возбудителя. Высокая вероятность клинического и бактериологического эффекта отмечается при значении AUC/MIC≥400. Обеспечить эту величину удается в отношении бактерий с МПК ванкомицина 1,0 мкг/мл при разовой дозе антибиотика 5–20 мг/кг, вводимой с интервалом 8–12 часов. При МПК ванкомицина в отношении возбудителя более 1,0 мкг/мл для лечения рекомендуется использовать альтернативные препараты.
Важным моментом правильного клинического применения ванкомицина служит учет того факта, что при лечении инфекций, вызванных метициллинчувствительными стафилококками, антибиотик по эффективности существенно уступает β-лактамам. Этот факт исключает возможность эмпирического применения ванкомицина при стафилококковых инфекциях без подтверждения метициллинрезистентности.
Бактериемии делят на осложненные и осложненные, последние определяют как развившиеся на фоне эндокардита или при наличии имплантированных устройств. Основу терапии составляют ванкомицин и даптомицин, при неосложненных формах достаточной считается 2-недельная длительность применения, при осложненных – 4–6 недель. Обсуждается вопрос о дозах даптомицина. Разрешенная доза составляет 6,0 мг/кг/сут, высказывается предположения о необходимости использовать при эндокардите дозы до 10,0 мг/кг/сут. Целесообразность использования комбинаций ванкомицина с аминогликозидами или рифампицином не доказана.
Ни один из новых препаратов не рекомендован для лечения интраабдоминальных MRSA-инфекций. Тигециклин, разрешенный по этому показанию при MSSA-инфекциях, на практике применяют и при MRSA- инфекциях.
Лечение нозокомиальной пневмонии, в т.ч. и вентиляторассоциированной, – один из немногих случаев, в котором показано достоверное преимущество линезолида перед ванкомицином. Даптомицин при легочных инфекциях практически неэффективен, поскольку ингибируется легочным сурфактантом [45].
При инфекциях мочевыводящих путей ни один из новых антибиотиков не показан, рекомендуется использовать нитрофурантоин или ко-тримоксазол, при осложненных формах – ванкомицин и даптомицин. Концентрации линезолида и тигециклина не достигают терапевтических значений в моче, соответственно, их использование нецелесообразно [46].
Новые антибиотики также не рекомендованы для лечения инфекций ЦНС; базовым препаратом считается ванкомицин, некоторые эксперты рекомендуют его комбинацию с рифампицином. Несмотря на отсутствие официальных показаний, имеется положительный опыт применения при менингитах и других инфекциях ЦНС линезолида и даптомицина.
Помимо существующих высокоэффективных антибиотиков в настоящее время в клиническую практику внедряются новые препараты, активные в отношении MRSA, VISA, VRSA. К их числу относятся тедизолид (Tedizolid), далбаванцин (Dalbavancin) и телаванцин (Telavancin). Тедизолид – бактериостатический антибиотик группы оксазолидинонов второго поколения, механизм его действия – нарушение сборки бактериального рибосомального комплекса, что приводит к нарушению биосинтеза белка клетки. Основной особенностью тедизолида считается преодоление резистентности к линезолиду. Препарат ориентирован на терапию ИКМТ у взрослых (FDA, 2014), также ведутся клинические испытания по поводу возможности использования тедизолида для лечения нозокомиальных пневмоний [47, 48]. Далбаванцин – дериват гликопептидов, относится ко второму поколению липогликопептидов, одобрен FDA в 2014 г. для лечения ИКМТ. Этот антибиотик, аналогичный ванкомицину, нарушает биосинтез клеточной стенки бактерии [49]. Телаванцин – парентеральный липогликопептид, нарушает биосинтез клеточной стенки, одобрен в 2009 г. для лечения стафилококковых ИКМТ, внутрибольничных пневмоний и вентиляторассоциированных пневмоний [50].
Заключение
Литература
Об авторах / Для корреспонденции
![Сравнительная оценка эффективности антибактериальной терапии MRSA – ассоциированной инфекции мягких тканей у тяжелообожженных пациентов в критическом состоянии]()
Отделения интенсивной терапии в настоящее время могут рассматриваться как зона высокого риска развития нозокомиальных инфекций. Грамположительная микрофлора, особенно в специализированных хирургических отделениях, может играть одну из ведущих ролей в развитие инфекционных осложнений данной группы, определяющих степень тяжести состояния пациентов, длительность пребывания в отделении интенсивной терапии и внутрибольничную летальность [13].
Золотистый стафилококк, в т. ч. штаммы MRSA, могут бессимптомно колонизировать кожные покровы как больных, в случае обращения их за медицинской помощью, так и медицинского персонала, эту помощь осуществляющего. Наиболее важными локусами человеческого тела в отношении колонизации золотистым стафилококком являются кожные покровы и слизистые преддверия носовой полости, кожа аксиллярных впадин и промежности. Период колонизации MRSA может протекать достаточно долгое время, в среднем 56 дней, до момента развития инфекции [8]. В этот период человек, колонизированный MRSA, может представлять серьезную эпидемиологическую опасность, распространяя метициллин-резистентные штаммы S.aureus в окружающей среде. По данным S.S. Huang, 2011 [8], у 24% пациентов, перенесших инфекционное заболевание, связанное с MRSA, в течение года наблюдения отмечался рецидив инфекции, причем у половины заболевших в первые три месяца после выписки. Особого внимания требуют приводимые данные о летальности пациентов с идентифицированной MRSA колонизацией. Авторы указывают, что в течение одного года после обнаружения MRSA умерли 46% больных этой группы. Более чем одна треть всех смертельных случаев (35%, 94 из 269 пациентов) была обусловлена непосредственно MRSA-инфекцией. Примечательно, что четкой зависимости летальности от длительности периода MRSA-колонизации найдено не было, как не была обнаружена и связь со сроками госпитализации у этих больных.
Также необходимо отметить, что контактный механизм распространения MRSA является основным в условиях стационаров. Он реализуется как непосредственно при прямых контактах между больным или носителем и восприимчивым человеком, так и контактно-бытовым путем, через загрязнение предметов окружающей среды. В редких случаях возможна передача инфекции гемоконтактным путем через контаминированное медицинское оборудование при проведении лечебно-диагностических манипуляций. Факты развития устойчивости к полусинтетическим пенициллинам в течение времени носительства S.aureus очень редки.
Таким образом, представляется рациональным включение даптомицина в эмпирическую терапию инфекции мягких тканей в зонах ожогового поражения в качестве препарата выбора, способствующего быстрой эрадикации грамположительных возбудителей (в т. ч. MRSA) и позволяющего предотвратить их дальнейшее носительство у реконвалесцентов.
Критериями исключения были наличие аллергических реакций на данные лекарственные средства, возраст пациента до 18 лет.
МАТЕРИАЛЫ И МЕТОДЫ
Поводом для перевода в специализированный ОРИТ ожогового центра Института хирургии им. А.В. Вишневского у всех пациентов было получение тяжелой термической травмы (индекс Франка более 60 единиц) с развитием ожоговой болезни в стадии септикотоксемии, осложненной течением инвазивной раневой инфекции в зонах ожогового поражения.
Всем пациентам (табл. 1), 12 человек (3 женщины, 9 мужчин, средний возраст 42 ± 17,3 года), на момент перевода в ОРИТ проводилась комплексная терапия, предусмотренная рекомендациями American Burn Association (ABA). Во всех наблюдаемых случаях имела место пролонгированная раневая инфекция в зонах ожогового поражения, этиология которой была определена ретроспективно.
Всем поступившим пациентам с целью ограничения патогенной нагрузки из областей раневой ожоговой инфекции были выполнены санирующие оперативные вмешательства. В послеоперационном периоде была продолжена многокомпонентная интенсивная терапия в условиях отделения реанимации. Все участвующие в исследовании получали необходимую терапию, основными составляющими которой были искусственная вентиляция легких, инфузионная и трансфузионная терапия, применение антикоагулянтов. В течение пребывания в ОРИТ больным проводилось всестороннее клиническое, лабораторное и инструментальное обследование с регистрацией клинических, биохимических показателей крови, гемостазиограммы; определением кислотно-щелочных показателей, газового состава артериальной и венозной крови.
До начала антибактериальной терапии у пациентов были выполнены микробиологические исследования раневого отделяемого. В дальнейшем микробиологический мониторинг осуществляли путем культурального бактериологического анализа отделяемого ран каждые 48 ч, до стабилизации состояния и перевода из отделения. Микробиологические исследования выполнялись в соответствии со стандартами Clinical and Laboratory Standards Institute (CLSI).
Назначение антибактериальных препаратов проводилось по деэскалационной схеме в течение первых 60 мин пребывания в отделении с учетом предшествующего стационарного лечения и предшествующих данных микробиологических исследований. В качестве этиотропной терапии предполагаемой на момент поступления MRSA-инфекции использовали ванкомицин как традиционный антибактериальный агент и даптомицин, ставший доступным с момента включения его в терапевтическую практику Института хирургии. С учетом данных обстоятельств были отобраны 6 пациентов (группа Vanco), получавших ВАНКОРУС® (VANCORUS) 1 г через 12 ч в виде медленной в/в инфузии со скоростью не более 10 мг/мин в течение не менее 60 мин, и 6 пациентов (группа Cubic), которым применяли КУБИЦИН (CUBICIN®) 6 мг/кг препарата 1 раз в сутки, вводя путем в/в инфузии в течение 30 мин.
Критериями эффективности проводимой терапии являлись сроки эрадикации MRSA по данным микробиологического исследования раневого отделяемого.
Статистическая обработка. Для анализа данных использовали базу данных Microsoft Access и архивные материалы. Статистическую обработку проводили с помощью системы STATISTICA 7.0 (StatSoft, США). Выборки в исследовании сравнивали относительно средних значений, используя непараметрическую альтернативу t-тесту для независимых групп (учитывая общее количество наблюдений в исследовании n Литература
Лечение метициллин-резистентного золотистого стафилококка является серьезной задачей для современной медицины. Среди стафилококковых инфекций во всем мире MRSA встречается все чаще, и это вызывает значительное беспокойство. По данным Центров по контролю и профилактике заболеваний США, ежегодно этот патоген является причиной более 70 тысяч случаев инфекции и более 10 тысяч летальных исходов.
Ситуация осложняется тем, что список антибиотиков, эффективных против MRSA, весьма узок. Применение ванкомицина и линезолида зачастую связано с развитием серьезных побочных эффектов. Воздействие ко-тримоксазола (комбинация сульфаметоксазола и триметоприма) на метициллин-резистентный стафилококк непредсказуемо, поэтому в клинической практике он применяется редко. Кроме того, устойчивость MRSA к различным классам антибиотиков неуклонно растет.
Многообещающие результаты продемонстрировали новые лекарственные средства, разработанные исследователями из Коннектикутского университета. Принцип их работы заключается в нарушении работы бактериального фермента, участвующего в обмене фолиевой кислоты. Похожим образом воздействует на бактерии и триметоприм, но за годы его использования появились новые изоформы ферментов, на которые он не оказывает воздействия.
Ключевым отличием новых средств является то, что при их разработке учитывались уже имеющиеся и возможные варианты структуры фермента. В итоге удалось создать антибиотики, оказывающие влияние на широкий спектр изоформ. Если же фермент изменит свою структуру настолько, чтобы избежать воздействия нового лекарства, то уже не сможет выполнять свою функцию, и бактерия все равно погибнет.
Для испытаний было взято девять штаммов метициллин-резистентного стафилококка, шесть из которых также были устойчивы к ко-тримоксазолу. Некоторые штаммы демонстрировали резистентность к другим антибиотикам, например, к средствам тетрациклинового ряда. Как утверждают авторы, эти штаммы были получены в ходе клинической практики. Однако, несмотря на высокую резистентность, ни один из патогенов не был устойчив к новым препаратам. Этот успешный результат уже опубликован в журнале Cell Chemical Biology.
Однако ученые не останавливаются на достигнутом: теперь их целью является сбор образцов MRSA со всей территории США. По их мнению, это может позволить им обнаружить новые механизмы антибиотикорезистентности. Кроме того, это, безусловно, позволит продемонстрировать эффективность новых средств в борьбе с различными штаммами метициллин-резистентного золотистого стафилококка.
Читайте также: