Псевдомонас флюоресценс в посеве
Обновлено: 05.10.2024
Опасные инфекции, вызываемые псевдомонадами, как правило, возникают в больницах, а микроорганизм обычно живет в сырых местах, например суднах и мочеприемниках. Удивительно, но этот микроорганизм обнаруживали даже в некоторых антисептических растворах. Как правило, тяжелые формы болезни возникают у ослабленных людей, чья иммунная система подавлена из-за медикаментозной терапии, других видов лечения или сопутствующих заболеваний.
Псевдомонада может поражать клапаны сердца, кровь, кожу, кости, уши, глаза, мочевыводящие пути и легкие. Тяжелые псевдомонадные инфекции возможны после ожогов, часто с развитием сепсиса и летальным исходом.
Характер симптомов вначале во многом зависит от места инфицирования, но затем обычно псевдомонадные инфекции приобретают тяжелое течение. Злокачественный наружный отит (воспаление наружного уха) может сопровождаться сильной болью в ухе и повреждением нерва, что наиболее распространено у больных сахарным диабетом. В результате травмы глаза из-за загрязнения контактной линзы или жидкости для хранения линз псевдомонада может вызывать изъязвление роговой оболочки. Псевдомонадные бактерии обнаруживаются в глубоких колотых ранах, особенно в ранах стопы у детей.
Псевдомонады могут вызвать тяжелую пневмонию у госпитализированных больных, особенно в реанимации. Эти бактерии часто инфицируют мочевыводящие пути, особенно после урологических процедур или при обструкции (нарушении проходимости) мочевыводящих путей.
После ожогов, а также у больных с онкологическими заболеваниями бактерии часто размножаются в крови. Без лечения тяжелая инфекция может привести к шоку и смерти. При заболеваниях, вызываемых псевдомонадами, часто наблюдается сыпь, состоящая из багрово-черных пятен до 1-1,5 см диаметром; в центре этих пятен имеется язва, окруженная областью покраснения и отека. Сыпь часто возникает в подмышках и в паху.
В редких случаях псевдомонады поражают клапаны сердца. Обычно поражаются протезы клапанов; тем не менее, естественные клапаны также могут инфицироваться, особенно у инъекционных наркоманов.
Когда инфекция поверхностная и ограничивается, например кожей, врач хирургически удаляет омертвевшие ткани и большие абсцессы, а затем орошает эту область растворами антибиотиков. При злокачественном наружном отите, поражении внутренних органов и сепсисе требуется внутривенное введение антибиотиков в течение нескольких дней или недель. Иногда при поражении клапана сердца благодаря приему антибиотиков возможно выздоровление, но часто требуется операция на сердце и протезирование клапана.

Pseudomonas fluorescens – вид бактерий рода Pseudomonas, на основе которых были созданы биологические препараты для защиты растений от болезней.
Штаммы Pseudomonas fluorescens
Физико-химические свойства
Бактерии Pseudomonas – распространенные сапротрофные бактерии, они заселяют ризосферу как естественные регуляторы фитопатогенных микроорганизмов. Бактерии характеризуются активным ростом, хорошо усваивают различные органические субстраты, продуцируют сидерофоры, бактериоцины и антибиотики, а также стимуляторы роста.
По строению эти бактерии – палочки размером 0,7-0,8х2,3-2,8 мкм. Колонии на мясо-пептонном агаре плоские, приподнятые или выпуклые, круглые, гладкие, цельные, светопроницаемые, иногда шероховатые. Культуры продуцируют флуоресцирующий пигмент (голубой или светло-коричневый). [1]
Действие на вредные организмы
Механизм действия. Действуют системно, защищают все органы растений, стимулируют их рост, увеличивают качество продукции, усиливают ростовые процессы в растениях, продуктивность и устойчивость к различным неблагоприятным факторам среды. [5] [4]
Штамм АР-33 проявляет фунгистатический эффект, заключающийся в основном в подавлении развития заболевания на стадии роста мицелия и споруляции. [5]
Штаммы 7Г, 7Г2К; 17-2 входящие в состав препарата Бинорам обладает дополнительной способностью воздействовать на обменные процессы в растении, способствуя лучшей сохранности урожая. [3]
Пестициды , содержащие
Pseudomonas fluorescens
для сельского хозяйства:
закончился срок регистрации:
Применение
Токсикологические свойства и характеристики
Пестицидыбезвредны для окружающей среды. [6] Препараты на основе Pseudomonas fluorescens относятся к 3 (штаммы 7Г, 7Г2К, 17-2) и 4 (штамм АР-33) классам опасности для человека, а также к 4 классу опасности для пчел. [2]
История
Препарат планриз разработан в НИИ генетики и цитологии АН Белоруссии. [1] Средство Бинорам было создано из природных популяций ризосферных бактерий диких злаков различных регионов Сибири. [3]
Оставьте свой отзыв:
Отзывы:
Последнее обновление: 18.09.18 17:20
Статья составлена с использованием следующих материалов:
Биологическая защита растений/М. В. Штерншис, Ф. С.-У. Джалилов, И. В. Андреева, О. Г. Томилова; Под ред. М. В. Штерншис. — М.: КолосС, 2004. — [4] л. ил.: ил. — 264 с. — (Учебники и учеб. пособия для студентов высш. учеб. заведений);
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
Дашкевич В.С.; Дашкевич Н.Ю.; Леонова Н.С.; Гребенникова В.В.; Бычкова М.А.; Тареев А.И. Результаты и перспективы использования биопрепаратов бинорам в системе биоземледелия для получения экологически чистой и высококачественной сельскохозяйственной продукции [Эффективность препарата в борьбе с грибными болезнями растений]. Новые и нетрадиционные растения и перспективы их использования: VI междунар. симп. : материалы / Всерос. науч.-исслед. ин-т селекции и семеноводства овощных культур РАСХН. - Москва, 2005; Т. 1. - с. 237-240
Манжесов В.И.; Аносова М.В.; Щедрин Д.С. Способы повышения сохранности фабричной свеклы [Действие фунгицида Бинорам на физиологическое состояние корнеплодов, содержание сахаров и сухих веществ; перспективы использования препарата при хранении сахарной свеклы]. Сахарная свекла, 2009; N 5. - С. 33-34
Чазова Л.Н. Эффективность биопрепарата Планриз и фунгицидов в борьбе с болезнями картофеля. Достижения науки и техники АПК, №11, 2004, с.24
Использование: сельское хозяйство, получение средств защиты растений от возбудителей заболеваний и касается нового штамма для получения вышеуказанного средства. Сущность изобретения: штамм Pseudomonas fluorescens выделен из чернозема. Депонирован в ВКМ под номером CR-330D. Для получения препарата штамм выращивают на агаризованной среде Хоттингера или картофельном агаре, или мясопептонном агаре, затем смывают физиологическим раствором или стерильной водой, разводят до титра 10 8 - 10 9 кл/мл. Полученную суспензию используют для защиты растений от фитопатогенов, таких как Alternaria solani, Helminthosporium sativum, Rhirocfonia solani. 5 табл.
Изобретение относится к сельскому хозяйству и касается штамма, который оказывает антагонистическое действие на фитопатогенные грибы и бактерии, и может быть использовано для защиты растений от заболеваний, вызываемых фитопатогенами. Известен штамм Pseudomonas sp. подавляющий рост гриба Helminthosporium sativum возбудителя корневой гнили злаковых растений. Однако отсутствуют сведения о действии этого штамма на другие фитопатогены. Известен штамм Pseudomonas putida, подавляющий рост фитопатогенного гриба Fusarium oxysporum. Однако не описано его действие на другие фитопатогены. Известен штамм Pseudomonas cepacia 526, активный против широкого спектра фитопатогенных грибов. Однако отсутствуют сведения о его действии на рост грибов Botrytis spp. Helminthosporium spp. Fusarium heterospolum, Fusarium solani, а также на фитопатогенные бактерии. Целью изобретения является выделение природного штамма бактерий с широким спектром антагонистического действия на фитопатогенные грибы и бактерии. Новый штамм Pseudomonas fluorescens BKM CR-330D был выделен в 1982 году из чернозема под некосимой залежью в Каменной степи (Воронежская область). Новый штамм характеризуется следующими признаками. Это грамотрицательные, подвижные короткие палочки с полярными жгутиками, спор не образуют, размер 0,6х1,5 2,0 мкм. Клетки хорошо растут на простых питательных средах: мясопептоном агаре (МПА), агаризованном бульоне Хоттингера, картофельном агаре, минимальных средах с глюкозой или глицерином. Морфология колоний на агаризованных средах (при 28 o C на 3 5-й день): на МПА колонии гладкие, беловатые, часто имеют слабый розовый оттенок, выпуклые, слизистой консистенции, диаметр 5 8 мм; на МПА с 2% глицерина наблюдается диссоциация на три колониальных типа: 1) серые или желтовато-серые, слабо выпуклые, маслянистой консистенции, 2) слизистые, выпуклые с розовым оттенком, крупные, 3) розовые, более плотные и мелкие. Пигмент на МПА желто-зеленый, диффундирующий в среду. Пигментация на диагностических средах Кинга для флуоресцирующих псевдомонад (King E.O. at all. Two simple media for the demonstration of pyocyanin and fluorescin. J. Lab. Clin, Med. 1954, v. 44, p. 301). Кинг А пигмент отсутствует, Кинг Б зеленый флуоресцирующий интенсивный пигмент. Физиолого-биохимические свойства: строгий аэроб, метаболизм глюкозы окислительный. В факторах роста не нуждается. Обладает активными протеолитическими свойствами: разжижает желатин, пептонизирует молоко. Редуцирует нитраты до нитритов. Образует леван из сахарозы. Максимальная температура роста на питательных средах равна 35 o C, минимальная -4 o C, оптимальная -28 o C. Хорошо растет при pH 5,0 8,0. В качестве единственного источника углерода усваивает арабинозу, ксилозу, глюкозу, сахарозу, глицерин и не усваивает рамнозу, галактозу, рафинозу, мальтозу, сорбит, маннит, дульцит, инозит, инулин. Из источников азота лучше использует нитратную форму, чем аммонийную. Новый штамм устойчив к антибиотикам: ампициллину (200 мкг/мл), тетрациклину (10 мкг/мл), хлорамфениколу (200 мкг/мл) и чувствителен к стрептомицину (100 мкг/мл), канамицину (100 мкг/мл). Штамм не фитотоксичен, о чем свидетельствует отсутствие мацерации на ломтиках картофеля и некротических пятен на листьях табака при нанесении на них уколом суспензии живых клеток штамма. Штамм не вирулентен для лабораторных животных: при введении одиннадцати мышам внутрибрюшинно суспензии его клеток по 250 млн клеток в объеме 0,5 мл в течение 10 дней животные не погибали. Новый штамм хранится на косяках картофельного агара в холодильнике с пересевом на свежие косяки через 2 4 месяца и в лиофильно-сухом состоянии (в ампулах) не менее 1 года. Штамм идентифицирован: 1) по первоисточнику H.Stolp, D.Dadkari in "The Prokaryotes", Berlinea, 1981, v. 1, cb. 61, p. 719 741; 2) по определителю "Bergey' s Manual of systematic Bacteriology", v. 1, ed. Krieg N.R. et al. Baltimore/London, 1984. Ниже приведены примеры, описывающие свойства нового штамма и показывающие возможность его применения для защиты растений от заболеваний. Пример 1. Клетки штамма Pseudomonas fluorescens BKM CR-330D выращивали в течение суток при 30 o C на чашках или матрицах с агаризованным бульоном Хоттингера или картофельным агаром, или с МПА, затем смывали физиологическим раствором или стерильной водой и разводили до титра 10 8 10 9 клеток на мл. С 1 см 2 поверхности питательной среды получали 10 9 клеток. Полученную суспензию клеток использовали как препарат для защиты растений от фитопатогенов. Клетки можно смывать средами, обычно применяемыми при лиофилизации, а полученную суспензию можно лиофилизировать. Пример 2. Методом агаровых блочков изучили антагонистическую активность штамма против фитопатогенных грибов. Культуру бактерий Pseudomonas fluorescens BKM CR-330D высевали сплошным "газоном" на поверхность питательного агара (МПА с 2% глицерина или среда Кинга Б) и выращивали при 28 o C в течение 2 3 суток. Затем пробочным сверлом (диаметр 8 10 мм) вырезали диски (агаровые блочки) и помещали их на поверхность сплошного "газона" тест-культуры фитопатогенного гриба. (Газон получен посевом глубинным способом суспензии клеток тест-культуры из расчета около 100 спор на 1 мл среды на среду Чапека или на картофельный агар). Чашки с "газоном" тест-культуры с помещенными на него агаровыми блочками, содержащими клетки нового штамма, помещали в термостат при 28 30 o C на 3 6 суток (в зависимости от скорости роста тест-культуры). Учет проводили по зонам отсутствия роста или подавления роста фитопатогенного гриба вокруг диска. Результаты приведены в табл. 1 и показывают, что новый штамм имеет широкий спектр действия на фитопатогенные грибы. Пример 3. Изучали действия штамма Pseudomonas fluorescens BKM CR-330D на фитопатогенные бактерии. Клетки штамма засевали уколом на чашки с различными агаризованными средами: NBY, картофельный агар, бульон Хоттингера с 1,5% агара, минимально солевая среда с глюкозой следующего состава (г/л дистиллированной воды): NH4Cl 1; KH2PO4 1,5; Na2HPO4 3,5; MgSO4 0,1; глюкоза (глицерин, сахароза) 2% агар Дифко 1,5% pH 7,0 7,5. Культуру выращивали 2 суток при 28 30 o C. Выросшие колонии убивали парами хлороформа, после чего на поверхность среды выливали 3 мл 0,7%-ной агаровой среды того же состава, смешанной с 0,1 мл индикаторной культуры фитопатогенной бактерии, выросшей до экспоненциальной фазы роста (1 3х10 8 кл/мл) на качалке в жидкой среде того же состава. В результате этой операции образовывался второй слой агаризованной среды с клетками тест-культуры фитопатогенной бактерии. Чашки с двумя слоями агаризованных сред выдерживали при 28 o C в течение 3 5 дней. Учет проводили по зонам подавления роста тест-культуры фитопатогенной бактерии вокруг колоний нового штамма. Полученные результаты приведены в табл. 2 и свидетельствуют о том, что новый штамм проявляет антагонистическую активность относительно большого числа фитопатогенных бактерий. Пример 4. Семена огурцов сорта "Нежинский" замачивали в воде (контроль) или в суспензии клеток штамма P. fluorescens BKM CR-330D. После 24 ч замачивания семена в течение 1 сут выдерживали при температуре окружающей среды. Затем семена высевали в ящики с почвой, инокулированной высококонцентрированной суспензией смеси спор фитопатогенных грибов - возбудителей корневых гнилей: Phytium debaryanum H. Phoma lingam D. Tusarium oxysporum Sch. Alteruaria sp. Botrytis cinerea. Для этого фитопатогенные грибы предварительно выращивали на косяках картофельного агара в течение 5 7 сут, смывали с косяка прокипяченной водой (10 мл на 1 косяк). Для инфицирования 3 4 кг почвы готовили суспензии спор с 5 7 косяков каждого гриба и полученные суспензии объединяли. Ящики с семенами содержали в комнатных теплицах "Флора" при 28 o C и световом дне 16 ч. Учет состояния рассады проводили через 49 дней после посева. Результаты представлены в табл. 3. Анализ данных показывает, что обработка семян огурцов суспензий клеток штамма Pseudomonas flurescens BKM CR-330D предотвращает заболевание растений огурца черной ножкой. Наилучшие результаты получены при использовании суспензии клеток нового штамма с титром клеток 10 8 10 9 клеток/мл. Представленные в табл. 3 данные свидетельствует также о том, что обработка семян суспензией клеток нового штамма приводила к ускорению роста растений огурца. Пример 5. В производственных условиях совхозов Краснодарского края изучили влияние препарата из клеток нового штамма на степень поражения саженцев винограда бактериальным раком. Заготовили 2-глазковые неодревесневшие черенки винограда. Нижние срезы черенков помещали на 3 4 ч в емкость с суспензией нового штамма. Контрольные растения помещали в емкость с водой на такое же время. Затем черенки размещали в установке для зеленого черенкования, где в условиях температуры 25 - 26 o C и постоянного туманообразования они находились 25 30 дней. За этот период формируются корни и трогается в рост верхний глазок (почка). После этого черенки переносили в почву, где они росли в течение вегетационного периода. Результаты представлены в табл. 4. Пример 6. Препарат из клеток нового штамма использовали для защиты растения гвоздики от грибных заболеваний. Базальные срезы черенков гвоздики на 3 4 ч замачивали в суспензии клеток штамма (титр 10 7 клеток/мл) и затем высаживали в перлит для укоренения. Контрольные черенки замачивали в воде. Результаты приведены в табл. 5. Таким образом, препарат из нового штамма позволяет защищать растения от бактериальных и грибковых заболеваний.
Штамм бактерий Pseudomonas fluorescens ВКМ CR-330 для получения препарата против возбудителей заболеваний растений.
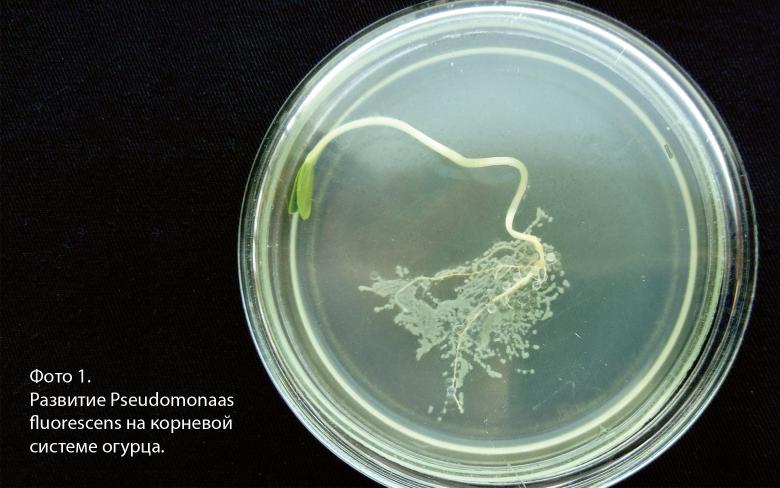
В проведённом исследовании был изучен процесс колонизации клетками Pseudomonas fluorescens штамм поверхности корневой системы растения огурца сорта Атлет гибрида F1. Также была предложена технологическая схема применения данных микроорганизмов.
В соответствии с теорией фитопатогенеза [1] , само растение способно на этих стадиях противостоять атаке фитопатогенного микроорганизма целым комплексом действий. Так, выделяемые растением экссудаты, при их метаболизме клетками фитопатогенного микроорганизма, блокируют синтез литических ферментов, в соответствии с классической теорией - регулирования ферментативной активности по механизму катаболитной репрессии. Растение способно выделять протеолитические ферменты, которые разрушают литические ферменты, выделяемые фитопатогенными микроорганизмами. Также растение способно выделять ингибиторы литических ферментов и низкомолекулярные соединения, обладающие противомикробным действием – фитоалексины, аналоги антибиотиков.
Последовательность запуска механизмов защиты растения от фитопатогенов может быть различной, но известно, что все эти механизмы работают только при условиях благоприятных для нормального роста растения и экссудации им корневых выделений.
При наступлении стресса, вне зависимости от его причин, экссудация корневых выделений резко меняется как по составу, так и по концентрациям, и даже может полностью прекратиться. В этот момент корневая система растения становится полностью беззащитна от воздействия фитопатогенного микроорганизма, колонизировавшего корневую систему и разросшегося за счет метаболизма экссудатов. И фитопатогенный микроорганизм попадает в растение.
Методы защиты во время стресса у растения
Существуют ли методы защиты корневой системы растения во время стресса от воздействия фитопатогенных микроорганизмов? По нашему мнению, существует несколько методов защиты корневой системы растения от фитопатогенной микрофлоры, особенно в период стрессовых для растения условиях. В данной статье мы постараемся рассмотреть один из этих методов, связанный с внесением и использованием биологических препаратов.
Действующим началом многих препаратов являются живые клетки микроорганизмов, споры или формы, содержащие метаболиты различных микроорганизмов. Количество видов микроорганизмов, разрешенных и используемых в биологических препаратах для защиты растений, незначительно и ограничено во многом из-за бюрократических трудностей введения тех или иных микроорганизмов в оборот. Но даже для столь малого количества видов микроорганизмов нет четкого понимания некоторых принципиальных методов оценки их свойств. К таким свойствам, на наш взгляд, стоит отнести:
- способность микроорганизмов, входящих в состав биологических препаратов средств защиты растений, метаболизировать экссудаты корневой системы с максимальной скоростью и до минимальных концентраций;
- способность колонизировать корневую систему растения и расти вместе с ней в объеме субстрата;
- способность подавлять развитие фитопатогенной микрофлорой при условиях метаболизма экссудатов корневой системы конкретного растения.
Безусловно, для оценки этих свойств микроорганизмов потребуется создание новых методов и технологий исследований, но это является необходимым шагом в развитии системы биологической зашиты растений.
Колонизация корневой системы огурца Pseudomonas fluorescens
Данная работа посвящена анализу результатов по колонизации корневой системы огурца на ранних стадиях его развития микроорганизмом Pseudomonas fluorescens .
В работе использовали семена огурца сорта Атлет гибрида F1 компании Гавриш, в качестве объектов исследования был использован штамм Pseudomonas fluorescens номер В001.
Методика проведения экспериментов заключалась в следующем. Микроорганизм выращивали глубинным способом на питательной среде Кинга соответствующего состава [2] в аэробных, стерильных условиях, при 25–280С в течении 2 суток. Суспензии клеток использовали для приготовления рабочего раствора, который готовили, разбавляя исходную суспензию физиологическим раствором так, чтобы концентрация клеток в нем была 106 КОЕ/мл.
Рабочие растворы использовали для нанесения клеток на семена. Для этого партию семян помещали на 2-3 минуты в соответствующую суспензию идалее помещалисемена огурцов в установку для выращивания.
Огурцы выращивали в специально разработанной системе, представляющей из себя стеклянные колонки диаметром 5 см и высотой 15 см с впаянными в них фильтрами Шотта. Колонки были заполнены на ½ объема вермикулитом со средним размером частиц 2-2.5 мм, сверху кколонке через ватно-марлевый тампон по шлангу подводился раствор для полива. Полив проводили модифицированным раствором Хогланда [3] дискретно с заданной скоростью. Одновременно в системе работало 4 описанных установки. Вся система для выращивания стерилизовалась в сборе в автоклаве. На наш взгляд, описанная выше схема проращивания семян огурца наиболее полно соответствует проращиванию в минераловатном субстрате с присыпкой Агровермикулитом.
Методика проведения экспериментов
Методика проведения эксперимента заключалась в следующем: семена огурца стерилизовали и далее обрабатывали в суспензии Pseudomonas fluorescens и помещались в установки. Вермикулит в установке смачивали стерильным раствором. Семена сажали на 1 см в вермикулит. Вся система термостатировалась при 25 0С. Через определенные интервалы времени одна из установок останавливалась и из неё аккуратно извлекалось семя вместе с корневой системой, отряхивалось от вермикулита и в стерильных условиях переносилось на агаризованную среду, которая в свою очередь выдерживалась в термостате. Выросшие на агаризованной среде колонии микроорганизмов фотографировали и в дальнейшем микроскопировали препараты, приготовленные из образцов с чашек Петри. Каждая последующая установка останавливалась через определенное время и с проросшим семенем огурца проводили аналогичные манипуляции.
На первом этапе исследований в установке было проведено проращивание семян огурца сорта Атлет в стерильных условиях. Это было необходимо для определения возможности работы установки и проращивания в ней семян и возможности проведения процесса в контролируемых стерильных условиях. Одновременно, часть семян проращивали во влажной камере по стандартной методике [4] Проведение эксперимента по описанной выше методике показало, что семена прорастают в установке аналогично тому, как они прорастают во влажной камере. Но, при этом корневаясистема располагается в объеме вермикулита не хаотично, а ориентировано к низу. Время от момента набуханиядо фазы развернутых семядолей (период мезотрофного проростка) в наших экспериментах составил ориентировочно 5 суток. Кроме того, было подтверждено, что система, используемая для исследований, позволяет в ходе эксперимента 5 и более сутокподдерживать процесс в стерильных условиях.
Следующим этапом исследований было изучение колонизации корневой системы огурца и семядолей клетками Pseudomonas fluorescens. Выращивание семян огурца Атлет, обработанных клеткамиPseudomonas fluorescens, проводили по аналогичной схеме. После извлечения проростка из системы культивирования он помещался на агаризованную среду Кинга и переносился в термостат.
На фото1 приведены характерные результаты выросших через сутки колоний микроорганизмов.
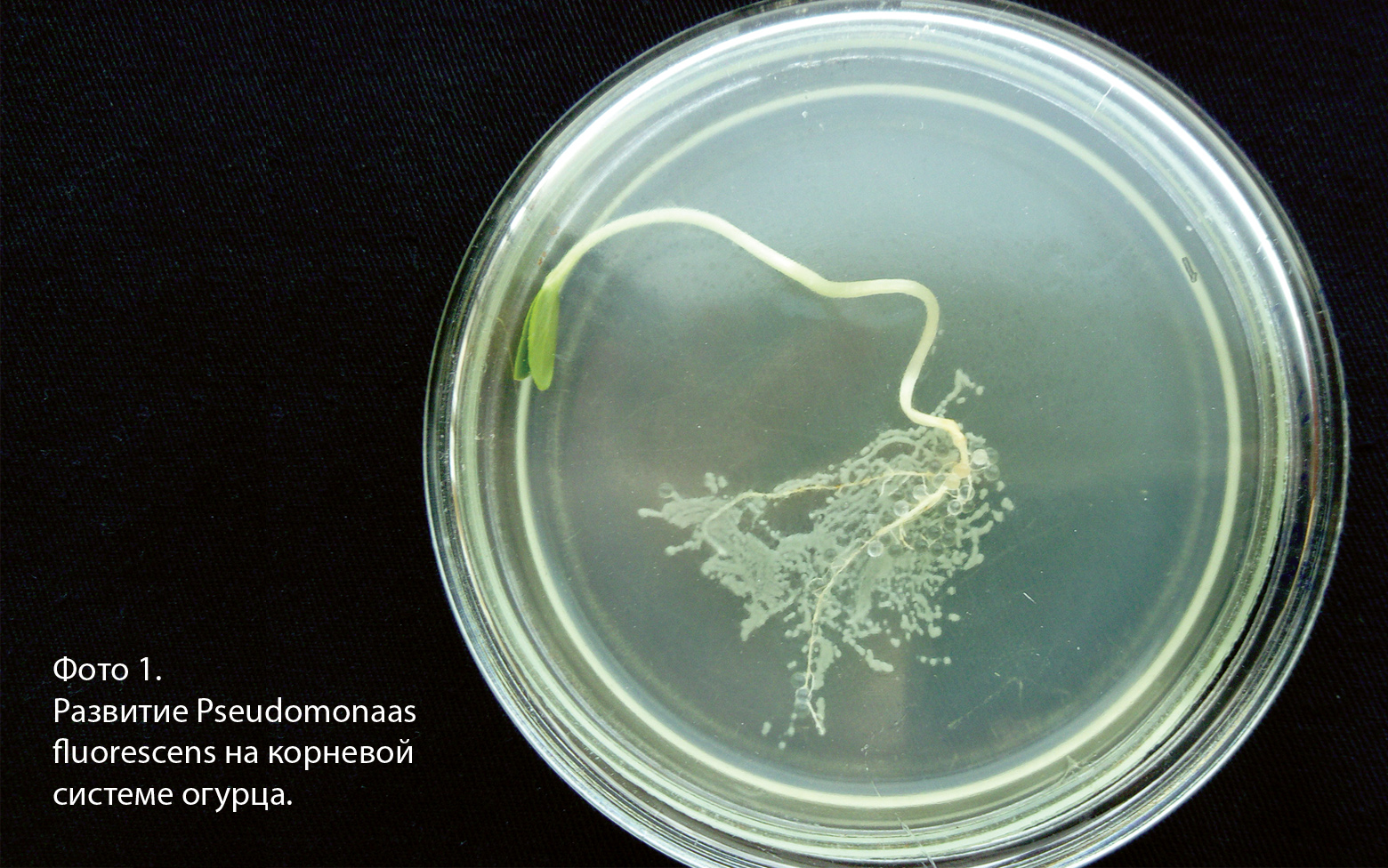
Как видно на фото 1 , характерные, однородные колонии расположены равномерно по всей длине корневой системы проростка огурца. Последующее микрокопирование колоний при помощи фиксированных окрашенных препаратов подтвердило, что по всей длине корневой системы были обнаружены исходные клетки Pseudomonas fluorescens . Аналогичные результаты были получены для всех образцов семян, извлеченных из установки с интервалом в одни сутки. Таким образом можно говорить о том, что клетки Pseudomonas fluorescens , нанесенные на семя огурца, при его прорастании растут вместе с корневой системой, по всей видимости покрывая ее. Вторым не менее интересным результатом является то, что ни на проростке, ни на семядолях во всех образцах мы не обнаружили никаких клеток, в том числе и клеток Pseudomonas fluorescens .
Полученные результаты показывают, что клетки Pseudomonas fluorescens эффективно колонизируют корневую систему огурца сорта Атлет и растут вместе с ростом корневой системы. Это может происходить только за счет выделений, образующихся при прорастании семян, скорее всего на этой стадии преобладают сахара, ди- и трикарбоновые кислоты, аминокислоты. А вот полное отсутствие микроорганизмов на стебле и семядолях проростка огурца свидетельствует о том, что их развитие не только невозможно в виду отсутствия экссудатов, которые в данной части растения не выделяются, но и скорее всего их развитие ингибируется продуктами метаболизма растения. Что это за вещества (фитоалексины или иные органические соединения или комплекс литических ферментов) пока не ясно, но ясно, что при обработке семян по принятой нами методике часть микроорганизмов просто неизбежно должна была контактировать с семядолями растения. Безусловно данные результаты требуют еще осмысления и проведение дальнейших исследований.
Бактерии Pseudomonas fluorescens обладают фунгицидными свойствами и соответственно необходимо было исследовать, как проявляются эти свойства у клеток, выросших на поверхности корневой системы проростков огурца.
Для этого были проведены эксперименты, в которых семена огурца обрабатывались суспензией клеток Pseudomonas fluorescens , помещались в систему выращивания, а далее, через сутки после того, как семена начинали прорастать, в систему стерильно вносили суспензию спор Fusarium oxysporum . Этим мы моделировали появление фитопатогенного микроорганизма рядом с прорастающим семенем.
В качестве контроля был взят образец семян, не обработанный суспензией клеток Pseudomonas fluorescens . Как и в предыдущем эксперименте, через каждые сутки одно из растений изымали из установки для определения колонизации корневой системы высевом на агаризованную среду. Контрольный вариант анализировали в конце эксперимента. Все остальные параметры эксперимента (температура, режим полива) оставались прежними.
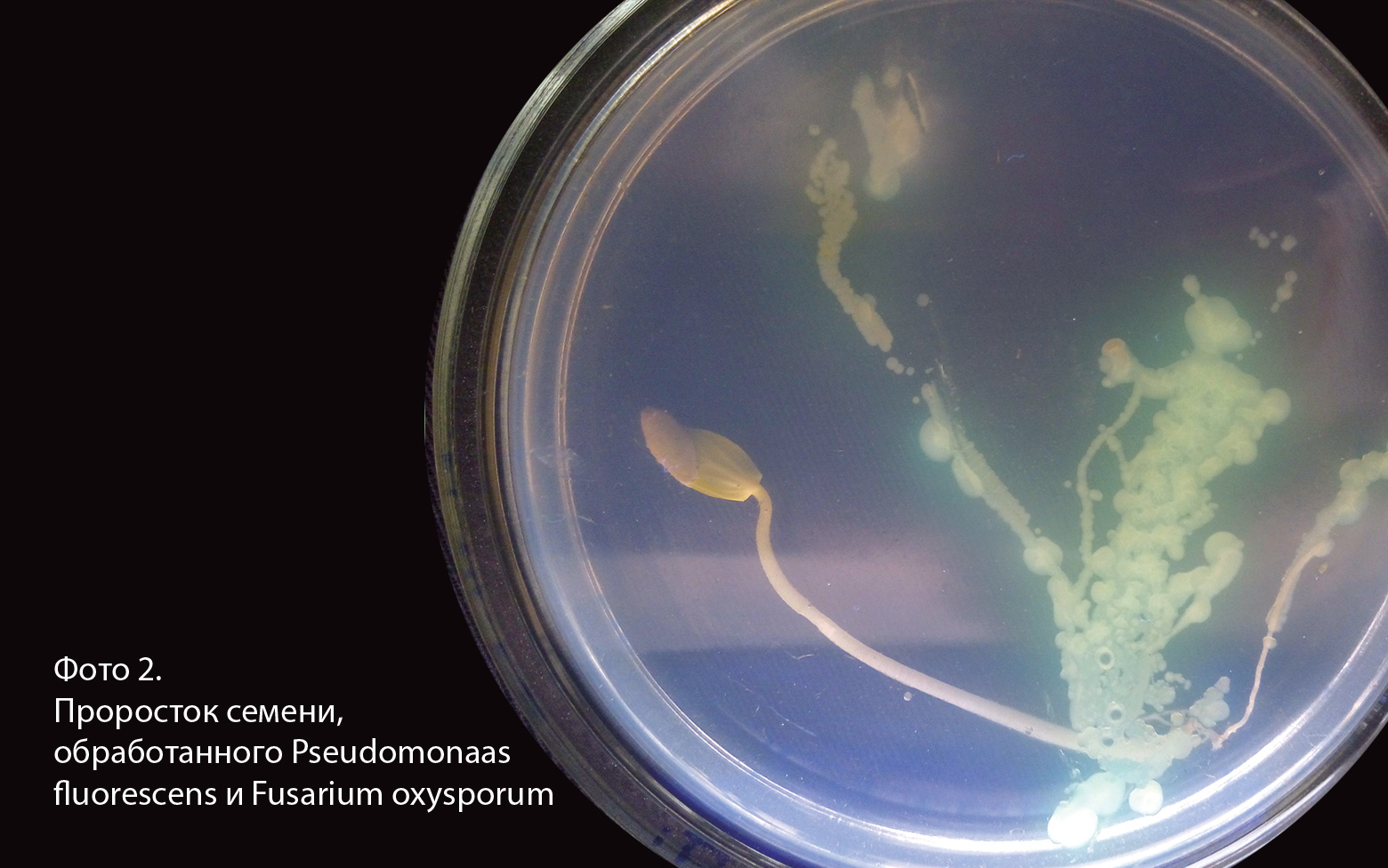
На фото 2 показан отпечаток корневой системы огурца, на семена которого были нанесены клетки Pseudomonas fluorescens , а затем после суток проращивания клетки Fusarium oxysporum . Как видно на фотографии вдоль корневой системы проростка практически нет колоний Fusarium oxysporum , зато вся корневая система покрыта колониями Pseudomonas fluorescens . В контрольном варианте вся корневая система проростка огурца покрыта Fusarium oxysporum (фото 3).

Таким образом из эксперимента видно, что предварительная обработка семян огурца сорта Атлет F1 клетками Pseudomonas fluorescens обеспечивает равномерное распределение клеток по корневой системе проростка несмотря на то, что их рост происходит против градиента кислорода. Это обусловлено тем, что вдоль прорастающей корневой системы находится зона с максимальной концентрацией экссудатов.
Отсутствие заражения корневой системы Fusarium oxysporum в варианте предварительной обработки семян клетками Pseudomonas fluorescens скорей всего объясняется совокупностью свойств клеток Pseudomona sfluorescens :
- высокой скоростью метаболизма экссудатов корневой системы огурца, очень низкой остаточной концентрацией экссудатов;
- колонизацией вдоль растущей корневой системы проростка и скорее всего образованием многослойной микробной пленки;
- стимулирование роста корневой системы за счет образования активных для растения биологических соединений;
- достаточно высокой фунгицидной активностью против грибов рода Fusarium.
1. Метлицкий Л.В. Как растения защищаются от болезней. – Наука, 2013.
2. Нетрусов А.И., Егорова М.А., Захарчук Л.М. Практикум по микробиологии: Учеб. пособие/Под ред. А.И.Нетрусова. – 2005.
3. Hoagland D. R. et al. The water-culture method for growing plants without soil //Circular. California agricultural experimentstation. – 1950. – Т. 347. –2nd edit.
5. Горюнова О.Б., Марквичев Н.С. Профилактическая защита рассады от болезней с умом. Как? // Биом. – 2017. –№1. –Москва
Читайте также:

