Штриховой посев при испытании антагонистической активности бактерий
Обновлено: 08.07.2024
Определить антагонистическую активность микроорганизмов Xanthomonas, Planococcus, Fusarium moniliforme и Alternaria по отношению к Bacillus subtilis.
Суть метода:
При использовании метода перпендикулярных штрихов на поверхность агаризованной среды в чашке Петри засевают штрихом исследуемый микроб-антагонист, продуцирующий антибактериальное вещество. Посев делают по диаметру чашки, которую затем помещают в термостат при температуре, оптимальной для роста.
Продолжительность культивирования определяется скоростью роста антагониста. После завершения роста и диффузии продуцируемого вещества в агаризованную среду, перпендикулярно к выросшему штриху, подсевают штрихами тест-культуры, начиная от краев чашки. Чашки помещают в термостат на 48 часов.
Если изучаемый микроорганизм-антагонист образует диффундирующее в среду вещество, оказывающее антимикробное действие в отношении тест-культур, то рост последних будет начинаться на некотором расстоянии от роста самого антагониста.
Чем больше это расстояние, тем более чувствительна тест-культура к продуцируемому антибиотическому веществу. Нечувствительные микроорганизмы будут развиваться в непосредственной близости от штриха.
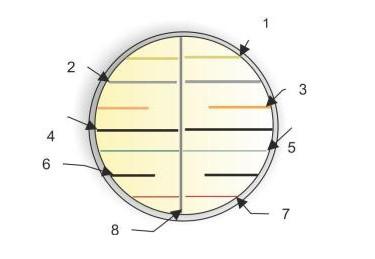
Рисунок 1 - Определение антагонистической активности микроорганизмов методом перпендикулярных штрихов (1, 2, 4, 5, 7 - рост нечувствительных, 3, 6 – рост чувствительных к антибактериальному веществу микроорганизма-антагониста (8) тесткультур)
Ход работы:
На поверхность агаризованной среды в чашки Петри засевали штрихом, исследуемый вид бактерий-антагонистов сенной палочки (Bacillus subtilis).
В первой эксперименте к сенной палочки перпендикулярно к штриху, подсевали штрихами тест-культуры бактерий Xahthomonas и Planococcus. Во втором эксперименте подсевали грибы Fusarium moniliforme и Alternaria.
Чашки поместили в термостат на 48 часов.
Результаты:


Рис. 2. Антагонистическая активность микроорганизмов:
1 – Planococcus; 2 – Xanthomonas; 3 – Alternaria; 4 – Fusarium moniliforme.
Вывод:
Bacillus subtilis оказывает нейтральное сдерживающее воздействие по отношению к Xanthomonas и Planococcus. Bacillus subtilis не подавляет рост грибов.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.

ОПРЕДЕЛЕНИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ ПРОБИОТИЧЕСКИХ ШТАММОВ МИКРООРГАНИЗМОВ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Основной проблемой последних лет является широкое распространение резистентных форм патогенных микроорганизмов и снижение эффективности ряда антибиотиков. Пробиотики, в отличие от антибиотиков, не оказывают отрицательного воздействия на нормальную микрофлору, поэтому их широко применяют для профилактики и лечения дисбактериозов.
Важной особенностью пробиотиков является их способность повышать противоинфекционную устойчивость организма, оказывать в ряде случаев противоаллергенное действие, регулировать и стимулировать пищеварение. В настоящее время в медицине уже широко используют лактобактерин, бифидум-бактерин, колибактерин, бификол, ацилакт и другие пробилтические препараты.
Для решения поставленной цели нами проводились исследования по изучению антибиотикопродуктивности исследуемых пробиотических штаммов микроорганизмов, в ходе которых была выявлена их антагонистическая активность относительно тест-организмов. Максимальная антагонистическая активность была выявлена по отношению к Escherichia coli (таблица 1).
В первую очередь, мы попытались определить, на какие сутки происходит наибольшая выработка антибиотикоподобных веществ в питательную среду. Для этого мы использовали метод с агаровыми лунками. Исследуемые микроорганизмы выращивали в питательном бульоне в течение 48, 72 и 96 часов. В дальнейшем опыте использовали фильтрат от бактерий, по результатам которого выяснили, что наибольшая выработка антибиотикоподобных веществ происходит на вторые сутки у Escherichia coli М-17 и Lactobacillusacidophilus, на третьи сутки культивирования Enterococcus faecium. Это можно объяснить ростом популяции бактерий и конкуренцией за питательные компоненты среды.
Таблица 1 – Сравнительная таблица по антибиотикопродуктивности методом наложения дисков
Одной из важнейших проблем современного здравоохранения является нарушение микробиоценоза желудочно-кишечного тракта (дисбактериоз), которое встречается у 70-90% населения большинства стран мира, в том числе и в России. Поэтому для профилактики и коррекции дисбактериозов крайне перспективным и экономически выгодным является создание доступных пробиотических препаратов.
Цель: оценить антагонистическую активность и биосовместимость перспективных для селекции потенциальных в качестве пробиотиков штаммов бифидобактерий и лактобактерий.
Материалы и методы
Результаты исследования
При определении антагонистической активности бифидобактерий и лактобацилл, была выявлена их высокая активность как по отношению грампозитивных, так и грамнегативных микроорганизмов, особенно B.subtilis, Shigella sonnei и Pseudomonas aeruginosa. Однако в отношении дрожжеподобных грибов рода Candida испытуемые штаммы были не активны. Установлено, что исследуемые бифидобактерии и лактобациллы не оказывают антагонистического воздействия между собой. В результате определения антагонистической активности исследуемых бифидобактерий и лактобацилл по отношению к представителям нормофлоры человека и другим пробиотическим штаммам установлено отсутствие их взаимного антагонизма.
Выводы
Таким образом, изученные штаммы лактобацилл и бифидобактерий могут быть использованы в качестве пробиотических штаммов при создании безопасного и эффективного пробиотика.

В работе представлены результаты определения антагонистической активности, выделенных из слепых отростков желудочно-кишечного тракта перепелов культур лактобацилл in vitro диффузионными методами.
Ключевые слова: Lactobacillus, тест-штамм, антагонизм, метод лунок, метод перпендикулярных штрихов, метод капель, культивирование, ингибирование
В последние годы серьезной проблемой гуманитарной и ветеринарной медицины стало распространение антибиотикорезистентных штаммов патогенных и условно-патогенных бактерий [2; 7; 10]. Следует отметить, что повсеместное использование антибиотиков в составе кормов в настоящее время привело также к снижению естественной резистентности организма сельскохозяйственных животных и птицы. Длительная антибиотикотерапия провоцирует угнетение собственной микрофлоры, при одновременном нарушении обменных процессов в организме. В свете сложившейся ситуации актуально применение с целью профилактики и терапии болезней животных и птицы пробиотических микроорганизмов (лактобациллы, энтерококки, бифидобактерии) [1; 3; 11; 12; 13].
Важнейшее практическое значение в микробиологии имеет правильное представление о динамике изменений в составе микрофлоры организма, особенно кишечника, и о возможных путях нормализации микробного ценоза при резких нарушениях количественного и качественного состава микрофлоры, ведущих к состоянию дисбактериоза [2; 4; 6; 8].
Одним из путей искусственного вмешательства в формирование нормального микробиоценоза или предотвращения возможных его нарушений является применение бактерийных препаратов, основным компонентом которых должны быть микробы, антагонистически действующие в отношении нежелательной, условно-патогенной микрофлоры. Такие препараты, используемые в целях бактериотерапии, применяются довольно широко. В то же время у различных видов животных и птицы циркулируют характерные для данных субъектов пробиотические микроорганизмы, и не всегда использование препаратов, сконструированных на основе бактерий, выделенных от одного вида животных эффективно при применении у других видов [9; 14].
Существующие методы определения антагонистической активности молочнокислых и других бактерий можно разделить на две группы: методы in vitro и in vivo. В первой группе применяемых методик штамм-антагонист и тест-культура взаимодействуют в искусственных условиях внешней среды, а во второй — непосредственно в тех естественных условиях, в которых планируется эксплуатировать предполагаемый штамм-антагонист. Методы in vitro позволяют быстро проверить большой массив штаммов молочнокислых бактерий и тест-культур нежелательных микроорганизмов (санитарно-показательных, патогенных или технически вредных). К данной группе относятся диффузионные методы и методы тестирования в жидких питательных средах. Первые (методы лунок, блоков, перпендикулярных штрихов, капель и т. п.) основаны на диффузии антибиотиков, образуемых испытуемыми штаммами лакто- и других бактерий, в толщу агаровой среды, содержащей тест-культуру, и подавлении роста последней.
Материалы иметоды исследований. Объектами исследований являлись лактобактерии — Lactobacillus agilis, Lactobacillus intermedius и Lactobacillus salivarius, которые независимыми микробиологическим методом, методом количественной полимеразной цепной реакции в реальном времени и метагеномными методами были выделены из слепых отростков желудочно-кишечного тракта перепелов [5].
Антагонистичскую активность выделенных культур лактобацилл определяли in vitro диффузионными методами: методом лунок, перпендикулярных штрихов и капель в различных модификациях по отношению к тест-культурам: Salmonella enterica subsp. enterica, выделенной от кур-несушек на Новороссийской птицефабрике; Staphylococcus aureus, выделенной от цыплят-бройлеров на Приморской птицефабрике Приморско-Ахтарского района; Escherichia coli А-20/О137, выделенной от кур-несушек на Новомышастовской птицефабрике Красноармейского района.
Результаты исследований иих обсуждение. Поскольку метод перпендикулярных штрихов имеет существенный недостаток (продуцент антибиотического вещества и тест-организм выращивают на одной среде, но не всегда одна и та же среда одинаково благоприятна как для продуцента и образования им антибиотика, так и для роста тест-организма), при тестировании антагонистической активности лактобацилл этим методом мы использовали модификацию, при которой на чашку со средой для культивирования засевали экспоненциальную культуру исследуемого штамма лактобацилл и культивировали при температуре 38 °С в течение 48 ч, затем в условиях стерильности убирали половину чашки питательной среды, заливали АГВ, после застывания которого перпендикулярно от края чашки к штриху выросшей культуры лактобацилл подсевали штрихом суточные экспоненциальные культуры тест-штаммов. Чашку вновь инкубировали при тех же условиях в течение 24 ч. О наличии и степени антагонистической активности у испытуемых культур лактобацилл судили по величине зоны ингибирования тест-штамма на границе со штрихом роста.
Для объективной оценки антагонистического действия лактобактерий и других микроорганизмов, выявляемого этим методом, необходимо учитывать, что он дает преимущество штаммам, которые продуцируют ингибиторные соединения небольшой молекулярной массы, быстрее диффундирующие в толщу агарового слоя и, следовательно, дающие более обширные зоны ингибирования роста тест-культуры.
Для более объективной оценки антагонистической активности пробиотических культур использовали метод лунок. В слое агара, засеянного тест-штаммом, пробочным сверлом вырезали лунки диаметром 6 мм, в которые помещали тестируемые культуры лактобацилл в концентрации 10 9 микробных клеток. Засеянную чашку Петри выдерживали при температуре 4 °С в течении 30 мин, затем в термостате при температуре 38 °С в течении 1824 ч, далее измеряли зону ингибирования роста тест-штамма вокруг лунки.
При определении антагонистической активности методом капель на поверхность подсушенной агаровой среды наносили капли культур лактобацилл и после инкубации чашек Петри при 38 °С в течение 2448 ч (для роста тестируемых бактерий и продуцирования ими ингибиторных веществ) сверху агара наливали слой полужидкой агаровой среды, содержащей тест-штамм в концентрации 10 5 /см 3 , и вновь инкубировали до появления зон ингибирования роста тест-штамма — 1824 ч.
При изучении антагонистической активности выделенных от перепелов культур лактобацилл, три штамма ингибировали рост тест-культур в пределах 25 мм, причем, при использовании метода перпендикулярных штрихов, зоны ингибирования роста выявлено не было, метода лунок — 23 мм, метода агаровых слоев — 25 мм. Наиболее чувствительной были культуры S. enterica subsp. enteric (зоны задержки роста 3 и 7 мм), и E. coli А-20/О137 (зоны задержки роста 3 и 6 мм).
Вывод. Таким образом, для производства пробиотической добавки выделенные культуры лактобацилл (Lb. salivarius, Lb. intermedius и Lb. agilis) перспективны.
1. Антибактериальная активность микроводоросли / Ю. А. Лысенко, Н. Л. Мачнева, В. В. Борисенко, В. И. Николаенко // Молодой ученый. — 2015. — № 5–1 (85). — С. 17–20.
2. Биохимические и микробиологические аспекты получения биопродуктов и фармпрепаратов и эффективность их применения в птицеводстве / А. И. Петенко, С. Б. Хусид, И. С. Жолобова, Г. А. Плутахин, Ю. А. Лысенко, А. Г. Кощаев // Труды Кубанского государственного аграрного университета. — 2015. –№ 52. — С. 212–218.
3. Интенсификация птицеводства с применением пробиотических кормовых добавок / Ю. А. Лысенко, Т. М. Шуваева, В. В. Радченко, Е. В. Ильницкая, А. Г. Кощаев // Ветеринария Кубани. — 2015. — № 5. — С. 7–10.
4. Кощаев А. Г. Пробиотик трилактобакт в кормлении перепелов / А. Г. Кощаев, О. В. Кощаева, С. А. Калюжный // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. — 2014. — № 95. — С. 633‒647.
5. Метагеномное профилирование бактериозеноза пищеварительного тракта различных линий перепелов / Е. Р. Кириллова, Т. В. Григорьева, М. Н. Синягина и др. // Материалы всероссийской конференции с международным участием, посвященная 40-летию кафедры генетики Института фундаментальной медицины и биологии Казанского университета. — Казань. — 2016. — С. 5556.
6. Мигина Е. И. Изучение токсикологического и раздражающего действия пробиотической кормовой добавки Трилактосорб для использования в перепеловодстве / Е. И. Мигина, Ю. А. Лысенко, А. Г. Кощаев // Ветеринария Кубани. — 2014. –№ 4. — С. 13‒16.
7. Пробиотическая кормовая добавка в кормлении перепелов / А. Г. Кощаев, Ю. А. Лысенко, А. В. Лунева, А. В. Лихоман // Зоотехния. — 2015. — № 10. –С. 4–6.
8. Продуктивность и мясные качества перепелов при использовании пробиотической кормовой добавки / А. Г. Кощаев, Г. В. Фисенко, Ю. А. Лысенко, Г. А. Плутахин, Т. М. Шуваева, Е. В. Ильницкая, А. С. Родионова // Аграрная наука. — 2015. — № 11. — С. 15–18.
9. Фармакологическое и токсикологическое действие пробиотической кормовой добавки, используемой в кормлении птицы / Ю. А. Лысенко, Г. В. Фисенко, А. С. Родионова, В. В. Радченко, А. Г. Кощаев // Зоотехния. — 2015. — № 12. –С. 17–18.
10. Фармакологическое обоснование использования жидкого пробиотика на основе молочнокислой и пропионовокислой микрофлоры в перепеловодстве / Ю. А. Лысенко, Г. В. Фисенко, А. В. Лихоман, Т. М. Шуваева, В. В. Радченко, А. Г. Кощаев // Ветеринария Кубани. — 2015. — № 6. — С. 6–8.
11. Хлорелла и триходерма в качестве функциональных кормовых добавок перепелам / А. Г. Кощаев, А. И. Петенко, Г. А. Плутахин, Н. Л. Мачнева, Г. В. Фисенко, И. В. Пятиконов // Аграрная наука. — 2012. — № 7. — С. 28‒29.
12. Koshchaev A. G. Peculiarities of formation of the charolais cattle gene pool in the south of Russia / A. G. Koshchaev, I. V. Shchukina, O. V. Koshchaeva // Advances in agricultural and biological sciences. — 2016. — V. 2. — № 3. — P. 23‒32.
13. Koshchayev A. G. Perspectives of use a polystrain feed probiotic in poultry / A. G. Koshchayev, Y. A. Lysenko, O. V. Koshchayeva // Advances in Agricultural and Biological Sciences. — 2015. — V. 1. — № 2. — P. 44‒52.
14. Kuzminova E. V. Influence of the carotenoid-based preparations on the metabolic and antioxidant protection of the cows’ body / E. V. Kuzminova, M. P. Semenenko, A. G. Koshchaev // Advances in agricultural and biological sciences. — 2015. — V. 1. — № 3. — P. 33‒40.
Основные термины (генерируются автоматически): антагонистическая активность, метод лунок, культура, бактерия, зона задержки роста, метод капель, объективная оценка, течение.
Ключевые слова
антагонизм, культивирование, лактобацилла, тест-штамм, метод лунок, метод перпендикулярных штрихов, метод капель, ингибирование, Lactobacillus
Lactobacillus, тест-штамм, антагонизм, метод лунок, метод перпендикулярных штрихов, метод капель, культивирование, ингибирование
Похожие статьи
Исследование активности штамма Bacillus subtilis BZR.
Ключевые слова: бактерии-антагонисты, фитопатогенные грибы, штамм-продуцент
Химический метод, бесспорно, продолжает оставаться важнейшим средством оперативного
Уменьшение диаметра зоны ингибирования (зона задержки роста F. oxysporum var. orthoceras.
Метаболиты сибирских изолятов грибов рода Trichoderma.
Определение бактерицидной активности исследуемых экстрактов осуществляли методом лунок.
Измерение диаметра задержки роста микроорганизмов проводили на пятые и десятые сутки инкубирования.
Пробиотическая кормовая добавка с антибиотическими.
Зона задержки роста, мм. E.coli. 6,1.
Антибактериальная активность микроводоросли | Молодой ученый
Материалы и методы.
Результаты изучения антагонистических свойств экстрактов концентрата и суспензии хлореллы показали, что зона задержки роста между кишечной палочкой и экстрактом суспензии хлореллы составила 3,5 мм, а экстрактом концентрата.
Изучение антагонистических свойств штаммов Trichoderma.
Исследование антагонистической активности штаммов Trichodermaasperellumк токсинобразующим фитопатогенным грибам рода Fusarium. Для оценки антимикробной активности проводили исследования методами перпендикулярных штрихов.
Разработка технологии получения нового экологически.
. микроорганизмов проводили методом Коха [6], определение антифунгальной активности бактерий - методом встречных культур [7]
Исследования антагонистической активности показали, что для штамма B. subtilis 336g максимальное антифунгальное действие в течение.
Хранение биопрепаратов на основе штаммов. | Молодой ученый
Ежемесячно определяли титр ЖК препаратов методом разведений [5] и антифунгальную активность с использованием метода встречных культур [6]. При исследовании
Рис. 1. Титр и антагонистическая активность ЖК штамма B. subtilis BZR 336g на КГС в процессе хранения.
Перспектива биоконтроля фитопатогенных микромицетов.
Антфунгальную активность штаммов изучали в условиях лабораторных опытов методом
Зоны угнетения роста тест-культур, мм.
Таким образом, из исследуемых коллекционных культур штаммы бактерий рода Bacillus проявили антифунгальную активность к F. glumarum.
Читайте также:

