Среды для посева грибов
Обновлено: 17.09.2024
а) Агар Сабуро — основа сред для выделения и культивирования грибов.
Состав:
• питательный агар — 1000 мл,
• глюкоза 40,0 г.
• pH-5,6±0,2.
• Стерилизовать при 121°С 15 мин.
Для придания селективных свойств в среду перед стерилизацией вносят 0,05 г левомицетина сукцината (хлорамфеникола)
б) Селективная и дифференциальная среда с 2,3,5-трифенил- тетразолиумхлоридом для выделения и дифференциации видов рода Candida.
Состав:
• агар Сабуро — 1000 мл,
• 2,3,5-тетразолиум-хлорид — 0,1 г.
Приготовление:
Перед употреблением в расплавленный питательный агар Сабуро вносят навеску 2,3,5-тетразолиума хлорида, растворенную в небольшом количестве стерильной воды, перемешивают и разливают по чашкам Петри.
в) Картофельно-морковная среда с желчью (РСВ) для идентификации С. albicans на основании микроморфологических признаков.
Состав:
• очищенная от кожуры морковь (натертая на терке) — 20,0 г,
• очищенный от кожуры картофель (натертый на терке) — 20,0 г,
• агар — 25,0 г,
• свежая бычья желчь — 150 мл,
• дистиллированная вода — 1000 мл.
• pH-6,0 ± 0,2.
Приготовление:
Агар и натертые овощи помещают в колбу с водой, доводят агар до растворения при подогревании, устанавливают pH, стерилизуют при 121°С -15 минут. Перед употреблением к расплавленной и охлажденной агаровой среде добавляют свежую бычью желчь, среду разливают в чашки Петри.
г) Кукурузно-агаровая среда для идентификаци C.albicans на основании микроморфологических признаков.
Состав:
• настой кукурузной муки — 50,0 г,
• глюкоза — 2,0 г,
• агар — 15,0 г,
• вода дистиллированная — 1000 мл.
• pH-6,0 ± 0,2.
Приготовление:
Готовят настой кукурузной муки до полного ее растворения в воде. К готовому настою добавляют основные ингредиенты, устанавливают pH, стерилизуют при 121°С — 15 мин.
д) Агаровая среда (модифицированная) для теста на использование нитрата.
Состав:
• нитрат калия KNO3 1,6 г,
• глюкоза — 40,0 г,
• бромтимоловый синий — 0, 12 г,
• агар — 16,0 г,
• вода дистиллированная — 1000 мл.
• рН - 6,0±0,2.
Приготовление:
Ингредиенты смешивают, помещают в воду, смесь нагревают при помешивании до кипения и полного растворения. Смесь должна иметь желтый цвет. Для доведения pH до 5,9-6,0 к смеси но каплям добавляют 1 N NaOH до приобретения зеленого цвета. Реакцию среды проверяют с помощью индикаторной бумаги или другим способом. Среду разливают по флаконам, стерилизуют при 121°С в течение 15 мин. Готовую среду разливают по чашкам или пробиркам (для получения скошенного агара). Среду засевают тестируемым грибом и инкубируют не менее 7 суток при температуре 25-30°С. При отрицательной реакции цвет среды — зеленовато-желтый, при положительной — голубой.
е) Агар Диксона.
Состав:
• солодовый экстракт — 18,9 г,
• пептон — 18,0 г,
• агар — 7,25 г,
• обезвоженная бычья желчь — 10,0 г,
• твин-40 - 5 мл,
• глицерина моноолеат — 2,5 мл,
• дистиллированная вода — 500 мл.
• рН-5,6±1.
Приготовление:
Ингредиенты увлажняют частью взятой воды, а остальную часть воды нагревают до кипения и вносят в емкость с увлажнёнными ингредиентами, смешивают и стерилизуют при 12Г’С в течение 10 мин. Разливают по пробиркам или чашкам Петри.
На среде можно выращивать культуры малассезий или патологический материал, например, чешуйки кожи от пациента.
ж) Варианты солевого агара (солетолерантная среда) с различными концентрациями хлорида натрия.
Состав:
• глюкоза — 20,0 г,
• дрожжевой экстракт — 10,0 г,
• агар — 10,0 г,
• натрия хлорид (NaCl) — 110, 120 или 130 мг
• дистиллированная вода — 1000 мл
• pH 5,6±0,2.
Среду стерилизуют при 121°С в течение 15 мин., а затем разливают в чашки Петри.
з) Дифференциальная среда Штайба (для выделения Cryptococcus neoformans).
Состав:
• семена Guizotia abissinica (продаются в зоомагазинах) — 50,0 г,
• глюкоза — 1,0 г,
• креатинин — 1,0 г,
• калия дигидрофосфат КН2PO4 —1,0 г,
• агар — 15,0 г,
• дистиллированная вода — 1000 мл
• pH 5,5.
Приготовление:
50,0 г растертых семян Guizotia abissinica добавить к 1000 мл дистиллированной воды, кипятить в течение 30 мин и затем профильтровать через бумажный фильтр. Довести водой объем фильтрата до 1000 мл и добавить остальные ингредиенты. Автоклавировать при 110°С в течение 20 мин. Среда должна быть бесцветной и иметь pH 5,5. Для подавления бактериальной микробиоты к охлажденной среде добавить 40 ЕД/мл стрептомицина и 20 ЕД/мл пенициллина. Коричневая окраска колоний С. neoformans (в отличие от других микроорганизмов) появляется на 4-10-й день культивирования.
и) Агаризованная среда L-DOPA (для идентификации Cryptococcus neoformans).
Состав:
• L-аспарагин — 1,0 г,
• глюкоза — 1,0 г,
• КН2РО4 - 3,0 г,
• MgSO3*7H2O - 0,25 г,
• тиамин — НС1 — 1,0 г,
• биотин — 5,0 мкг,
• L-DOPA — 100,0 мг,
• агар — 20,0 г.
• дистиллированная вода — 1000 мл • pH 5,6.
к) Сусло-агар. Солодовое сусло профильтровать, разбавить в 2 раза водопроводной водой, разлить в пробирки или колбы и стерилизовать при 121°С 30 минут. Затем из сусла приготовить 2%-ную агаровую среду.
л) Картофельный агар для выделения и быстрой идентификации плесневых грибов.
Состав:
• обезвоженные картофельные хлопья — 20,0 г,
• глюкоза — 10,0 г,
• агар — 15,0 г,
• дистиллированная вода — 1000 мл.
Смешивают ингредиенты и доводят смесь до кипения при постоянном помешивании. Стерилизуют среду при 121°С 15 мин Разливают в чашки Петри или пробирки. Картофельные хлопья оседают на дно, но среду не нужно взбалтывать.
м) Агар Чапека-Докса.
Состав:
• глюкоза — 20,0 г,
• калий моногидрофосфат К2НРО4 - 1,0 г,
• нитрат натрия NaNO3 - 3,0 г,
• хлористый калий КС1 — 0,5 г,
• MgSO4 • 7Н2O — 0,5 г,
• FeSO4 - 0,015 г,
• агар — 20,0 г,
• водопроводная вода 1000 мл.
Стерилизовать в течение 30 минут при 0,5 атм.
н) Окраска калькофлуором белым.
Приготовление реактива. Растворить 0,1 г калькофлуора белого (M2R) и 0,05 Эванса голубого в 100 мл дистиллированной воды, тщательно перемешать и хранить в темной емкости при комнатной температуре.
Окрашивание: добавить 1 каплю раствора калькофлуора белого и 1 каплю 10 %-ного раствора едкого кали КОН к исследуемому образцу на предметном стекле, накрыть покровным стеклом. Просматривать в УФ-свете, используя возбуждающий фильтр К530 и барьерный фильтр В12 (или G365 возбуждающий и LP420 барьерный фильтры).
Элементы гриба флуоресцируют зеленым или голубовато-белым светом (в зависимости от сочетания фильтров) на тусклом красноватом фоне.
При составлении питательных сред для микроорганизмов необходимо учитывать их потребность в элементах питания. По составу питательные среды подразделяются на две группы: естественные (натуральные) и синтетические.
Естественными обычно называют среды, которые состоят из продуктов животного или растительного происхождения, имеющих сложный неопределенный химический состав.
На естественных средах хорошо развиваются многие микроорганизмы, так как в этих средах имеются, обычно, все компоненты, необходимые для роста и развития. Однако среды с неопределенным составом малопригодны для изучения физиологии обмена веществ микроорганизмов, поскольку они не позволяют учесть потребление ряда компонентов среды, а с другой стороны, выяснить, какие вещества образуются по ходу развития микроорганизмов. Это связано с тем, что состав естественных сред очень сложен; кроме того, он не является постоянным, так как существенно колеблется в зависимости от сырья и способа приготовления сред. Это заметно влияет на рост микроорганизмов. Естественные среды неопределенного состава используются главным образом для поддержания культур микроорганизмов, накопления их биомассы и для диагностических целей.
Для грибов, наиболее широко используют полноценные среды, приготовленные на основе солодового сусла. В состав сусла входят глюкоза, фруктоза, сахароза, мальтоза, мальтотриоза, небольшое количество пентоз – арабиноза, ксилоза, рибоза. Эти вещества и являются основными источниками углерода и энергии для грибов. В сусле имеются также аминокислоты, витамины и минеральные вещества. Для культивирования грибов в питательных средах обычно устанавливают рН 5–6, поскольку грибы в большинстве своем являются ацидофильными микроорганизмами.
Синтетические среды − это такие среды, в состав которых входят только определенные, химически чистые соединения, взятые в точно указанных концентрациях. Синтетические среды следует готовить на дистиллированной воде. Для разработки синтетических сред, обеспечивающих нормальный рост изучаемого микроорганизма или максимальный биосинтез какого-либо продукта его жизнедеятельности, необходимо знать особенности обмена веществ данного организма и его потребности в источниках питания. В настоящее время в распоряжении микробиологов имеется достаточное количество синтетических сред, не уступающих по своим качествам сложным средам неизвестного состава. Синтетические среды могут иметь относительно большой набор компонентов, но могут быть и довольно простыми по составу. Синтетические среды наиболее удобны для исследования обмена веществ микроорганизмов. Зная точный состав и количество входящих в среду компонентов, можно изучить их потребление и превращение в соответствующие продукты обмена.
Для курсового проекта были использованы следующие питательные среды:
- сусло-агар (СА). Поскольку основой служит сусло-бульон с кислой среды, для получения плотных агаризованных сред берут небольшой избыток агар-агар в расчете на то, что в процессе стерилизации часть его подвергнется температурно-кислотному гидролизу. Во флаконы с сусло-бульоном вносят агар-агар до концентрации 2–2,5% для плотной среды и 1,0-1,5% для полужидкой. Стерилизуют при 0,5 ати 30 мин.
- питательный агар для грибов (агар Чапека)
Для приготовления агара Чапека берут 20−30 г агар-агара, заливают его 1000 мл дистиллированной воды и вымачивают в течение 2 ч при комнатной температуре. Воду сливают и измеряют ее объем для определения количества воды, впитавшейся агаром. Затем агар промывают 2−3 раза дистиллированной водой.
Взвешивают остальные компоненты среды (сахароза − 30,0 г, азотнокислый натрий −3,0 г, фосфорнокислый однозамещенный калий −1,0 г, сернокислый магний − 0,5 г, хлористый калий − 0,5 г, сернокислое закисное железо−0,01 г) и растворяют в дистиллированной воде, которую берут в объеме, равном количеству воды, слитой при вымачивании агара. К раствору добавляют отмытый агар, после чего среду варят в автоклаве текучим паром в течение часа.
Полученную среду фильтруют, разливают по пробиркам или колбам и стерилизуют в автоклаве при температуре 110−112°С (под давлением 0,05 МПа по показанию манометра) в течение 20 мин.
Для ее приготовлении к 100 см 3 дистиллированной воды добавляют 1,8 г агара и оставляют на 30 мин для его набухания, затем добавляют 4 г мальтозы или глюкозы и 1 г пептона, нагревают до полного растворения (при наличии осадка фильтруют). Стерилизуют среду при температуре 115 0 С в течение 15 минут.
Для повышения селективности, т.е. подавления развития посторонних микроорганизмов, в среду Сабуро добавляют растворы антибиотиков – пенициллина (50 ЕД/см 3 ), левомицетина (10 мкг/см 3 ). [6]
Кроме того, в курсовом проекте был использован физиологический раствор (ФР). Для его приготовления 8,5 г хлористого натрия растворяют в 1 л дистиллированной воды. Стерилизуют при 0,15 МПа в течение 20 минут [19].
Субстрат для выращивания грибов
pH среды, принципы составления
В большинстве случаев субстрат для культивирования грибов содержит в достаточном количестве все основные макро- и микроэлементы, необходимые для развития мицелия и плодообразования. Рассмотренные выше минеральные добавки предназначены для создания следующих эффектов:
1) подщелачивания и усиления буферной емкости субстрата (по отношению к закислению);
2) улучшения структуры и состояния воды в субстрате (улучшается аэрация, связывается свободная вода).
Улучшение структуры субстрата, повышение его аэрированности положительно сказывается на развитии мицелия. Гипс слабо изменяет рН среды, он не является щелочным агентом. Жженый гипс или алебастр связывает воду, снова превращаясь в гипс:
СаSО 4 . 1/2Н 2 О + 11/2Н 2 О -> СаSО 4 . 2Н 2 О
Некоторые грибоводы добавляют до 10% гипса от сухой массы субстрата, что позволяет сохранять оптимальную структуру в течение длительного периода культивации.
Реакция среды.
Важным фактором роста и развития базидиальных грибов является реакция питательной среды. Реакция внешней среды оказывает влияние на рН клеточного содержимого. Меняя рН питательной среды, Бьюнинг, пользуясь индикаторами, наблюдал изменение рН клеточного содержимого от 4,2 до 5,0.
Установлено, что рН клеточного сока плодовых тел шляпочных грибов колеблется в пределах 5,9 — 6,2. Большинство видов грибов предпочитают слабокислые среды. Процессы роста и спороношения могут иметь различные оптимумы рН. При развитии гриба рН среды меняется. Высшие грибы хорошо развиваются при рН 6,0, однако пределы от верхней до нижней границы рН у различных видов отличаются друг от друга. Семейство строфариевых, например, в основе своей ксилофиты, растут на слабокислых почвах. В зависимости от источника углерода реакция в процессе роста гриба может сдвигаться в сторону подкисления или подщелачивания. Источники углерода, изменяя рН, играют определенную роль в образовании органических кислот. От уровня рН зависят поступление тех или иных питательных веществ в клетку, активность ферментов, образование грибами пигментов, антибиотиков, а также полового и бесполого спороношений. Значение оптимального рН для развития высших грибов определяется соотношением в среде углерода и азота. Увеличение концентрации углеводов в среде при постоянном содержании азота вызывает значительные отклонения в углеводном обмене грибов. В среде, в самом мицелии накапливаются различные продукты обмена, органические кислоты, жиры и др. Рост и развитие мицелия при этом прекращаются.
рН среды можно корректировать добавлением щелочи или мела, но, как правило, необходимо использовать буферную смесь, лучше в виде фосфатного буфера (фосфат калия).
[в связи с тем, что текст публикуется с некоторыми сокращениями, здесь была выпущена таблица (Кислотность субстратов после добавления извести) и часть текста о благоприятном рН , касающийся конкретных видов – строфарий и вешенки]
Показано, что интенсивный биосинтез ПСБ коррелирует с фазой активного роста мицелия при кислом рН среды (Catalfomo Ту1ег, 1964).
Такое же действие оказала покрывная смесь. Земля черного цвета с рН 5,75 (крупнозернистый чернозем г. Богородск) давала более быстрое и более обильное плодоношение, чем покрывающая земля коричневого цвета Питерского происхождения с рН 6,6.
Имеются отдельные исследования по влиянию различных источников углерода, азота (Leung, Paul, 1969; Scurti еt al., 1972) и фосфора (Neal et al., 1968) на рост и продукцию ПСБ в культурах ряда видов агариковых, однако обобщающие заключения сделать в настоящее время трудно, так как оптимальные условия культивирования, пoвидимому, индивидуальны для каждого вида. Так, синтетическая среда, предложенная Катальфоно и Тайлером, дала положительный эффект для культур P. сubensis и Panaeolus subbalteatus, но не благоприятствовала выработке ПСБ культурами Psilocybe суапеsсепs и P. pelliculosa (Catalfomo, Ту1ег, 1964; Scutri et al., 1972). Попытки увеличить биосинтез IICB в культуре P. сubensis добавками в питательную среду триптофана не увенчались успехом (Catalfomo, Tyler, 1964).
Выработка ПСБ в основном зависит от вида и штамма гриба. Установлено, что плодоношению спосoбствует высокая влажность воздуха — 95%, (Heim et al, 1958), хорошая аэрация (Heim, Wasson, 1958) и воздействие света, особенно коротковолнового диапазона вцдимой области спектра (Нeim et al., 1958; Badham, 1980).
Применение
Минеральные добавки могут нести споры конкурентных микроорганизмов, поэтому их необходимо подвергать такой же тепловой обработке, как субстрат.
Минеральные добавки надо равномерно распределять по всему субстрату путем тщательного перемешивания.
Известь добавляют в виде маточного "раствора" (болтушки).
В зависимости от состава субстрата минеральные добавки могут давать хороший результат, либо не оказывать положительного действия.
Хранить минеральные добавки надо в сухом, чистом помещении с надлежащими санитарными условиями.
ПРИНЦИПЫ СОСТАВЛЕНИЯ КОМПОЗИЦИЙ СУБСТРАТОВ.
Основные принципы.
Композиция субстрата должна удовлетворять химическим, физическим и биологическим потребностям грибов.
Химический состав обеспечивает необходимыми питательными веществами: органическими и неорганическими.
Физические свойства - обеспечивают нормальные условия развития мицелия: аэрацию, влажность.
Биологические свойства - создают необходимую селективность субстрата и развитие полезной микрофлоры.
Для составления субстратной композиции необходимо хорошо знать свойства исходных компонентов. Вариантов субстратных смесей очень много. Они разрабатываются в зависимости от местных условий, от имеющихся в распоряжении растительных отходов, от технологии подготовки субстрата и культивирования. Рассмотрим следующие основные варианты композиций:
Одноосновная: субстрат состоит только из основы, например, соломы или лузги подсолнечника;
Двухосновная: субстрат состоит из двух основных компонентов, например, солома + лузга подсолнечника;
Многокомпонентная:
а) солома - основа;
б) отруби пшеницы - питательная добавка;
в) мел (мел + гипс) - минеральная добавка;
Расширенная:
а) основа;
б) питательная добавка;
в) минеральная добавка;
г) защитная добавка (фундазол*, димилин**).
* Фундазол - это фунгицид, эффективно подавляющий развитие конкурентных плесеней.
** Димилин - это регулятор роста насекомых, ингибирующий синтез хитина и, соответственно, линьку личинок. Эффективен против личинок грибных мух и комариков.
Но лучше стараться обходиться без химических реагентов.
Субстратные композиции.
Примеры двухосновных, многокомпонентных композиций, расширенной композиции; пропись трехкомпонентной композиции субстрата на основе растительных отходов растениеводства и составление композиции субстрата, основанное на задаче улучшения физических и химических свойств даны в таблицах ниже.
Костра льна обладает хорошей аэрацией (структура), но плохой влагоемкостью. Бумага имеет хорошую влагоемкость, но очень плохую структуру (слипается в массу, аэрация недостаточная). Какавелла имеет хорошую питательность. Мел или известь смещают рН субстрата в нужную слабощелочную зону 7,0-8,0. В целом вся композиция субстрата имеет хорошие показатели по основным параметрам. Вместо бумаги можно использовать хлопковые очесы. (Для биологической защиты в субстрат еще можно добавить фундазол (50 ррm) и димилин (25 ррm) – (прим., мы не советуем это делать. В небольших лабораторных производствах можно добавлять гентамицин или 3% перекись водорода во время тепловой обработки субстрата, которая полностью разлагается на безвредные воду и кислород. Хотя данный способ нарушает селективность среды, что нежелательно и неестественно для природы).
Для роста мицелия съедобных грибов, как и других микроорганизмов, требуются вода, различные питательные вещества, определенное соотношение разных ионов, особенно водородных, и т. д.
Многие из съедобных базидиальных грибов являются ауксотрофными, т. е. для своего роста нуждаются в определенных факторах роста — витаминах, аминокислотах и т. д.
Главную роль в питании грибов играют углеродсодержащие субстраты, обеспечивая грибной организм углеродом, необходимым для синтеза веществ живой клетки, и участвуя в процессах окисления, где являются единственным источником энергии. Высшие базидиальные грибы, к которым относится большинство известных съедобных, являясь экологически неоднородной группой, сталкиваются в природе с большим разнообразием углеводов, чаще всего с полимерными формами простых сахаров. Поэтому при искусственном культивировании съедобные грибы предпочитают сахара другим источникам углерода. Существует мнение, что глюкоза является универсальным источником углерода для всех грибов, хотя она и не всегда обеспечивает максимальный рост мицелия. Для большинства съедобных грибов фруктоза является таким же хорошим источником углерода, как и глюкоза.
Из пентоз хорошо используется многими подстилочными и дереворазрушающими грибами ксилоза. На ксилозе лучше всего растут виды Agaricus, хорошо растут виды Coprinus. Из спиртов для многих базидиомицетов пригодны 6-атомный спирт маннит и 3-атомный — глицерин.
Из дисахаридов грибами используются мальтоза, целлобиоза: сахароза, по мнению многих исследователей, не является универсальным источником углерода, а лактоза использовалась наименьшим количеством исследованных штаммов.
Из полисахаридов наилучшим источником углерода является крахмал. Для многих грибов, в частности Tricholoma, Agaricus, хорошим источником углерода являются пектиновые вещества, им уступают декстрины.
Большинство высших базидиомицетов в природе принимают участие в разложении целлюлозы и хорошо используют этот высокомолекулярный углевод при искусственном культивировании. Лигнин используется многими дереворазрушающими и подстилочными грибами, однако в культуре грибы, как правило, должны быть адаптированы к этому источнику углерода. Наиболее доступен для базидиальных грибов так называемый биологический лигнин. В процессе разложения древесины разрушаются связи клетчатки с лигнином, что делает его доступным для питания гриба. Многие дереворазрушающие грибы хорошо используют лигносульфонат кальция, содержащийся в сульфитном щелоке — отходе целлюлозно-бумажной промышленности.
Относительно усвоения высшими базидиомицетами, в том числе съедобными, углеводородов сведения в литературе очень немногочисленны. При выращивании на мягких парафинах 11 видов базидиомицетов мы отметили их слабый рост, несколько лучше росли Armillariella mellea, Coriolus zonatus, Schizophyllum commune.
Японские исследователи приводят данные об усвоении высшими базидиомицетами, в том числе Pleurotus ostreatus, Flammulina velutipes, Lentinus edodes, Schizophyllum commune, неуглеводных источников углерода, интересных с точки зрения метаболизма этих грибов и как дешевые субстраты.
Изучалось усвоение алифатических спиртов, α-алканов, органических кислот трикарбонового цикла, приведены сравнительные данные о биохимическом составе плодовых тел и мицелия при выращивании грибов на глюкозе и неуглеводных субстратах. Многие испытанные субстраты оказывали стимулирующее действие как на рост мицелия в глубинной культуре, так и на плодоношение. У Lentinus edodes хорошие результаты получены на метаноле. Flammulina velutipes обнаружил хороший мицелиальный рост и плодоношение на этиловом и изопропиловом спиртах, пропиленгликоле, молочной и α-кетоглютаровой кислотах, глицерине. Стимулирующее действие оказывало добавление в среду 0,1 % дрожжевого, мясного или мальц-экстракта. Для образования мицелия у Pleurotus ostreatus наилучшими оказались глицерол и этанол. Выход мицелия на среде с 2%-ным этанолом через 72 ч составлял 10,5 г/л; мицелий содержал 55—60% белка и имел более приятный запах, чем на среде с углеводами. Испытанные грибы хорошо усваивали также этиловый, изопропиловый и пропиловый спирты, глицерин, лимонную, щавелевую, α-кетоглютаровую, молочную, яблочную, янтарную кислоты, пропиленгликоль.
Подбор источника азота очень важен для достижения хорошего роста мицелия в культуре. Потребность грибов в азоте в значительной мере зависит от снабжения углеродом, а также и от других факторов. Грибы могут использовать как неорганические, так и органические источники азота. Основными источниками неорганического азота являются нитраты и аммонийные соли. По мнению ряда исследователей, нитраты плохо усваиваются многими высшими базидиомицетами. Имеются, однако, сведения, что некоторые виды Tricholoma лучше использовали нитраты, чем соли аммония. Аммонийный азот усваивается, как правило, всеми экологическими группами высших базидиомицетов. Отношение к источникам азотного питания может быть различным у разных штаммов одного и того же вида.
Из органических источников азота, используемых для выращивания мицелия съедобных грибов на жидких средах, чаще всего используются мочевина, пептон, аминокислоты. Обычно органический азот обеспечивает лучший рост мицелия по сравнению с минеральными солями. Наилучшими источниками азота для большинства грибов являются пептоны, содержащие высоко — и низкомолекулярные полипептиды и даже свободные аминокислоты. Хорошим источником его является гидролизат казеина, содержащий все важнейшие аминокислоты за исключением триптофана. Исследования физиологии видов рода Coprinus показали, что существуют штаммовые различия в усвоении разных форм азота. Так, одни штаммы С. fimetarius Fr. способны усваивать нитраты, другие — нитриты. По отношению к высокомолекулярным углеводам были выделены виды, разлагающие только лигнин или только целлюлозу, или то и другое. Хорошо используется грибами в качестве источника органического азота мочевина.
Изменение концентрации азота в среде при одном и том же содержании углерода приводит к изменению количества и химического состава образуемого мицелия.
Для создания оптимальных условий роста мицелия необходимо правильное соотношение в среде углерода и азота. Обычно считают, что для роста разных видов высших базидиомицетов благоприятным является соотношение С : N от 8 : 1 до 20: 1. Имеются данные о влиянии содержания азота на появление грибного запаха в мицелии.
Для нормального роста грибы нуждаются и в источниках минерального питания. В относительно больших количествах используются фосфор, калий, сера, магний и в небольших — железо, цинк, медь, марганец, кальций и др. Роль элементов минерального питания для роста съедобных грибов исследована очень мало и необходимо выяснение потребностей в них каждого конкретного культивируемого штамма.
Большинство изученных высших базидиальных грибов не могут развиваться на синтетических средах, так как нуждаются в витаминах. Гетеротрофность в отношении витамина В1 (тиамина) выделяет базидиомицеты среди других групп грибов. Тиамин принимает участие в углеводном обмене и влияет как на синтез, так и на расход углеводов. Грибы могут нуждаться в наличии в среде тиамина, одной из составляющих тиамина молекул пиримидина или тиазола, или же в обоих составных частях витамина B1. Потребность грибов в витамине B1 не является абсолютной, а изменяется в зависимости от штамма, состава среды и др. Стимулирующее действие на рост некоторых съедобных грибов в жидких средах оказывают биотин, пиридоксии (витамин В6), рибофлавин, пантотеновая кислота, фолиевая кислота и др.
Имеются данные о том, что намного эффективнее и экономичнее использовать в качестве стимуляторов такие природные субстраты, как экстракты и отвары растений, автолизаты, содержащие целый комплекс витаминов, аминокислот и др. Проведенные нами исследования показали целесообразность использования в качестве стимулирующих добавок в питательную среду отваров кормовых растений. Ниже представлены наши данные о влиянии таких добавок на образование мицелия у Pleurotus ostreatus при выращивании на жидких средах, % к сухой массе мицелия в контроле:
Контроль (минеральная среда) — 100
Минеральная среда + витамин В, — 159
Минеральная среда +0,1% отвара
Одним из важнейших факторов, регулирующих рост базидиальных грибов в культуре, является концентрация водородных ионов в среде. Литература, имеющаяся по этому вопросу, немногочисленна, разрозненна, а иногда и противоречива. Имеются основания полагать, что большинство высших базидиальных грибов способны расти при довольно больших колебаниях кислотности, хотя для многих оптимум лежит в пределах pH 5—6. По данным Э. Мелина, О. Модесса, Н. М. Шемахановой и некоторых других авторов, настоящие микоризообразователи хорошо растут в кислой среде, хуже — в нейтральной, а в щелочной совсем не развиваются.
Таким образом, грибы, принадлежащие к одной и той же экологической или систематической категории, могут значительно отличаться по своему отношению к исходному значению кислотности среды, изменяя ее в процессе роста в благоприятную или неблагоприятную для роста сторону, что зависит как от состава питательной среды, гак и физиологических особенностей гриба.
В. Рипачек, изучавший дереворазрушающие грибы, указывает на свойство грибов, способных разрушать целлюлозу, регулировать кислотность среды до более низких значений pH по сравнению с лигниноразрушающими грибами. Он отмечает, что штаммы одного и того же вида, выделенные из разных местообитаний, отличаются по отношению к pH среды. О. П. Низковская и Н. М. Милова, изучавшие влияние исходной реакции питательной среды на образование мицелия 15 видами (преимущественно из порядка Aphyllophorales), установили, что среди испытанных видов имелись культуры и с высокой и с низкой оптимальной кислотностью, а у 3 видов — Flammulina velutipes, Pleurotus ostreatus, Piptoporus betulinus — отмечено два оптимума кислотности.
Очевидно, что способность многих видов грибов расти при разных начальных значениях pH среды связана с их свойством изменять кислотность среды в сторону, благоприятную для их существования. Из испытанных нами такие виды, как Boletus variegatus, Coprinus ephemerus, Panus tigrinus, P. conchatus, Marasmius oreades, Pholiota adiposa и другие, в процессе роста выравнивали pH среды при всех исходных значениях, приближая кислотность среды к оптимальным для них значениям. Для проведения предварительных исследований, если pH среды не установлен заранее, можно рекомендовать использовать питательные среды с pH около 5,0, т. е. в тех пределах, в которых отмечен рост подавляющего большинства базидиомицетов как нами, так и другими исследователями.
Предварительно установив pH, оптимальный для роста культивируемого штамма, питательную среду перед автоклавированием доводят до нужного pH, учитывая, что автоклавирование несколько снижает pH. Для подщелачивания используют обычно концентрированную NaOH, для подкисления — концентрированную НСl, лимонную кислоту и др. Кислотность среды может значительно изменяться в процессе роста гриба. На изменение pH среды влияют источники азота, углерода, их соотношение в питательной среде, образование грибами в качестве продуктов метаболизма аммиака, органических кислот и т. д. Контроль за изменением pH среды ведется постоянно в процессе ферментации, и для поддержания нужного значения pH добавляют соответственно щелочь, мел, кислоту. Обычно для поддержания реакции питательных растворов на постоянном уровне применяют буферные системы. Для этой цели часто используют фосфатные буферы, так как фосфаты не ядовиты в концентрациях, обладающих хорошей буферной способностью. Накопление в среде в качестве продуктов обмена органических кислот, жиров, в результате чего резко изменяется pH среды и падает урожай мицелия, может быть вызвано избытком в питательной среде углеводов.
Если для приготовления питательной среды используют только определенные химические соединения, что особенно важно для установления потребностей в различных компонентах питательной среды, то такая среда называется синтетической. Оптимальный же рост мицелия большинства изученных съедобных грибов получен на средах с добавлением различных сложных природных субстратов — дрожжевой автолизат, пивное сусло, мальц-экстракт, отвары, экстракты растений и т. д. Такие среды называются сложными. Полусинтетические среды помимо природных субстратов содержат также определенные химические соединения. При составлении питательных сред необходимо исходить из физиологических потребностей каждого конкретного культивируемого штамма. Для получения максимального роста культур применяют сложные полусинтетические среды. Органические субстраты, входящие в состав этих питательных сред, являются обычно также стимуляторами роста. Некоторые органические субстраты имеют, однако, непостоянный состав. По мере изучения физиологии высших базидиальных грибов растет число предложенных питательных сред. В каждом отдельном случае выбор среды зависит от эколого-физиологических особенностей культуры и поставленной задачи. Хотя на синтетических средах грибы растут обычно хуже, чем на сложных, эти среды широко используются для изучения потребности в различных питательных веществах.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Выделение грибов. Неселективные среды для грибов. Селективные среды для грибов. Выявление противогрибковых антител ( AT ). Выявление грибковых антигенов ( Аг ).
Культуральные условия и потребности роста у патогенных грибов отличаются от таковых у возбудителей бактериальных инфекций. Большинство патогенных грибов не требовательно к питательным средам и хорошо растёт в аэробных условиях.
Для роста грибов среды могут включать какой-либо органический источник углерода, неорганического азота в виде нитратов или аммонийных солей. рН питательных сред кислый (около 4,0—6,5)f большинство бактерий не способно расти в подобных условиях. Среди витаминов большинство грибов нуждется в водорастворимых (например, биотине, рибофлавине, тиамине и др.). Большинство патогенных видов мезофилы и растёт в интервале температур 20-45 °С.
При выделении грибов обычно делают парные посевы, один из которых инкубируют при 25 °С, а второй — при 37 °С; подобная манипуляция позволяет выявить возможный диморфизм. Идентификацию возбудителя проводят по морфологическим и биохимическим признакам. В практической работе обычно используют два типа сред — неселективные и селективные.
Неселективные среды для грибов
Наиболее распространён агар Сабуро — пептонный агар с мальтозой (или глюкозой). Его отличает высокое содержание углеводов, ингибирующее размножение бактерий. Также используют МПА, картофельно-декстрозный агар, агар Чапека-Докса, дрожжевой агар, сусло-агар и др. Нередко среды модифицируют добавлением антибиотиков, циклогексимида или хлоргексидика. Для выделения прихотливых патогенов (например, Blastomyces dermatitidis и Histoplasma capsulatum) в качестве обогащенных сред применяют 5-10% КА, дополненный сердечным и мозговым экстрактом, либо асцитический агар. После образования колоний следу-ет делать пересев на более простые среды, например картофельно-декстрозный агар или среду Сабуро, на которых можно быстрее выявить споруляцию возбудителей.
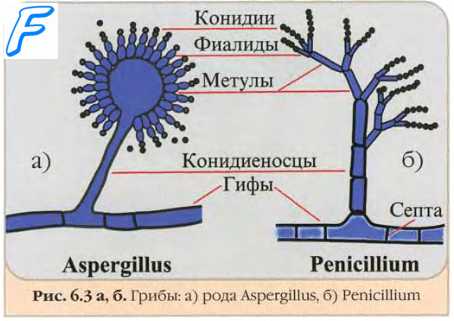
Селективные среды для грибов
Селективные среды для грибов обычно получают на основе неселективных, с добавлением пенициллина (20 ЕД/мл), стрептомицина (40 ЕД/мл) или гентамицина (0,5 мкг/мл), левомицетина (16 мкг/мл). Для ингибирования бурного роста плесеней, подавляющих медленно растущие диморфные грибы, в среды вносят циклогексимид (0,5 мкг/мл). Следует помнить, что препарат подавляет рост некоторых патогенных грибов (например, Cryptococcus neoformans и Aspergillus fumigatus).
Выявление противогрибковых антител ( AT ). Выявление грибковых антигенов ( Аг )
Наиболее часто применяют реакцию латекс-агглютинации (выявляет IgM), PCK (выявляет IgG) и ИФА. Результаты реакций часто могут быть сомнительными вследствие перекрёстного реагирования с Аг различных грибов. Тем не менее идентификация AT или циркулирующих Аг в крови, СМЖ и моче позволяет установить диагноз до получения результатов посевов.
Кожные пробы ранее были одним из популярных методов диагностики микозов, однако их неспецифичность ограничивает диагностическую ценность. В настоящее время их чаще используют для изучения иммунной прослойки в популяции при эпидемиологических исследованиях.
Гибридизация нуклеиновых кислот — новый метод идентификации патогенных грибов, разработанный для определения основных возбудителей системных микозов — бласто-, крипто- и кокцидиоидомикозов, а также гистоплазмоза. Для постановки реакции проводят экстракцию РНК из культуры и вносят одно цепочечные молекулы ДНК, меченные флюоресцеином. При наличии в культуре одного из четырёх указанных возбудителей происходит гибридизация соответствующей ДНК с РНК патогена с образованием легко обнаруживаемого комплекса. Основное достоинство метода — возможность применения на ранних сроках (5 сут) в культурах, содержащих мицелиальные и дрожжевые формы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

