Участок днк служащий для прикрепления регуляторного белка при инициализации транскрипции называется
Обновлено: 05.10.2024
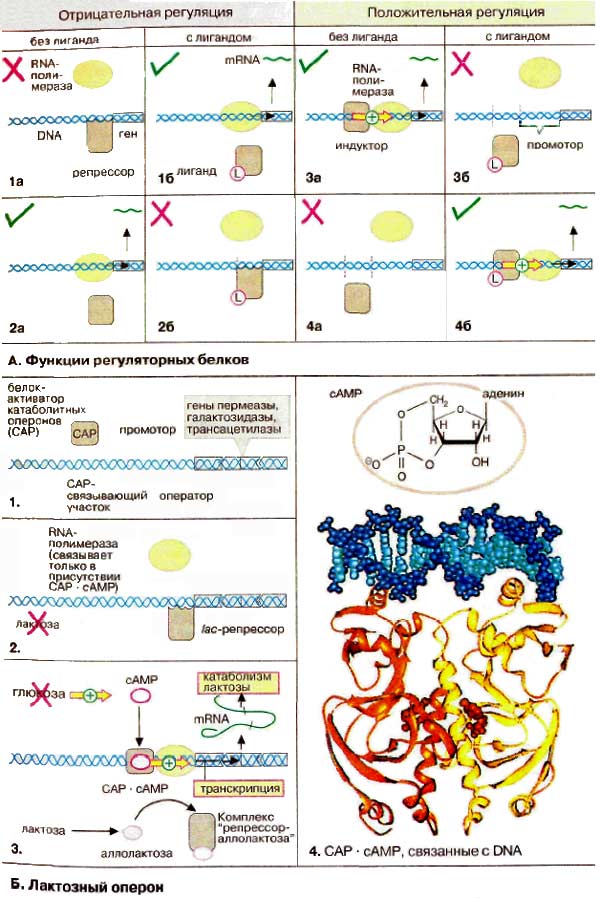
А. Функции регуляторных белков
Во всех клетках экспрессия генов (см. с. 234) контролируется регуляторными белками, которые связываются с определенным участком ДНК (DNA) и таким образом стимулируют пли подавляют транскрипцию гена ( контроль транскрипции , см. с. 240). Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают все новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть. Несовершенна также их номенклатура. Как для белков, так и для участков ДНК, с которыми они связываются, используются различные наименования в зависимости от принципа действия. Регуляторный белок, который влияет на транскрипцию генов, называют фактором транскрипции . Белок, подавляющий транскрипцию, называют репрессором , а стимулирующий — индуктором . Последовательности ДНК, с которыми связываются регуляторные белки, называются регуляторными элементами . У прокариот регуляторные алименты, которые служат участками связывания РНК-полимеразы, называют промоторами , в то время как для репрессорных участков связывания употребляется название оператор . Регуляторные элементы, связывающие активирующие факторы, называют энхансерами (от англ. enhancer — усилитель), в то время как элементы, связывающие негативные (ингибирующие) факторы, — сайленсерами (от англ. silencer — успокоитель).
Многочисленные известные регуляторные белки можно разделить по механизму действия на четыре группы. Негативная генетическая регуляция , т. е. выключение соответствующих генов, может вызываться репрессорами. Некоторые репрессоры связываются с ДНК только в отсутствие специфического лиганда ( 1а ). Комплекс репрессора с лигандом в этом случае теряет способность к связыванию и оставляет свободным участок промотора для присоединения РНК-полимеразы ( 1б ). Часто свободный от лиганда репрессор не может связываться с ДНК, т. е. транскрипция подавляется только в присутствии лигандов ( 2а, 2б ). Аналогично при позитивной генетической регуляции можно различать два случая. Если связывается только свободный индуктор, транскрипция подавляется соответствующими лигандами ( 3 ). Напротив, многие индукторы становятся активными только после образования комплекса с лигандом ( 4 ). К этой группе принадлежат, например, стероидные гормоны (см. с. 366).
Б. Лактозный оперон
В качестве примера приведен лактозный оперон бактерии Е. coli (участок ДНК), который подвержен одновременно негативному и позитивному контролю. Оперон содержит структурные гены трех ферментов, которые необходимы для утилизации лактозы, и регуляторные элементы для управления транскрипцией оперона.
Так как лактоза превращается в клетке в глюкозу, экспрессия генов лактозного оперона не имеет смысла, когда глюкоза присутствует в клетке. Действительно гены транскрибируются только в отсутствие глюкозы и в присутствии лактозы ( 3 ). Регуляция достигается благодаря взаимодействию двух регуляторных белков. В отсутствие лактозы lac -penpeccop блокирует участок промотора ( 2 ). При наличии лактозы она превращается в изомерную аллолактозу , которая связывается с белком-репрессором и тем самым вызывает диссоциацию репрессора и оператора ( 3 ). Тем не менее этого недостаточно для транскрипции структурных генов. Для связывания РНК-полимеразы необходим индуктор, белок-активатор ка таболитных оперонов (САР от англ. catabolite activator protein), который связывается с ДНК только в комплексе с цАМФ (cAMP). Сигнал голодания возникает только в отсутствие глюкозы.
Взаимодействие комплекса САР-цАМФ с ДНК представлено на рис. 4 . Каждая субъединица димерного индуктора (желтого и оранжевого цвета соответственно) связывает молекулу цАМФ (красного цвета). Контакт с ДНК (голубого цвета) опосредуется двумя спиральными участками полипептидной цепи, специфически взаимодействующими с большой бороздкой на ДНК.
Факторы транскрипции (транскрипционные факторы) — белки́, контролирующие процесс синтеза мРНК, а также других видов РНК [1] на матрице ДНК (транскрипцию) путём связывания со специфичными участками ДНК [2] [3] . Транскрипционные факторы выполняют свою функцию либо самостоятельно, либо в комплексе с другими белками. Они обеспечивают снижение (репрессоры) или повышение (активаторы) константы связывания РНК-полимеразы с регуляторными последовательностями регулируемого гена [4] [5] [6] .
Определяющая черта факторов транскрипции — наличие в их составе одного или более ДНК-связывающих доменов, которые взаимодействуют с характерными участками ДНК, расположенными в регуляторных областях генов. Другие белки, играющие ключевую роль в регуляции экспрессии генов, такие как коактиваторы, гистонацетилазы, киназы, метилазы, не имеют ДНК-связывающих доменов, и, следовательно, не могут быть причислены к транскрипционным факторам [7] [8] [9] .

Структура комплекса TATA-связывающего белка/транскрипционного фактора TF(II)B из археи Pyrococcus woesei с ДНК по результатам рентгеноструктурного анализа. Сверху — схематичное изображение третичной структуры, снизу — молекулярной поверхности комплекса
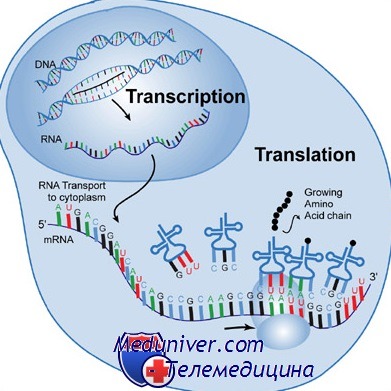
После расшифровки генетического кода встал вопрос: каким образом осуществляется перенос информации с ДНК на белок? Биохимическими исследованиями было установлено, что основная масса ДНК в клетке локализована в ядре, тогда как синтез белка идет в цитоплазме. Это территориальное разобщение ДНК и синтеза белка обусловило поиски посредника. Поскольку синтез белка шел с участием рибосом, то на роль посредника была выдвинута РНК. Была создана схема, иллюстрирующая направление потока генетической информации в клетке:
ДНК → РНК → белок
Она получила название центральной догмы молекулярной биологии. Ф. Крик постулировал, что синтез макромолекул по этой схеме осуществляется по матричному принципу. На доказательство правильности этого постулата потребовались многие годы.
Схема процесса транскрипции

Вначале предполагалось, что роль посредника выполняет рибосомальная РНК (“один ген — одна рибосома — один белок”). Однако в скором времени выяснилась несостоятельность такого предположения. Было показано, что в процессе белкового синтеза количество рибосом не изменяется, т.е. новая РНК не синтезируется и, следовательно, новая информация не поступает. Вскоре в составе рибосом была обнаружена фракция нестабильной РНК, молекулы которой непрочно удерживаются на рибосоме с помощью катионов Mg. Методом молекулярной гибридизации было показано, что молекулы этой РНК являются копиями определенных участков ДНК. Она получила название матричной, или информационной РНК. Ее также называли раньше РНК-посредник и мессенджер-РНК. Комплементарность этих молекул определенным участкам ДНК говорила о том, что они синтезируются по матричному типу на ДНК.
Постепенно был выяснен весь путь переноса информации от ДНК к белку. Он состоит из двух этапов: транскрипции и трансляции. На этапе транскрипции происходит считывание и перенос генетической информации с ДНК на иРНК. Процесс транскрипции протекает в три стадии: инициации, элонгации и терминации. Информация считывается только с одной цепи ДНК (+ цепь), так как исходя из свойств генетического кода, комплементарные участки ДНК не могут кодировать структуру одного и того же белка из-за отсутствия комплементарной вырожденности кода. Ведет транскрипцию фермент РНК-полимераза, состоящий из четырех субъединиц (ααββ') и не обладающий специфичностью в отношении источника ДНК. На начальном этапе транскрипции — инициации — к ферменту присоединяется пятая субъединица, так называемый s-фактор, который осуществляет узнавание специфического участка ДНК, промотора. Промоторы не транскрибируются. Узнаются они s-фактором по наличию в них специфической последовательности нуклеотидов. В бактериальных промоторах она называется блоком Прибнова и имеет вид ТАТААТ (с небольшими вариациями). К промотору присоединяется фермент РНК-полимераза. Рост цепи иРНК идет в одном направлении, скорость транскрипции равняется ≈ 45-50 нуклеотидов в 1 секунду. На этапе инициации синтезируется только короткая цепочка из 8 нуклеотидов, после чего s-фактор отделяется от РНК-полимеразы и начинается этап элонгации. Наращивание цепи иРНК ведет уже белок-тетрамер. Участок, с которого считывается информация, называется транскриптоном. Он заканчивается терминатором — специфической нуклеотидной последовательностью, играющей роль stop-сигнала. Дойдя до терминатора, фермент РНК-полимераза прекращает работу и с помощью белковых факторов терминации отделяется от матрицы.

Структура молекулы тРНК
В бактериальных клетках образующиеся молекулы иРНК могут сразу выполнять роль матриц для синтеза белка, т.е. транслироваться. Они соединяются с рибосомами, к которым одновременно молекулы транспортных РНК (тРНК) доставляют аминокислоты. Цепочки транспортных РНК состоят примерно из 70 нуклеотидов. Однонитиевая молекула тРНК имеет участки комплементарного спаривания, в составе которых находятся активные центры: участок узнавания тРНК ферментом тРНК-синтетазой, присоединяющим к тРНК соответствующую активированную аминокислоту; акцептор — участок, к которому присоединяется аминокислота, и антикодоновая петля.
Схема синтеза белка (трансляция)

Антикодон — это триплет, комплементарный соответствующему кодону в молекуле иРНК. Взаимодействие кодон-антикодон идет по типу комплементарного спаривания, во время которого происходит присоединение аминокислоты к растущей белковой цепи. Инициирующим кодоном в составе разных иРНК является кодон AUG, соответствующий аминокислоте метионину. Поэтому первой к матрице подходит тРНК с антикодоном UAC, соединенная с активированной аминокислотой метионином. Ферменты, активирующие аминокислоты и соединяющие их с тРНК, называются аминоацил-тРНК-синтетазы. Все этапы биосинтеза белка (инициация, элонгация, терминация) обслуживаются белковыми факторами трансляции. У прокариот их по три на каждый этап. В конце матрицы иРНК находятся нонсенс-кодоны, которые не считываются и знаменуют собой конец трансляции.
В геноме многих организмов, от бактерий до человека, обнаружены гены и соответствующие им тРНК, осуществляющие нестандартное считывание кодонов. Это явление получило название неоднозначности трансляции.

Оно позволяет избежать негативных последствий ошибок, возникающих в структуре молекул иРНК при транскрипции. Так, при появлении внутри молекулы иРНК нонсенс-кодонов, способных преждевременно прекратить процесс транскрипции, включается механизм супрессии. Он состоит в том, что в клетке появляется необычная форма тРНК с антикодоном, комплементарным нонсенс-кодону, чего в норме быть не должно. Ее появление является результатом действия гена, осуществляющего замену основания в антикодоне тРНК, близким по составу к нонсенс-кодону. В результате такой замены нонсенс-кодон считывается как обычный значащий кодон. Подобные мутации получили название супрессорных, т.к. они подавляют изначальную мутацию, которая привела к появлению нонсенс-кодона.
Перейти к чтению других тем книги "Генетика и селекция. Теория. Задания. Ответы":
Большинство процессов метаболизма в организме катализируются белковыми ферментами. Кроме того, белки — основные структурные компоненты тела человека. Аминокислотные последовательности всех белков зашифрованы в ДНК, а процесс превращения закодированной информации в сам белок включает её транскрипцию на гяРНК, процессинг на иРНК, трансляцию на полипептид и окончательную сборку белка.
Строение гена
В отличие от прокариот у эукариот большинство генов имеют участок ДНК, который прерывает кодирующую последовательность. Данные некодирующие фрагменты называют нитронами, в то время как другие, кодирующие участки— экзонами. У обеих групп после кодирующего участка присутствуют лидерная и трейлерная последовательности, а также ряд последовательностей, контролирующих процесс транскрипции.
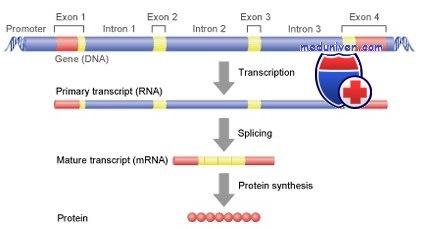
Фрагмент, расположенный ниже участка начала транскрипции (5'—3'), называют лидерной последовательностью, он не транслируется. Затем следует кодирующий участок, обычно прерываемый одним или несколькими интронами, а после — некодирующий трейлерный (концевой) участок, на конце которого участок полиаденилирования (поли-А-сайт), имеющий вариабельную последовательность наподобие 5'-ААТАА-3' (5'-ААУАА-3' на РНК-транскрипте) длиной 10-30 пар нуклеотидов в направлении 3'—5'.
Интроны начинаются последовательностью ГТА(/Г)ГАГТ и заканчиваются серией из Ц- или Т-оснований, предшествующих АГ. Для удаления интрона значение имеют первые основания Г и Т (Г и У в гяРНК) и последние АГ, а также остаток аденина в составе последовательности ближе к 5'-концу. Участок, находящийся ближе к 5'-концу, известен под названием донор, ближе к З'-концу — акцептор, а остаток аденина называют участком ветви.
Транскрипция при синтезе иРНК
Таким образом формируется транскрипционное вздутие. Как только он достигает участка начала транскрипции, происходит отщепление одного из факторов транскрипции и присоединение другого, после чего начинается процесс синтеза РНК.
Используя в качестве матрицы цепь в направлении 3'—5' (слева направо), РНКаза II поочерёдно захватывает рибонуклеотиды и соединяет их друг с другом, образуя комплементарную последовательность РНК, ориентированную в обратном направлении (то есть от 5' к 3').
Другими словами, используя правила комплементарного спаривания оснований при взаимодействии с матричной цепью, РНКаза создаёт точную РНК-копию кодирующей цепи. Фермент транскрибирует лидерный и трейлерный участки, экзоны, интроны и (по всей видимости, напрасно) продвигается дальше в направлении 5'—3'.
Факторы транскрипции при синтезе иРНК
Факторы транскрипции — белки, прикрепляющиеся к промоторной последовательности и запускающие процесс транскрипции. В их состав обычно входят активационный домен и ДНК-связывающий домен. Активационные домены богаты глутаматом, а также аспартатом или пролином, которые облегчают формирование транскрипционного комплекса. Кроме того, различают четыре типа ДНК-связывающих доменов.
• Спираль-петля-спираль состоит из двух белковых а-спиралей, которые соединены длинной, гибкой петлёй, позволяющей параллельно упаковывать их близко друг к другу. Считают, что данная структура осуществляет контроль процесса транскрипции путём блокирования других регуляторных белков гена.
• Спираль-поворот-спираль состоит из двух коротких а-спиралей, разделённых аминокислотной последовательностью, слишком короткой, чтобы позволить им лежать в одной плоскости. Этот фрагмент — характерный признак гомеобокса (см. главу 12).
Процессинг РНК
Для того чтобы только что синтезированные гяРНК стали кодирующими матрицами для последующей трансляции и образования полипептидов, они претерпевают ковалентное видоизменение. При этом вначале к 5'-концу в обратном направлении прикрепляется 7-метил-ГТФ (кэп). Как только на цепи гяРНК возникает участок полиаденилирования, она в этом месте расщепляется, а затем при помощи полиА-полимеразы происходит присоединение 100—200 остатков адениловой кислоты и таким образом формируется поли-А-хвост (полнаденильный хвост).
Наряду с кэпом поли-А-хвост предположительно защищает молекулу от разрушения экзонуклеазами, служит так называемым паспортом, необходимым для её попадания в цитоплазму, а позже становится сигнальным участком для рибосомы, указывающим на возможность начала трансляции.
Молекула гяРНК в среднем содержит около 7000 нуклеотидов, количество которых в иРНК сокращается до 1200 путём удаления примерно 50 интронов. Характерная особенность гистонных генов — отсутствие интронов.
Рибонуклеиновые комплексы, которые удаляют нитроны, называют сплайсомами. Они имеют в своём составе несколько малых ядерных РНК (U1—U6), каждая из которых соединена со специфическим белком. Рибонуклеопротеин, содержащий малую ядерную РНК U1 (Ul-малая ядерная РНК), благодаря наличию комплементарной последовательности, присоединяется к участку начала сплайсинга в направлении 3'—5'.
К участку ветви прикрепляется малая ядерная РНК U2, которая затем связывается с U1, в результате чего возникает петля гяРНК. После этого U2 отсекает гяРНК в направлении 3'—5' сразу после последовательности Г—У (см. выше) и соединяет ближний к 5'-конец интрона с участком соединения, образуя так называемое лассо. Конец интрона, находящийся ближе к 3', отсекается сразу после последовательности А—Г, распуская лассо РНК. При этом сплайсома соединяет между собой экзоны.
Иногда в некоторых транскриптах (особенно при производстве антител) обнаруживают альтернативные механизмы сплайсинга, однако ошибки в данном процессе играют важную роль в развитии многих генетических заболеваний. Так, церебральный паралич и задержка умственного развития при синдроме Жильбера обусловлены внедрением Т—А в нормальную последовательность ТАТАА промотора гена УДФ-гликозилтрансферазы. А-аманитин, содержащийся в бледной поганке (Amanita phalloides), блокирует действие РНКазы II.
Антибиотик рифампицин блокирует транскрипцию у бактерий путём связывания с b-субъединицей бактериальной РНК-полимеразы, в то время как актиномицин внедряется между парами оснований Г—С .
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

