Технология производства лизина из пшеницы
Обновлено: 18.09.2024
В последние годы в Российской Федерации резко сократилась продукция животноводства и, как следствие этого, возрос до недопустимых размеров импорт мясопродуктов.
Одной из причин уменьшения производства мясопродуктов является ухудшение качества кормов и повышение их стоимости, что вызвано практически полной остановкой предприятий производивших кормовой белок в силу их неконкурентоспособности при изменившейся структуре цен. Сегодня кормовой белок почти полностью импортируется.
Однако, есть альтернативное решение проблемы повышения качества кормов. Известно, что дефицит белка может быть компенсирован введением в корма незаменимых аминокислот, причем в первую очередь устраняется дефицит аминокислоты, находящейся в относительном минимуме, затем следующей – и так далее, т.к. привесы определяются не общим содержанием белка, а именно по содержанию наиболее дефицитной незаменимой аминокислоты в нем. Порядок лимитирования определяется применяемыми компонентами кормов и потребностями в аминокислотах у животных и птицы. Аминокислотный состав кормовых ингредиентов и потребности в различных аминокислотах хорошо изучены и давно известны.
Так, для зерна злаковых и всех сельскохозяйственных животных и птицы лимитирующими аминокислотами являются метионин, лизин, триптофан и треонин.
В настоящее время в России в сельском хозяйстве птицеводство является ведущей отраслью. При кормлении птицы первой лимитирующей аминокислотой является лизин, второй - метионин, который производится как в России, так и за рубежом методом химического синтеза, и в достаточных количествах поступает на российский рынок.
Эффект применения незаменимых аминокислот, в частности L-лизина, основывается на том, что белок зерновых – основного компонента кормов для сельскохозяйственных животных и птицы – имеет неблагоприятный состав, образующих его аминокислот. Одна из них – L-лизин – находится в дефиците и не может быть синтезирована в организме животного.
В развитых странах в последнее время потребление L-лизина интенсивно растет – 12-15% прироста ежегодно – и приблизилось сегодня к 500 тыс.т./год. До начала экономических реформ СССР являлся крупнейшим производителем L- лизина (до 1/3 мирового производства в середине 80-х годов).
1. Характеристика конечной продукции производства
Лизин – это незаменимая аминокислота, входящая в состав практически любых белков, необходима для роста, восстановления тканей, производства антител, гормонов, ферментов, альбуминов.
В настоящее время установлено, что лизин в организме является не только структурным элементом белка, но и выполняет ряд важных биохимических функций — является предшественником карнитина и оксилизина, способствует транспорту кальция и стронция в клетки и др.
Доказано, что лизин улучшает аппетит, способствует секреции пищеварительных ферментов, предотвращает кариес зубов у детей.
В основном L-лизин используется в качестве кормовой добавки, что связано с низким количеством этой аминокислоты в растительных кормах.
Лизинсодержащие препараты могут использоваться в растениеводстве. Применение таких препаратов, содержащих кроме аминокислот и другие биостимуляторы, дает значительное увеличение урожая тепличных и полевых сельскохозяйственных культур.
Кроме того, предложено использовать препараты лизина в качестве пищевых атрактантов для дезориентации личинок проволочников.
Пантотенат лизина может быть использован против лейкопении. Противоанемическим и анаболизирующим действием обладают соли фитиновой кислоты и лизина, оксилизина. Ацетиласпартат лизина может использоваться для лечения миокарда, интоксикаций эндогенного или экзогенного происхождения, заболеваний печени и т. д.
Образующиеся после ферментации клетки микроорганизмов, наряду с маточными растворами, обычно утилизируют в белковый кормовой продукт по технологии производства кормовых дрожжей.
Лизин (2,6-диаминогексановая кислота) — алифатическая аминокислота с выраженными свойствами основания; незаменимая аминокислота. Лизин известен в виде двух оптически активных D- и L-форм. Бесцветные кристаллы. Природный L-лизин (tпл 224—225°С, с разложением) хорошо растворим в воде, кислотах и основаниях, плохо — в спирте. Выделен в 1889 из гидролизата казеина, синтезирован в 1902; входит в состав почти всех белков животного и растительного происхождения (в большом количестве лизин содержится в гистонах и протаминах, в малом — в белках злаков. Отсутствие лизина в пище замедляет рост у детей, у взрослых приводит к отрицательному балансу азота и нарушению нормальной жизнедеятельности организма. Суточная потребность в лизине у взрослых составляет 23 мг/кг массы тела, у младенцев — 170 мг/кг.
2. Химическая схема производства
Химизм образования молекулы лизина показан на рис. 1.
Рис. 1.Химизм биосинтеза лизина
При получении лизина необходимо исключить нежелательные побочные процессы. Так, при недостаточной аэрации может идти образование аланина или молочной кислоты вместо синтеза лизина. Очень важным фактором является концентрация дефицитных аминокислот — гомосерина, метионина и треонина в среде. Для нормального роста и биосинтеза лизина культурой Brevibacteriumsp. 22 оптимальной считается концентрация треонина в 800 мг, метионина — 200 мг на литр питательной среды. Кроме того, для развития культуры необходим тиамин в концентрации 200 мкг на 1 л среды. Важным регулятором процесса является биотин. Одна и та же культура Brevibacteriumsp. 22 при концентрации биотина в среде, равной 1—4 мкг/л, продуцирует глутаминовую кислоту, а при концентрации 15— 20 мкг/л — лизин. Считают, чтобиотин изменяет проницаемость клеточной оболочки. При концентрации биотина 2,5 мг/л стимулируется также образование молочной кислоты.
Важную роль играет треонин, являясь обязательным фактором роста на начальном этапе ферментации. Однако концентрация его не должна быть большой, так как на дальнейших этапах ферментации (при синтезе лизина) он может действовать как ингибитор фермента аспартаткиназы. Присутствие лизинаусиливает ингибирующие свойства треонина.
В производственных условиях, если выход лизина составляет 35,7% от используемых сахаров,суммируемое превращение глюкозы, аммиака и кислорода влизин и клеточную биомассу можно описать уравнением:
В правой части данного уравнения первый член показывает количество лизина, получаемого из глюкозы. Из 1 молекулы глюкозы образуется 0,35 молекулы лизина. Второй член характеризует образование биомассы. Из уравнения видно, что на переработку каждой молекулы глюкозы требуется 2,19 молекулы кислорода. Это значит, что интенсивность аэрации во время роста культуры должна составлять 2—4 г 02 в час на 1 л среды.
3. Технологическая схема производства
В зависимости от назначения из культуральной жидкости можно получить различные микробиологические препараты (рис. 1): жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ), кристаллический лизин.
Рис. 2. Технологическая схема производства препаратов лизина
Для биосинтеза лизина используют гомосериндефицитные мутанты ауксотрофных бактерий родов Brevibacterium, Micrococcus, Corynebacterium.
4. Характеристика сырья, материалов
В промышленных условиях в качестве источника углерода применяют фуражное зерно, мелассу, гидрол, гидролизаты целлюлозосодержащего сырья, крахмал, а также уксусную кислоту.
4.1 Приготовление стерильных питательных сред
Все продуценты лизина являются биотинзависимыми микроорганизмами. Количество биотина в среде должно быть значительно выше (29 мкг/л), чем это необходимо для нормального роста и развития микробной клетки (4–5 мкг/л). Если снизить количество биотина до 1–2 мкг/л, биосинтез лизина замедляется, но одновременно усиливается образование глутаминовой кислоты.
Источником биотина, витаминов и ряда аминокислот являются обычно кукурузный экстракт и свекловичная меласса. Максимальный биосинтез лизина наблюдается на средах с сахарозой (табл. 1).
Влияние источника углерода (концентрация 7,5 %) на биосинтез
L-лизина продуцентом Brevibacterium flavum
| Источник углерода | АСБ * , г/л | Лизин, г/л | Ассимилляция сахара, % | YP/S |
| Глюкоза | 15,2 | 22,0 | 7,6 | 0,37 |
| Сахароза | 18,2 | 25,0 | 7,1 | 0,42 |
| Галактоза | 2,0 | 1,0 | 0,7 | 0,02 |
| Ксилоза | 5,2 | 3,5 | 2,5 | 0,06 |
| Манноза | 9,3 | 6,0 | 4,5 | 0,10 |
| Рамноза | 3,6 | 2,0 | 1,3 | 0,03 |
| Арабиноза | 1,0 | Следы | 0,7 |
Существенное значение в процессе ассимиляции углеродсодержащих соединений имеет их концентрация в питательной среде. Наибольшее количество лизина получено на средах, содержащих 10–12 % сахарозы. При более высоких концентрациях сахарозы удельная скорость роста продуцента снижается и уменьшается коэффициент конверсии сахара (YP/S).
Изобретение относится к пищевой промышленности. Зерно пшеницы измельчают до фракции мучного помола и увлажняют его водой в соотношении 1:2. Осуществляют ферментативный гидролиз. Протосубтилином Г-ЗХ в концентрации 0,3% в течение 22 часов при 45-50°С и рН 6,5-7,5. Разделяют увлажненную массу центрифугированием на осадок и фугат. Изобретение позволяет получить продукт, обладающий высокой концентрацией незаменимых лимитирующих аминокислот. 3 табл.
Изобретение относится к производству пищевых продуктов из растительного сырья.
Известно, что обеспечение полноценного белкового питания человека в нашей стране является социально значимой задачей. Наиболее оптимально она могла бы быть решена за счет продуктов животного происхождения. Однако в современных условиях она не может быть полностью реализована из-за дефицита указанных продуктов. В то же время установлено, что обеспечение полноценного белкового питания человека возможно и на основе растительной пищи, особенно для вегетарианцев.
Доказано, что у людей, придерживающихся вегетарианства, реже возникают заболевания сердечно-сосудистой системы (например, поражение сердечной мышцы - инфаркт миокарда), отдельные виды онкологической патологии. Вегетарианцы реже страдают от избыточной массы тела.
Экономически наиболее доступной растительной пищей являются зерновые. Однако по химическому скору видов зерновых, производимых в Сибири: пшеница, ячмень, овес, рожь, установлено, что они имеют лимитирующие аминокислоты. Причем первой лимитирующей кислоты (лизина) в зерновых культурах явно недостаточно, поэтому создание полноценных по белку продуктов из нативных зерновых не представляется возможным.
Концентрация лизина в распространенных зерновых (пшеница, рожь, овес, ячмень) составляет от 340 до 390 мг на 100 г съедобной части продукта (Химический состав пищевых продуктов. Справочные таблицы содержания аминокислот, жирных кислот, витаминов, макро- и микроэлементов, органических кислот и углеводов. Под ред. д.м.н. М.Ф.Нестерина. М.: Пищевая промышленность. 1979). Концентрация же лизина в мясном сырье выше примерно в 4 раза (мышечная ткань говядины, например, содержит 1624 мг лизина в 100 г продукта). Поэтому количество лизина, поступившее в организм с 230 г мясного продукта (ежедневная медицинская норма потребления мяса), может быть обеспечено и при потреблении примерно 900 г зерновых (т.е. примерно 1,4 кг хлебных изделий). Однако такой режим вегетарианского питания будет предельно далек от физиологически рационального.
Лизин относится к тем незаменимым аминокислотам, которые регулируют основные физиологические функции человека и увеличивают интенсивность роста. Недостаток его в пище приводит к нарушению процессов кроветворения, снижению количества эритроцитов и содержания в них гемоглобина. Нарушается азотистое равновесие. Норма потребления лизина в соответствии с данными института питания составляет 3-5 г/сутки (Нормы физиологических потребностей в пищевых веществах для различных групп населения в РФ. Методические рекомендации. 2008; Справочник по диетологии. Под ред. академика АМН СССР А.А.Покровского. М.: Медицина, 1981).
Недостатком указанного способа является низкое содержание в полученной смеси незаменимых аминокислот, % (треонин - 0,09, валин - 0.16, метионин - 0,04, изолейцин - 0,18, лейцин - 0,26, фенилаланин - 0,14, лизин - 0,09).
Технической задачей настоящего изобретения является выделение аминокислот из зернового сырья и их последующее использование для разработки полноценного белкового продукта. Способ основан на том, что большинство аминокислот в той или иной степени водорастворимы. Лизин же отличается более высокой растворимостью в воде.
Техническим результатом изобретения является получение растительного продукта, обладающего высокой концентрацией незаменимых лимитирующих аминокислот.
Способ осуществляется следующим образом. На первом этапе зерно предварительно измельчают на мельнице до фракции мучного помола.
Поскольку крахмал (основная фракционная составляющая зерновых) имеет больший удельный вес, чем белок и не растворим в воде комнатной температуры, то после центрифугирования (сепарирования) он поступает в осадок. В фугат же поступят отделенные от белка протеолитическими ферментами и растворенные в воде аминокислоты.
Измельченную зерновую массу увлажняют водой из расчета 1:2, вносят Протосубтилин Г-ЗХ активностью 70 ед./г из расчета 0,3% от веса сухого вещества зерна пшеницы. Полученный субстрат подвергается ферментации в течение 22 часов. Для создания оптимальных условий ферментации увлажненную массу подогревают до 45-50°С и доводят ее до величины рН 6,5-7,5.
В результате процесса ферментации происходит частичное расщепление крахмала зерновых до простых сахаров, а белков - до полипептидов и аминокислот, которые легко перевариваются в пищеварительном тракте человека. Ферментированную массу направляют на центрифугирование (3000 об/мин) или сепарирование, где происходит ее разделение на осадок и фугат. Фугат представляет собой переработанное зерновое сырье с высоким содержанием полипептидов и аминокислот, которые можно будет использовать как основу для производства полноценного белкового вегетарианского продукта. Указанный способ позволяет извлечь из пшеницы до 40% лизина. Осадок, содержащий значительную долю крахмала и простых сахаров, может быть использован на корм сельскохозяйственных животных.
В итоге выполненных биохимических анализов установлено, что
полученные продукты содержат следующие питательные вещества:
| Таблица 1 | |||
| Результаты химического анализа | |||
| № | Показатели | Осадок зерновой (пшеница) | Фугат (пшеница) |
| 1 | Влажность, % | 52,83 | 82,32 |
| 2 | Сырой протеин, % | 14,33 | 10,48 |
| 3 | Сахар, % | 9,57 | 6,36 |
| 4 | Крахмал, % | 10,93 | следы |
| Аминокислоты, % на сухое вещество | |||
| 1 | Треонин | 0,89 | 2,25 |
| 2 | Валин | 1,33 | 3,0 |
| 3 | Метионин | 0,66 | 0,26 |
| 4 | Изолейцин | 1,12 | 3,6 |
| 5 | Лейцин | 3,2 | 6,4 |
| 6 | Фенилаланин | 1,23 | 2,93 |
| 7 | Лизин | 0,7 | 1,9 |
Предлагаемый способ производства высокобелкового продукта из зерна пшеницы открывает возможности его использования в производстве пищевых продуктов в качестве ингредиента комбинированного продукта.
Анализ полученных экспериментальных данных и научно-технической информации показывает, что по содержанию лизина фугат не уступает коровьему молоку.
| Таблица 2 | ||
| Содержание лизина в 100 г в перерасчете на сухое вещество, мг* | ||
| Молоко коровье | Молоко сухое цельное | Фугат |
| 2055 | 1846 | 1923 |
| *Справочник. Химический состав пищевых продуктов. Под ред. И.М.Скурихина и М.Н.Волгарева. М.: ВО Агропроиздат, 1987. |
В кулинарии фугат возможно использовать в рецептуре, например, картофельного пюре взамен коровьего молока без снижения содержания лизина в готовом продукте.
| Таблица 3 | ||
| Содержание лизина в различных рецептурах картофельного пюре естественной влажности, мг | ||
| Состав картофельного пюре | Рецептура на 100 г | Содержание лизина, мг в 100 г сырья |
| Картофель 100 г + вода | 100 г картофель | 135 |
| Картофель 100 г + коровье молоко 15 г | 86,96 г картофель + 13,04 г молока | 151,4 |
| Картофель 100 г + фугат 15 г | 86,96 г картофель + 13,04 г фугата | 161,7 |
| Примечание: содержание лизина в 100 г картофеля - 135 мг; | ||
| содержание лизина в 15 г коровьего молока - 39,15 мг (справочник Скурихина И.М.). | ||
| Содержание лизина в 15 г фугата - 51,0 мг (расчет приведен в пояснительной записке). |
В результате реализации указанного способа создается продукт растительного происхождения с высокой концентрацией белка.
Способ производства высокобелковой основы из зерна пшеницы для приготовления пищевого продукта, включающий измельчение зерна пшеницы до фракции мучного помола, увлажнение его водой в соотношении 1:2, ферментативный гидролиз Протосубтилином Г-ЗХ в концентрации 0,3% в течение 22 ч при 45-50°С, рН 6,5-7,5, разделение увлажненной массы центрифугированием на осадок и фугат.
Изобретение относится к пищевой промышленности и может быть использовано при производстве хлебобулочных и мучных кулинарных изделий. .
Изобретение относится к биотехнологии, в частности к получению кормовой биологически активной белково-углеводной добавки, обладающей пробиотическими свойствами, на основе крупнотоннажного отхода пивоваренного производства - зерновой дробины.



Изобретение относится к способу выделения ценных фракций из отрубей злаков (отрубей пшеницы, ячменя, овса и рисовой шелухи). .

Изобретение относится к пищевой промышленности и может быть использовано в мукомольной, спиртовой и других отраслях промышленности, в которых используется зерно пшеницы и/или мука из нее, для получения пищевого клейковинного продукта.
Изобретение относится к способу получения клейковинного продукта и может быть применено в мукомольной, спиртовой и других отраслях промышленности для получения клейковинного продукта, являющегося самостоятельным белковым продуктом, или в виде пищевой добавки для улучшения качества муки.
Лизин (α, ε-диаминокапроновая кислота, H2NCH2CH2CH2CH2CH(NH2)COOH) относится к числу незаменимых аминокислот. Мировое производство лизина в 2001 г. составляло 550 тыс. т [92].
Основные стадии ферментации [15, 108]
Промышленными продуцентами лизина являются ауксотрофные штаммы бактерий вида Brevibacterium flavum и Corynebacterium glutamicum.
Состав среды. Все продуценты лизина являются биотинзависимыми микроорганизмами. Количество биотина в среде должно быть значительно выше (29 мкг/л), чем это необходимо для нормального роста и развития микробной клетки (4–5 мкг/л). Если снизить количество биотина до 1–2 мкг/л, биосинтез лизина замедляется, но одновременно усиливается образование глутаминовой кислоты.
Источником биотина, витаминов и ряда аминокислот являются обычно кукурузный экстракт и свекловичная меласса. Максимальный биосинтез лизина наблюдается на средах с сахарозой (табл. 15.7.96).
Существенное значение в процессе ассимиляции углеродсодержащих соединений имеет их концентрация в питательной среде. Наибольшее количество лизина получено на средах, содержащих 10–12 % сахарозы. При более высоких концентрациях сахарозы удельная скорость роста продуцента снижается и уменьшается коэффициент конверсии сахара (YP/S).
В промышленных условиях в качестве источника углерода применяют мелассу, гидрол, гидролизаты целлюлозосодержащего сырья, крахмал, а также уксусную кислоту.
Таблица 15.7.96
Влияние источника углерода (концентрация 7,5 %) на биосинтез
L-лизина продуцентом Brevibacterium flavum [3]
| Источник углерода | АСБ * , г/л | Лизин, г/л | Ассимилляция сахара, % | YP/S |
|---|---|---|---|---|
| Глюкоза | 15,2 | 22,0 | 7,6 | 0,37 |
| Сахароза | 18,2 | 25,0 | 7,1 | 0,42 |
| Галактоза | 2,0 | 1,0 | 0,7 | 0,02 |
| Ксилоза | 5,2 | 3,5 | 2,5 | 0,06 |
| Манноза | 9,3 | 6,0 | 4,5 | 0,10 |
| Рамноза | 3,6 | 2,0 | 1,3 | 0,03 |
| Арабиноза | 1,0 | Следы | 0,7 |
Среди источников азота наиболее часто используют соли аммония и кукурузный экстракт (получают обработкой кукурузных жмыхов серной кислотой при 90–100 °С), кислотные гидролизаты дрожжей или казеина. Последние содержат необходимые ауксотрофному штамму аминокислоты и витамины. Оптимальное соотношение углерода и азота в среде составляет 11 : 1 (при его увеличении выход лизина падает, при уменьшении накапливается аланин). В питательной среде также должны содержаться соли калия, магния и фосфора (табл. 15.7.97).
Таблица 15.7.97
Состав питательных сред при выращивании продуцента лизина (%) [109]
| Компоненты | Посевной аппарат | Промышленный ферментер |
|---|---|---|
| Мелассная среда | ||
| Меласса (по содержанию сахара) | 7,5 | 7–12 |
| Кукурузный экстракт (содержание СВ 50 %) | 2 | 1,2–1,5 |
| Сульфат аммония | 2 | 2 |
| Однозамещенный фосфат калия | 0,05 | 0,05 |
| Двухзамещенный фосфат калия | 0,05 | 0,05 |
| Мел | 1 | 1 |
| Пеногаситель синтетический | 0,1 | 0,1 |
| Вода | Остальное | Остальное |
| рН среды | 6,9–7,0 | 7,0–7,2 |
| Ацетатная среда | ||
| Ацетат аммония | 1,5 | 1,5 |
| Глюкоза | 1,0 | 1,0 |
| Однозамещенный фосфат калия | 0,02 | 0,02 |
| Сульфат магния | 0,04 | 0,04 |
| Сульфат аммония | 3,0 | 3,0 |
| Гидролизат соевой муки | 1,5 | 1,5 |
Посевной материал размножают в две стадии: сначала в колбах, а затем в посевных аппаратах, объем которых зависит от объема промышленного ферментера и обычно составляет 10 м 3 .
Если в качестве источника углерода используют уксусную кислоту (ацетат аммония), то, вследствие угнетающего действия ацетат-ионов на рост клеток при концентрации выше 2 %, осуществляют дробную подачу субстрата по мере его потребления.
Условия культивирования. Общая схема производства препаратов лизина представлена на рис. 15.7.12.
Процесс получения лизина требует строгих асептических условий.
Выращивание производственной культуры продуцента лизина обычно осуществляется периодическим способом в ферментаторах, объем которых составляет 50, 63 или 100 м 3 . Посевной материал в количестве 5–10 об. % от объема питательной среды поступает в ферментатор. Сразу после засева в него подается воздух, нагретый до 50 °С, из расчета 1 объем воздуха на 1 объем питательной среды в минуту при давлении 0,12–0,13 МПа.
Продолжительность ферментации составляет 55–72 ч, процесс проводят при интенсивном перемешивании среды, температуре 28–32 °С, рН = 7,0÷ 7,5 (поддерживается добавлением в среду аммиачной воды) и периодической подачей стерильного пеногасителя.
Процесс культивирования состоит из двух стадий. В первые сутки клетки потребляют около 25 % углеводов и азотистых веществ; в это время накапливается почти вся биомасса. На второй стадии скорость накопления биомассы резко снижается, но в КЖ происходит накопление лизина. По окончании процесса перестает потребляться титрующий агент (аммиачная вода) и концентрация лизина составляет 60–100 г/л, биомассы накапливается 10–15 г/л (СВ), коэффициент потребления сахара в расчете на лизин составляет 25–35 %.
Получение препаратов лизина [15, 48]
В зависимости от назначения из КЖ можно получить различные микробиологические препараты (рис. 15.7.12): жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ), кристаллический лизин.
Рис. 15.7.12. Технологическая схема производства препаратов лизина [15]
Жидкий концентрат лизина. Для получения ЖКЛ и ККЛ культуральную жидкость, содержащую 10–13 % СВ, подкисляют HCl до рН = 5,0 и добавляют 0,15% раствор гидросульфита натрия для стабилизации лизина. Стабилизированную культуральную жидкость упаривают под вакуумом до 35–40 % СВ.
Сухой концентрат лизина (ККЛ) получают, высушивая ЖКЛ в распылительных сушилках до влажности 5–6 %. Сухой ККЛ очень гигроскопичен, поэтому сразу после сушки его упаковывают в полиэтиленовые мешки.
Менее гигроскопичный ККЛ получают, высушивая ЖКЛ вместе с наполнителями (костной мукой, кормовыми дрожжами, пшеничными отрубями и др.).
В состав кормовых препаратов входят помимо лизина и другие аминокислоты, а также витамины, макро- и микроэлементы (табл. 15.7.98).
Таблица 15.7.98
Химический состав кормовых препаратов лизина [48]
| Компонент | Содержание |
|---|---|
| Аминокислоты, масс. % от массы СВ | |
| Лизин | 15–20 |
| Глутаминовая кислота | 2,5–3,7 |
| Валин | 1,2–4,8 |
| Аланин | 1,3–3,1 |
| Аспарагиновая кислота | 0,8–1,4 |
| Лейцин | 0,6–1,1 |
| Пролин | 0,3–2,8 |
| Глицин | 0,6–0,9 |
| Аргинин | 0,3–0,8 |
| Тирозин | 0,4–0,7 |
| Метионин | 0,4–0,6 |
| Изолейцин | 0,4–0,6 |
| Фенилаланин | 0,2–0,6 |
| Триптофан | 0,5–0,6 |
| Серин | 0,4–0,6 |
| Треонин | 0,3–0,6 |
| Гистидин | 0,2–0,3 |
| Цистеин | 0,2–0,3 |
| Азотистые вещества, масс. % от массы СВ | |
| Общий азот | 5,2–7,9 |
| Протеин (N ´ 6,25) | 37,5–49,4 |
| Азот: | |
| белковый | 1,9–3,6 |
| α-аминный | 0,9–2,0 |
| аммиачный | 0,3–1,4 |
| бетаина | 0,82–1,66 |
| Бетаин | 6,0–13 |
| Витамины, мкг/г | |
| Тиамин (витамин В1) | 1,7–9,7 |
| Рибофлавин (витамин В2) | 84,2–160 |
| Пантотеновая кислота (витамин В3) | 30–60 |
| Фолиевая кислота (витамин В4) | 10–20 |
| Пиридоксин (витамин В6) | 100–340 |
| Никотиновая кислота (витамин РР) | 8–10 |
| Другие органические вещества, масс. % от массы СВ: | |
| редуцирующие вещества | 4,6–12,7 |
| жиры | 1,3 |
| клетчатка | 0,3 |
| Минеральные вещества, масс. % от массы золы | |
| Зола, масс. % от массы СВ | 19,0–28 |
| Кальций | 5,2–12,5 |
| Калий | 28,6–33,6 |
| Натрий | 0,8 |
| Магний | 1,1–1,5 |
| Железо | 0,1–0,25 |
| Фосфор | 2,2–4,4 |
| Кремний | 10,9–11,5 |
| Микроэлементы, мг/100 г | |
| Цинк | 1821 |
| Кобальт | 67,8 |
| Кадмий | 476,7 |
| Молибден | 545,9 |
| Марганец | 3071 |
| Медь | 280 |
Кристаллический лизин выделяют из КЖ после отделения биомассы.
Для получения кормовых продуктов пригодны препараты лизина с содержанием основного вещества (лизинмонохлоргидрата) от 70 % и выше. При этом допускается окраска кристаллов в желтый и светло-коричневый цвета. К препаратам медицинского назначения предъявляются более жесткие требования; для парентерального питания содержание основного вещества должно быть не ниже 99 %.
При нормальном течении процесса доля побочных аминокислот не превышает 3 % от содержания лизина, доля микробных клеток — 1,5 %. Для отделения биомассы от КЖ используют саморазгружающиеся сепараторы, а также фильтрование с намывным слоем либо на барабанном вакуум-фильтре, либо на рамных фильтр-прессах с последующей промывкой осадка водой.
Растворы, содержащие лизин, после подкисления соляной кислотой (рН = 5,0÷5,2) и введения стабилизатора (NaHSO3) концентрируют выпариванием в вакууме до 45–50 % СВ. Полученный концентрат подвергают кристаллизации, которую проводят при 5–12 °С в течение 1–2 сут. Осадок отделяют от маточника в проточных промышленных центрифугах и далее высушивают в распылительной сушилке или в кипящем слое. Готовый продукт, как правило, окрашен в коричневый цвет и содержит не менее 70 % основного вещества.
Другим способом выделения лизина является ионообменный процесс. Для этого раствор продукта подкисляют H2SO4 до рН = 1,6÷ 2,0, в результате чего образуется дикатион аминокислоты. После хемосорбции на катионите (КУ-2х8), используемом в Н + или форме, отделяются примеси нейтральной и кислотной природы. Аминокислоты элюируют из катионита 0,5–5 % гидроксида аммония, раствор упаривают, подкисляют HCl до рН = 4,9÷5,0, а концентрат кристаллизуют при 5–12 °С, получая кристаллы монохлоргидрата лизина светло-желтого или светло-коричневого цвета, которые после высушивания содержат 90–95 % основного вещества и 1,0–12,5 % золы. Для получения препарата более высокой степени чистоты в схему очистки включают стадию обработки раствора активным углем, перекристаллизацию из 50% этанола и др.
Энзиматический синтез L-лизина [110]
Производство L-лизина посредством энзиматического синтеза основано на предварительном химическом синтезе DL-α-амино-ε-капролактама (АКЛ), который далее используют для селективного ферментативного гидролиза L-АКЛ до L-лизина; D-АКЛ подвергается ферментативной рацемизации и вновь используется как субстрат для гидролиза. Гидролизующий фермент получают из клеток Cryptococcus laurendii, а фермент, катализирующий рацемизацию, — из клеток Achromobacter obae.
При получении L-лизина целесообразно использовать совместное действие на субстрат двух ферментов [7]. Для этого в водный раствор DL-α-амин-ε-капролактама вводят необходимое количество дрожжевых и бактериальных клеток, проявляющих гидролазную и бактериальную активности. Оптимальные условия для действия обоих ферментов следующие: рН = 8,0÷ 8,5; температура 30–50 °С.
Выход L-лизина в этом процессе составляет 99,8 % (мольных) от субстрата.
Применение лизина [48, 95]
В основном L-лизин используется в качестве кормовой добавки, что связано с низким количеством этой аминокислоты в растительных кормах. Очищенный лизин используется как добавка в продукты питания, а также в препаратах медицинского назначения и для других целей.
Лизинсодержащие препараты могут использоваться в растениеводстве [53]. Применение таких препаратов, содержащих кроме аминокислот и другие биостимуляторы, дает значительное увеличение урожая тепличных и полевых сельскохозяйственных культур.
Кроме того, предложено использовать препараты лизина в качестве пищевых атрактантов для дезориентации личинок проволочников [73].
Пантотенат лизина может быть использован против лейкопении. Противоанемическим и анаболизирующим действием обладают соли фитиновой кислоты и лизина, оксилизина. Ацетиласпартат лизина может использоваться для лечения миокарда, интоксикаций эндогенного или экзогенного происхождения, заболеваний печени и т. д.
Образующиеся после ферментации клетки микроорганизмов, наряду с маточными растворами, обычно утилизируют в белковый кормовой продукт по технологии производства кормовых дрожжей.
Лизин (а, е-диаминокапроновая кислота) известен в виде двух оптически активных D- и L-форм и рацемической DL-формы. Эмпирическая формула C6H12N2O2. Молекулярная масса 146,19. Лизин хорошо растворим в воде, кислотах, основаниях; трудно растворим в спирте и нерастворим в эфире. Аминокислота при температуре 224-225 °С разлагается. Кристаллизуется лизин в виде бесцветных игл или гексагональных пластинок.
Установлено, что в организме лизин определяет не только биологическую ценность белка. Аминокислота выполняет много и других биохимических функций - она способствует секреции пищеварительных ферментов и транспорту кальция в клетки, улучшает общий азотный баланс в организме. Применение лизина в хлебопекарной промышленности повышает биологическую ценность и улучшает качество изделий. От добавления лизина в рационы животных (0,1-0,4%) значительно увеличивается коэффициент использования белка, и тем самым снижается расход кормов на единицу продукции.
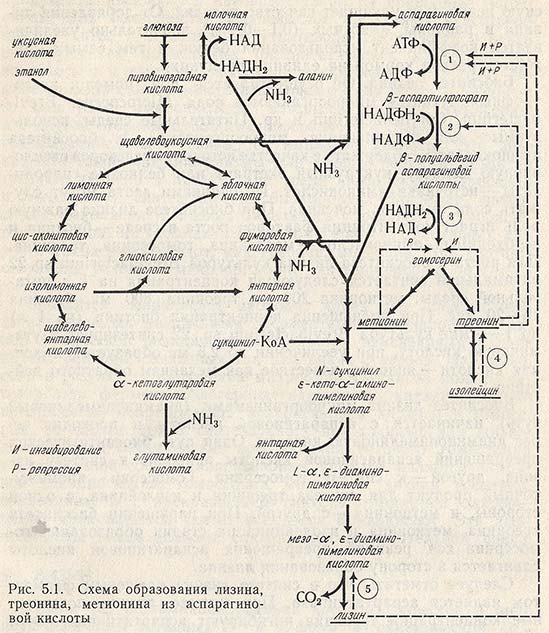
Биосинтез лизина
Он осуществляется при помощи ауксотрофных мутантов микроорганизмов рода Micrococcus, Brevibacterium, Corynebacterium и др. Питательные среды, используемые для выращивания микроорганизмов и биосинтеза аминокислоты, содержат в качестве источника углеводов свекловичную мелассу, кукурузный экстракт или белковые гидролизаты - источники аминокислот. Источниками азота могут служить соли аммония, мочевина. При биосинтезе лизина важную роль играет концентрация факторов роста в среде - биотина и необходимых аминокислот - метионина, гомосерина, треонина. Для роста и биосинтеза лизина культурой Brevibacterium sp. 22 оптимальной считается следующая концентрация на 1 л питательной среды: метионина 200 мг, треонина 800 мг, биотина 15-20 мкг. При уменьшении концентрации биотина (на 1 л) до 1-4 мкг культура Brevibacterium sp. 22 синтезирует глутаминовую кислоту, при увеличении до 2,5 мг образуется молочная кислота - явление, известное как механизм обратного действия.
Биосинтез лизина микроорганизмами (диаминопимелиновый путь) начинается с аспарагиновой кислоты и проходит через диаминопимелиновую кислоту. Один путь биосинтетических превращений аспарагиновой кислоты приводит к синтезу лизина, другой - к синтезу гомосерина. Гомосерин - промежуточный продукт для синтеза треонина и изолейцина, с одной стороны, и метионина - с другой. При нарушении биосинтеза треонина, метионина и изолейцина на стадии образования гомосерина ход реакций превращения аспарагиновой кислоты сдвигается в сторону образования лизина.
Следует отметить, что в синтезе лизина ключевым ферментом является аспартаткиназа. При синтезе лизина повышенные концентрации треонина ингибируют аспартаткиназу. Этот эффект усиливает присутствие лизина. Треонин у бактерий (Е. coli, Micrococcus glutamicus) ингибирует дегидрогеназу полуальдегида аспарагиновой кислоты и гомосериндегидрогеназу. Метионин по отношению к гомосериндегидрогеназе является репрессором. Треониндегидрогеназу ингибирует изолейцин. Таким образом, продукты обмена веществ, угнетающие различные ферменты и участвующие в синтезе лизина, должны быть выведены из реакции. Именно поэтому ауксотрофные микроорганизмы являются наиболее удобными для производства. Например, культура, лишенная активности гомосериндегидрогеназы, обеспечивает достаточно высокие выходы лизина.
На рис. 5.1 приведена схема биосинтеза лизина в бактериальных клетках, на которой показаны промежуточные метаболиты, синтезируемые по общему с лизином пути из аспарагиновой кислоты.
Технологические схемы производства L-лизина. Технология получения кристаллического L-лизина, разработанная Всесоюзным научно-исследовательским институтом генетики и селекции промышленных микроорганизмов, состоит из двух основных стадий: культивирования продуцента и выделения конечного продукта. На стадии культивирования производится двухступенчатое выращивание посевной культуры Micrococcus glutamicus в инокуляторах и посевных аппаратах. Предварительно выраженной культурой засевается ферментатор, в котором в стерильных аэробных условиях при непрерывном перемешивании и термостатировании (30-33 °С) осуществляется биосинтез. При ферментации в течение 50-70 ч при pH 7,4 концентрация лизина в растворе достигает 40 г/л.
Полученная после биосинтеза культуральная жидкость направляется на осветление, в результате отделяется биомасса. Осадок отделяют фильтрацией, сушат, размалывают и используют как кормовой продукт, содержащий около 40 % белковых веществ.
Очищенный раствор с pH 7,0 пропускают через катионит марки КУ-2 или КБ-4П-2 в NH4+-форме. Каждые 100 г катионита сорбируют 6-8 г лизина. После промывки ионообменника водой проводится десорбция лизина 0,5-5,0%-ной аммиачной водой, получаемый раствор содержит 80-90% лизина от сорбированного количества. Элюат упаривается в вакууме при 60 °С до 30-50%-ного содержания аминокислоты. При помощи соляной кислоты устанавливают pH 4,9, раствор упаривают и кристаллизуют аминокислоту при охлаждении до 12-14 °С. Кристаллы монохлоргидрата лизина отделяют на нутч-фильтре, промывают этиловым спиртом и высушивают при 60 °С. Форма готового продукта: L-лизин монохлоргидрат, содержание основного вещества 97-98%, влажность 0,5%, зольность до 0,3%, температура плавления 210 °С. Выход лизина на стадии выделения 76-78%.
Для животноводства Институтом биохимии им. А. Баха АН СССР совместно с Институтом микробиологии им. А. Кирхенштейна АН Латвийской ССР на Ливанском опытном биохимическом заводе было налажено производство кормового концентрата лизина - ККЛ (рис. 5.2).
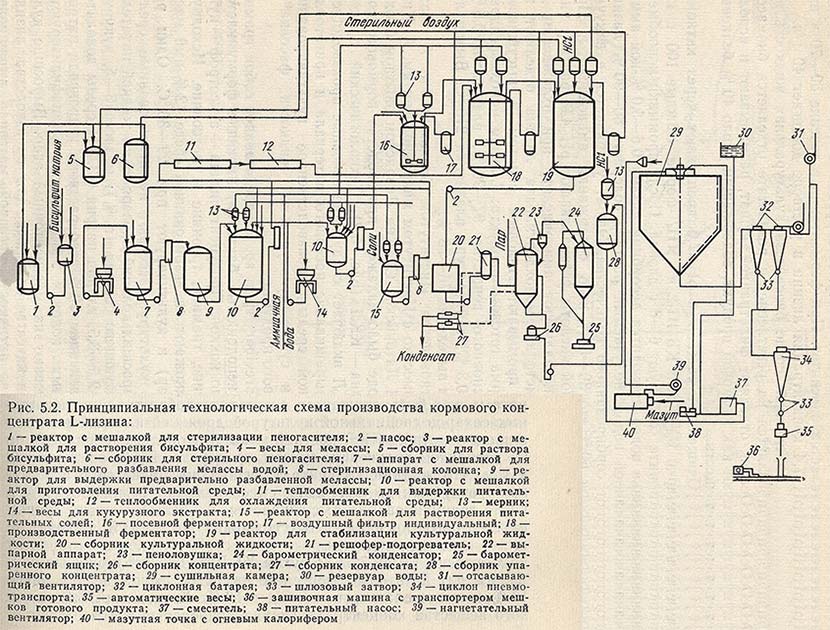
Технологический процесс получения ККЛ включает следующие основные производственные стадии: выращивание посевного материала и приготовление питательной среды, производственное культивирование, выпаривание и сушка культуральной жидкости, фасовка и упаковка готового продукта.
Культура Brevibacterium sp. 22 представляет собой грамположительные неподвижные бактерии, имеющие форму клеток от овальных до кокков. Продуцент лизина - ауксотроф - нуждается в биотине, тиамине, треонине и метионине. Исходную культуру размножают на агаризованной среде (2%-ный мясопептонный агар) и культивируют при 29-30 °С. Один раз в два месяца культуру рассевают на агаризованные среды. Активность выросших колоний проверяют на жидкой питательной среде следующего состава (в %): меласса 3-5, кукурузный экстракт 2,5-3,5, хлорид натрия 0,3. pH среды доводится до 7-7,2 добавлением 20%-ного раствора гидроксида натрия. Часть активных колоний высушивают (лиофилизируют), а часть пересевают на мясопептонный агар. Выросшие культуры служат в качестве исходных для производства лизина. Проверенный на активность посевной материал выращивают на мелассно-кукурузной среде в колбах (на 750 мл) в течение 24 ч при pH 6,9-7,0 и температуре 29-30 °С. Посевной материал характеризуется титром клеток 2,0*10 в 8 степени в 1 мл среды. Для выращивания культуры-продуцента в посевном аппарате готовят среду следующего состава (в %):

Среду стерилизуют 1 ч при температуре 126 °С. В посевной ферментатор на 250 л вносят 3-5% (от объема среды) посевного материала. Коэффициент заполнения посевного аппарата равен 0,5. Культуру выращивают при 29-30 °С, непрерывной аэрации (1 объем на 1 объем среды в минуту) и перемешивании (мешалка турбинного типа, 300 об/мин) в течение 24 ч. Для пеногашения добавляют 0,3% (от объема среды) простерилизованного (в течение 1 ч при температуре 120 °С) кашалотового жира.
Производственное культивирование продуцента. Производственное культивирование осуществляется в ферментаторах вместимостью 50 и 100 м3. До засева посевным материалом ферментатор промывается и стерилизуется в течение 1 ч при 0,1 МПа. Культура выращивается на среде следующего состава (в %):
Выпаривание и сушка культуральной жидкости. Стабилизированная 0,15%-ным бисульфитом натрия культуральная жидкость с pH 5,0-6,0 выпаривается на вакуум-выпарной установке. Начальная концентрация сухих веществ в жидкости, поступающей на выпарку, составляет 10-15%, конечная - около 40%. Упаренная культуральная жидкость высушивается нагретым воздухом на распылительной сушилке с дисковым распылителем при 300/90 °С.
Фасовка и упаковка готового продукта. Высушенный до остаточной влажности 4-8% ККЛ фасуется по 20 кг в крафт-мешки с полиэтиленовым вкладышем. При правильном соблюдении технологического режима выход лизина на стадии ферментации составляет 23-26% от содержания усвоенного сахара, а в культуральной жидкости накапливается до 20-25 г/л L-лизина. Общие потери лизина на стадии выпаривания и сушки не превышают 15%.
Сухой концентрат кормового лизина, получаемый высушиванием стабилизированной и сконцентрированной жидкости, имеет существенный недостаток. Он очень гигроскопичен и при хранении слеживается крупными комками. Гигроскопичность препарата может быть снижена в результате дображивания остаточных сахаров специальной культурой дрожжей или добавлением в процессе сушки ККЛ костной муки, бентонита, аэросила. Один из вариантов получения сухого препарата ККЛ заключается в том, что жидкий концентрат лизина смешивается с пшеничными отрубями до получения смеси влажностью около 70% и после гранулирования высушивается на конвективных сушилках. Готовый препарат ККЛ содержит до 7-10% лизина, он сыпуч и негигроскопичен.
Согласно ТУ 59-72-74 сухой ККЛ должен содержать монохлоргидрат L-лизина в пересчете на сухое вещество не менее 10% и иметь влажность не более 10%. Химический состав сухого вещества концентрата лизина приведен ниже.

Комбинированный, или энзиматический, способ производства лизина
Процесс состоит из стадий органического синтеза и ферментативного гидролиза. Исходным сырьем для получения этой аминокислоты служит циклогексан. В результате химических реакций из циклогексана получается циклический ангидрид лизина (DL-a-амино-е-капролактам), который на стадии ферментативного гидролиза превращается в L-лизин.
При этом производят разделение оптических изомеров, являющееся сложным и дорогостоящим процессом при синтезе не только L-лизина, но и других аминокислот. Разделение оптических изомеров DL-а-амино-е-капролактама осуществляется при использовании микробных ферментов. При этом происходит асимметрический гидролиз с помощью гидролазы аминокапролактама с образованием L-лизина.
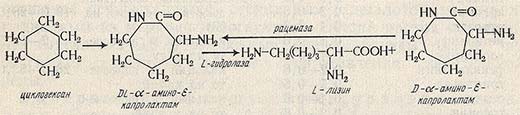
Помимо лизина в реакционной смеси содержится D-a-амино-e-капролактам, который с целью увеличения выхода L-лизина подвергают рацемизации. Для выявления преимущества рассматриваемого процесса необходимо, чтобы одновременно с гидролазой L-a-амино-е-капролактама действовал фермент, рацемизующий D-a-амино-е-капролактам. Только совместное действие этих двух ферментов обеспечивает превращение DL-а-амино-е-капролактама в L-лизин почти со 100%-ным выходом. Содержание аминокислоты в реакционной смеси может достигать 200 г/л.
Установлено, что способностью синтезировать гидролазу L-a-амино-е-капролактама обладают дрожжи родов Cryptococcus, Candida, Trichosporon. Активаторами этого фермента служат ионы Mn2+, Mg2+, Zn2+, ингибитором - этилендиаминтетрауксусная кислота. Фермент рацемазу а-амино-е-капролактама получают при выращивании бактерий, относящихся к родам Achromobacter, Flavobacterium и др. Ингибирующее действие на этот фермент оказывает гидроксиламин. Принцип действия рацемазы а-амино-е-капролактама, по-видимому, такой же, как и рацемаз других аминокислот, требующих в качестве кофактора пиридоксаль-5-фосфат.
Совместное действие двух ферментов на субстрат достигается введением в водный раствор DL-аминокапролактама определенного количества биомассы или сухих клеток дрожжей, обладающих гидролазной активностью, и бактерий с рацемазной активностью аминокапролактама. В результате реакции DL-аминокапролактам количественно переходит в L-лизин. Оптическая чистота получаемой аминокислоты более 99%.
Новый способ получения лизина интересен еще и тем, что L-гидролазу и рацемазу аминокапролактама можно получать, в иммобилизованной форме, что дает большие преимущества по сравнению с использованием растворимых ферментов. Для этого раствор DL-аминокапролактама, полученный химическим способом, пропускают через колонку, содержащую два иммобилизованных фермента микробного происхождения. Первый из них гидролизует амидную связь в L-аминокапролактаме, не затрагивая D-изомера, второй фермент - рацемаза - с высокой скоростью превращает D-изомер в рацемат. При правильно подобранных условиях и режиме работы колонки единственным продуктом процесса является L-лизин, его выход составляет 95%.
Читайте также:

