Культуральный посев на среду mccoy триха хлам
Обновлено: 19.09.2024
Что такое Бактериологический посев (культуральный метод)?
Бактериологический посев (культуральное или микробиологическое исследование) - лабораторное исследование, при котором биоматериал, в котором предположительно могут находиться патогенные микроорганизмы, помещают в благоприятную для их размножения среду при определенных температурных параметрах с последующей оценкой результатов и определения чувствительности к антибактериальным препаратам. Метод ценен для определения условно-патогенной микрофлоры, определения чувствительности к антибиотикам.
Бактериологический посев (культуральное или микробиологическое исследование) - лабораторное исследование,при котором биоматериал,в котором предположительно могут находиться патогенные микроорганизмы,помещают в благоприятную для их размножения среду при определенных температурных параметрах с последующей оценкой результатов и определения чувствительности к антибактериальным препаратам.
Почему важно делать Бактериологического посева (культуральный метод)?
Из всех методов диагностики инфекционных заболеваний это самый дорогой и трудоемкий метод. Однако эти его недостатки с лихвой компенсируются: если анализ на инфекцию методом посева дает положительный результат, можно не сомневаться в присутствии этих бактерий в организме.
Преимуществом культурального метода является относительно высокая специфичность исследования и возможность лабораторного моделирования терапевтического воздействия на микроорганизмы и учет его эффективности.
Недостатками являются длительность исследования, высокие требования к забору материала, повышенные требования к квалификации персонала лабораторий.
При каких заболеваниях делается Бактериологический посев (культуральный метод)?
Выделяемые микроорганизмы: аэробы (стрептококки, стафилококки, энтеробактерии, неферментирующие, энтерококки), анаэробы (Actinomyces, Bacteroides, Clostridium, Eubacterium, Fusobacterium, Gemella, Peptostreptococcus, Porphyromonas, Prevotella, Propionibacterium, Veilonella).
Как проходит Бактериологический посев (культуральный метод)?
Материал для исследования:отделяемое из очагов поражения.Материал может браться не только из половых органов,но и из полости рта,прямой кишки.
Правила забора аналогичны забору при ПЦР-диагностике.Сроки выполнения различны от нескольких дней до нескольких недель(зависят от определяемого возбудителя).Для забора материала используются стерильные специальные инструменты или тампоны.Материал помещают в транспортную среду,если забор проводится вне лаборатории и в дальнейшем его помещают в специальные питательные среды.В зависимости от задач исследования применяют множество сред с добавлением различных биопрепаратов и химических соединений.Питательная среда с внесенным материалам помещается в специальные приборы(термостаты),в которых создается и автоматически поддерживаются условия,необходимые для размножения микроорганизмов (температура,влажность,газовая смесь и.т.д.).По истечению определенного времени проводят контрольные проверки-осмотры питательных среды.Рост микроорганизмов происходит в виде так называемых колоний,обладающих видимыми характеристиками - размер,плотность,форма,цвет и.т.д.При необходимости проводится микроскопическое исследования материала,взятого из колоний с окраской специальными красителями.Для того,чтобы дифференцировать микроорганизмы,сходные по типу колоний и (или) микроскопической картине проводят дополнительное исследования по способностям микроорганизмов разлагать некоторые неорганические и органические соединения - так называемое исследование с помощью биохимического ряда.Для определения количественных показателей используют различные методы,о которых сказано ниже.Выделенный и определенный микроорганизм называют культурой.
Задача упрощается в тех,случаях,когда посев материала проводят на специальные среды,на которых могут размножаться только определенные виды микробов.(например среда Маккоя для определения хламидий).
Материал для сдачи Бактериологического посева (культуральный метод)
Материал для исследования может браться не только из половых органов, но и из полости рта, прямой кишки. Правила забора аналогичны забору при ПЦР-диагностике. Сроки выполнения различны - от нескольких дней до нескольких недель (зависят от определяемого возбудителя).
Кровь для посева следует брать до назначения антибактериальных препаратов. Если больной уже получает антибактериальную терапию, кровь следует забирать непосредственно перед очередным введением препарата. Забор крови осуществляется на высоте подъема температуры.
Микробиологическое исследование, позволяющее выявить возбудителя трихомониаза – Trichomonas vaginalis.
Синонимы русские
Посев на трихомониаз.
Синонимы английские
Trichomonas vaginalis, culture.
Метод исследования
Какой биоматериал можно использовать для исследования?
Секрет простаты, отделяемое влагалища, отделяемое уретры, эякулят, разовую порцию мочи.
Как правильно подготовиться к исследованию?
- Женщинам рекомендуется сдавать урогенитальный мазок или мочу до менструации или через 2-3 дня после ее окончания.
- Мужчинам не следует мочиться в течение 3 часов до сдачи урогенитального мазка или мочи.
Общая информация об исследовании
Урогенитальный трихомониаз (трихомоноз) – это широко распространенное инфекционное заболевание мочеполовой системы, передающееся преимущественно половым путем. Его возбудителем является простейшее Trichomоnas vaginalis. Наиболее часто поражается уретра и влагалище (у женщин). Источник инфекции – больной трихомониазом. Основной путь передачи – половой.
Инкубационный период у женщин составляет 5-28 дней. Признаки заболевания у них часто появляются (или усиливаются) при наступлении менструаций: пенистые желтоватые выделения из влагалища, зуд и жжение в нем и в области вульвы, боль при мочеиспускании и при половом акте. Нередко инфекция протекает бессимптомно. При беременности трихомониаз может быть причиной низкого веса новорождённых или преждевременных родов.
У мужчин трихомониаз сопровождается постоянными белыми выделениями из уретры, однако часто симптомы отсутствуют. Изредка трихомониаз вызывает баланопостит, простатит, эпидидимит, цистит.
"Золотым стандартом" диагностики трихомониаза является культивирование на питательных средах (посев). Это наиболее чувствительное исследование. Его применяют, как правило, для подтверждения диагноза или в тех случаях, когда результаты микроскопии оказываются отрицательными при симптомах трихомониаза.
ФГУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
ФБУН НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
Сравнение пределов обнаружения микроскопии, культурального посева и методов амплификации нуклеиновых кислот, используемых в лабораторной практике для выявления Trichomonas vaginalis
Журнал: Клиническая дерматология и венерология. 2012;10(3): 16-21
Гущин А. Е., Рыжих П. Г., Махлай Н. С. Сравнение пределов обнаружения микроскопии, культурального посева и методов амплификации нуклеиновых кислот, используемых в лабораторной практике для выявления Trichomonas vaginalis. Клиническая дерматология и венерология. 2012;10(3):16-21.
Gushchin A E, Ryzhikh P G, Makhlaĭ N S. Comparison of detection limits of microscopy, culture, and nucleic acid amplification techniques using in the laboratory practice for the identification of Trichomonas vaginalis. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(3):16-21. (In Russ.).





Trichomonas vaginalis, простейшее, вызывающее урогенитальный трихомониаз, - одна из наиболее распространенных инфекций, передающихся половым путем. Классическими тестами, используемыми для обнаружения T. vaginalis, являются микроскопия и культуральный посев. Однако в последние годы все большую роль в диагностике инфекций играют методы амплификации нуклеиновых кислот, которые позволяют обнаружить возбудитель при минимальном его количестве. Представлены результаты интересной работы по установлению значения пределов обнаружения методов выявления T. vaginalis - микроскопии, культурального посева, полимеразной цепной реакции (ПЦР) и реакции транскрипционной амплификации (НАСБА), - используемых в лабораторной практике при диагностике мочеполового трихомониаза. Установлено, что среди методов выявления T. vaginalis наибольшей аналитической чувствительностью (наименьшим пределом обнаружения) обладают методы амплификации нуклеиновых кислот ПЦР и НАСБА на основе наборов реагентов Амплисенс, а наименьшей - микроскопические методы. Чувствительность культурального метода была выше, чем у метода микроскопии, но уступала методам амплификации ДНК и РНК.
ФГУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
ФБУН НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
Цель настоящего исследования — установить значения пределов обнаружения методов выявления T. vaginalis – микроскопии, культурального посева, ПЦР и НАСБА, используемых в лабораторной практике при диагностике мочеполового трихомониаза.
Материал и методы
В общем виде схема исследования аналогична использованной в нашей предыдущей работе (П.Г. Рыжих, 2011).
Исследования образцов с помощью микроскопии. Для микроскопического исследования отбирали аликвоты по 10 мкл и готовили: 1) три нативных препарата, которые исследовали в течение 2—3 мин с момента приготовления, подсчитывали среднее количество подвижных клеток в 10—100 полях зрения при увеличении 400 (×400); 2) три препарата, окрашенных по методу Романовского—Гимзы, которые исследовали в течение суток с момента приготовления, и подсчитывали среднее количество клеток трихомонад в 10—100 полях зрения (×1000).
При проведении культурального исследования по 100 мкл аликвот из разведений суспензии трихомонад переносили в пробирки с 900 мкл соответствующей питательной среды. Для каждого варианта питательных сред готовили и исследовали по три образца из каждого разведения. Пробирки с питательными средами после внесения посевного материала сразу помещали в термостат для инкубации при 37±1 oC. Учет результатов проводили через 2, 4 и 7 сут. Наличие или отсутствие роста трихомонад определяли при микроскопии нативного материала из придонного слоя питательной среды. Учет результатов проводился на основании наличия подвижных клеток T. vaginalis при просмотре 10—20 полей зрения.
Результаты
В нашем исследовании мы впервые провели количественную оценку пределов обнаружения лабораторных тестов, используемых для выявления T. vaginalis на основе серийно выпускаемых и используемых в Российской Федерации наборов реагентов.
Для этого были приготовлены суспензия клеток трихомонад c известной исходной концентрацией (1,45±0,24)×10 6 клеток/мл, и 10-кратные разведения, из которых отбирались аликвоты, объемом, соответствующим протоколу используемого метода. Пределом обнаружения считали минимальную концентрацию простейших, при которой они обнаруживаются при использовании определенного метода.

Результаты выявления T. vaginalis разными методами представлены в таблице.
Оценивая результаты двух методов микроскопии, следует отметить, что при высокой (более 10 6 клеток/мл) концентрации клеток T. vaginalis в исходном образце в обоих случаях было выявлено достаточное содержание клеток в каждом поле зрения микроскопа и для интерпретации результатов достаточно было проанализировать не более 10 полей зрения.
При микроскопическом исследовании аликвот из разведения с концентрацией 10 5 клеток/мл приходилось просматривать больше полей зрения, и не в каждом из них обнаруживались клетки трихомонад. В среднем при микроскопии нативного препарата обнаруживались 1—2 клетки в поле зрения, при микроскопии окрашенного препарата — 2—3 клетки в поле зрения. Разведение клеточной суспензии до 104 клеток/мл привело к тому, что при анализе 100 полей зрения было обнаружено всего несколько клеток простейшего при микроскопии нативного препарата. Согласно существующим рекомендациям, положительным результатом теста считается наличие хотя бы одного подвижного простейшего при микроскопии нативного препарата или хотя бы одного простейшего с типичной морфологией T. vaginalis при микроскопии окрашенного препарата в одном из 5 полей зрения [2]. В реальной лабораторной практике клетки трихомонад располагаются среди большого количества других клеток организма человека (зрелые эпителиальные клетки и их предшественники, лейкоциты, макрофаги, клетки сперматогенеза, дрожжеподобные грибы и др.) и бактериальной микрофлоры, присутствующих в биологическом материале. Это приводит к трудностям в выявлении единичных клеток простейших. Таким образом, установленным нами пределом обнаружения микроскопического метода в условиях чистой культуры T. vaginalis следует считать значение более 10 5 клеток/мл, а при исследовании биологического материала от пациентов эта величина может быть больше.
При проведении культурального исследования нами были получены следующие результаты: при высокой концентрации клеток простейших в разведении (более 10 5 клеток/мл) после 2 сут инкубации на исследованных питательных средах во всех полях зрения микроскопа было зафиксировано более 200 клеток трихомонад. Причем содержание неподвижных клеток составляло не более 3—4%, что соответствует экспоненциальной фазе роста микроорганизма. При уменьшении концентрации клеток простейших в разведении до 104 клеток/мл через 4 сут культивирования на коммерческих питательных средах были выявлены единичные подвижные клетки T. vaginalis не в каждом поле зрения микроскопа. При содержании простейших в исследуемом разведении 10 3 клеток/мл, зафиксировано не более 1 клетки не в каждом поле зрения микроскопа только для среды СВТ через 4 сут культивирования. Дальнейшая инкубация образцов не приводила к увеличению содержания клеток, и через 7 сут культивирования в этих пробирках со средой СВТ были выявлены только неподвижные клетки трихомонад. На средах НПО Диагност-Мед и Himedia при данной посевной дозе через 96 ч культивирования выявлялись только единичные неподвижные клетки трихомонад.
При культивировании на питательной среде СВТ+L-41, даже если концентрация клеток простейших в разведении составляла 102 клеток/мл, в каждом поле зрения микроскопа насчитывалось более 200 особей. Разница была лишь в том, что указанный количественный уровень достигался за разное время культивирования — от 2 до 7 сут. Минимальная концентрация простейших в разведении, при которой наблюдался рост на среде СВТ+L-41, составила всего 10 клеток/мл.
Таким образом, установленный нами предел обнаружения культурального метода с использованием серийно производимых сред составил более 10 3 клеток/мл, а при культивировании T. vaginalis в питательной среде СВТ в присутствии клеточной линии L-41 предел обнаружения составил более 10 клеток.
При исследовании с использованием наборов реагентов для проведения ПЦР и НАСБА в реальном времени получены самые низкие значения пределов обнаружения. Для ПЦР предел обнаружения соответствовал разведению 1,45 кл/мл. Однако при данном разведении ДНК T. vaginalis детектировалась в 1 из 3, а РНК T. vaginalis - в 2 из 3 тестирований. Воспроизводимое при 3-кратных тестированиях обнаружение ДНК и РНК T. vaginalis было получено для разведения с концентрацией трихомонад более 10 клеток/мл.
Первое исследование, в котором была установлена прямая зависимость между количеством T. vaginalis в образце и диагностической чувствительностью микроскопического метода, — работа A. Philip и соавт. [8]. Авторы разработали методику культивирования T. vaginalis на агаризированной культуральной среде с подсчетом колониеобразующих единиц в 1 мл (КОЕ/мл). Используя эту методику, авторы определили содержание простейших у обследованных пациентов и сравнили полученные результаты с клиническим статусом и долей положительных результатов, полученных с помощью микроскопии. Содержание возбудителя в биологическом материале варьировало от 40 до 10 6 КОЕ/мл. Возбудитель обнаруживался микроскопически, если его содержание в биологическом материале превышало 10 5 КОЕ/мл. У пациентов, имеющих значения, превышающие этот порог, инфекция протекала преимущественно с клиническими проявлениями, и, наоборот, среди бессимптомных лиц преобладали те, у кого концентрация возбудителя была ниже порога обнаружения микроскопическим методом. Таким образом, было показано, что бессимптомная трихомонадная инфекция чаще всего сопровождается низким уровнем возбудителя в организме и, следовательно, хуже диагностируется с помощью микроскопии. Учитывая то, что для формирования колонии необходима как минимум одна живая клетка простейшего, то полученное авторами значение предела обнаружения метода микроскопии соответствует значению, полученному в нашем исследовании.
Протоколы культивирования T. vaginalis, применяемые в рутинной лабораторной практике, основаны на использовании бесклеточных питательных сред, производимых как серийно, так и в бактериологических лабораториях. ДЧ культурального метода может значительно варьировать в зависимости от состава питательной среды и качества ее компонентов. Тем не менее полученные нами результаты не выявили разницы между средами разных производителей. Предел обнаружения при культивировании T. vaginalis в питательных средах был ниже, чем при микроскопии, что, как уже было отмечено, и обеспечивало более высокую ДЧ культурального метода. В нашем исследовании для видимого роста возбудителя в среде необходимо, чтобы его концентрация была не меньше 10 3 клеток/мл. Данная величина предела обнаружения соответствует экспериментально установленному значению, полученному ранее [9]. Установлено, что для инициирования детектируемого роста культуры T. vaginalis, необходимо, чтобы в ней присутствовало не менее 3×10 3 клеток/мл простейших. В той же работе, как и в ряде других [10, 11], было показано, что для культивирования T. vaginalis cо значительно меньшей начальной концентрацией простейших необходимо наличие эукариотической клеточной линии (McCoy), которая создает условия, более близкие к естественной среде обитания трихомонад. В этом случае для начала роста культуры достаточно всего 2—3 клеток T. vaginalis. В нашем исследовании мы также оценивали эффективность культурального выявления трихомонад в присутствии клеточной линии (L-41). В результате предел обнаружения снизился до
14,5 клеток/мл, что полностью согласуется с данными G. Garber и других авторов. К сожалению, несмотря на столь высокую чувствительность метода культивирования T. vaginalis на эукариотических клеточных линиях, его применение в клинической лабораторной практике весьма проблематично.
Среди методов диагностики трихомонадной инфекции самая высокая диагностическая чувствительность принадлежит МАНК, которая обеспечивается самым низким пределом обнаружения возбудителя, что в свою очередь определяется рядом условий при разработке амплификационных методик. В частности, для выявления ДНК T. vaginalis разными вариантами ПЦР большое значение имеет выбор генетической мишени. Ранее было показано, что доля выявленных с помощью ПЦР случаев трихомонадной инфекции в значительной степени зависела от выбора генетической мишени для амплификации и структуры праймеров [12]. Наибольшей чувствительностью обладали методики, в которых использовали праймеры к генетическим повторяющимся элементам T. vaginalis, насчитывающие несколько сотен копий на геном простейшего [13].
Вывод
В результате исследования установлено, что среди методов выявления T. vaginalis, используемых в лабораторной диагностике трихомониаза, наибольшей аналитической чувствительностью (наименьшим пределом обнаружения) обладают методы амплификации нуклеиновых кислот ПЦР и НАСБА на основе наборов реагентов Амплисенс, а наименьшей аналитической чувствительностью — микроскопические методы. Чувствительность культурального метода была выше, чем метода микроскопии, но уступала методам амплификации ДНК и РНК.
При взятии образцов в первые несколько дней жизни возможны отрицательные результаты посева, поскольку у новорожденных элементарные тельца формируются в течение нескольких дней. С помощью некультуральных методов — реакции прямой иммунофлюоресценции, твердофазного иммуноферментного анализа и полимеразной цепной реакции (ПЦР) — возможно исследование любых образцов, результаты получают значительно быстрее. В настоящее время выпускаются наборы для ПЦР.
Данную реакцию считают наиболее чувствительным некультуральным методом верификации хламидий. В настоящее время доступны реактивы для экспресс-ПЦР с образцами из глаза при подозрении на хламидийную и/или вирусные инфекции (например, вирус герпеса). Следует уточнять возможность проведения ПЦР в лаборатории учреждения с образцами из глаза:

2. Среды для культивирования хламидий. Необходимо помещать образцы в питательную среду сразу же после забора. В каждой лаборатории используют специфические среды, выпускаемые для определенного типа микроорганизма. Следует получить соответствующие среды в лаборатории. Ниже указаны классические среды, используемые для каждого типа микроорганизмов.
а. Питательные среды для культивирования бактерий:
(1) Триптиказо-соевый бульон.
(2) Чашки Петри с кровяным агаром.
(3) Чашки Петри с шоколадным агаром для Hemophilus influenzae, Neisseria gonorrhea.
(4) Среда Тайера-Мартина при подозрении на N. gonorrhea.
б. Сохраняющие вирусы среды, например среда М4 для транспортировки вирусов и хламидий (Remel, Lenexa, KS, USA).
в. Среда для транспортировки культуры хламидий, например среда М4 для транспортировки вирусов и хламидий (Remel, Lenexa, KS,USA).
г. Агар Сабуро при подозрении на грибковый конъюнктивит.
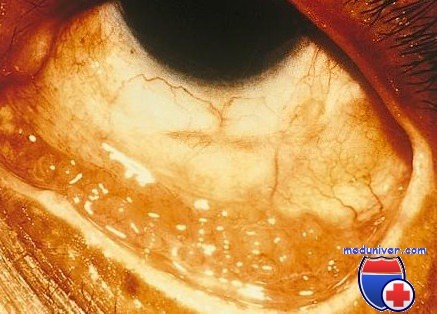
Оценка результатов цитологического исследования конъюнктивы
1. Клеточная реакция.
а. Полиморфноядерная реакция.
(1) Бактериальные инфекции.
(2) Хламидийная инфекция.
(3) Крайне тяжелая вирусная инфекция.
б. Мононуклеарная реакция: вирусная инфекция.
в. Эозинофилия и базофилия: аллергические состояния.
г. Плазматические клетки: хламидийная инфекция.
2. Интраэпителиальные клеточные включения.
а. Хламидийная инфекция:
(1) Ацидофильные включения в цитоплазме, шапочки над ядрами эпителиальных клеток.
(2) Базофильные первичные тела в цитоплазме.
б. Вирусная инфекция. Можно обнаружить гигантские многоядерные эпителиальные клетки (например, герпетический кератоконъюнктивит).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

