Лабораторная работа посев микроорганизмов шпателем тампоном петлей
Обновлено: 05.10.2024
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.

Знание физиологии и методов идентификации чистых культур бактерий является основой микробиологической диагностики инфекционных болезней. Питательные среды необходимы для выделения и идентификации микробов.
Цель: ознакомление с способами посева бактерий на плотные питательные среды
Слушатель должен знать
Способы посева бактерий (сплошной, истончающий штрих)
Слушатель должен уметь
1. Овладеть техникой посевов бактериологической петлей и шпателем Дригальского.
Зарисовать схемы посева микроорганизмов (сплошной посев методом Дригальского, посев истончающим штрихом по Голду).
Теоретическая часть
Рабочее место, где непосредственно проводится работа с культурами микроорганизмов, требует особенно тщательной обработки. Рабочий стол следует дезинфицировать не только до начала работы, но и после ее окончания. Для протирания поверхности стола можно использовать растворы лизола и хлорамина, а также 70%-ные (по объему) растворы изопропилового или этилового спиртов. В лаборатории не разрешается курить, хранить и употреблять еду, напитки, жевательную резинку. Работать следует в халатах.
Правила работы с культурами микроорганизмов. В лаборатории микроорганизмы выращивают в питательных средах, которые разливают в пробирки, колбы, матрацы и чашки Петри. Внесение микроорганизмов в стерильную среду называется посевом, или инокуляцией. Перед посевом следует тщательно надписать на пробирке (колбе или чашке Петри) название микроорганизма и дату посева. Надпись делают маркером на стекле или на наклеенной этикетке. Клетки микроорганизмов для посева или приготовления препаратов берут бактериологической петлей, если микроорганизмы выращены на плотной среде. В том случае, когда пересевают культуры микроорганизмов, выросшие в жидкой питательной среде, пользуются стерильной пипеткой. Использованную пипетку следует немедленно перенести в дезинфицирующий раствор, например, 3 - 5%-ный водный раствор фенола или 2%-ный раствор хлорамина, не касаясь ею окружающих предметов.
Для получения смывов пользуются стерильными ватными тампонами, которые перед употреблением смачивают в стерильном физиологическом растворе. При исследовании мелких предметов (телефон) смыв делают со всей поверхности (тщательно протереть поверхность телефона). Затем тампон помещают в пробирку со стерильным физраствором, выдерживают там 5 минут, при этом пробирку постоянно нужно потряхивать.
Для получения изолированных колоний предложен разные методы разобщения клеток. Наибольшее распространение для выделения чистой культуры аэробных и факультативно-анаэробных бактерий получили метод посева штрихом и метод Дригальского.
Метод Дригальского – последовательный перенос исследуемого материала с помощью шпателя из одной чашки в последующие 2-3 чашки с агаром (рисунок 1).
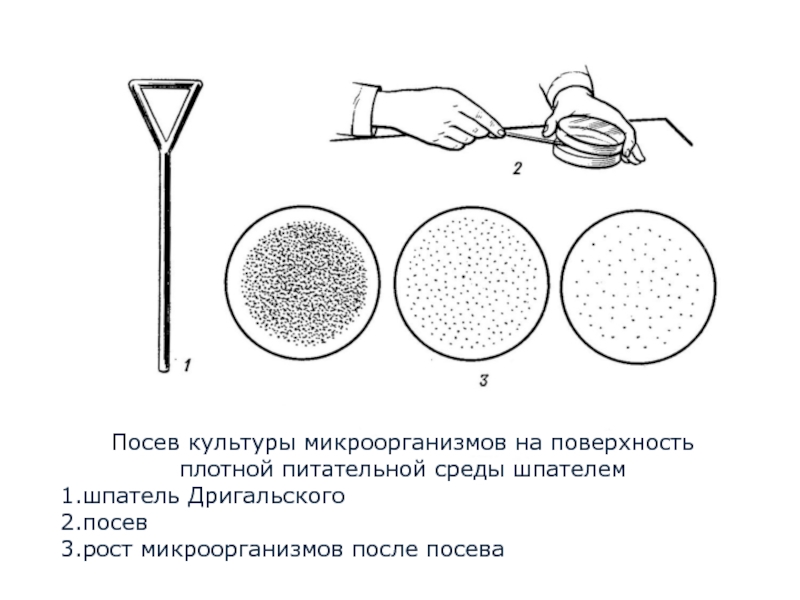
Рисунок 1 – Получение изолированных колоний по методу Дригальского
Посев штрихами с помощью бактериологической петли (рисунок 2).
Рисунок 2 – Схема посева штрихами (а, цифрами указана последовательность нанесения штрихов) и результат посева (б).
Техника посева зависит от характера исследуемого материала и консистенции питательной среды. Жидкий материал для посева берут бактериологической петлей или стерильной пипеткой. Все манипуляции проводят вблизи пламени горелки с соблюдением правил асептики. Бактериологическую петлю перед взятием материала и по окончании посева прокаливают в пламени горелки. Пипетки после посева погружают в дезраствор.
При посеве штрихом стерильной петлей берут каплю исследуемого материала и наносят его параллельными штрихами на поверхность агара в чашке Петри. В начале посева на петле имеется большое количество микробов, поэтому рост будет сплошным. С каждым штрихом на петле остается все меньше микробов, поэтому отмечается рост изолированных колоний. Посев штрихом имеет множество вариантов (рисунок 3).
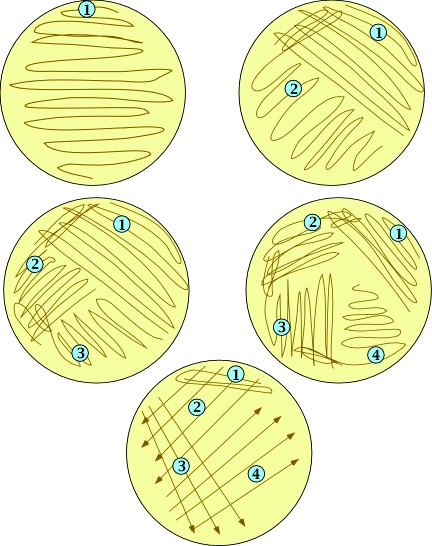
Рисунок 3 – Варианты посева штрихами. Цифрами обозначена последовательность нанесения штрихов.
Шпателем по методу Дригальского исследуемый материал распределяется по поверхности среды в нескольких чашках Петри. При этом вначале материал распределяют по поверхности агара в первой чашке Петри, затем этим же шпателем материал переносят на последующие чашки. На первой чашке отмечается сплошной рост культуры, а на последующих выявляются изолированные колонии (рисунок 1).
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат слегка наклонно в левой руке между большим и указательным пальцами так, чтобы края пробирок были на одном уровне (пробирка с исследуемым материалом должна быть первой по отношению к работающему). В правую руку берут бактериологическую петлю (иглу или пипетку) как писчее перо. Пробки от пробирок прижимают мизинцем к ладонной поверхности правой кисти, в зоне пламени горелки пробирки открывают, края пробирок обжигают. Петлю вертикально прокаливают в пламени горелки. Простерилизованную петлю (иглу, пипетку) вводят через пламя горелки в пробирку с посевным материалом. Петлю охлаждают, забирают небольшое количество материала, переносят в пробирку со стерильной питательной средой. Материал стряхивают в среду или, слегка погружая в жидкость петлю, растирают посевной материал по стенке пробирки не касаясь среды держателем, после чего смывают его средой. Края пробирок и пробки вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив или стакан. При посеве материала с помощью пипетки использованную пипетку опускают вниз концом в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Посевы выполняют разными способами. Эти способы основаны на том, что микроорганизмы иммобилизуются на поверхности или в глубине питательной среды.
Посев в пробирку. Материал, забранный петлей, опускают до дна пробирки со скошенным агаром, погружают в конденсационную жидкость и зигзагообразными движением петли проводят снизу вверх, слегка касаясь поверхности среды (посев штрихом). При посеве материала уколом в столбик среды, петлей с материалом или иглой прокалывают вертикально центру пробирки питательную среду, петлю или иглу вынимают, прожигают. (Правила работы с пробирками и петлей при посеве в пробирку с плотной средой аналогичны правилам при посеве на жидкие питательные среды).
Посев на чашку Петри. Чашку берут в левую руку, большим пальцем левой руки слег приподнимают крышку, чтобы в образовавшуюся щель свободно проходили петля или шпатель, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли.
1. Посев штрихом. Посевной материал втирают петлей в поверхность среды у края чаш избыток снимают, проколов агар. Оставшийся материал растирают параллельными штрихами по поверхности среды.
2. Посев петлей на секторы: дно чашки расчерчивают на секторы, посев производят зигзагообразными движениями от края чашки к центру так, чтобы штрихи с одного сектора не переходили на другой.
3. Дробный посев: бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри, петлю прожигают в пламени горелки, дают остыть и часть материала из первого сектора (А) распределяют во втором секторе (В) аналогичным способом, затем в третьем (С) и четвертом (Д) секторах.
Посев шпателем. Материал наносят на поверхность среды петлей или пипеткой, затем стеклянным или металлическим шпателем тщательно втирают по всей поверхности агара, вращая полуоткрытую чашку. После посева стеклянный шпатель помещают в дезинфицирующий раствор, металлический — прокаливают в пламени горелки.
Посев тампоном. Тампон с исследуемым материалом вносят в чашку и круговыми движениями втирают его содержимое в поверхность среды, одновременно вращая тампон и чашку.
Посев газоном. 1 мл исследуемого материала (жидкая бульонная культура или взвесь микробов в физиологическом растворе) наносят пипеткой на поверхность среды и тщательно распределяют жидкость по всей поверхности чашки. Избыток материала отсасывают пипеткой и вместе с ней помещают в дезинфицирующий раствор.
Посев уколом. Посев уколом в агар столбиком (прямой агар) применяется для выращивания анаэробов или выявления характерного признака микроба, так как рост по уколу типичен для ряда бактерий. Посев уколом в полужидкий агар практикуется также с целью длительного хранения культур. При посеве уколом в столбик желатина наблюдается разжижение ее бактериями, обладающими протеолитическим ферментом. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, вынимают пробку и обжигают край пробирки, и в центре столбика питательной среды сверху вниз почти до самого дна пробирки вкалывают петлю с находящимся на ней материалом.
Свидетельство и скидка на обучение каждому участнику
Лабораторная работа № 1
Цель: ознакомиться с техникой безопасности и правилами работы в микробиологической лаборатории, ее оборудованием. Ознакомиться с устройством микроскопа и правилами микроскопии.
Теоретические и справочно-информационные материалы
по теме работы
Оснащение микробиологической лаборатории
Микробиологи имеют дело с популяциями (культурами) микроорганизмов, состоящими из миллионов особей. Культуру, содержащую микроорганизмы одного вида, называют чистой . Если в культуре содержится более одного вида микроорганизмов, она носит название смешанной ( накопительной ) . В микробиологической практике используют главным образом чистые культуры микроорганизмов. Ввиду того что в воздухе и на поверхности предметов (на столах, инструментах, одежде), а также на руках, волосах и т. д. всегда имеется большое количество разнообразных микроорганизмов, следует постоянно заботиться о сохранении чистоты изучаемых культур. Требование чистоты культур в значительной степени определяет специфику устройства микробиологической лаборатории и правила работы микробиолога.
Микробиологическая лаборатория включает ряд помещений, где проводят работу с микроорганизмами или подготовку к ней. Под лабораторные комнаты отводят наиболее светлые, просторные помещения, естественная освещенность которых должна составлять не менее 110 лк (люкс).
В каждой лаборатории предусмотрены:
а) микробиологический бокс – изолированное помещение с тамбуром (предбоксником) для выполнения работ в асептических условиях. В боксе ставят стол для посевов, табурет, над рабочим местом монтируют бактерицидные лампы. Как правило, для посевов и пересевов микроорганизмов используют ламинарные боксы (ламинары) – устройство для работы с биологическими объектами в стерильных условиях. Представляет собой
шкаф, оборудованный осветителями, ультрафиолетовыми лампами и системой подачи стерильного воздуха (рисунок 1).
б) средоварная – помещение для приготовления питательных сред;
в) стерилизационные – помещения для стерилизации питательных
сред, растворов, посуды;
г) препараторская – помещение для подготовки лабораторной по-
суды, ватно-марлевых пробок и т. д.;
д) лабораторные комнаты для микробиологических исследований;
е) моечная, оборудованная для мытья посуды.
Рисунок 1 – Ламинарный бокс
Лабораторное помещение оборудуется столами лабораторного типа, шкафами и полками для хранения необходимой при работе аппаратуры, посуды, красок и реактивов. В лабораторной комнате имеется место для окраски микроскопических препаратов, где находятся растворы красок, спирт, кислоты, фильтровальная бумага и пр.
Микробиологическая лаборатория снабжена следующим оборудованием: биологическими иммерсионными микроскопами с дополнительными приспособлениями (осветитель, фазово-контрастное устройство и др.), люминесцентным микроскопом, термостатами, приборами для стерилизации (автоклав, сушильный шкаф), рН-метрами, аппаратом для получения дистиллированной воды (дистиллятор), центрифугами, техническими и аналитическими весами, аппаратурой для фильтрования (фильтр Зейтца и др.), водяными банями, холодильниками, аппаратом для изготовления ватно-марлевых пробок, набором инструментов (бактериологические петли, шпатели, иглы, пинцеты и др.), лабораторной посудой (пробирки, колбы, чашки Петри, матрацы, флаконы, ампулы, пастеровские и градуированные пипетки) и др.
Основным оборудованием микробиологической лаборатории являются термостат, сушильный шкаф, автоклав, микроскопы и весы.
Термостат – прибор для поддержания постоянства температуры. Применяется для выращивания культур микроорганизмов и представляет собой шкаф (рисунок 2), в котором в течение длительного времени поддерживается определенная температура.
Сушильный шкаф используют для стерилизации посуды, инвентаря и т. д. сухим жаром. Для этого стерилизуемый материал предварительно заворачивают в бумагу и помещают в шкаф так, чтобы он не касался стенок мела (рисунок 3) . Стерилизацию проводят при температуре 160°С в течение 2 ч или при температуре 180 ºС в течение часа. Простерилизованный материал вынимают после отключения и охлаждения шкафа.
Автоклав применяется для стерилизации паром посуды и питательных сред под давлением. Это герметичный котел с двойными металлическими стенками и крышкой. Он снабжен манометром, предохранительными клапанами и краном для спуска воды и пара. Применяется для стерилизации питательных сред под давлением от 0,5 до 1,0 МПа в течение 20–30 мин (рисунок 4) .
Весы. В лаборатории необходимы весы двух видов – технические и аналитические. Технические имеют точность до 0,01 г; аналитические – до 0,001 г. Кроме того, используют центрифуги и мешалки, рН-метры для определения кислотности полуфабрикатов и др.
Рисунок 2 – Термостат
1— корпус; 2 — термометр; 3 — дверца; 4 — потенциометр; 5 — тумблер; 6 — лампочка; 7 — вентиляционные отверстия
Рисунок 3 - Сушильный электрический шкаф
1— термометр; 2 — крышка; 3 — корпус; 4 — редуктор; 5 — блок управления; 6 —маркировка
Рисунок 4 – Устройство автоклава:
1 – стерилизационная камера; 2 – кран для выхода воздуха;
3 – манометр; 4 – предохранительный клапан;
5 – водопаровая камера; 6 – воронка для заполнения автоклава водой;
7 – отверстия для поступления пара в стерилизационную камеру;
8 – крышка; 9 – подставка для размещения стерилизуемых материалов
К посуде, используемой в микробиологической лаборатории, относятся пробирки, мерные цилиндры, колбы, чашки Петри и пр.
Чашки Петри применяют для выращивания культуры микроорганизмов на плотных питательных средах. При помощи пипеток проводят пересев жидких культур микроорганизмов.
В микробиологической лаборатории имеются следующие приспособления: бактериологические петли и препарировальные иглы, шпатели, пипетки, штативы для пипеток и пробирок, карандаш по стеклу, набор ершей для мытья посуды.
Пробирки и колбы используют для хранения питательных среди выращивания культур микроорганизмов. Бродильные трубки применяются для определения активности газообразующей способности муки и теста. В чашках Петри выращивают культуры микроорганизмов на плотных питательных средах. Бактериологические иглы и петли используют для проведения посевов микроорганизмов, шпатели – для размазывания жидких культур на поверхности плотной питательной среды. Пипетки необходимы для пересева жидких культур микроорганизмов.
Рисунок 5 – Посуда для культивирования микроорганизмов:
1 – качалочная колба; 2 – качалочная колба с отбойниками;
3 – коническая колба; 4 – чашка Петри; 5 – пробирка; 6 – матрас
Рисунок 6 – Бактериологическая игла ( а ); шпатель ( б ); петли, сделанные правильно ( в ) и неправильно ( г )
Правила работы в микробиологической лаборатории
В лабораторию запрещается входить в верхней одежде и класть на столы сумки, пакеты и другие личные вещи.
В лаборатории разрешается работать только в халатах.
На каждом занятии назначаются дежурные, которые следят за порядком и за выполнением каждым студентом правил работы и поведения в лаборатории.
За каждой группой студентов (3 человека) закрепляется постоянное рабочее место, которое должно содержаться в порядке не протяжении всего занятия.
Бактериологические петли и препаровальные иглы в ходе работы обеззараживаются прокаливанием над пламенем горелки, предметные стекла и пипетки после работы помещаются в кастрюльку с дезинфицирующим раствором.
В лаборатории категорически запрещается применять пищу.
Не допускаются лишние хождения, резкие движения, посторонние разговоры (особенно во время посева микроорганизмов).
Категорически запрещается выносить микробные культуры за пределы лаборатории.
Перед работой проверить исправность оборудования.
Соблюдать правила работы с химическими реактивами.
Приступать к работе только с разрешения преподавателя.
При работе с исследуемой культурой бактерий соблюдать осторожность и придерживаться приемов, исключающих возможность заражения работника.
При работе с жидкой микробной культурой использовать резиновые груши, соединенные пипеткой.
Если исследуемый материал попал на стол, удалить его тампоном, смоченным дезраствором. Если разбили пробирку – сообщите преподавателю.
По окончании работы исследуемый материал и инструменты обеззаразить, рабочее место необходимо привести в порядок.
Устройство микроскопа
Для изучения клеток микроорганизмов, невидимых невооруженным глазом, применяют специальные оптические приборы – микроскопы (греч. micros – малый, scopeo – смотрю), обеспечивающие увеличение исследуемых объектов в сотни (световые микроскопы) и сотни тысяч и более (электронные микроскопы) раз. С помощью светового микроскопа в микробиологии изучают морфологию и строение клеток микроорганизмов, их рост и развитие, проводят первичную идентификацию исследуемых организмов, ведут наблюдения за характером развития микробных ценозов (сообществ) в почве и других субстратах. С помощью электронного микроскопа в микробиологии исследуют субмикроскопическое строение клеток микроорганизмов, выявляют неизвестные ранее формы мельчайших микроорганизмов, ведут их учет.
В микробиологической практике применяют световые микроскопы отечественных марок: МБР-1, МБИ-1, МБИ-2, МБИ-3, МБИ-6, Биолам Р-1 и др. Они предназначены для изучения формы, структуры, размеров и других признаков различных микроорганизмов, величина которых не менее 0,2–0,3 мкм.

Рис. 1 . Устройство световых микроскопов:
А - МИКМЕД-1; Б - БИОЛАМ.
1 - окуляр, 2 - тубус, 3 - тубусодержатель, 4 - винт грубой наводки, 5 - микрометренный винт, 6 - подставка, 7 - зеркало, 8 - конденсор, ирисовая диафрагма и светофильтр, 9 - предметный столик, 10 - револьверное устройство, 11 - объектив, 12 - корпус коллекторной линзы, 13 - патрон с лампой, 14 - источник электропитания.
Световой микроскоп (рисунок 8) состоит из двух частей – оптической и механической.
Оптическая часть включает объективы, окуляры, осветительное устройство – зеркало, конденсор, диафрагму.
Объектив - одна из важнейших частей микроскопа, поскольку он определяет полезное увеличение объекта. Объектив состоит из металлического цилиндра с вмонтированными в него линзами, число которых может быть различным. Увеличение объектива обозначено на нем цифрами. В учебных целях используют обычно объективы х8 и х40. Качество объектива определяет его разрешающая способность.
Окуляр устроен намного проще объектива. Он состоит из 2-3 линз, вмонтированных в металлический цилиндр. Между линзами расположена постоянная диафрагма, определяющая границы поля зрения. Нижняя линза фокусирует изображение объекта, построенное объективом в плоскости диафрагмы, а верхняя служит непосредственно для наблюдения. Увеличение окуляров обозначено на них цифрами: х7, х10, х15. Окуляры не выявляют новых деталей строения, и в этом отношении их увеличение бесполезно . Таким образом, окуляр, подобно лупе, дает прямое, мнимое, увеличенное изображение наблюдаемого объекта, построенное объективом.
Для определения общего увеличения микроскопа следует умножить увеличение объектива на увеличение окуляра.
Осветительное устройство состоит из зеркала или электроосветителя, конденсора с ирисовой диафрагмой и светофильтром, расположенных под предметным столиком. Они предназначены для освещения объекта пучком света.
Зеркало служит для направления света через конденсор и отверстие предметного столика на объект. Оно имеет две поверхности: плоскую и вогнутую. В лабораториях с рассеянным светом используют вогнутое зеркало.
Электроосветитель устанавливается под конденсором в гнездо подставки.
Конденсор состоит из 2-3 линз, вставленных в металлический цилиндр. При подъеме или опускании его с помощью специального винта соответственно конденсируется или рассеивается свет, падающий от зеркала на объект.
Ирисовая диафрагма расположена между зеркалом и конденсором. Она служит для изменения диаметра светового потока, направляемого зеркалом через конденсор на объект, в соответствии с диаметром фронтальной линзы объектива и состоит из тонких металлических пластинок. С помощью рычажка их можно то соединить, полностью закрывая нижнюю линзу конденсора, то развести, увеличивая поток света.
Кольцо с матовым стеклом или светофильтром уменьшает освещенность объекта. Оно расположено под диафрагмой и передвигается в горизонтальной плоскости.
Механическая система микроскопа состоит из подставки, коробки с микрометренным механизмом и микрометренным винтом, тубуса, тубусодержателя, винта грубой наводки, кронштейна конденсора, винта перемещения конденсора, револьвера, предметного столика.
Подставка - это основание микроскопа.
Коробка с микрометренным механизмом , построенном на принципе взаимодействующих шестерен, прикреплена к подставке неподвижно. Микрометренный винт служит для незначительного перемещения тубусодержателя, а, следовательно, и объектива на расстояния, измеряемые микрометрами. Полный оборот микрометренного винта передвигает тубусодержатель на 100 мкм, а поворот на одно деление опускает или поднимает тубусодержатель на 2 мкм. Во избежание порчи микрометренного механизма разрешается крутить микрометренный винт в одну сторону не более чем на половину оборота .
Тубус или трубка - цилиндр, в который сверху вставляют окуляры. Тубус подвижно соединен с головкой тубусодержателя, его фиксируют стопорным винтом в определенном положении. Ослабив стопорный винт, тубус можно снять.
Револьвер предназначен для быстрой смены объективов, которые ввинчиваются в его гнезда. Центрированное положение объектива обеспечивает защелка, расположенная внутри револьвера.
Тубусодержатель несет тубус и револьвер.
Винт грубой наводки используют для значительного перемещения тубусодержателя, а, следовательно, и объектива с целью фокусировки объекта при малом увеличении.
Предметный столик предназначен для расположения на нем препарата. В середине столика имеется круглое отверстие, в которое входит фронтальная линза конденсора. На столике имеются две пружинистые клеммы - зажимы, закрепляющие препарат.
Кронштейн конденсора подвижно присоединен к коробке микрометренного механизма. Его можно поднять или опустить при помощи винта, вращающего зубчатое колесо, входящее в пазы рейки с гребенчатой нарезкой.
Правила работы с микроскопом
При работе с микроскопом необходимо соблюдать операции в следующем порядке:
1. Работать с микроскопом следует сидя.
2. Микроскоп осмотреть, вытереть от пыли мягкой салфеткой объективы, окуляр, зеркало или электроосветитель.
3. Микроскоп установить перед собой, немного слева на 2-3 см от края стола. Во время работы его не сдвигать.
4. Открыть полностью диафрагму, поднять конденсор в крайнее верхнее положение;
5. Работу с микроскопом всегда начинать с малого увеличения.
6. Опустить объектив 8 - в рабочее положение, т.е. на расстояние 1 см от предметного стекла.
8. Положить микропрепарат на предметный столик так, чтобы изучаемый объект находился под объективом. Глядя сбоку, опускать объектив при помощи макровинта до тех пор, пока расстояние между нижней линзой объектива и микропрепаратом не станет 4-5 мм.
9. Смотреть одним глазом в окуляр и вращать винт грубой наводки на себя, плавно поднимая объектив до положения, при котором хорошо будет видно изображение объекта . Нельзя смотреть в окуляр и опускать объектив. Фронтальная линза может раздавить покровное стекло, и на ней появятся царапины;
10. Передвигая препарат рукой, найти нужное место, расположить его в центре поля зрения микроскопа.
11. Если изображение не появилось, то надо повторить все операции пунктов 6, 7, 8, 9.
12. Для изучения объекта при большом увеличении, сначала нужно поставить выбранный участок в центр поля зрения микроскопа при малом увеличении. Затем поменять объектив на 40х, поворачивая револьвер, так чтобы он занял рабочее положение. При помощи микрометренного винта добиться хорошего изображения объекта. На коробке микрометренного механизма имеются две риски, а на микрометренном винте - точка, которая должна все время находиться между рисками. Если она выходит за их пределы, ее необходимо возвратить в нормальное положение. При несоблюдении этого правила, микрометренный винт может перестать действовать.
13. По окончании работы с большим увеличением, установить малое увеличение, поднять объектив, снять с рабочего столика препарат, протереть чистой салфеткой все части микроскопа, накрыть его полиэтиленовым пакетом и поставить в шкаф.
14. В конце работы привести в порядок рабочее место, поставить микроскопы в шкаф (помните, что нести их нужно двумя руками: правой держать за стойку, а левой поддерживать за основание).
Порядок выполнения работы:
Ознакомиться с устройством микробиологической лаборатории и правилами работы в ней.
Рассмотреть устройство аппаратов, посуду, приспособления и ознакомиться с их назначением.
Изучить устройство микроскопа, используя биологические микроскопы БИОЛАМ
Перечислить в лабораторной тетради основные части светового микроскопа и правила работы с ним.
Вывод: Ознакомились с назначением, устройством, оборудованием и режимом работы микробиологической лаборатории; изучили строение микроскопа и правила работы с ним.
Читайте также:

