По готовым посевам изучить характер роста пигментных бактерий зарисовать и описать
Обновлено: 04.10.2024
рассмотреть п од микроскопом бактерии нашей р отовой полости.
Под культивированием понимают выр ащивание определенного вида
микроорганизма, или смеси разных микроорганиз мов на искусственных или
естественных субс тратах. Культивирование производят на простых и
сложных, жидк их, полужидких или твердых п итательных среда х.
К простым средам от носят мясной бульон, агар, , молоко, ломтики
1. Создадим необходи мые у словия для развития картофельной и сенной
Способ выращ ивания культуры к артофельной пал очки
Картофельная палочка р азвиваетс я на кар тофеле. Для ее получения следует
взять неочищенный картофель, нарезать небольшими кубиками, поместить в
небольшую пос уду, залить доверху водой и нагреть до 80°С. Для заражения
приготовленн ой питатель ной среды спорами картофельной палочки, нужно
опустить в нее небольшой комочек почвы, после этого поставить в теплое
место на 3 дня. За это время картофельная пал очка размножается в большом
Сено и з разнотравья мелко нарезают ножницам и и помещают в конические
колбы, заливают водо й, добавляют щепотку мела и кипят ят в течение
15 мин. К олбу закрывают ватной пробкой и помещают в термостат при
температуре 25°С на 2–3 суток. На поверхности сенного отвара образуется
сероватая пленка, со стоящая из особей грамотрицатель ной сенной палочки.
В сене всегда присутствуют споры Bac. subtilis, так как они не гибнут при
кипячении и дают р ост вегетативным формам бактерии. Другие
микроорганизм ы при этом выра стают редко и в не б ольших количества х
Бактерии занимают различные среды обитания, и наш организм являет ся
одной из таких ср ед. Наша задача рассмот реть форму бактериальных клеток
ротовой полости под микроскопом, док азать что организм является одной из
1. Микроско п должен располагаться на расстояни и 5 - 8 см от края ст ола.
2. Свет направл яется зеркалом в отве рстие предметног о столика.
3. П оместив препарат на предметн ый столик, п ользуясь винтом, опустите
тубус так, что бы нижний край о бъектива находилс я на 1 - 2 мм от препа рата.
Колонию, выросшую на агаре в чашке Петри, изучают сначала невооруженным глазом в проходящем свете. Отмечают общий характер роста и число колоний (мало, много, несосчитываемое количество и т.д.), подчеркивая при этом специальными чернилами или карандашом (со стороны дна чашки) колонии, которые отличаются между собой.
Отмечают величину колонии (крупная, мелкая, точечная), измеряя ее окулярным микрометром и переводя в миллиметры: точечные колонии – меньше 1 мм в диаметре, видимые простым глазом; мелкие – в 1-2 мм, средние – в 2-4 мм, крупные – в 4-6 мм и более в поперечнике.
Колония может иметь правильную круглую форму; неправильную – амебовидную, розеткообразную, ризоидную или корневидную. Колонии могут быть заметно приподнятыми над средой – выпуклыми или плоскими, плосковыпуклыми; куполообразными с приподнятой серединой или вдавлением в центре. Отмечают характер поверхности: матовая или блестящая, гладкая или шероховатая.
Структуру колоний изучают под лупой или микроскопом со слабым увеличением, сухой системой при суженной диафрагме или несколько спущенном конденсоре, при этом чашку помещают на столик дном вверх и, передвигая ее, отмечают колонии различной структуры.
По цвету колонии могут быть очень разнообразными. Чаще они встречаются совершенно бесцветные, иногда белые, молочно-мутные, голубоватые, желтые, золотистые, золотисто-желтые, оранжевые, лимонно-желтые, сиреневые, красные и черные. Иногда в толще колонии развиваются небольшие образования сферической или неправильной формы (дочерние колонии). Они отличаются от основной колонии особой способностью преломлять свет. Механизм образования дочерних колоний не выяснен, однако отмечено, что по мере их роста материнская колония лизируется.
Консистенцию колонии определяют при прикосновении к ней петлей.
Структура и форма колоний, так же как и другие признаки, могут изменяться. Хорошо изучены S- и R-формы. S-формы круглые, гладкие, выпуклые, с ровными краями, имеют блестящую поверхность. Шероховатые R-колонии неправильной формы, с зазубренными краями и шероховатой поверхностью.
Выделение чистой культуры бактерий аэробов
Чистой культурой бактерий называют видимый рост одного вида микробов, полученных из одной клетки.
Выделение чистой культуры является основой бактериологической работы, так как в практической деятельности врачу-бактериологу приходится иметь дело с материалом, содержащим смесь микробов (гной, испражнения и т.п.). Идентификация вида возможна только тогда, когда бактерии получены в чистом, кодированном виде.
Выделение чистой культуры лежит в основе бактериологического исследования – важнейшего метода лабораторной диагностики инфекционных заболеваний.
Цель – выделение культуры и ее идентификация, что позволяет правильно поставить диагноз инфекционного заболевания.
Основная задача при выделении чистой культуры – получение отдельных колоний, т.е. скопления микробов одного вида как результата размножения одной клетки. Простейшим способом разъединения бактерий является последовательное растирание исследуемого материала стеклянным шпателем или бактериальной пипеткой по поверхности мясопептонного агара в чашках Петри.
Самостоятельная работа студента
На практическом занятии
| Последовательность действий (этапы) | Способы действия (ориентиры) |
| I. Изучение культуральных свойств бактерий | 1. Познакомиться с характером роста бактерий на жидких и плотных питательных средах (демонстрация), описать в дневнике. 2. Изучить характер роста пигментных бактерий по готовым посевам и описать в дневнике. |
| II. Выделение чистой культуры аэробов (I этап) | 1. Ознакомиться с методом получения изолированных колоний (демонстрация преподавателя). 2. Приготовить мазок из смеси бактерий, окрасить по Граму, микроскопировать, зарисовать и сделать вывод, к какому семейству принадлежат бактерии (мазок обязательно показать преподавателю). 3. Произвести посев смеси бактерий на чашку с питательной средой, обосновать цель высева. |
Молекулярный кислород явился фактором, разделившим живые существа на две неравные части: анаэробы (их немного) и аэробы (огромное количество видов).
Тип биологического окисления, как и отношение к окраске по Граму, позволяет дифференцировать различные микроорганизмы. По этому признаку можно выделить, по крайней мере, три группы бактерий.
Первая – облигатные аэробы. Они способны получать энергию только путем дыхания и поэтому нуждаются в кислороде как акцепторе протонов и электронов в окислительно-восстановительных процессах. Таким образом, дыхание – биологический процесс окисления различных органических веществ, при котором происходит перенос протонов и электронов от субстрата (донора) к кислороду (акцептору) и образование молекул АТФ. Органеллами дыхания у бактерий являются производные цитоплазматической мембраны – мезосомы, содержащие специальные дыхательные ферменты типа цитохромоксидаз.
Вторая группа – облигатные анаэробы – бактерии, способные расти только в среде, лишенной кислорода (кислород для них токсичен). Для них как тип окислительно-восстановительных процессов характерна ферментация,при которой происходит перенос протонов и электронов от субстрата-донора к субстрату-акцептору.
Третья группа – факультативные анаэробы – бактерии, способные расти как при наличии, так и в отсутствие кислорода. Среди них следует различать бактерии аэротолерантные, которые могут расти в присутствии атмосферного кислорода, но не способны его использовать, так как получают энергию исключительно с помощью брожения (например, молочнокислые бактерии), и факультативно-анаэробные бактерии (например, энтеробактерии), которые в отсутствие кислорода способны перестраиваться на брожение.

Знание физиологии и методов идентификации чистых культур бактерий является основой микробиологической диагностики инфекционных болезней. Питательные среды необходимы для выделения и идентификации микробов.
Цель: ознакомление с способами посева бактерий на плотные питательные среды
Слушатель должен знать
Способы посева бактерий (сплошной, истончающий штрих)
Слушатель должен уметь
1. Овладеть техникой посевов бактериологической петлей и шпателем Дригальского.
Зарисовать схемы посева микроорганизмов (сплошной посев методом Дригальского, посев истончающим штрихом по Голду).
Теоретическая часть
Рабочее место, где непосредственно проводится работа с культурами микроорганизмов, требует особенно тщательной обработки. Рабочий стол следует дезинфицировать не только до начала работы, но и после ее окончания. Для протирания поверхности стола можно использовать растворы лизола и хлорамина, а также 70%-ные (по объему) растворы изопропилового или этилового спиртов. В лаборатории не разрешается курить, хранить и употреблять еду, напитки, жевательную резинку. Работать следует в халатах.
Правила работы с культурами микроорганизмов. В лаборатории микроорганизмы выращивают в питательных средах, которые разливают в пробирки, колбы, матрацы и чашки Петри. Внесение микроорганизмов в стерильную среду называется посевом, или инокуляцией. Перед посевом следует тщательно надписать на пробирке (колбе или чашке Петри) название микроорганизма и дату посева. Надпись делают маркером на стекле или на наклеенной этикетке. Клетки микроорганизмов для посева или приготовления препаратов берут бактериологической петлей, если микроорганизмы выращены на плотной среде. В том случае, когда пересевают культуры микроорганизмов, выросшие в жидкой питательной среде, пользуются стерильной пипеткой. Использованную пипетку следует немедленно перенести в дезинфицирующий раствор, например, 3 - 5%-ный водный раствор фенола или 2%-ный раствор хлорамина, не касаясь ею окружающих предметов.
Для получения смывов пользуются стерильными ватными тампонами, которые перед употреблением смачивают в стерильном физиологическом растворе. При исследовании мелких предметов (телефон) смыв делают со всей поверхности (тщательно протереть поверхность телефона). Затем тампон помещают в пробирку со стерильным физраствором, выдерживают там 5 минут, при этом пробирку постоянно нужно потряхивать.
Для получения изолированных колоний предложен разные методы разобщения клеток. Наибольшее распространение для выделения чистой культуры аэробных и факультативно-анаэробных бактерий получили метод посева штрихом и метод Дригальского.
Метод Дригальского – последовательный перенос исследуемого материала с помощью шпателя из одной чашки в последующие 2-3 чашки с агаром (рисунок 1).
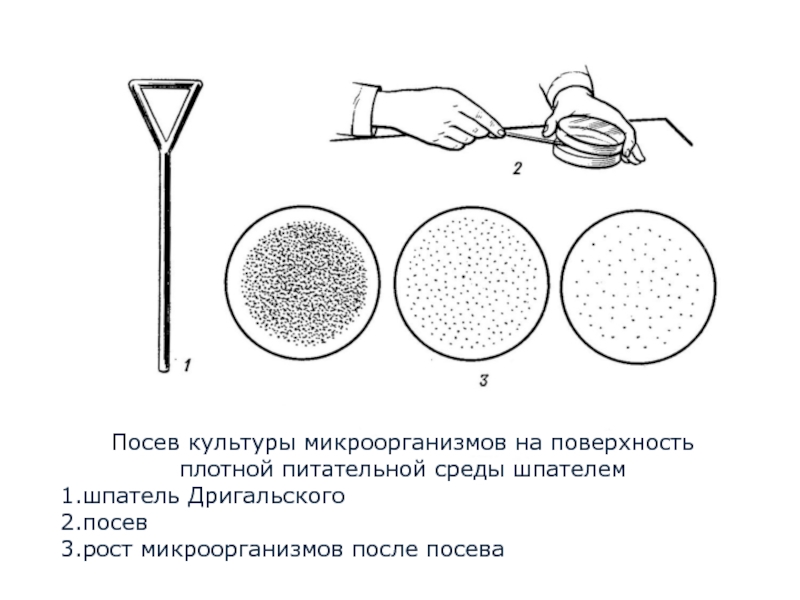
Рисунок 1 – Получение изолированных колоний по методу Дригальского
Посев штрихами с помощью бактериологической петли (рисунок 2).
Рисунок 2 – Схема посева штрихами (а, цифрами указана последовательность нанесения штрихов) и результат посева (б).
Техника посева зависит от характера исследуемого материала и консистенции питательной среды. Жидкий материал для посева берут бактериологической петлей или стерильной пипеткой. Все манипуляции проводят вблизи пламени горелки с соблюдением правил асептики. Бактериологическую петлю перед взятием материала и по окончании посева прокаливают в пламени горелки. Пипетки после посева погружают в дезраствор.
При посеве штрихом стерильной петлей берут каплю исследуемого материала и наносят его параллельными штрихами на поверхность агара в чашке Петри. В начале посева на петле имеется большое количество микробов, поэтому рост будет сплошным. С каждым штрихом на петле остается все меньше микробов, поэтому отмечается рост изолированных колоний. Посев штрихом имеет множество вариантов (рисунок 3).
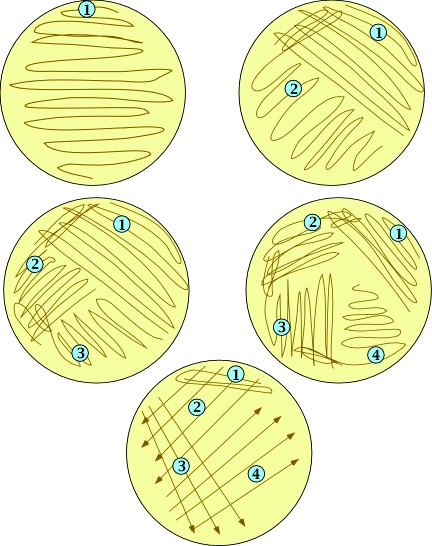
Рисунок 3 – Варианты посева штрихами. Цифрами обозначена последовательность нанесения штрихов.
Шпателем по методу Дригальского исследуемый материал распределяется по поверхности среды в нескольких чашках Петри. При этом вначале материал распределяют по поверхности агара в первой чашке Петри, затем этим же шпателем материал переносят на последующие чашки. На первой чашке отмечается сплошной рост культуры, а на последующих выявляются изолированные колонии (рисунок 1).
1. Изучение культуральных свойств бактерий. Ознакомьтесь с характером роста бактерий на жидких и плотных питательных средах, опишите их в тетради. Изучите характер роста пигментных бактерий по готовым посевам и опишите в тетради.
2. Выделение чистой культуры аэробов (второй день). Изучите и опишите в тетради выросшие на чашке колонии. Отберите изолированные колонии, принадлежащие разным видам бактерий, приготовьте из них мазки, микроскопируйте и зарисуйте. Произведите пересев одной из отобранных колоний на скошенный агар.
3. Выделение чистой культуры анаэробов (третий день). Изучите и опишите колонии в трубке Вейон–Виньяля. Отберите изолированную колонию, извлеките её путём распила трубки, приготовьте мазок, окрасьте по Граму, микроскопируйте, зарисуйте, произведите пересев из этой же колонии на среду Китта–Тароцци.
4. Методы стерилизации. Ознакомьтесь с аппаратурой для стерилизации (демонстрация).
5. Устройство термостата, бокса для проведения посевов (демонстрация).
ЗАНЯТИЕ 8
ВЫДЕЛЕНИЕ ЧИСТЫХ КУЛЬТУР БАКТЕРИЙ (ОКОНЧАНИЕ).
ИЗУЧЕНИЕ ФЕРМЕНТАТИВНЫХ СВОЙСТВ БАКТЕРИЙ.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
ВОДЫ И ВОЗДУХА. НОРМАЛЬНАЯ МИКРОФЛОРА
ОРГАНИЗМА ЧЕЛОВЕКА
Способность микробов расщеплять углеводы и белки широко используется в микробиологической практике для идентификации (определения вида) микроба. Дело в том, что разные виды бактерий, в том числе и имеющие одинаковую морфологию, могут отличаться по ферментативной активности. Поэтому идентифицировать такие виды только по их морфологии невозможно. После выделения чистой культуры морфологически сходных микробов производят их посев на среды с углеводами и белковые среды.
В окружающей нас природе наряду с микробами–сапрофитами могут находиться и патогенные микроорганизмы. Поэтому систематический микробиологический контроль почвы, воды и воздуха имеет большое практическое значение как для предупреждения инфекционных заболеваний, так и в интересах экологии - сохранения постоянства микрофлоры в естественной среде обитания.
Цель самоподготовки
После самостоятельного изучения темы студент должен знать:
- ферменты микробов; методы определения ферментативной активности микробов, применяемые для этого питательные среды;
- микрофлору почвы, воды и воздуха; методы санитарно–бактериологического исследования объектов внешней среды.
Исходный уровень знаний
Для усвоения материала темы необходимо знать:
- выделение чистой культуры аэробов и анаэробов;
Цель занятия
1. Изучить принципы идентификации чистых культур по морфологическим, культуральным, биохимическим и другим свойствам.
2. Показать разнообразие ферментов у микроорганизмов и возможности их использования для идентификации.
3. Изучить методы и показатели, необходимые для микробиологической оценки объектов окружающей среды.
План изучения темы
1. Ферменты микробов – по лекции и по учебнику. Обратите внимание на особенности ферментных систем прокариотов. Определение ферментативной активности микробов – по практическому руководству и по дополнительному материалу к данному занятию.
2. Санитарно-бактериологическое исследование почвы, воздуха и воды - по учебнику, по лекции, по практическому руководству. Микрофлору внешней среды следует усвоить по определенному плану: постоянная микрофлора данной среды, санитарно-показательные микроорганизмы, показатели микробного загрязнения; для каких инфекционных заболеваний данная среда может быть фактором передачи. Методы санитарно-бактериологических исследований и предельно-допустимые показатели – усвоить конкретно.
3. Нормальная микрофлора организма человека.
После изучения темы студент должен уметь
Охарактеризовать колонии микроорганизмов.
Провести посев изолированных колоний на скошенный питательный агар.
Проводить оценку санитарно-бактериологического состояния воздуха, воды, почвы по микробиологическим показателям.
Освоить методику взятия материала для микробиологического исследования со слизистой рото-носоглотки и зева стерильным ватным тампоном.
Дополнительный материал к занятию
Среды, содержащие белковые вещества (пептон, желатину, молоко, свёрнутую сыворотку крови, куриный белок и т.д.) для выявления протеолитических ферментов.
Среды с сахарами или многоатомными спиртами (углеводами), для определения сахаролитической активности микроорганизмов.
Среды с химическими веществами, изменяющимися под влиянием окислительно-восстановительных ферментов, продуцируемых микробами.
Среды, содержащие индифферентные химические вещества, являющиеся источником питания одних видов и не ассимилируемые другими видами микробов.
Применяются также комбинированные среды, содержащие не один углевод, а два или три, например, среда Олькеницкого – трёхсахарный агар с мочевиной. Одна пробирка среды Олькеницкого заменяет скошенный агар и среды Гисса с лактозой, сахарозой и глюкозой. Среда готовится на основе не очень плотного МПА. Содержит лактозу (1%), сахарозу (1%), глюкозу (0,1%), мочевину, соль Мора (сульфат железа), гипосульфит натрия и индикатор.
Среду после стерилизации в расправленном виде оставляют застывать в таком положении, чтобы получился столбик и скошенная часть. Посев производится штрихом по скошенной части и уколом в столбик. При сбраживании углеводов, которые содержатся в большем количестве (лактозы, сахарозы или обоих сахаров) изменяется цвет всей среды; при сбраживании только глюкозы изменяется цвет столбика, а скошенная часть остается без изменений. Образование газа определяется по наличию пузырьков в столбике агара. Культуры, расщепляющие мочевину с образованием аммиака, дают щелочную реакцию. При этом происходит нейтрализация кислоты, образующейся при сбраживании углеводов, и цвет всей среды не изменяется. Расщепление мочевины свойственно протеям и некоторым кишечным палочкам. Патогенные энтеробактерии не разлагают мочевину. Добавление соли Мора и гипосульфита позволяет также изучить способность бактерий расщеплять белки с образованием сероводорода, что определяется по почернению в столбике агара в результате превращения сульфата железа в сульфид чёрного цвета.
При росте микроорганизмов, образующих амилазу, на средах с растворимым крахмалом происходит его расщепление. Об этом узнают, прибавив к культуре несколько капель раствора Люголя, – цвет среды не изменяется. Нерасщеплённый крахмал даёт с этим раствором синее окрашивание.
Протеолитические ферменты у бактерий изучают на средах с желатином, молоком, сывороткой, пептоном и на некоторых полиуглеводных средах (например, на среде Клиглера). Показателями глубокого расщепления белка является образование индола, аммиака, сероводорода.
Сероводород обнаруживают с помощью полоски фильтровальной бумаги, пропитанной раствором ацетата свинца, которую закрепляют между стенкой засеянной пробирки и пробкой (при взаимодействии сероводорода и ацетата свинца бумага чернеет в результате образования сульфида свинца), или на средах, в состав которых входят соли железа или свинца, которые при взаимодействии с сероводородом дают чёрное окрашивание самой среды или выросших колоний (среды Вильсона-Блера, Клиглера и т.д.)
Для обнаружения индола по способу Мореля узкие полоски фильтровальной бумаги, смоченные горячим насыщенным раствором щавелевой кислоты и высушенные, помещают между стенкой пробирки с питательным агаром и пробкой. При выделении индола на 2-3-й день нижняя часть полоски бумаги приобретает розовый цвет. Другой, более чувствительный, метод обнаружения индола позволяет концентрировать индол на поверхности среды ксилолом или эфиром, а добавление раствора Ковача (парадиметиламинобензальдегида) приводит к образованию красного кольца. Индол образуется при наличии у бактерий фермента триптофаназы.
Наличие аммиака определяют по посинению розовой лакмусовой бумажки, помещённой между стенкой и пробкой засеянной пробирки.
Желатиназа. При посеве уколом в желатин некоторые микробы (холерный вибрион, стафилококк, сибиреязвенная палочка и др.) при комнатной температуре (20-22°С) разжижают его, причём различные виды микробов дают характерную для них форму разжижения (послойно, в виде гвоздя, ёлочки и т.д.).
Другие протеолитические ферменты:
– при посеве на свёрнутую сыворотку вокруг колоний появляются углубления (разжижение);
– в молоке происходит расщепление сгустка казеина с образованием пептона, в результате чего оно приобретает желтоватый цвет (пептонизация молока).
Наличие уреазы у бактерий определяют на среде с мочевиной и индикатором фенол-рот (начальный цвет среды – жёлтый). При расщеплении мочевины на аммиак и углекислый газ накапливается аммоний, что сдвигает рН в щелочную сторону и изменяет цвет индикатора на красный.
Образования ацетоина (ацетил-метил-карбинола) при ферментации глюкозы проводится с помощью реакции Фогес-Проскауэра. Добавление к культуре 40% КОН и 5% альфа-нафтола даёт красное окрашивание, т.е. в щелочных условиях ацетоин образует с альфа-нафтолом соединение красного цвета – ацетилметилкарбинол.
Утилизацию цитрата с целью выявления способности бактерий использовать его как источник углерода проверяют на среде Симмонса. Среда содержит набор солей, агар, неорганический источник азота, цитрат натрия, индикатор бромтимоловый синий. При наличии фермента цитрат-пермеазы среда подщелачивается и окрашивается в синий цвет. При отсутствии роста бактерий среда остается зеленой.
Каталаза – это фермент, катализирующий реакцию разложения перекиси водорода с образованием воды и кислорода. Каталазу содержат аэробы и факультативные анаэробы, но она отсутствует у облигатных анаэробов. Обнаружить каталазу можно по пузырькам кислорода, которые начинают выделяться сразу же после смешивания микробных клеток с 1% раствором перекиси водорода. На предметное стекло помещают каплю перекиси водорода и суспендируют в ней небольшое количество культуры микроорганизмов, выращенной на плотной среде.
Обнаружение цитохромоксидазы у аэробных и факультативно-анаэробных микроорганизмов проводится путём нанесения и растирания петли культуры на индикаторную бумажку, пропитанную спиртовым раствором альфа-нафтола и 1% водным раствором ментола. При положительном результате бумажка синеет.
Выявление нитратредуктазы характерно в основном для факультативных анаэробов. Фермент восстанавливает нитраты в нитриты. Нитрат является конечным акцептором электронов. В кислой среде нитраты окисляют йодид калия. Выделившийся йод, реагируя с крахмалом, даёт синее окрашивание среды.
Тест окисления/ферментации глюкозы (в аэробных/анаэробных условиях) устанавливается на среде Хью-Лейфсона. В среде содержится агар, соли, пептон, глюкоза и индикатор бромтимоловый синий. Посев осуществляют уколом в столбик питательной среды в две пробирки. Для создания анаэробных условий после посева среда в одной из пробирок заливается слоем стерильного вазелинового масла. Посев выращивают 3-4 суток. Образование кислоты из глюкозы изменяет зеленый цвет среды в жёлтый. При окислении глюкозы изменение цвета происходит в верхней части пробирки без вазелинового масла. При ферментации меняется цвет среды под слоем вазелинового масла (в анаэробных условиях). Тест используется для дифференциации аэробных бактерий от анаэробов и факультативных анаэробов. Аэробы (например, Pseudomonas aeruginosa) расщепляют глюкозу в аэробных условиях, то есть только окисляют глюкозу, но не ферментируют её; анаэробы (например, Clostridium perfringens) утилизируют глюкозу только в анаэробных (т.е. ферментируют). Факультативные анаэробы (например, Escherichia coli, Staphylococcus aureus) утилизируют глюкозу в аэробных и анаэробных условиях.
Гемолитические свойства микроорганизмов (способность микроорганизмов разрушать эритроциты) изучают при посеве их на среды с кровью. Жидкие среды при разрушении эритроцитов становятся прозрачными, а на плотных средах вокруг колоний появляется прозрачная зона (гемолиз). Кровяной агар Цейсслера (для культивирования анаэробов) состоит из мясо-пептонного агара с 1% глюкозы на 20% свежей дефибринированной крови. Возбудитель газовой гангрены образует зону гемолиза вокруг колоний. Гемолитические штаммы стафилококков и стрептококков дифференцируют на кровяном агаре по наличию альфа- (неполного) или бета- (полного) гемолиза вокруг колонии.
В последние годы для изучения биохимической активности выпускаются наборы систем индикаторных бумажных, микротест-системы и другие подобные системы одноразового использования, которые позволяют изучить ферментный профиль микробов.
Системы индикаторные бумажные (СИБ) представляют собой наборы бумажных дисков для выявления самых разнообразных ферментов бактерий. Диски пропитаны субстратом (углеводами, аминокислотами, цитратом, ацетатом, малонатом и другими веществами), а также содержат индикатор. Полную петлю исследуемой культуры или каплю густой микробной взвеси вносят в стерильный физиологический раствор (в некоторых случаях в забуференный: рН 5,4-5,6) либо в 1% пептонную воду и помещают в эту пробирку соответствующий диск. В контрольные пробирки культуру бактерий не вносят. Для определения сероводорода диск помещают в пробирку на поверхность МПА, засеянного уколом, что позволяет одновременно определить подвижность. После инкубации в термостате оценивают результаты тестов по изменению цвета среды и диска. Утилизация вещества приводит к изменению цвета индикатора. Во всех пробирках учитывают предварительный результат в тот же день и окончательный – через восемнадцать–двадцать четыре часа. Имеются наборы, которые содержат от десяти до тридцати тест-бумажек.
Диагностические микротест-системы (МТС), типа API-20-Е (для энтеробактерий), API-32-Gr+, ID32 GN, Enterotube и другие. Они представляют собой полистироловые пластины с лунками, или планшеты, в которых содержатся стерильные дифференциально-диагностические среды или только субстраты и индикаторы. Стерилизацию МТС проводят ультрафиолетовым облучением. Существует два основных типа таких систем. Это индивидуальные системы, рассчитанные на идентификацию одной культуры. К ним относятся тест-системы ПБДЭ, ПБДС (Россия), системы API (Франция) и многие другие. Второй тип систем основан на использовании многорядных планшетов, позволяющих одновременно проводить идентификацию нескольких культур. К системам этого типа относятся тест-системы фирмы Lachema (Чехия), ММТ Е (Россия), Enterotube II (США) и др. В каждую ячейку засевают взвесь культуры бактерий определённой густоты. В контрольные ячейки наливают физиологический раствор. Инкубация тест-систем проводится в обычных термостатах или в специальных термостатируемых устройствах, входящих в комплект автоматизированных систем, где учёт результатов и их интерпретация осуществляется автоматически с помощью компьютера (Vitek, BioMerieux, Франция). Результат учитывают после 3–4-часовой инкубации в термостате визуально или при использовании автоматизированной компьютерной системы по изменению цвета индикатора. Микротест-системы особенно удобны при массовых бактериологических исследованиях в практических лабораториях.
Название работы: Характер роста микробов на жидких и плотных питательных средах. Колонии микроорганизмов. Пигментообразование у бактерий. Бактериологический метод
Категория: Конспект урока
Предметная область: Медицина и ветеринария
Описание: ЗАНЯТИЕ 4 ТЕМА ЗАНЯТИЯ: Характер роста микробов на жидких и плотных питательных средах. Колонии микроорганизмов. Пигментообразование у бактерий. Бактериологический метод второй этап. Выделение чистой культуры бактерий. УЧЕБНАЯ ЦЕЛЬ ЗАНЯТИЯ: Изучить характер рос
Дата добавления: 2013-06-13
Размер файла: 28 KB
Работу скачали: 144 чел.
ТЕМА ЗАНЯТИЯ : Характер роста микробов на жидких и плотных питательных средах. Колонии микроорганизмов. Пигментообразование у бактерий. Бактериологический метод (второй этап). Выделение чистой культуры бактерий.
УЧЕБНАЯ ЦЕЛЬ ЗАНЯТИЯ : Изучить характер роста микробов на жидких и плотных питательных средах. Изучить характеристику колоний микроорганизмов. Ознакомиться с пигментообразованием у бактерий. Освоить второй этап бактериологического исследования - выделение чистой культуры бактерий.
1. Изучить характер роста микробов на жидких и плотных питательных средах.
2. Освоить характеристику колоний микроорганизмов.
3. Ознакомиться с пигментообразованием у бактерий.
4. Освоить второй этап бактериологического исследования - выделение чистой культуры бактерий.
Характер роста микробов на питательных средах
Рост микробов на плотной питательной среде . Для изучения свойств коло ний микробы культивируют на плотных питательных средах в чашках Петри. При этом посев материала проводят таким образом, чтобы получить изолированные колонии. Для характеристики колоний используют следующие признаки:
1. Размер колонии . Колонии обычно измеряют в миллиметрах или пользуют ся для этого описательными терминами, такими, например, как точечные (диаметр менее 1 мм), мелкие (диаметр 1-2 мм), средние (диаметр 2-4 мм) и крупные (диаметр 4-6 мм и более).
2. Форма колонии . Бывает правильной (круглая), неправильной (амебовидная), ризоидной (корневидная, напоминающая переплетающиеся корни деревьев).
3. Контуры края . Определяют при рассмотрении колонии под лупой или микроскопом с малым увеличением. Различают ровные края в виде четко выра женной линии и неровные края ( фестончатый, волнистый, эрозированный или зазубренный, бахромчатый).
4. Рельеф колонии характеризуется приподнятостью ее над поверхностью пи тательной среды и формой на вертикальном разрезе. Определяется рельеф колонии невооруженным глазом или при помощи лупы при рассматривании сверху и сбоку. Различают каплеобразные и куполообразные колонии правильной круглой формы, плоско-выпуклые колонии, конусообразные колонии, колонии с приподнятой серединой, колонии с вдавленным центром, плоские колонии.
5. Поверхность колонии . Изучают при помощи лупы или под микроскопом при малом увеличении. Поверхность колонии бывает матовая или блестя щая с глянцем, сухая или влажная, гладкая или шероховатая. Гладкие ко лонии обозначают буквой S ( smooth - гладкий), шероховатые - буквой R ( rough - шероховатый).
6. Цвет колонии . Определяется пигментом, который продуцирует культура микробов. Преобладающее большинство патогенных бактерий пигмента не образует, вследствие чего колонии их бесцветны или молочно-мутного цвета. Пигментообразующие виды микробов дают колонии различных цветов: кремовые, желтые, золотисто-оранжевые, си ние, красные, сиреневые, черные и др.
7. Структура колоний . Определяется в проходящем свете при слабом увеличе нии микроскопа, суженной диафрагме или при несколько опущенном кон денсоре. По структуре различают гиалиновые колонии, зернистые колонии, нитевидные или волокнистые колонии.
8. Консистенция колоний . Исследуют посредством прикосновения или взятия из нее части материала бактериоло гической петлей. По характеру консистенции колонии бывают пастообразные, вязкие или слизистые, волокнистые или кожистые, хрупкие сухие.
Особенности микробного роста на жидких питательных средах .
1. Рост бактерий с равномерным помутнением среды.
2. Придонный рост бактерий , характеризующийся образованием осадка на дне пробирки с жидкой питательной средой.
3. Пристеночный рост бактерий , выражающийся в образовании рыхлых хлопьев, прикрепленных к внутренней поверхности стенок сосу да.
4. Поверхностный рост бактерий , характеризующийся появлением на поверх ности жидкой питательной среды пленки.
Рост на полужидкой питательной среде характеризуется по мутнением всей толщи среды или образованием сосульки цилиндрической или конической формы.
Пигментообразование у бактерий
Многие сапрофитные и некоторые патогенные микроорганизмы в процессе жизнедеятельности на питательных средах способны образовывать пигменты различного цвета. Образование пигментов происходит в присутствии кислорода, при пониженном освещении и температуре 20-25 О С. Их классифицируют по цвету, химическому составу (каротиноиды, пирролы, азахиноны, феназины и др.), раство римости, по способности диффундировать в окружающую среду и другим призна кам. Пигменты класса каротиноидов имеют белый, желтый, оранжевый, красный, бежевый цвет. Они обнаружены у стафилококков, сарцин, микрококков, микобак-терий, коринебактерий, пурпурных бактерий, дрожжей. Пигмент феназинового класса синего цвета - пиоцианин присутствует у синегнойной бактерии. Пирролловый пигмент красного цвета - продигиозин выявлен у серратий ( S . marcescens ). К азахинонам принадлежит индигоидин - синий пигмент, выделяемый коринебактериями, псевдомонами, артробактерами и др. Производным индола является пигмент виоласеин, придающий сине-фиолетовую окраску колониям хромобактера. Бактериохлорофиллы встречаются у зеленых, красных несерных бактерий и др. К классу пиразиновых пигментов относится пулъхерримин, окрашивающий колонии грибов рода кандида в темно-красный цвет. Грибы обычно активно про дуцируют пигменты широкой цветовой гаммы. Цвет пигмента зависит от состава питательной среды и условий культивирования. Важными элементами для обра зования пигментов являются азот, магний, железо, некоторые аминокислоты.
Пигменты подразделяют на растворимые в воде или в жирорастворителях (спирте, ацетоне, эфире) и нерастворимые в воде и спирте. Водорастворимые (феназиновые, пиразиновые) способны диффундировать в окружающую среду и окрашивают не только колонии микроорганизмов, но и питательные среды. Спирторастворимые (каротиноиды) и нерастворимые (птерины, мелани ны) тесно связаны с клеткой (хромофорные) и окрашивают только колонии микро организмов.
Пигменты локализуются во внутриклеточных выростах ЦПМ, имеющих вид трубочек или пузырьков (у пурпурных бактерий), в тилактоидах - системах эле ментарных мембран цитоплазмы (у цианобактерий), в фикобилисомах (гранулах, локализованных в цитоплазме на поверхности тилакоидов).
В жизни микроорганизмов пигменты имеют важное значение. Пигментиро ванные клетки более устойчивы к действию солнечных, ультрафиолетовых лучей, некоторые из них способны продуцировать антибиотические вещества, участвуют в процессах бактериального фотосинтеза и фототаксиса. Цвет пигмента может быть использован в качестве диагностического признака при идентификации ми кроорганизмов.
Выделение чистой культуры бактерий
Чистой называют культуру, содержащую микроорганизмы одного вида и полученную как потомство одной клетки. Чистые культуры можно получить из исходной микробной клетки, изолиро ванной при помощи микроманипулятора, или из изолированных колоний путем их пересева в отдельные пробирки с питательной средой. Для выделения чистой культуры используют следующие методы.
1. Метод Дригалъского. При этом методе расплавленную питательную среду разливают в 3 чашки Петри. В первую чашку вносят одну каплю исследуемого материала и сте рильным шпателем распределяют его по поверхности питательной среды. Затем шпатель переносят во вторую и далее в третью чашки, втирая в поверхность питательных сред оставшийся на нем материал. При посеве этим методом на второй и на третьей чашках вырастают изолированные колонии. Полученные отдельные колонии пересевают в пробирки с питательной средой для получения чистой культуры микроорганизма.
2. Метод параллельных штрихов. При этом способе материал с помощью бактериологической петли распределяют по поверхности агара параллельными штрихами в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходу ется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
3. Метод Коха (метод рассева в глубине среды). При этом методе в пробирку с агаром, расплавленным и остуженным до 43-45°С, вносят одну бактериологическую петлю исследуемого материала и тщательно перемешивают. После этого из этой пробирки одну петлю материала переносят во вторую пробирку, а затем из нее в третью пробирку. Приготовленные разведения бактерий выливают из пробирок в стериль ные чашки Петри. После застывания среды чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Читайте также:

