Посев вирусов на куриных эмбрионах
Обновлено: 20.09.2024
Метод выделения вирусов гриппа человека и животных, включая высоко патогенные штаммы вирусов гриппа птиц, в клеточных культурах является высоко чувствительным тестом при использовании клинических образцов высокого качества.
Предназначен для вирусологов, микробиологов, эпидемиологов. Его использование позволяет, в первую очередь, значительно повысить эффективность изоляции эпидемических штаммов из клинических материалов (смывы, аспираты, секционный материал), а также расширить число выделяемых возбудителей с составлением более полной картины о природе вирусных популяций, циркулирующих среди людей, что необходимо для более полного понимания закономерностей распространения и эволюции возбудителей, прогнозирования эпидемий, а также быстрого распознавания появления нового пандемического вируса гриппа типа А.
Методические рекомендации подготовлены проф., д.м.н.А.А.Сомининой и к.м.н.Е.И.Бурцевой (при участии специалистов ГУ НИИ гриппа РАМН Т.Г.Лобовой, Н.И.Коноваловой, Т.М.Гудковой, к.б.н.О.М.Литвиновой, а также специалистов ГУ НИИ вирусологии РАМН проф., д.м.н.А.Н.Слепушкина и д.б.н.В.Т.Ивановой).
При подготовке настоящих Методических рекомендаций были использованы инструктивные материалы, разработанные WHO Collaborating Center for Surveillance, Epidemiology and Control of Influenza (CDC, Atlanta, USA), за предоставление которых авторы выражают свою искреннюю благодарность.
1. Введение
Важным преимуществом метода изоляции перед другими тестами является получение инфекционного вируса, который может быть далее использован для антигенного и генетического анализа, а также выяснения таких важнейших свойств возбудителя, как чувствительность к химиопрепаратам, неспецифическим ингибиторам, тропизм к разным системам хозяина и др. Ряд факторов (трудоемкость, необходимость использования высоко чувствительных клеточных линий, длительность анализа, высокая стоимость) ограничивает использование метода выделения вирусов гриппа в качестве диагностического теста. В прошлые годы для этих целей, как правило, использовали куриные эмбрионы, однако изменение тропизма современных вирусов с резким снижением частоты изоляции в них возбудителей гриппа обусловило необходимость широкого лабораторного применения клеточных культур. Одной из таких линий, которая была рекомендована экспертами ВОЗ, является перевиваемая культура клеток, полученная из почек собаки породы спаниель - MDCK. Вместе с тем, поскольку кандидаты в вакцинные штаммы должны быть изолированы на куриных эмбрионах, лабораториям, располагающим такими возможностями рекомендуется использовать для выделения вирусов гриппа обе системы. В любом случае исходные клинические материалы необходимо хранить до начала следующего эпидемического сезона при низкой температуре (-70°С) для обеспечения возможностей выделения наиболее перспективных в антигеном отношении штаммов в куриных эмбрионах в специализированных лабораториях научно-исследовательских институтов.
2. Описание метода
2.1. Формула метода
Суть метода заключается в заражении сформированного монослоя клеток MDCK, характеризующихся наиболее высокой чувствительностью к современным вирусам гриппа, клиническими материалами, полученными от больных гриппоподобными заболеваниями. Инфицированные культуры инкубируют в термостате при 37°С, контролируя под микроскопом состояние монослоя, а также периодически определяют наличие гемагглютининов в культуральной среде. При развитии специфического цитопатического действия, проявляющегося в разрушении монослоя, культуральную жидкость используют для типирования вирусного изолята в реакции торможения гемагглютинирущей активности (РТГА), а также осуществляют последующий пассаж в целях накопления вируса, который затем направляют в холодовом режиме в соответствующие Центры по гриппу (Федеральный центр по гриппу и ОРВИ на базе ГУ НИИ гриппа РАМН или Центр экологии и эпидемиологии гриппа на базе ГУ Института вирусологии им.ДИ.Ивановского РАМН) для последующей идентификации и изучения особенностей антигенной структуры возбудителя.
Непременным условием успешного выделения вирусов являются правильный сбор клинических материалов, соответствующий состав транспортных сред, соблюдение условий доставки материалов в лабораторию (на холоду и в кратчайшие сроки) и безотлагательное заражение заранее подготовленных клеточных культур.
2.2. Показания и противопоказания к применению метода
Показанием к применению метода является рост гриппа и острых респираторно-вирусных заболеваний, регистрация вспышек гриппа среди людей, а также среди птиц, обследование контактных лиц из групп риска в случае появления у них симптомов гриппа. Противопоказания к использованию метода отсутствуют.
2.3. Материально-техническое обеспечение
Для выполнения работ по изоляции вирусов гриппа в клеточной культуре MDCK необходимо иметь 2 набора реагентов, один из которых предназначен для субкультивирования клеток, а второй - непосредственно для работ по выделению вирусов из материалов от больных.
2.3.1. Перечень материалов, необходимых для субкультивирования клеток MDCK (из расчета на 10 пассажей):
Клеточная культура MDCK (7 млн.) в монослое, выращенном во флаконе Т 25*
_______________
* - как указано выше
Модифицированная среда Игла D-MEM, "GIBCO BRL", (США), кат. N 11965-092, производитель - "Биолот" (Санкт-Петербург) или среда Игла MEM с двойным набором аминокислот (Предприятие при ГУ НИИ полиомиелита и вирусных энцефалитов РАМН, Москва) ФС 42-94 ВС-88
Альбумин бычий, фракция V, 7,5% раствор), "Sigma" (США), кат. N А8412 или "GIBCO BRL", США, кат. N 15260-011
HEPES - буфер 1М раствор, рН 7,2, "Sigma" (СШA), кат. N Н0887 или "GIBCO BRL", США, кат. N 15630-023
Эмбриональная сыворотка КРС, "Sigma" (США), кат. N F3018 или Ну Clone Lab.Inc, кат. N A-1111-L
Раствор для отторжения клеточной культуры (0,05% трипсин в смеси с 0,53 мМ раствором EDTA .4Na) "GIBCO BRL", США, кат. N 25300-054 или раствор химопсина (0,125 мг/мл) на 0,53 мМ растворе версена
Пенициллин, ОАО "Красфарма", ГФХ ст.95
Стрептомицин, ОАО "Биохимик", ГФХ стр.636
Флакон для культивирования клеток Т 25, "Sarstedt" (Германия), кат. N 7245082
Примечание: набор может храниться при +4°С в течение 6 месяцев (за исключением клеточной культуры MDCK, которая подлежит непрерывному субкультивированию, но не более 10-20 пассажей, после чего ее чувствительность понижается, что определяет необходимость ее повторного восстановления из криобанка). Культура получена из CDC, Atlanta (USA), хранится в Коллекциях клеточных культур при ГУ НИИ гриппа РАМН и ГУ Институт вирусологии им Д.И.Ивановского РАМН.
2.3.2. Перечень материалов, необходимых для изоляции вирусов гриппа (рассчитан на проведение 100 анализов):
А. Транспортная среда (для получения и доставки клинических материалов):
Среда 199 на растворе Хенкса, "Биолот" (Санкт-Петербург) или Предприятие при ГУ НИИ полиомиелита и вирусных энцефалитов (Москва)
Альбумин бычий, V фракция (7,5% раствор), "Sigma" (США), кат. N А8412 или "GIBCO BRL", США, кат. N 15260-011
HEPES - буфер 1М раствор, рН 7,2, "Sigma"(CLUA), кат. N Н0887 или "GIBCO BRL", США, кат. N 15630-023
Гентамицин "ХИНОИН", Венгрия, кат. N АТС: JOIGB03
Тампоны стерильные для взятия мазков
Б. Растворы для культивирования клеток (10 пассажей) и выделения вирусов (100 анализов):
Среда Игла в модификации Дальбекко (DMEM) или среда Игла MEM с двойным набором аминокислот *
_______________
* - как указано выше
Эмбриональная сыворотка КРС*
_______________
* - как указано выше
Альбумин бычий, фракция V, 7,5% раствор), "Sigma" (США), кат. N А8412 или "GIBCO BRL", США, кат. N 15260-011
Трипсин ТРСК, тип XIII, "Sigma", США, кат.N Т1426 (расфасован по 200 мкг/амп.)
Раствор для отторжения клеточной культуры*
_______________
* - как указано выше
HEPES - буфер 1М раствор, рН 7,2, "Sigma"(CUIA), кат. N Н0887 или "GIBCO BRL", США, кат. N 15630-023
Пенициллин* 500 ед.
_______________
* - как указано выше
Стрептомицин* 0,5 г.
_______________
* - как указано выше
Дистиллированная вода (для растворения трипсина ТРСК), ГОСТ 6709-72
Глицерин АО "Каустик" ГОСТ 6259-75 кв "Z"
В. Клеточная культура MDCK* (в монослое, флакон Т25, 7 млн.клеток)
_______________
* - как указано выше
Среда Игла с сывороткой для транспортирования клеток*
Флакон культуральный Т25*
_______________
* - как указано выше
Насадка фильтрующая шприцевая GyroDisc, размер пор 0,2 мкм, "Биолот"
Примечание: Набор хранится при +4°С в течение 6 мес. После растворения трипсин ТРСК и антибиотики хранить при температуре не выше -20°С, а остальные компоненты набора - при 4°С.
2.3.3. Материалы и оборудование для постановки реакции гемагглютинации и торможения гемагглютинации в целях индикации и идентификации выделенных вирусов:
Автоматическая пипетка с переменным объемом 5-50 мкл
Наконечники для автоматических пипеток до 200 или 250 мкл
Пипетки 10,0 мл; 5,0 мл и 1,0 мл
Эритроциты человека 0 (I) группы крови, 0.75%
Сыворотки диагностические гриппозные к различным субтипам вируса гриппа А и к вирусу гриппа В, ООО "Предприятие по производству диагностических препаратов" при ГУ НИИ гриппа РАМН, ВФС 42-03215509-04
2.3.4. Оборудование
Бокс ламинарный II уровня защиты Холодильник бытовой (4 ± 1) °С
Рефрижератор (-70 ±2)°С
Центрифуга лабораторная (до 3000 об/мин) Термостат (36 ± 1)°С, желательно - CO инкубатор
Микроскоп биологический (МБИ-3) или инвертированный (ЛОМО, Россия или Unico 1 V 900, United Product and Instrum. Inc., США )
2.4. Описание метода
Принцип метода заключается в заражении сформированного в пенициллиновых флаконах (или пробирках) монослоя клеток MDCK клиническими образцами, полученными от больных с симптомами гриппа.
Инфицированные культуры инкубируют при 35-37°С, желательно в инкубаторе с подачей воздуха в смеси 5% СО. Ежедневно контролируют состояние монослоя. При появлении первых признаков размножения вируса вируссодержащую культуральную жидкость исследуют на наличие гемагглютининов в среде, которую используют далее для накопления вируса. Полученные изоляты направляют в холодовом режиме в соответствующие Центры по гриппу. Использование метода изоляции вирусов гриппа в клеточной культуре MDCK в дополнение к известному способу выделения вирусов гриппа на куриных эмбрионах позволяет резко расширить диапазон выделяемых возбудителей с составлением наиболее полной картины о структуре циркулирующих вирусных популяций, что необходимо для надзора за гриппом, понимания закономерностей эволюции возбудителя и прогнозирования предстоящих эпидемий, а также составления рекомендаций по штаммовому составу вакцин и диагностических препаратов на предстоящий эпидемический сезон.
Не все виды клеток способны расти в виде монослон, в некоторых случаях поддержание дифференцированных клеток возможно только в культуре органа. Обычно это суспензия ткани, обладающей специализированной функцией, также обозначаемая как культура переживающей ткани.
Куриные эмбрионы при диагностике вирусных инфекций
Куриные эмбрионы (рис. 11-20) — практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание). Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость либо в желточный мешок.
Заражение вирусом на хорион-аллантоисную мембрану. Обычно используют 10-12-суточные эмбрионы. Яйца просматривают в проходящем свете, отмечают локализацию воздушного мешка и выбирают область без сосудов. Осторожно удаляют фрагмент скорлупы, освобождают наружную оболочку и отслаивают её осторожным надавливанием. Затем делают отверстие у края воздушного мешка. При отсосе через это отверстие хорион-аллантоисная оболочка отслаивается от наружной оболочки. На неё наносят исследуемый материал, свободный от бактерий и простейших (пропущенный через бактериальные фильтры и обработанный бактерицидами). Заражение в амниотическую полость. Обычно используют 7-14-суточные эмбрионы, у которых после отслоения хорион-аллантоисной оболочки (см. выше) расширяют отверстие, захватывают пинцетом амниотическую оболочку и выводят через хорион-аллантоисную оболочку. Через неё в амниотическую полость вводят исследуемый материал.
Заражение вирусом в аллантоисную полость. 10-суточные эмбрионы заражают через отверстия, сделанные в скорлупе и подлежащих оболочках (см. выше).
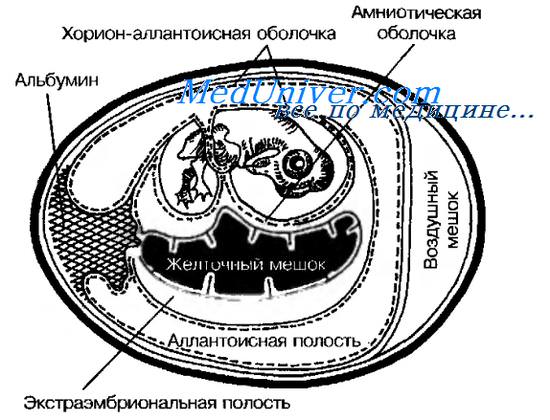
Рис. 11-20. Схематическое изображение развивающегося куриного эмбриона.
Наблюдение и учет результатов заражении вирусом куриного эмбриона
В качестве вируссодержащего материала можно использовать содержимое желточного мешка, аллантоисную и амниотическую жидкости либо весь эмбрион, нарезанный вместе с окружающими тканями на кусочки. Для выявления характерных поражений на хорион-аллантоисной мембране удаляют скорлупу и наружную оболочку. Затем мембрану извлекают и помещают в стерильную воду. Характер поражений изучают на тёмном фоне.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает. Если болезнь не развивается, то патологические изменения можно обнаружить при вскрытии. У животных наблюдаются иммунологические сдвиги. Однако далеко не все вирусы можно культивировать в организме животных;
Выбор экспериментальных животных определяется целью работы и видовой чувствительностью к изучаемому вирусу. Для заражения используют обезьян, кроликов, морских свинок, хомячков, белых крыс и мышей.
Лабораторных животных заражают различными способами в зависимости от тропизма вируса к определенным тканям. Так, например, для культивирования нейротропных вирусов заражение производят преимущественно в мозг (вирусы бешенства, клещевого энцефалита и др.), культивирование респираторных вирусов осуществляется при интраназальном инфицировании животных (вирусы гриппа), дерматотропных (вирус оспы) – путем накожного и внутрикожного заражения. Наиболее часто используются накожное, внутрикожное, внутримышечное, внутрибрюшинное и внутримозговое заражение.
Индикацию, т.е. обнаружение факта размножения вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА). РГА основана на способности некоторых вирусов вызывать агглютинацию (склеивание) эритроцитов различных видов животных, птиц и человека за счет поверхностного вирусного белка – гемагглютинина.
В настоящее время использование животных для культивирования вирусов ограничено.
2) культивирование вирусов в развивающихся куриных эмбрионах. Большинство известных вирусов обладают способностью размножаться в курином эмбрионе (рис.56). Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9–10-, осповакцины – в 12-, паротита – в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка. На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05–0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 ч инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).
Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5–10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
Индикацию вирусов в курином эмбрионе осуществляют на основании специфических поражений оболочек и тела эмбриона (оспины, кровоизлияния), а также в РГА.
В результате заражения могут происходить и появляться:
1) гибель эмбриона;
2) дефекты развития: на поверхности оболочек появляются образования – бляшки, представляющие собой скопления погибших клеток, содержащих вирионы;
3) накопление вирусов в аллантоисной жидкости (обнаруживают путем титрования);
4) размножение в культуре ткани (это основной метод культивирования вирусов).

Для понимания различных процессов на разных уровнях организации, биологических функций и структур используют модельные объекты. Существует несколько видов моделей: химические, биологические, физико-химические. Вирусология - наука, изучающая природу вирусов, особенности химического состава, морфологии, механизмов размножения и генетики. Одним из основных модельных объектов в вирусологии является куриный эмбрион. Куриные эмбрионы вошли в вирусологическую практику в 30-х годах ХХ века.
Куриный эмбрион представляет собой зародыш, находящийся на разных стадиях эмбрионального развития. Яйцо с развивающимся куриным эмбрионом покрыто снаружи твёрдой скорлупой, к которой плотно прилегает подскорлупная оболочка. Подскорлупная оболочка разделяется на два листка, между которыми образуется воздушная камера. Тело зародыша лежит в яйце эксцентрично, спиной ближе к скорлупе, голова направлена в сторону воздушной камеры. Зародыш окружён околоплодной жидкостью, заполняющей амниотическую полость, и пуповиной связан с желтком. Желток располагается немного в сторону от центра и относительно зародыша по другую сторону продольной оси. Под подскорлупной оболочкой находится аллантоидная полость, покрывающая амнион и желточный мешок. В процессе развития аллантоидная оболочка срастается с хорионом, образуя единую хорионаллантоисную оболочку (ХАО). В остром конце яйца находится остаток белка(см. рисунок 1) .
Рис 1. Строение куриного эмбриона.
В лабораторных условиях эмбрионы содержат в термостате при температуре 37 o C и влажности 60-70%. Качество яйца оценивается несколькими признаками: его размером, состоянием скорлупы, правильностью формы. При предынкубационном отборе отбраковываются крупные (свыше 65-70 г) и мелкие (45-47 г) яйца. Слишком крупные разбиваются во время инкубации, из мелких выводятся цыплята с пониженной жизнеспособностью и малой массы. К инкубации яйца с загрязненной скорлупой не допускаются. Скорлупная оболочка должна быть гладкой, матового тона, что свидетельствует о свежести яйца и целостности скорлупы. Яйца с тёмными пятнами не допускаются к исследованию, так как их наличие указывает на развитие микроорганизмов. Используются куриные эмбрионы от 5-го до 12-го дня инкубации. Эмбрионы размещают воздушной камерой вверх в штативах, вентиляционные отверстия должны быть открыты.
Подготовка куриных эмбрионов к заражению состоит из нескольких этапов: подготовку рабочего места, дезинфекцию скорлупы, овоскопирование.
Овоскопирование - просмотр яиц против яркого источника света, на неосвещенной стороне скорлупы образуются тени от внутренних структур. На скорлупной оболочке карандашом отмечают 3 участка: границу воздушной камеры, бессосудистую зоны размером 0,5 х 0,5 см и место расположения зародыша. В дальнейшем отметки используют в качестве ориентира при выборе места введения вируссодержащего материала. Также на этом этапе определяют погиб или жив зародыш посредством его активных движений. Заражение проводят в асептических условиях. В предбокснике скорлупную оболочку обеззараживают йодированным спиртом, затем в боксе повторно протирают, и иногда обрабатывают пламенем смоченного спиртом тампоном.
Существуют несколько методов заражения эмбрионов. Выбор метода определяется видом вируса, целью заражения. При заражении вводят 0,1-0,2 мл инфекционного материала.
Заражение в аллантоидную полость. При заражении этим методом хорошо размножаются вирусы ринопневмании лошадей, гриппа, везикулярного стоматита и др. Куриный эмбрион располагают вертикально тупым концом вверх. В скорлупе на стороне зародыша делают отверстие диаметром около 1 мм. Иглу с вирус содержащим материалом вводят параллельно продольной оси на глубину 10-12 мм. (см. рисунок 2) После инъекции её извлекают, а отверстие в скорлупе запечатывают расплавленным стерильным парафином.
Рис 2. Заражение в аллантоидную полость.
Заражение на хорионаллантоисную оболочку. Этот метод используется при культивировании чумы плотоядных, катаральной лихорадки овец и др. Эмбрион фиксируют в штатив вертикально тупым концом вверх, и в скорлупе против центра воздушной камеры вырезают отверстие диаметром 15-20мм(см. рисунок3). Пинцетом снимают подскорлупную оболочку, на обнажившийся участок ХАО вводят 0,2 мм вирус содержащей суспензии, отверстие закрывают лейкопластырем или покровным стеклом, укрепив его парафином.
Рис. 3. Заражение на хорионаллантоисную оболочку.
Заражение в желточный мешок. Этот метод используется для размножения катаральной лихорадки овец, хламидий, ринопневмонии лошадей и др. Эмбрионы закрепляют в штатив в вертикальном положении. Делают отверстие в скорлупе и вводят иглу на глубину 3,5-4 см под углом 45 к вертикальной оси, (см. рисунок 4)
Рис 4. Заражение в желточный мешок.
В вирусологии существуют несколько признаков размножения вируса в курином эмбрионе. Одним из главных может служить гибель эмбрион в характерные для данного вируса сроки. Следующим признаком является патологоанатомические изменения, появляющиеся в различных структурах эмбриона (например, хорионаллантоисная оболочка может иметь кровоизлияния, узелки, может быть отечной). Существуют вирусы, которые, размножаясь в эмбрионах, не вызывают ни патологоанатомических изменений, ни гибели (например, вирус ньюкаслской болезни) Выявить такой вирус можно с помощью реакции гемагглютинации.
Гибель зародыша в течение первых 24 часов после инфицирования обусловлена размножением бактериальной микрофлоры, грибов или повреждением при заражении. Эмбрионы инкубируют до максимального накопления вируса. Срок инкубации является определенным и варьирует в пределах от 2 до 8 суток. Полученные образцы умерщвляют охлаждением при 4 в течение 3-4 ч и вскрывают.
Вскрывают куриные эмбрионы, с целью получения вируссодержащего материла, обнаружения признаков размножения вирусов. Все эти процессы требуют правила асептики при вскрытии. В зависимости от того, каким вирусом был заражен куриный эмбрион, вируссодержащим материалом могут быть: желточный мешок (его стенки), ткани зародыша, амниотическая жидкость и др. Перед вскрытием скорлупу эмбриона обрабатывают йодированным спиртом. Вскрытие совершают в боксе, используя стерильную посуду и инструменты. Скорлупу срезают над воздушной камерой, яйцо должны держать под определенным углом, чтобы скорлупа не упала. Инструменты не должны повреждать оболочку, лежащую под воздушной камерой. При вскрытии эмбрионов ставят бактериологический контроль вируссодержащего материала посевом на МППБ, МПБ, МПА. Материал хранят при температуре - 26 o С и ниже.
Использование куриного эмбриона дало возможность успешнее решать задачи, стоящие перед вирусологией, в связи с тем, что имеют ряд преимуществ перед лабораторными животными:
1) относительно высокая чувствительность к широкому спектру вирусов;
2)скорлупа и подскорлупная оболочка надежно защищают эмбрион от заражения со стороны внешней среды;
Читайте также:

