При диагностике истинного крупа к обязательному обследованию относится посев
Обновлено: 07.07.2024
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Дифтерия: причины, симптомы, диагностика и способы лечения.
Дифтерия – одна из самых грозных инфекций, представляющая высокий риск для жизни пациента. Не случайно первая Нобелевская премия по физиологии и медицине была присуждена в 1901 г. Э.А. Берингу за разработку лечебной сыворотки против этого заболевания.
Несмотря на то, что многие считают дифтерию исключительно детской болезнью, она встречается и у взрослых.
Источником инфекции является больной или бактерионоситель, возбудитель передается воздушно-капельным, контактно-бытовым и пищевым путями.
Дифтерия – бактериальная инфекция, возбудителем которой является Corynebacterium diphtheriae (дифтерийная палочка, или бацилла Леффлера).
Этот микроорганизм обладает высокой устойчивостью к воздействию факторов окружающей среды. Это необходимо знать и учитывать при проведении дезинфекции в очаге распространения.
Отрицательное воздействие на С. diphtheriae оказывают прямые солнечные лучи, высокая температура и некоторые химические вещества (дезинфектанты).
Распространение токсина по организму приводит к поражению органов и систем, среди которых наиболее часто страдают сердце, надпочечники, почки и нервные волокна.
Характерным признаком болезни является образование плотных серовато-белых фибриновых пленок на слизистых ротоглотки. Дифтерийный налет покрывает миндалины, а также глотку и гортань, что вызывает сужение их просвета и нарушает прохождение воздуха в нижележащие дыхательные пути. Закупорка дыхательных путей пленкой и отек могут привести к развитию крупа, особенно у детей раннего возраста.
Классификация форм заболевания
Проявления заболевания могут быть связаны с местом проникновения бактерий в организм: дифтерия ротоглотки, гортани, носа, глаз, половых органов, ран и т. д. В зависимости от распространенности поражения выделяют локализованную, распространенную, комбинированную, а также токсическую формы болезни. Токсическая форма протекает тяжелее остальных и характеризуется поражением внутренних органов.
Дифтерия различается по степени тяжести: легкая, среднетяжелая и тяжелая, которая, в свою очередь, также подразделяется на три степени. Для этого заболевания, особенно при тяжелом течеении, характерно развитие осложнений, присоединение вторичной инфекции, а также обострение хронических заболеваний.
Симптомы дифтерии
Наиболее часто встречается дифтерия ротоглотки и гортани. Большинство форм дифтерии сопровождаются лихорадкой (повышением температуры тела с ознобом), отеком и некрозом слизистой оболочки миндалин, увеличением лимфоузлов.
Дифтерия ротоглотки отличается появлением на небных миндалинах пленок беловато-серого цвета, которые могут распространяться на нёбные дужки, язычок, нёбо.
Ощущается болезненность во время глотания. При попытке снять пленки обнажается кровоточащая слизистая. Для дифтерии ротоглотки, особенно у непривитых пациентов, характерно развитие осложнений.
В отличие от дифтерии ротоглотки, при дифтерии гортани (истинном крупе) токсическое поражение внутренних органов нетипично. Опасность в данном случае представляют легко отслаивающиеся от слизистой фибриновые пленки, которые приводят к сужению дыхательных путей вплоть до полной их закупорки и развития асфиксии (удушья).
Необходимо различать истинный круп при дифтерии и ложный круп при острой респираторной вирусной инфекции.
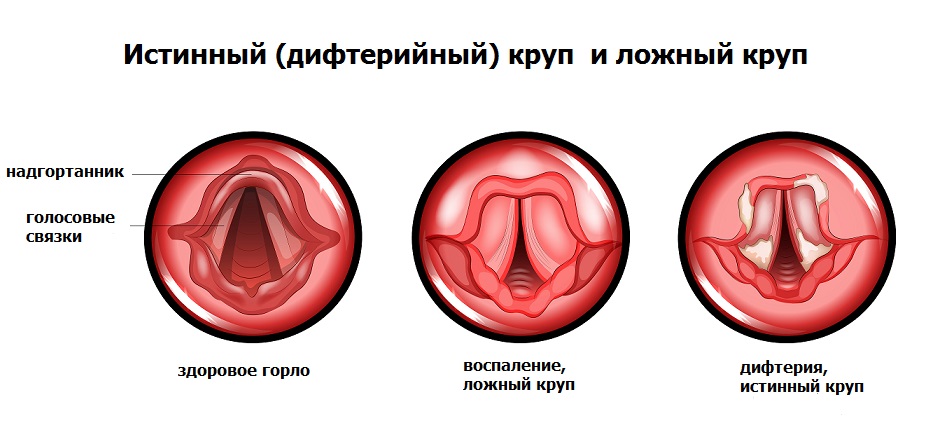
Для истинного крупа характерно постепенное ухудшение состояния больного, появление лающего кашля с изменением голоса иногда до полной афонии. Приступы ложного крупа можно облегчить ингаляциями с глюкокортикостероидными препаратами, что, к сожалению, не действенно при дифтерийном крупе.
Диагностика
Диагностика дифтерии начинается со сбора жалоб, истории заболевания, клинического осмотра пациента.
Врачу важно знать, есть ли у ребенка прививки от дифтерии, а также есть ли в его окружении больные с подозрением на дифтерию.
Основным методом лабораторной диагностики дифтерии является бактериологическое исследование (посев) мазка из зева.
Микробиологическое исследование, позволяющее выявить возбудителя дифтерии (C. diphtheriae) в исследуемом биоматериале и подтвердить диагноз дифтерии.
Возбудителем гемофильной инфекции является бактерия Haemophilus influenzae (или палочка Пфейффера) из семейства Pasteurellaceae (Hib). Длительное время гемофилы считались возбудителем гриппа, так как эта инфекция наиболее часто протекает в форме ринофарингита или ОРЗ без специфических особенностей, что и обусловило такое название. Бактерия представляет собой мелкую полиморфную палочку, иногда по форме напоминающую коккобациллу. Спор нет, имеет капсулу. Для культивации требует кровь, специальные добавки и витамины. В зависимости от различий химического строения и антигенных свойств капсулы выделяют 6 серотипов H. influenzae (серотипы a, b,c,d,e,f), а также бескапсульные штаммы.
Инфицирование гемофильными палочками редко приводит к заболеванию, однако спектр инфекционных поражений может быть чрезвычайно широк и зависит от серотипа возбудителя. У взрослых H.influenzae вызывает преимущественно очаговую бронхопневмонию, часто сочетающуюся с выраженным трахеобронхитом. Пневмония редко приобретает тяжелое течение, но в отдельных случаях может осложниться экссудативным плевритом, перикардитом, менингитом, артритом и т.п. Гемофилы входят в состав нормальной флоры верхних дыхательных путей, уровень бессимптомного носительства у детей достигает более 40%.
Наиболее патогенными свойствами и способностью вызывать тяжелые формы заболевания обладает H.influenzae тип b (Hib). Ее вирулентные свойства связаны преимущественно с капсульным полисахаридом и продукцией мембранотоксина.
При инвазивных формах заболевания возбудитель выявляется в стерильных жидкостях организма – СМЖ, крови, плевральной жидкости и др. К неинвазивным формам инфекции относится пневмония (без бактериемии), синусит, средний отит, ринофарингит, конъюнктивит. При генерализации инфекционного процесса развиваются инвазивные формы инфекции, наиболее частым проявлением которых является менингит (51–65%), септицемия – 12%, эпиглоттит – 10%, пневмония (с бактериемией) – 8% в структуре инвазивных Hib инфекций.
Наиболее часто Hib-инфекции подвержены дети в возрасте 6–48 мес, реже новорожденные и дети старше 5 лет. Подавляющее число заболевших приходится на возраст от 3 мес до 3 лет.
Факторами риска являются:
- посещение детских организованных коллективов (ясли, детские сады), особенно закрытого типа (дома ребенка, интернаты);
- искусственное вскармливание;
- иммунодефициты (первичные и вторичные, включая ВИЧ-инфекцию);
- хронические заболевания (сердца, легких, сахарный диабет).
Распространение инфекции происходит воздушно-капельным или бытовым путями передачи. В более редких случаях – при родах, от матери с гемофильной колонизацией генитального тракта.
Источником и основным резервуаром инфекции является только человек. В среднем среди здоровых детей бактерионосители составляют 2–5%, однако в окружении больного доля их может возрастать до 30% и выше. Уменьшение частоты носительства способствует снижению уровня заболеваемости. В странах, где введена вакцинация против Hib-инфекции, доля носителей в популяции здоровых детей снизилась до 0,5–1%.
Показания к обследованию
- Исследования по эпидемиологическим показаниям – среди контактных лиц в очаге Hib-инфекции (чаще всего Hib-менингит);
- профилактические исследования – с целью выявления уровня носительства в популяции, особенно в закрытых детских коллективах;
- диагностические исследования – при подозрение на заболевание эпиглоттитом, пневмонией, менингитом, септицемией, отитом, синуситом, гнойным артритом, остеомиелитом.
Материал для исследований
- Мокрота, лаважная жидкость, пунктаты (при подозрении на пневмонию); гнойное отделяемое, пунктаты; (средний отит, синусит); СМЖ, кровь; (менингит, менигоэнцефалит); кровь (септические состояния); пунктаты (гнойный артрит, остеомиелит); секционный материал; мазок из зева (обследование контактных в очаге Hib–менингита и проведение профилактических исследований) – культуральные исследования;
- СМЖ, кровь, пунктаты – обнаружение фрагментов ДНК;
- СМЖ, кровь – обнаружение АГ.
Этиологическая лабораторная диагностика включает микроскопию исследуемого материала, посев материала с дальнейшей культуральной и биохимической идентификацией возбудителя, определением антибиотикочувствительности; обнаружение генетических фрагментов ДНК Hib и АГ Hib в стерильных жидкостях организма.
Дифференциальная диагностика проводится с микробными агентами:
- При эпиглоттите – с возбудителями вызывающими истинный и ложный круп (C.diphtheriae, S.pyogenes, различные вирусы);
- при менингите – с возбудителями, вызывающими гнойный менингит (N.meningitidis, S.pneumoniae, S.aureus и др.);
- при пневмонии – S.pneumoniae, C.pneumoniae, M.pneumoniae, L.pneumophila, S.aureus, семействомEnterobacteriaceae, вирусами гриппа;
- при отите и синусите – S.pneumoniae, Ps.aeruginosa, S.aureus, M.catarrhalis, S.pyogenes, дрожжевые грибки родаCandida;
- при гнойном артрите, остеомиелите – S.aureus, E.coli, анаэробная инфекция.
Сравнительная характеристика методов лабораторной диагностики. Микроскопические исследования используют для выявления гемофильных палочек в разных видах биологического материала: ликворе, крови, пунктатах стерильных локусов, пунктатах нестерильных локусов (мокрота, мазки из зева, придаточных пазух, уха и др.). Микроскопия, как самостоятельное исследование, обычно не проводится, так как имеет малую диагностическую ценность. Микроскопическое исследование может использоваться только для решения вопроса пригодности мокроты или лаважной жидкости для посева (в мазке должно находиться более 25 сегментоядерных лейкоцитов и менее 10 эпителиальных клеток в поле зрения), а также определения микробных ассоциаций.
Для посева с дальнейшей культуральной и биохимической идентификацией возбудителя, определением антибиотикочувствительности используют материалы стерильных локусов (кровь, ликвор, синовиальную, перикардиальную, плевральную жидкости) и различный материал из нестерильных локусов.
Важной проблемой для лечения Hib-инфекции является рост устойчивости β-лактамным антибиотикам, в первую очередь ампициллину, обусловленных продукцией плазмидных β-лактамаз. Кроме того, в мире отмечается увеличение резистентности к гентамицину, эритромицину, левомицетину.
При определении чувствительности к антибиотикам культуры, выделенной из нестерильных локусов, в первую очередь исследуют устойчивость к ампициллину, ампициллину/сульбактаму, ко-тримоксазолу. Желательно провести тест на продукцию β-лактамаз с нитроцефином. В качестве дополнительных препаратов для характеристики штамма в исследование включают цефалоспорины II–III поколения, тетрациклины, макролиды, хлорамфеникол, фторхинолоны.
Штаммы, выделенные из ликвора и крови, исследуют на чувствительность к ампициллину, цефоласпоринам III поколения, карбапенемам, хлорамфениколу, другие препараты (тетрациклины, макролиды, фторхинолоны) добавляются для более полной характеристики культуры.
Обнаружение АГ Hib в стерильных жидкостях организма (ликворе, крови) выполняют при использовании наборов реагентов, основанных на реакции латекс-агглютинации или коагглютинации.
Обнаружение фрагментов ДНК Hib проводят методом ПЦР. Исследование основано на обнаружении специфического фрагмента гена bex A, кодирующего связанный с капсулой белок возбудителя и проводится только с материалом, полученным из стерильных локусов (СМЖ, кровь, пунктаты)
Особенности интерпретации результатов лабораторных исследований. Диагноз Hib-инфекция считается установленным в случае:
Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 17.04.2019
- Время чтения: 1 mins read
Как проводится выявление микроорганизмов методом посева и для чего нужен этот анализ
При инфекционном поражении следует узнать, какой микроб вызвал болезнь и с помощью какого антибиотика от него лучше избавиться. Поэтому нужно, чтобы возбудитель проявил себя, показав слабые стороны.
Для этого берутся образцы крови, мочи, слюны, секрета простаты, семенной жидкости, слизи из уретры и цервикального канала, носоглотки, мокроты, грудного молока, содержимого ран и язв. Материал переносится на питательные среды – специальные смеси, на которых микробы лучше всего растут. Для посева используются плоские чашечки Петри или пробирки.
Затем образец помещают в температурные условия, наиболее благоприятные для микробного роста, и оставляют на определенное время. Через некоторое время на питательных средах начинают появляться микробные колонии – скопления возбудителя, расположенные внутри среды или вовне.
Снаружи разрастаются анаэробные микробы, которым для жизни требуется воздух. Внутри питательной среды развиваются анаэробы – микробы, не любящие воздух и развивающиеся без него.
Из полученных колоний делают мазки, которые рассматривают под микроскопом, чтобы выяснить, какая именно микробная культура высеялась. Делается также вывод об их количестве (обсемененности). Этот показатель важен для дозировки применяемых препаратов. Чем больше обнаружено возбудителей, тем выше будет доза антибактериального средства, назначенного врачом.
Количественный анализ учитывается при выявлении условно-патогенной микрофлоры. Эти микробы и грибки не доставляют проблем, если находятся в организме в ограниченном количестве. Однако превышение норм приводит к болезням, поэтому требует назначения лекарств. Один из самых известных условно-патогенных микроорганизмов – грибок кандида, вызывающий при разрастании его колоний кандидоз (молочницу).
При проведении анализа определяется чувствительность микрофлоры к антибиотикам. Для этого проводится специальный тест, называемый антибиотикограммой.
Патогенные бактерии пересаживают в благоприятную среду и подвергают воздействию различных антибактериальных средств. Для этого в чашку Петри, где находятся колонии микробов, помещают бумажные полоски, смоченные в антибиотике. Через 3-5 дней оценивают результат:
- Микробная гибель на расстоянии 2,5 см от полоски говорит о высокой чувствительности микробов к данному антибактериальному препарату.
- Если все возбудители умерли в радиусе 1,5-2,5 см, чувствительность к антибиотику средняя.
- Если микробы погибли на расстоянии менее 1,5 см от полоски, чувствительность будет слабой. Такой препарат применять нежелательно.
- При отсутствии гибели колоний считается, что данный антибиотик на эту микрофлору не действует.
Степень чувствительности указывается в результатах анализов, чтобы врач потом мог назначить наиболее эффективные препараты.
Анализ желательно проводить всем больным перед началом антибиотикотерапии. Чувствительность к антибактериальным препаратам – индивидуальная характеристика, которая может отличаться у разных больных, даже страдающих одним и тем же заболеванием.
Таким же образом проводится анализ на чувствительность к бактериофагам – специальным вирусам, убивающим определенные виды бактерий.
Микробиологическая диагностика позволяет выбрать из огромного количества выпускаемых препаратов наиболее подходящий и эффективный.
Антибиотикотерапия без проведения анализов может быть абсолютно бесполезной, а иногда и вредной. Микробы, как и любые другие существа, конкурируют друг с другом, поэтому уничтожение одних бактерий всегда вызывает рост других. Если же применять антибиотики без проведения посева, можно убить абсолютно не ту флору, позволив возбудителям инфекции бесконтрольно размножаться.
Для определения каких микроорганизмов чаще всего проводятся бактериальные посевы
- Разнообразной кокковой флоры, вызывающей гнойное поражение половых путей, органов дыхания, ЛОР-органов, нагноения ран и язв.
- Дифтерийной палочки – возбудителя опасной болезни – дифтерии, поражающей дыхательные пути, глаза, нос.
- Возбудителей кишечных инфекций – кишечную палочку, дизентерийную группу, брюшнотифозные бактерии, возбудителей паратифа, сальмонеллу, иерсинию.
- Разнообразных микробов, вызывающих урогенитальные патологии и половые инфекции – гонококк, микоплазму, уреаплазму, трихомонаду, грибок молочницы.
- Кроме того, высевают возбудителей, которые могут вызывать различные заболевания – энтеробактерии, гемофильные микроорганизмы, клебсиеллы.
Показания к проведению посевов на флору и чувствительность к антибиотикам
- Любые урогенитальные патологии, в том числе ЗППП. Этот метод диагностики особенно рекомендуется при инфекциях, трудно поддающихся лечению.
- Проблемы с кишечником. Анализ высевает все основные кишечные группы и позволяет подобрать не только антибиотики, но и пробиотики.
- Любые гнойные поражения – язвы, раны, лактационный мастит. С помощью посева можно понять, какие микробы вызывали нагноение, и подобрать антибиотик.
- Беременность – в этот период делаются посевы из носоглотки, чтобы выявить микрофлору, опасную для будущего малыша.
- ЛОР-инфекции и поражение дыхательных путей. Проведение бакпосева рекомендуется при затяжных ринитах, фарингитах, частых ангинах. Это позволит выявить микроорганизмы, вызывающие указанные заболевания.
- Анальный зуд – в этом случае нужно сдать посев на грибок молочницы, который часто вызывает такой симптом.
- Обследование детей перед поступлением в дошкольное учреждение и школу, поездкой в детский лагерь или санаторий.
- Профосмотр работников, занятых в пищевой промышленности или работающих с продуктами питания.
Недостатки исследований на бактериальный посев
- Длительное время проведения анализа. Нужно не только выявить возбудителя, но и определить его чувствительность, что занимает много времени. К сожалению, ускорить этот процесс нельзя. Бактерии вырастают в термостате – приборе, поддерживающем нужную температуру, за определённое время. Ускорение приведет к искажению результатов.
- Не все представители микрофлоры высеваются в питательную среду – существуют виды, которые невозможно вырастить в лабораторных условиях.
- Возможность ложноотрицательного результата, который возникает, если пациент перед сдачей материала принимал антибиотики или использовал местные антибактериальные препараты.
Поэтому при сдаче анализов на посев нужно очень аккуратно и точно соблюдать все предписания врача.
Как происходит взятие материала
Анализ сдается как минимум через 10 суток после окончания антибиотикотерапии. Перед забором материала нельзя мыть место его взятия гелем или мылом с антибактериальными компонентами.
Процедура зависит от материала, который берется на диагностику:
- Моча собирается утром после подмывания половых органов без использования антибактериального мыла. Образец собирается в чистую емкость в объеме примерно 10-15 мл и сразу доставляется в лабораторию. Образцы, взятые с клеенок и суден, не подходят из-за бактериальной загрязненности.
- Перед взятием мазков из половых путей нельзя спринцеваться, вводить свечи и гели. Материал не собирается во время критических дней.
- Образец на анализ кала берется утром специальной лопаткой в чистую посуду в объеме примерно 30 мг. Нельзя использовать кал, взятый у детей из подгузников, полученный с помощью клизм и слабительных средств.
- Мокроту собирают в специальную чашечку после чистки зубов и полоскания полости рта. Анализ из носоглотки и горла берется медперсоналом клиники.
- Грудное молоко собирают после мытья груди и обработки околососковой зоны спиртом. Первые капли сцеживаются, чтобы промыть молочные протоки, а затем собирается 15 мл в пробирку.
- Мазок из уретры у мужчин берется врачом-урологом. Перед этим в течение 5-6 часов желательно воздержаться от мочеиспускания, иначе урина смоет микробов, и результат будет неточным.
Сколько времени делается анализ, расшифровка
Тем, кто решился на такое обследование, нужно помнить, что быстро такая диагностика не проводится. Минимальный срок, как правило, составляет 3-4 дня, а максимальный – до 10 сут. За это время нужно вырастить возбудителя и определить его чувствительность к антибиотикам.
Количество выявленных микроорганизмов оценивается в КОЕ/мл, где это КОЕ – колониеобразующие единицы. Чем выше этот показатель, тем больше микробов обнаружено. В бланке анализов обязательно указывается чувствительность к наиболее распространенным антибиотикам (высокая, средняя, низкая).
Самостоятельно больному определить, какая именно флора была высеяна, очень сложно. Поэтому с полученным анализом нужно обратиться к урологу, гинекологу, маммологу, который проведет расшифровку результатов.
Это несложное исследование позволит выявить и вылечить самые различные инфекции – от простых до достаточно сложных. Антибиотики и другие антибактериальные препараты, назначенные по результатам анализов, действительно пойдут на пользу.
Читайте также:

