Термостат для культивирования посевов
Обновлено: 07.07.2024
Для успешного культивирования бактерий, кроме правильно подобранных сред и проведенного посева, необходимы оптимальные условия: температура, влажность, аэрация. В среднем температура для культивирования большинства микробов должна быть в пределах 37-38 °С.
Для выращивания микробов в лабораторных условиях используют специальный аппарат - термостат, в котором поддерживается постоянная и определенная температура (рис. 26).
Термостаты бывают различного устройства и размера. Термостат представляет собой шкаф с полками внутри и открывающейся дверцей, сделанные из теплоизолирующих материалов. Источником нагрева в современных термостатах являются электронагревательные элементы, которые прогревают воздух или воду.
Существенной частью любого термостата является система терморегуляции, которая обеспечивает поддержание температуры на оптимальном уровне. Датчиком температуры в большинстве термостатов является ртутный контактный термометр с магнитной головкой. Такой термометр имеет два контакта, один из которых представляет собой платиновую подвижную проволоку, заключенную в канал термометра, другой присоединяется к ртути. Уровень температуры по положению подвижного контакта регулируется магнитной головкой. При нагревании термостата выше 37° замыкаются контакты термометра, и сигнал поступает в электронное устройство, которое с помощью реле отключает источники нагрева. При снижении температуры контакты размыкаются и подается сигнал для включения источников нагрева. Таким образом, в термостатах постоянно поддерживается нужная температура.
В больших лабораториях по такому же принципу создаются комнаты-термостаты.
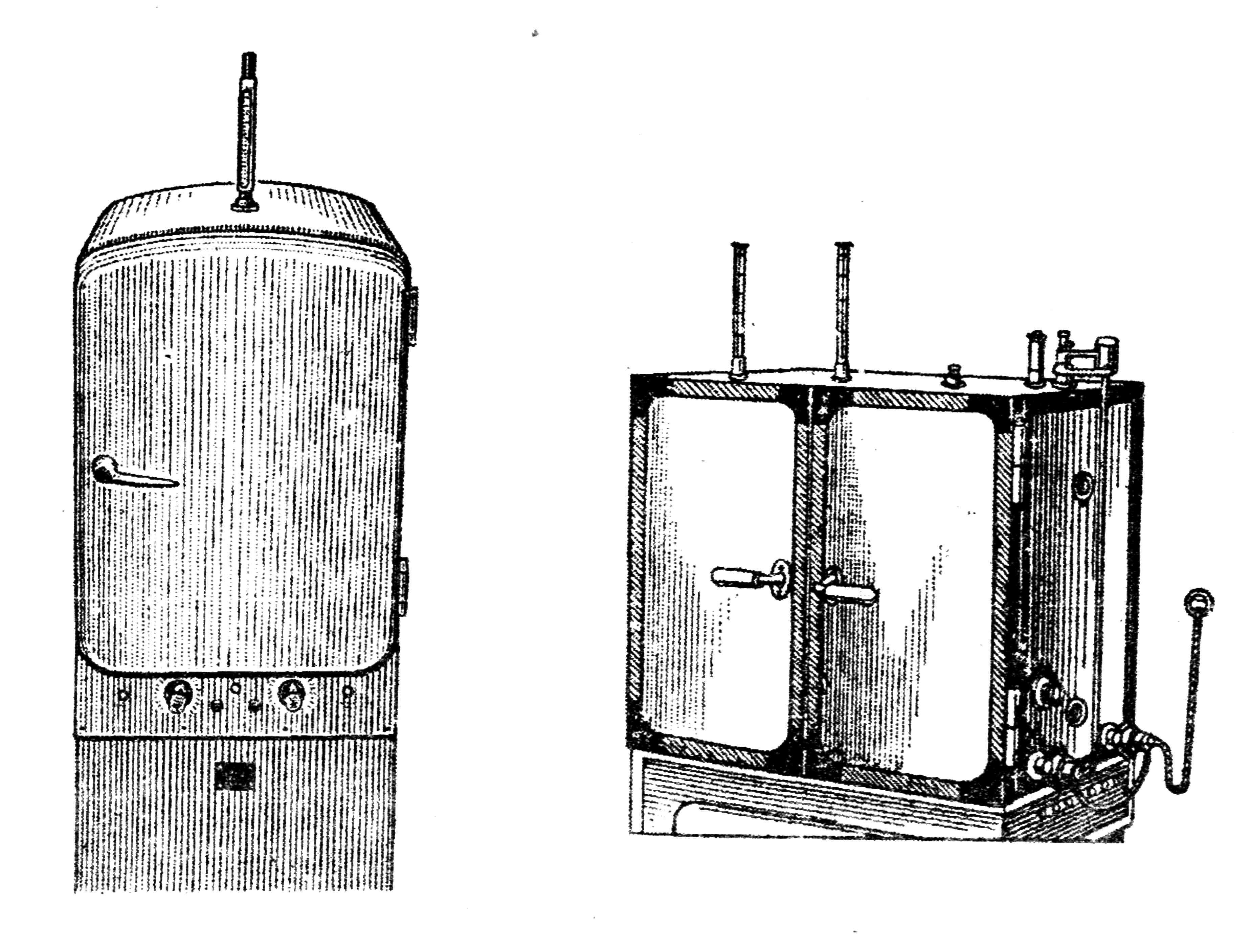
Рис. 26. Различные системы термостатов: сухо-воздушный (А), с водяной рубашкой (Б)
Свет подавляющему большинству патогенных микробов не нужен: их культивируют в темноте. Однако для изучения пигментообразования, которое происходит активнее на рассеянном свету, бактериальные культуры после термостата выдерживают 2-3 дня при комнатном освещении.
Для успешного культивирования бактерий необходимо применять свежие питательные среды, содержащие определенное количество влаги. Особенно это касается использования плотных питательных сред, которые разливают в чашки и скашивают в пробирках в день посева.
При выращивании аэробов и факультативных анаэробов аэрация происходит в естественных условиях без применения каких-либо дополнительных приспособлений.
8.3. Методы выделения чистых культур бактерий
Морфологические, культуральные и биохимические особенности микроорганизмов, необходимые для определения вида с целью постановки бактериологического диагноза, изучают, используя чистые культуры бактерий.
Микробы, выделенные из внешней среды, организма животных или людей и размноженные на питательных средах, называют культурами.
В исследуемом материале патогенные микроорганизмы во многих случаях находятся в числе других, чаще сапрофитных бактерий. Выделить чистую культуру возбудителя болезни является основной задачей при проведении бактериологической диагностики.
Чистая культура микробов содержит только один вид микроорганизмов, который определяется по совокупности его свойств. Культура микроорганизмов, выделенная из определенного источника (организм животного, воздух, почва и др.) получила название штамм.
Если выделенная бактериальная культура одного вида различается по некоторым признакам, то она называется – вариант.
Методы выделения микроорганизмов из исследуемого материала можно отнести к двум группам – механические и биологические.
А. Механические методы
Они основаны на механическом разъединении одной бактериальной клетки от другой с целью получения отдельных изолированных колоний на плотной питательной среде. После культивирования посевов в термостате из отдельной нужной колонии делается пересев на питательную среду, в которой вырастают чистые культуры бактерий.
1-й день исследования
Из исследуемого материала готовят мазки и окрашивают их по Граму. При микроскопии устанавливают наличие бактерий, их морфологические особенности и отношение к окраске по Граму.
Для получения изолированных колоний исследуемый материал высевают на поверхность плотной питательной среды в чашках Петри.
Агар в чашки разливают следующим образом: флакон со стерильной питательной средой помещают в водяную баню. После расплавления агара и его охлаждения до 42°С флакон берут в правую руку, левой рукой извлекают пробку, обжигают горлышко флакона, большим и указательным пальцами левой руки слегка приподнимают крышку чашки. Вводят горлышко флакона под крышку чашки (не касаясь краев), наливают 15-20 мл питательного агара, быстро выводят горлышко флакона и закрывают чашку крышкой. Края горлышка флакона подводят к пламени и закрывают его обожженой пробкой. Слегка покачивая круговыми движениями чашку, достигают равномерного распределения среды. Чашки оставляют на месте, пока среда не застынет, а затем их переносят в термостат, поворачивая вверх дном, снимают крышку и оставляют в таком виде на 15-20 минут для подсушивания.
Существует несколько методов посева материала для выделения чистой культуры бактерий. Посев на чашки штрихом производится при помощи петли, которой набирают небольшое количество исследуемого материала и, не вынимая петлю из пробирки, стряхивают излишнее его количество. Чашку с питательной средой помещают на столе вверх дном. Левой рукой берут дно чашки, держа ее почти вертикально, и густо заштриховывают петлей небольшой участок агара в верхней части чашки. Петлю следует держать свободно большим и указательным пальцами правой руки, ближе к концу петледержателя. Освободив таким образом петлю от излишнего материала, легкими движениями, не повреждая поверхности среды, наносят, отрывая друг от друга, параллельные штрихи на расстоянии около 0,5 см.
В отдельных случаях можно производить последовательный рассев материала, используя для этого несколько чашек с питательной средой. Набрав петлей материал, производят посев штрихами на первой чашке и той же петлей, не набирая материала, вновь наносят штрихи на вторую и третью чашки с питательным агаром. На первой чашке обычно получают рост в виде сплошных штрихов, на второй и, особенно на третьей бактерии развиваются в виде изолированных колоний (рис. 27).
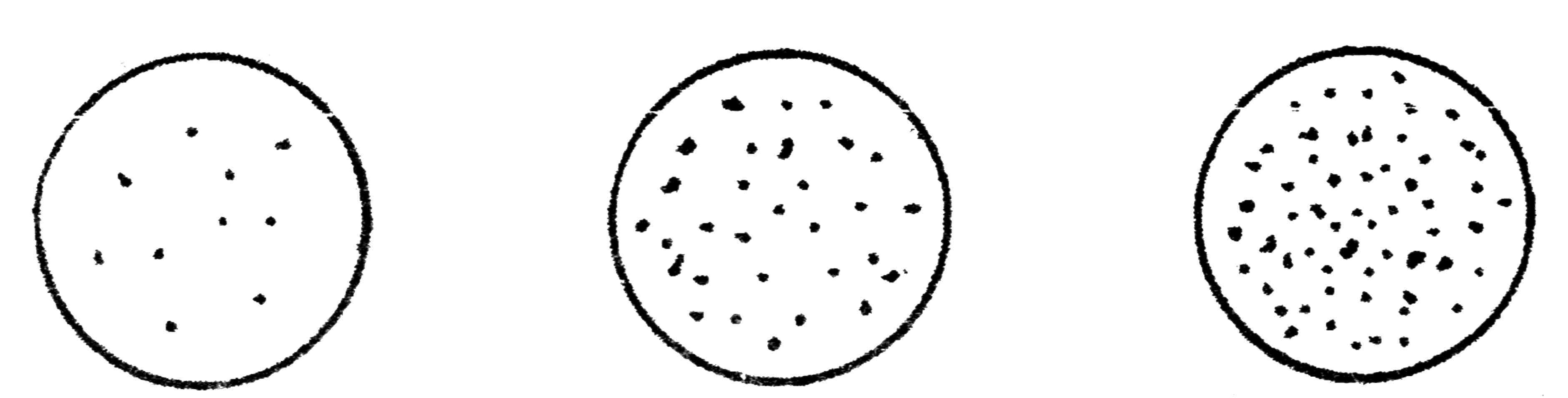
Рис. 27. Рост бактерий на плотной питательной среде при последовательном посеве
Посев шпателем. Посев исследуемого материала нередко производят шпателем, который заранее заворачивают в бумагу и стерилизуют горячим воздухом. Исследуемый материал в количестве одной петли или капли наносится пастеровской пипеткой в центр чашки со средой, каплю шпателем распределяют на небольшом участке среды, а затем круговыми движениями по всей ее поверхности. На время посева крышка чашки, поддерживаемая левой рукой, остается слегка открытой.
Шпатель из первой чашки быстро переносят во вторую чашку, а затем в третью. По окончании посева шпатель погружают в банку с дезинфицирующим раствором. Чашку с соответствующей надписью на дне помещают в термостат вверх дном для того, чтобы конденсационная вода, скапливающаяся на внутренней поверхности крышки, не попадала на поверхность посева и не размывала выросшие колонии.
2-й день исследования
Изучают культуральные свойства чистой культуры, выросшие колонии на третьей чашке. Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда под стереоскопическим микроскопом.
Нужную колонию отмечают со стороны дна чашки восковым карандашом. Из нее делают мазок и окрашивают по Граму. При микроскопии изучают морфологические особенности и отношение бактерий к окраске по Граму. Из этой колонии делают пересев на питательные среды (МПА и МПБ). Посевы помещают в термостат для культивирования.
3-й день исследования
Изучают культуральные свойства бактерий на МПА и МПБ, делают мазок, окрашивают по Граму, микроскопируют. Убедившись в том, что бактериальная культура чистая, приступают к изучению ее биохимических (ферментативных) свойств, устанавливают подвижность, определяют чувствительность к антибиотикам и др.
В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из одной клетки. Такая культура называется клон. Для его получения чаще всего пользуются микроманипулятором. Этот прибор снабжен инструментами (иглами, пипетками) микроскопических размеров. С помощью держателя под контролем микроскопа их вводят в препарат с бактериями на предметном стекле и одну нужную клетку засевают в питательную среду.
Б. Биологические методы
Они основаны на учете тех или иных биологических особенностей выделяемых бактерий в чистую культуру.
1. Выделение спорообразующих микроорганизмов
При выделении чистых культур из исследуемого материала, содержащего споровые формы микробов, его прогревают 10 мин при 80° или 2-3 мин при 100° в расчете на то, что менее стойкие неспоровые формы погибнут при этой температуре. При этом споровые формы останутся жизнеспособными.
Из прогретого материала проводится посев на питательные среды, на которых вырастают спорообразующие микроорганизмы.
2. Выделение кислоустойчивых микроорганизмов.
Для выделения чистой культуры возбудителей туберкулеза и па-ратуберкулеза из патологического материала используют химический метод. С этой целью исследуемый материал после его гомогенизации обрабатывают 6%-ным раствором серной кислоты в течение 5-7 мин, добавляя ее в равном объеме. Благодаря этому погибают микробы сопутствующей микрофлоры, а кислотоустойчивые остаются жизнеспособными.
После нейтрализации раствора кислоты проводят посев на специальные питательные среды, на которых вырастают кислотоустойчивые микробы.
3. Выделение подвижных микроорганизмов (метод Шукевича)
Исследуемый материал, из которого выделяется подвижный микроб, засевают в конденсационную воду скошенного МПА. При посеве необходимо следить, чтобы петля с материалом не коснулась поверхности среды над конденсационной водой. Бактерии, обладающие активной подвижностью, вырастут не только в конденсационной воде, но и вне ее, на поверхности МПА. Из верхней части роста производят повторно посев в конденсат свежей питательной среды. Производя таким образом несколько пересевов, в конце концов получают чистую культуру подвижных бактерий.
4. Выделение патогенных микроорганизмов
Чистые культуры патогенных бактерий выделяют путем заражения исследуемым материалом лабораторных животных, наиболее восприимчивых к тому или иному возбудителю.
Задания для самостоятельной работы
1. Приготовить мазки-препараты из смеси бактерий, окрасить по Граму и провести микроскопию.
2. Овладеть техникой посева на скошенный МПА и МПБ.
3. Освоить методы и приемы выделения чистой культуры бактерий (1-й день исследования);
а) из смеси бактерий произвести рассев на солевой МПА для выделения чистой культуры стафилококка;
б) из смеси бактерий произвести рассев на среде Эндо для выделения чистой культуры кишечной палочки;
в) взвесь бактерий прогреть в течение 10 мин при 80° или 2-3 мин при 100°. Прогретую взвесь микробов рассеять на МПА для выделения чистой культуры вакцинного штамма сибиреязвенной палочки.
4. Посевы поместить в термостат и ознакомиться с его устройством.
5. Сведения о проделанной работе внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. Найдите каждому определению соответствующий термин:
1. Популяция микробов, состоящая из особей одного вида.
2. Культура микроорганизмов, полученная из одной особи (одноклеточная культура).
3. Культура микробов одного вида, выделенная из определенного источника (организм животного, окружающая среда).
4. Культура микроорганизмов одного вида, различающаяся по некоторым признакам (в пределах характеристики вида).
А. Клон. В. Вариант.
Б. Штамм. Г. Чистая культура.
2. В ветеринарную лабораторию поступил исследуемый материал после убоя животного с подозрением на туберкулез. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителей туберкулеза?
А. Прогреть при 80° 2-3 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
3. В ветеринарную лабораторию поступил несвежий патологический материал (кусочки мышц) после гибели коровы с подозрением на эмфизематозный карбункул. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителя?
А. Прогреть при 80° 15-20 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
4. В ветеринарную лабораторию на экспертизу поступили пробы мяса после вынужденного убоя животного. Необходимо исключить присутствие в них вульгарного протея, который может вызвать массовые отравления людей. Какой метод используете для выделения чистой культуры этого микроба?
А. Рассев на МПА в чашках Петри.
Б. Прогрев материала с последующим посевом на МПА.
Г. Посев на скошенный МПА в конденсат.
5. В ветеринарную лабораторию поступил исследуемый материал (ухо) от павшей нетели с подозрением на сибирскую язву. Какой метод используете для выделения чистой культуры возбудителя?
Техника посевов микроорганизмов на питательные среды

Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.


Рис. 24. Посев на агар в чашки Петри шпателем Дригальского
Глубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:
N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.
2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
Микроорганизмы в окружающей нас природе находятся повсеместно: в почвах, водоемах, на поверхностях всевозможных предметов, ими населены люди и животные. Все это может служить источниками загрязнения микробами продуктов питания, лекарств, производственных линий. Культивирование бактерий необходимо для изучения их свойств, потребностей, особенностей. Это в свою очередь является важным этапом в разработке различных лекарственных препаратов, лабораторной диагностике заболеваний, расчете производственных реакторов и многого другого.
Общие понятия
Под культивированием бактерий в микробиологии понимают выращивание микроорганизмов, осуществляемое в лабораторных условиях. В свою очередь микробы, которые выросли на подобранной питательной среде, называют культурой. Культуры могут быть смешанными, если они образованы разными видами микроорганизмов, и чистыми, если представлены только одним видом бактерий.
Если в питательную среду помещают только одну клетку, а получают в результате ее размножения группу особей, то эту совокупность микроорганизмов называют клоном. Когда клон развивается до такого уровня, что становится виден невооруженным глазом, такое скопление бактерий называют колонией.
Обычно культивирование бактерий, выделенных из различных источников, производят отдельно друг от друга. Каждую такую отдельно выращенную группу микробов называют штаммом. Так, если один вид стафиллококка выделен из трех источников (или разных порций одного и того же продукта, разных человек), говорят о трех штаммах этого вида стафилококка.
Факторы роста бактерий
К ним относят различные аминокислоты, липиды, пуриновые основания и другие соединения, необходимые для развития микроорганизмов. Некоторые микробы могут самостоятельно вырабатывать необходимые им вещества, а другим необходимо получать их в готовом виде. По потребности микроорганизмов в тех или иных ростовых факторах проводят идентификацию и дифференциацию бактерий. Также этот параметр важен для правильного изготовления питательной среды в целях проведения лабораторных и биотехнологических работ:
- Аминокислоты. Бактерии могут нуждаться в одной конкретной аминокислоте или какой-либо группе кислот. Так, клостридиям необходим лейцин и тирозин, стрептококкам - лейцин и аргинин. Микроорганизмы, которым для роста необходимо получение аминокислот извне, называют ауксотрофными.
- Пуриновые и пиримидиновые основания, а также их производные (аденин, гуанин и другие). Они являются важным фактором роста многих видов стрептококков.
- Витамины. Они входят в состав коферментов, требуемых бактериям. Так, никотиновая кислота, а также ее амид, входящие в состав НАД и НАДФ, нужна коринебактериям дифтерии, шигеллы. Тиамин, как составная часть пирофосфата, требуется золотистому стафилококку, пневмококку, бруцеллам. Пантотеновая кислота, входящая в кофермент КоА, требуется бациллам столбняка и отдельным видам стрептококка. Цитохромы, а значит, образующие их фолиевая кислота, гемы и биотин, необходимы микобактериям туберкулеза и гемофильным бактериям.
Требования к средам
Условия, предъявляемые к питательным средам для культивирования бактерий:
- Питательность. Они должны содержать вещества, причем находящиеся в легко усвояемом виде, необходимые микроорганизмам для питания и пополнения энергии. К ним относят органогены и минеральные вещества. Для некоторых микроорганизмов дополнительно необходимы витамины и аминокислоты, которые они не могут синтезировать.
- Оптимальный уровень рН. Он влияет на проницаемость клеточной оболочки и, соответственно, на возможность усвоения питательных веществ бактерией. Чаще всего значение водородного показателя должно быть на уровне 7,2–7,4. Многие микроорганизмы в ходе своей жизнедеятельности вырабатывают продукты с кислой или щелочной реакций, и для того, чтобы рН питательной среды не изменялся, она должна обладать буферностью.
- Изотоничность. Осмотическое давление в питательной среде для культивирования бактерий должно иметь те же значения, что и внутри микробных клеток. Обычно оно соответствует 0,5 % раствору NaCl.
- Стерильность. Связано это с тем, что появление посторонних бактерий исказит результаты изучения анализируемого штамма.
- Уровень влажности. Этот показатель наряду с консистенцией среды должен иметь оптимальные характеристики для конкретного вида бактерий.
- Окислительно-восстановительный потенциал (RH2). Он показывает соотношение веществ, которые отдают и которые принимают электроны, а также уровень насыщения кислородом питательной среды. Для аэробов и анаэробов условия культивирования бактерий несколько разнятся по данному показателю. Анаэробные микроорганизмы лучше всего размножаются при значениях RH2, не превышающих 5, а аэробные – не менее 10.
- Унифицированность. Важно, чтобы питательная среда содержала неизменные количества отдельных ее ингредиентов. Кроме того, предпочтительны прозрачные растворы, на которых легче отслеживать рост культуры или заметить ее загрязнение.
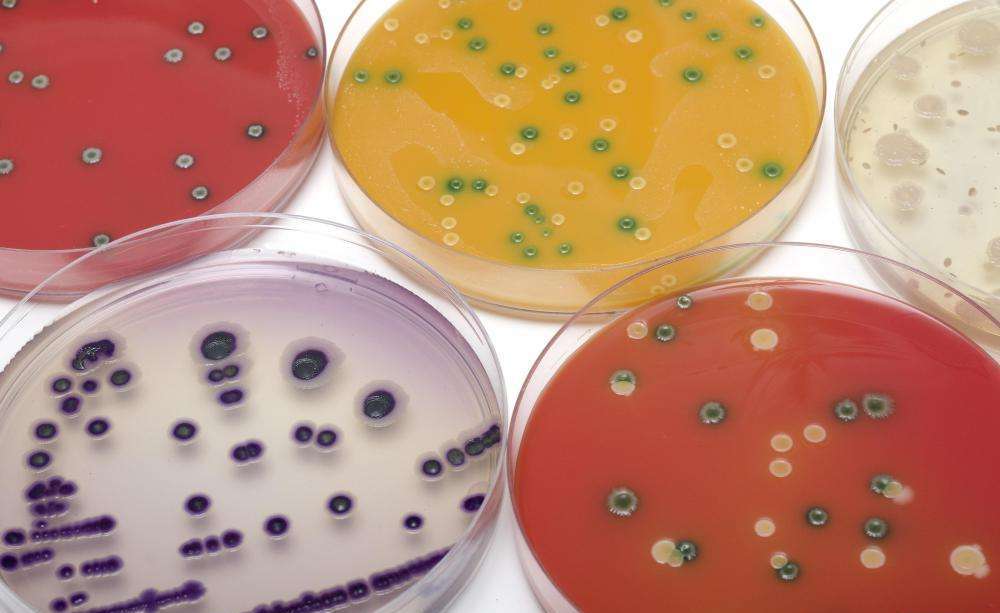
Виды питательных сред
На выбор той или иной среды для выращивания микроорганизмов влияет множество факторов, среди которых - особенности их питания и цели исследования. Основными признаками, положенными в основу классификации питательных сред, являются:
1. Компоненты. По исходным веществам, используемым для создания субстрата, различают:
- натуральные, которые готовятся из продуктов животного или растительного происхождения (например, мяса, молока, фруктов) и удобны для выращивания смешанных культур;
- полусинтетические, в которых дорогостоящие натуральные пищевые продукты заменены на непищевые (например, костную муку, сгустки крови), и которые оптимальны для культивирования бактерий отдельных видов или выделения из среды продуктов их жизнедеятельности;
- синтетические, которые готовятся из точных количеств химических соединений, имеют известный постоянный состав и легко воспроизводятся.
2. Консистенция (плотность). Различают среды:
Последние две готовят из специальных растворов или жидких веществ с добавлением агар-агара или желатина для создания необходимой плотности. Кроме того, плотной средой для роста бактерий является свернутая сыворотка крови, картофель, среды с силикагелем, каррагинан.
3. Состав. По данному признаку среды бывают:
- простые, список которых короток - это мясопептонный бульон (МПБ), бульон и агар Хоттин-гера, мясопептонный агар (МПА), питательный желатин и пептонная вода.
- сложные, приготовляемые из простых с добавлением крови, сыворотки, углеводов и другие веществ.
4. Назначение. Выделяют следующие питательные среды:
- основные служат для выращивания многих патогенных микробов (обычно простого состава);
- специальные применяют для выделения и культивирования бактерий, которые не растут на простых субстратах;
- элективные (они же избирательные) подходят для выделения конкретного вида бактерий и подавляют рост сопутствующих микробов (селективность создается путем прибавки к средам некоторых веществ, например антибиотиков или солей, или коррекцией рН);
- дифференциально-диагностические дают возможность отличить один вид бактерий от другого путем оценки ферментативной активности, например, среды;
- консервирующие нужны для первичного посева с последующей транспортировкой образцов, поскольку предотвращают отмирание микроорганизмов, а также подавляют рост других бактерий.
Приготовление питательных сред
Важнейшим этапом культивирования анаэробных бактерий является приготовление подходящей питательной среды. После того, как выбраны оптимальные параметры, переходят к следующим стадиям:
- взвешивание, путем отбора навески компонентов на аналитических весах;
- растворение, проводимое в подогретой до 70 °С дистиллированной воде, причем отдельно растворяют фосфаты, микро- и макросоли;
- кипячение, осуществляемое на водяной бане на протяжении двух минут;
- определение pH, выполняемое индикаторной бумагой или потенциометром;
- фильтрация, производимая через смоченный матерчатый или бумажный фильтры для жидких, а также расплавленных плотных сред, и через ватно-марлевый фильтр для агаровых;
- розлив, выполняемый на 3/4 емкости;
- стерилизация, зависящая от состава среды;
- контроль на стерильность осуществляется путем отстаивания в течение двух суток в термостате с последующим просмотром;
- химический контроль для установления рН и содержания необходимых элементов;
- биологический контроль путем пробного засева.
Стерилизация посуды и сред
Одним из основных принципов культивирования бактерий является стерильность. Рост и развитие посторонних микроорганизмов может повлиять на характеристики питательной среды путем изменения ее химического состава и рН. Стерилизация является главным условием выращивания чистых культур. На практике под этим термином подразумевают методы уничтожения абсолютно всех жизненных форм на поверхности и в объеме стерилизуемых объектов. Стерилизации подвергается посуда, применяемые инструменты, среды, а также другие предметы, используемые в ходе исследования.
Некоторые виды стерилизации:
- Прокаливание. Стерилизацию петель и игл для посева, предметных стекол, некоторого инструмента можно выполнять с помощью горелки или спиртовки.
- Кипячение. Годится для обработки шприцов, игл, пищевых продуктов, но не убивает споры бактерий.
- Сухожаровая стерилизация. Проводится в особом сушильном шкафу и подходит для обработки колб, пробирок и прочей лабораторной посуды.
- Стерилизация паром. Проводимый в автоклаве этот метод является высокоэффективным. Но он не годится для питательных сред, в состав которых входят белки или какие-либо другие соединения, разрушающиеся при высоких температурах. Более щадящей можно назвать тиндализацию. Она проводится в кипятильнике Коха и сочетает проращивание спор с их уничтожением.
- Пастеризация. Применяется для сред, меняющих свои свойства при кипячении (например, молоко, вино, пиво), способна избавить их от неспороносных микроорганизмов. Температура обработки составляет всего 50-60 °С на протяжении пятнадцати-тридцати минут. В некоторых случаях применяют холодную стерилизацию, осуществляемую с помощью фильтров или УФ-лучей.

Условия культивирования бактерий
Рост и развитие бактерий возможны лишь при определенных факторах и значениях каждого из них:
1. Температура. Различают три группы бактерий, отличающихся температурными предпочтениями:
- термофилы, или теплолюбивые микробы, растут при 45-90°С, а значит, не размножаются в организмах человека и животного;
- психрофилы, или холодолюбивые микроорганизмы, предпочитают температуру в интервале 5-15 °С и выращиваются в холодильных камерах;
- мезофилы, развиваются при температуре 25-37 °С, к ним относится основная масса бактерий.
2. Свет. Является особенностью культивирования бактерий-фототрофов, поскольку они осуществляют фотосинтетический процесс. Но для большинства микробов освещение не является обязательным условием. И даже наоборот, солнечный ультрафиолет может подавлять их развитие.
3. Вода. Всем микроорганизмам необходима вода в доступной (жидкой) форме. Вот почему в замороженных продуктах бактерии практически не развиваются.
4. Кислотность среды. Этот принцип культивирования бактерий уже был подробно разобран выше.
5. Аэрация. Кислород, как химический элемент, является составной частью воды и немалого количества соединений, применяемых для выращивания микроорганизмов. Газообразный кислород также может содержаться в воде и прочих жидкостях в растворенном виде. Существенная часть бактерий нуждается в постоянном поступлении молекул кислорода. Но ряду микроорганизмов он без надобности, или, хуже того, газообразный кислород токсичен для них, поскольку они не имеют каталазы и пероксидазы, разрушающих токсичные продуты дыхания. Поэтому важнейшим этапом культивирования анаэробных бактерий является удаление молекул О2 из питательной среды.
6. Культивирование микроорганизмов. Выращивание аэробных и анаэробных бактерий проводится в различных слоях среды и в разных режимах.
Выращивание аэробных микроорганизмов
Для культивирования аэробных бактерий требуется молекулярный кислород. Для получения чистых культур аэробов, которые можно успешно применять в медицине и пищевой промышленности, используются следующие методы:
- поверхностное выращивание на плотных средах или в жидких средах (их тонком слое), когда кислород поступает прямо из воздуха;
- глубинное культивирование в жидких средах, когда повышения количества растворенного в них кислорода добиваются путем постоянной аэрации.
Выращивание анаэробных микроорганизмов
Основным принципом культивирования бактерий этого типа является минимальный их контакт с кислородом воздуха. Обеспечить условия их роста гораздо сложнее, чем для аэробов. Для изоляции анаэробов от молекулярного О2 применяются следующие методы:
- Физические. Этот метод культивирования анаэробных бактерий сводится к их выращиванию в специальном вакуумном аппарате - микроанаэростате. Воздух в нем заменен на особую газовую смесь из азота с добавлением 10 % водорода и 5 % углекислого газа.
- Химические. К ним относятся: использование поглощающих агентов (например, Fe, Na2S2O4, CuCl) или восстанавливающих агентов (например, аскорбиновая кислота).
- Биологические. Сводится к совместному выращиванию аэробов и анаэробов в закрытой системе. Этот метод культивирования бактерий предполагает засевание одной половины чашки Петри каким-то из аэробных видов бактерий, а второй - изучаемым анаэробом. Развитие его начнется в тот момент, когда истратится весь кислород.
Для культивирования анаэробных бактерий подходят следующие способы посева:
- в поверхностном слое;
- в поверхностном слое с заливкой стерильным парафином;
- в толще плотной питательной среды;
- в глубинных слоях вязких сред.

Получение чистой культуры
Микробиологи в своей работе обычно имеют дело с образцами, заселенными множеством различных видов микробов. Однако для определения систематического положения микроорганизмов (семейство, род, вид), а также изучения их особенностей необходимо их изолировать и вырастить чистую культуру. Они имеют важнейшее значение во многих пищевых производствах, например, сыра, хлеба, кваса, вина и т. д. Культивирование молочнокислых бактерий позволяет получить важнейший компонент для производства кисломолочных продуктов, теста, какао, силоса и даже пластика.
Способ выделения чистой культуры в плотной среде основан на механическом отделении клеток микроорганизмов с последующим их изолированным выращиванием. Образец переносится в стерильный объем воды или физраствора (объемом 10—100 мл), а затем встряхивается на протяжении двух минут. Чтобы извлечь микроорганизмы, находящиеся в толще исследуемого материала (например, колбасы или сыра), сначала выполняют растирание кусочков образца стерильными инструментами с песком. Материал, прошедший предварительную подготовку, массой 1 г или объемом 1 мл разбавляют стерильной водой в 10, 100, 1000 и т. д. раз. Выбирают ту степень разведения, которая дает концентрацию клеток, соответствующую возможностям метода.
Последующее выращивание микроорганизмов заключается в подготовке питательной среды. Обычно выбирается плотная среда (МПА). Ее предварительно расплавляют и остужают до 45—50 °С, а уже потом разливают в несколько чашек Петри (три-пять штук), на дно которых помещены смывы с исследуемого вещества различных концентраций. Далее проводят перемешивание еще не застывшей питательной среды и внесенного в нее материала. Так добиваются фиксирования клеток в различных точках объема субстрата.
Далее чашки Петри помещают в термостат на 2 суток при 22 °С. За это время клетки размножаются до такой степени, что колония, образованная каждой из клеток, становится видна невооруженным глазом. Каждая из них является чистой культурой того вида бактерий, из клеток которого она выросла.
После этого с чашек Петри микроорганизмы пересевают в отдельные пробирки, наполненные питательной средой. Таким образом проводится выделение чистых культур из смешанного образца. Этот метод носит имя своего разработчика - Р. Коха. Также его принято называть чашечным методом, или истощающим посевом. После получения чистых культур различных видов бактерий выполняют установление их формы, обнаружение спор, семейства.
Все работы должны выполняться согласно принципам асептики. Чтобы избежать преждевременного развития микроорганизмов, исследование необходимо проводить сразу после отбора проб. Водопроводную воду анализируют после слива первых порций, поскольку в них могут находиться накопившиеся в трубах и кранах микробы. Микрофлора фруктов, ягод и овощей преимущественно размещена на поверхности (кожуре), поэтому выполняют смывы с нее. Для этого в стерильную емкость помещают плод и заливают его необходимым количеством воды. Затем их довольно энергично встряхивают и сливают воду в другую емкость. Посевы с матерчатых изделий также получают смывами, но предварительно из них вырезают кусочки заданного размера.
Для культивирования микроорганизмов (микробы, риккетсии, вирусы, грибы) необходимы и широко используются термостаты специального назначения, имеющие различные габариты и пределы регулирования температуры. Термостатирующие устройства могут быть как сухожаровыми, так и с водяным обогревом. В некоторых моделях термостатов предусмотрено устройство для подачи и равномерной циркуляции CО2 и воздуха, что позволяет использовать термостат как для аэробных, так и для анаэробных микробов [28].
Развитие исследований по микробиологическому синтезу ставит перед специалистами многочисленные задачи, одна из которых — разработка аппаратуры и систем непрерывного культивирования микроорганизмов.
Представляет несомненный интерес отечественный аппарат АК-10 для глубинного ферментирования микроорганизмов [4].
В ферментере рабочей емкостью 5 л осуществляется автоматическая стабилизация температуры питательной среды, ее аэрирование и перемешивание. Воздух, предварительно очищенный от механических примесей, подается к аппарату под давлением 1,4 кг/см 2 через регулирующий клапан, индикатор расхода и биофильтр. Ввод воздуха производится через форсунку с обратным клапаном, предотвращающим попадание клеточной суспензии в воздушный клапан при прекращении аэрации. Система ротаметров позволяет регулировать поток воздуха. На выходе отработанного воздуха имеется конденсационный сосуд с фильтром для предотвращения попадания клеток в рабочее помещение.
Перемешивание осуществляется турбинной мешалкой, насаженной на вал привода. На верхней части вала мешалки укреплен диск механического пеногашения, препятствующий подъему пены к выходным штуцерам.
Рис. 47. Сосуд для хранения и транспортировки питательных сред МЛ-100.
Система терморегуляции обеспечивает плавное регулирование и поддержание температуры в диапазоне от 20 до 60° С, с точностью ±5° С. Число оборотов мешалки — от 50 до 1500± ±10% об/мин. Масса прибора — 65 кг.
В качестве примера такого устройства может быть приведена контрольная панель ЛП-300 с ферментером (рис. 48) шведской фирмы [27].

Рис. 48. Контрольная панель ЛП-300 с ферментером.
Панель обеспечивает контроль и поддержание в заданных пределах скорости перемешивания питательной среды, температуры и подачи газа, дозирования компонентов питательной среды. Противопенные препараты вводятся с помощью перистальтического насоса, который автоматически включается, если пенный пробоотборник определяет наличие пены.
Рис. 49. Ферментер ФЛ-110.
Ферментеры изготовлены из пирексового стекла. Дно и крышка ферментера выполнены из нержавеющей стали. Лабораторные ферментеры установлены на металлических ножках, что облегчает снятие дна и крышки ферментера и дает возможность присоединять к штуцерам, вмонтированным в дно прибора, датчиков различных приборов (рН-метра, измерителя оптической плотности, газоанализатора и др.), а также для введения добавок, титрующих агентов, пеногасителей.
Рис. 50. Ферментер ФМ-100.
Основные достоинства этого типа ферментера: перемешивающее устройство, вмонтированное в дно сосуда, облегчает манипуляции, перемешиватель легко вынимается и может быть установлен на любой необходимой высоте над дном сосуда. Мощный электромотор перемешивающего устройства имеет электронный контроль скорости вращения. Заглушки и воздуховоды легко удаляются, если необходима вихревая аэрация. Введение различных препаратов обеспечивается наличием пяти вводных отверстий на крышке. Взятие проб и введение дополнительных компонентов под поверхность жидкости обеспечиваются через входные отверстия с мембранами. Контроль температуры осуществляется электронным устройством. Имеется устройство для противопенного контроля и измерения рН.
Оба автоклавируемых типа ферментера имеют цилиндрическую конструкцию из термостойкого стекла с двойной рубашкой, позволяющей проводить культивирование при необходимой температуре. Вдавленная крышка со стандартным шлифом снабжена пятью коническими шлифами, которые можно использовать для различных целей. Оба ферментера имеют водосливы, а на нижнем конце имеется устройство для отбора проб.
Внутри этого аппарата размещены вращающиеся титановые диски, увеличивающие площадь при данном объеме питательной среды, позволяя получать большие количества первичных клеток как для исследовательских, так и для промышленных целей, включая производство вакцин и сывороток. Выпускается в двух модификациях: на 4 л из стекла (рис. 51) и на 14 л из нержавеющей стали.

Рис. 51. Многодисковое устройство для получения тканевых культур.
Роллерные установки предназначены для культивирования тканевых культур при вирусологических исследованиях на внутренних стенках цилиндрических сосудов при вращении их на подвижных валиках (роликах) с различными скоростями. В этих условиях происходит орошение культуры, прикрепленной на внутренней стенке сосуда, а вместе с тем и более оптимальная аэрация, что способствует более эффективному размножению вируса.
Выпускаются роллеры различных моделей: от настольной, рассчитанной на 5—15 флаконов, до напольной с 7 полками, на каждой из которых можно разместить по 4 сосуда. Все модели оборудованы тахометрами, с погрешностью в пределах 1%, для контроля скорости вращения сосудов. Интервалы скоростей вращения могут изменяться от 0,1 до 4 об/мин. Аппараты оборудованы звуковой сигнализацией, включающейся при падении напряжения в сети или при отключении аппарата. На рис. 52, а, б, в представлены различные варианты роллерных устройств.
Рис. 52. Роллерные аппараты.
а, б — настольные варианты; в — напольный вариант
Замороженный биологический материал при помощи гидравлического пресса продавливается через узкое отверстие в специальную камеру. Манипуляция с продавливанием может быть повторена несколько раз, в результате чего образуется достаточно дезинтегрированная клеточная масса, которая для количественного учета может подвергаться нефелометрированию на колориметре - нефелометре. Дезинтеграции могут подвергаться как любые бактериальные, так и тканевые клетки.
Для аналогичных целей фирмой MSE (Англия) выпущена модель ультразвукового дезинтегратора клеток (рис. 53).
Рис. 53. Ультразвуковой дезинтегратор клеток.
Принцип работы дезинтегратора основан на кавитационном действии ультразвуковой волны, распространяемой в жидкости, содержащей клеточную массу, в результате чего происходит разрушение микроорганизмов, клеток тканей и других биологических материалов. Прибор снабжен саморегулируемой настройкой, что позволяет поддерживать выработанную оператором частоту, амплитуду колебаний и мощность. Прибор может быть также использован в качестве ультразвуковой моечной машины для мытья мелкой капиллярной посуды.

Рис. 54. Прибор для анализа и подсчета микробных колоний.
Читайте также:

