Клиндамицин устойчивый в посеве
Обновлено: 19.09.2024
Если Вы врач, то после регистрации на сайте Вы получите доступ к специальной информации.
Чувствительность и устойчивость к антибиотикам в педиатрической практике при стафилококковом синдроме ошпаренной кожи
Inbal Braunstein, Karolyn A. Wanat, Katrina Abuabara, Karin L. McGowan, Albert C. Yan, James R. Treat. Antibiotic Sensitivity and Resistance Patterns in Pediatric Staphylococcal Scalded Skin Syndrome.
Чувствительность и устойчивость к антибиотикам в педиатрической практике при стафилококковом синдроме ошпаренной кожи
Инбаль Браунштайн, Каролин Wanat А., Катрина Abuabara, Карин л. Макгоуэн, Альберт С. Ян, и Джеймс р.,Детская больница Филадельфии,США
Исторически сложилось, что часто в лечении стафилококкового синдрома ошпаренной кожи (СРЦБ) выбор падает на эмпирически выбранный антибиотик, но мало известно о различии в восприимчивости между СРЦБ и других детских стафилококковых инфекций. Ретроспективный обзор диаграммы культуры-подтвержденных случаев СРЦБ проводился в детской больнице Филадельфии между 2005 и 2011 гг. В большинстве случаев СРЦБ, в нашем учреждении, обусловлен оксациллин-чувствительным золотистым стафилококком, и примерно в половине случаев обусловлены клиндамицин-резистентных штаммов. Клиндамицин и пенициллиназа-устойчивые пенициллины, предложенные в качестве эмпирического лечения для СРЦБ, пока получался результат посева культуры, назначались в начале терапии.
Методы: После утверждения экспертным советом, ретроспективная Диаграмма обзора стационарной дерматологической консультации в детской больнице Филадельфии в период с 2005 по 2011 год, была выполнена. Критерии включения были: диагноз и документально подтверждённый факт роста золотистого стафилококка из посева кожи. Статистическая обработка материала проведена с использованием программы stata/СК 11.0 программного обеспечения (StatCorp, ЛП, колледж стейшн, Техас). Точные тесты-Фишер были использованы для категориальных переменных, а тесты Вилкоксона-Манна-Уитни использовались для непараметрических непрерывных переменных. Оксациллин диски использовались в восприимчивости тестирования, эквивалентным методом для определения метициллин резистентности. Случаи из литературы были получены путем поиска англоязычной литературы в pubmed с использованием ключевых слов “стафилококковой ошпаренной кожи”, “восприимчивость”, “устойчивость”, “метициллин,” “метициллин резистентность” и “клиндамицин.” Отчеты бак.посева с кожи подтвердили рост культуры золотистого стафилококка.
Результаты: Результаты оценивались у двадцати одного пациента с культурально подтверждённым диагнозом: СРЦБ (10 мальчиков, 11 девочек в возрасте от 0.5-68 месяцев). Восемь детей получали лечение монотерапией клиндамицином, девять - клиндамицин и еще один антибиотик, один пациент поучал цефазолин и ванкомицин, и три ребёнка получали три или более противомикробных препарата. У троих детей (14%) выросли оксациллин-резистентные S. aureus, и у 10 (48%) выросли клиндамицин-устойчивый S. aureus. У одного ребенка имели оксациллин-резистентные и клиндамицин-резистентные культуры на отдельных участках (волосистая часть головы и периоральная область), его выписали домой для продолжения лечения обоими антибиотиками, но был утрачен контроль. Троих детей с клиндамицин-резистентными культурами выписали домой на монотерапии клиндамицином. Остальные 17 детей были выписаны для дальнейшего получения антибиотиков, к которым их культур были чувствительны.
Чувствительность к оксацилину была значительно выше, чем при других стафилококковых инфекциях (86% при СРЦБ, против 52% при других больничных стафилококковых инфекциях), в то время как чувствительность к клиндамицину была значительно ниже, чем при других больничных культурах (52% при СРЦБ, против 82% при других больничничных стафилококковых инфекциях). Таким образом, клиндамицин при лечении СРЦБ показал более высокую устойчивость, чем при лечении других стафилококковых инфекциях. Устойчивость к клиндамицину была замечена у детей младшего возраста ( дети,в среднем возрасте в 2,8 месяцев при лечении СРЦБ, к клиндамицину более резистентны, чем старше 31 месяца). Не было никакого существенного различия, по устойчивости и чувствительности, в среднем возрасте у тех детей, которые получали оксациллин. Не было никакого существенного различия в резистентности к оксациллину или клиндамицину по признаку пола, в анамнезе с атопическим дерматитом или по продолжительность пребывания в стационаре.
Выводы: Восемь-шесть процентов случае с СРЦБ, в детской больнице Филадельфии, обусловлены оксациллин-чувствительным золотистым стафилококком, в то время как устойчивость к клиндамицину наблюдается в 52% случаев и может диспропорционально влиять на детей младшего возраста. Наши данные добавлены к отчетам из роддомов Соединенного Королевства, Японии, Франции, Китая и Тайваня, проводивших исследования по антибиотикочувствительности и резистентности в лечении СРЦБ. Тайваньское ретроспективное исследование показало, что только 31% случаев СРЦБ и стафилококкого синдрома токсического шока были обусловлены оксациллин-чувствительным золотистым стафилококком, в то время как 37% были обусловлены клиндамицин-чувствительным золотистым стафилококком. Недавнее ретроспективное исследование из Китая показало более низкие показатели чувствительности клиндамицина (~14%), но все возбудители СРЦБ были чувствительны к оксациллину. Эти результаты показывают, что региональные различия являются важными факторами, чтобы продолжать данные исследования. Наши данные, представляют собой первый доклад о восприимчивости возбудителя СРЦБ в Соединенных Штатах.
Клиндамицин является бактериостатическим препаратом, что благоприятствует в лечении кожных стафилококковых инфекций из-за превосходного проникновения в кожу. Клиндамицин также ингибирует бактериальный токсин, что делает его предпочтительным препаратом для токсин-опосредованных заболеваний, таких как СРЦБ. Но, учитывая частоту устойчивости клиндамицина в нашей популяции, мы предостерегаем против эмпирической монотерапии клиндамицином в лечении СРЦБ и рекомендуем его использовать вместе с пенициллиназа-устойчивыми пенициллинами.
Это ретроспективное исследование показало, что оксациллин-чувтвительные и, часто, клиндамицин-резистентные штаммы S. aureus являются наиболее частой причиной СРЦБ, которые могут отличаться от других форм детских стафилококковых инфекций. Это важно учитывать при выборе эмпирической терапии заболеваний с потенциально тяжёлым и неблагоприятным исходом заболевания и привести к смерти. Основываясь на этих данных, мы предполагаем, что пенициллиназа-устойчивые пенициллины необходимо использоваться наряду с клиндамицином для эмпирической терапии СРЦБ, до получения результатов культуры по чувствительности к возбудителю.Необходимо дальнейшее изучение больших когорт пациентов из различных регионов, которые нужны для подтверждения этих выводов.
С. С. Леуш, Г. Ф. Рощина, И. В. Мацидонская, Т. В. Дзюбанчук
Кафедра акушерства и гинекологии № 1 Киевской медицинской академии последипломного образования им. П. Л. Шупика (зав. каф. проф. Леуш С. С.), Киев
Введение
В настоящее время вагинальные инфекции относят к числу наиболее частых заболеваний, встречаемых в акушерстве и гинекологии. Частота выявления бактериального вагиноза (БВ) среди вульвовагинитов составляет 30–40% [1,2, 3, 5, 7, 9, 11], что, естественно, побуждает к изучению последнего клиницистами как у беременных, так и в послеродовом периоде, а также у гинекологических больных с различными воспалительными проявлениями и дисгормональными сдвигами, у пациенток, перенесших гистерэктомию.
Нормальный вагинальный биоценоз женщины репродуктивного периода включает в себя доминирующие микроорганизмы — лактобациллы (90–95% в микробной ассоциации), в результате своей жизнедеятельности создающие во влагалище определенную рН за счет продукции молочной кислоты. Молочная кислота образуется из гликогена, содержащегося в полигональных клетках второго и плоских клетках третьего слоев слизистой влагалища, росту которых и соответственно накоплению в них гликогена способствует эстрогенная активность яичников. Молочная кислота, поддерживая кислую реакцию влагалищного содержимого (рН 3,8–4,4), не только стимулирует рост лактобацилл, но и создает неблагоприятные условия существования кокковой флоры.
БВ имеет многочисленные, оставшиеся в прошлом синонимы, в частности вагинит, Haemophilus, гарднереллезный вагинит, негонорейный или неспецифический вагинит, аминокольпит, коринебактериальный вагинит или анаэробный вагиноз, общим признаком которых было ошибочное представление о воспалительном характере процесса [3, 11]. Клиническому течению этого заболевания не свойственна воспалительная реакция слизистой оболочки влагалища, что и привело к пересмотру терминологии.
БВ является полимикробным заболеванием, замена нормального биоценоза вагины происходит за счет совокупности нескольких видов микроорганизмов — Gardnerella vaginalis, Bacteroides sрр., Peptococcus spр., Mycoplasma hominis, Mobiluncus spр ., в количественном же отношении увеличение концентрации такой микробной ассоциации происходит в 1000 и более раз [1, 3, 7, 9].
Клинические проявления анаэробных микробных ассоциаций, которые обусловливают БВ, очень разнообразны. В литературе имеются упоминания о том, что в ряде случаев при лечении аминогликозидами воспалительных и гнойно-воспалительных процессов в области гениталий (канамицин, мономицин, гентамицин) не только не отмечалась положительная динамика, но и наблюдалось ухудшение состояния больных, вплоть до летального исхода [4, 7]. Лишь позже было установлено, что группа аминогликозидных антибиотиков не обладает бактериостатическим действием по отношению к анаэробам, а некоторые из препаратов этой группы используются в селективных средах для культивирования анаэробов. Этот факт, в связи со значительным ростом анаэробной инфекции женских половых органов над аэробной, говорит о возможной селекции возбудителей из-за необоснованного использования антибиотиков.
Способность неспорообразующих анаэробных микроорганизмов продуцировать ферменты, биологически активные вещества (гиалуронидаза, гепариназа, фибринолизин, коллагеназа) влияет на течение беременности и родов на фоне БВ и приводят к таким осложнениям, как невынашивание, преждевременные роды, преждевременный разрыв плодовых оболочек (в 2,6–3,8 раз чаще) [1, 3, 7, 8, 10, 11]. Механизм инициации родовой деятельности и преждевременного разрыва амниотических оболочек связывают с тем, что в процессе развития и метаболизма анаэробов вырабатываются микробные фосфолипазы, которые запускают механизм синтеза тканевых простагландинов. Интересен также и тот факт (McRay C. at al., 1977) , что микробиоценоз влагалища во время беременности и в послеродовом периоде меняется: число анаэробов на 1 культуру возрастает в III триместре беременности в 2,5 раза, а на 3-й день после родов — в 4,9 раз. Возрастает также число грамотрицательных палочек.
По данным некоторых авторов (В. И. Кулаков, 1995; М. Г. Симакова и соавт., 1995; Moberg P. J. at al.,1992) , частота гнойно-септических осложнений в послеродовом периоде у рожениц с БВ увеличивается в 2,2–2,5 раз, послеабортных эндометритов — в 3 раза, риск развития гнойно-воспалительных осложнений после оперативных вмешательств на гинекологической сфере и инвазивных диагностических процедур увеличивается в 3,2–4,2 раза. Эти клинические проявления подтверждаются исследованиями показателей, составляющих макет при синдроме системного воспалительного ответа — воспалительные цитокины (интерлейкины, фактор некроза опухоли) достоверно увеличиваются при генитальной анаэробной инфекции [11].
Особого внимания заслуживают факты, которые появились в последние годы в отношении эпидемиологической связи БВ с неопластическими процессами на шейке матки — нитрозамины, которые являются продуктом метаболизма облигатных анаэробов и коферментами канцерогенеза [7, 8].
Нарушения гормональной регуляции, обусловленные либо хирургическими вмешательствами (экстирпация матки с придатками), либо менопаузой, также приводят к дисбиотическим процессам во влагалище [11, 12]. После надвлагалищной ампутации матки с сохранением или резекцией яичников, функция последних, равно как и желез цервикального канала, обеспечивает возможность сохранения факторов местного иммунитета и, как следствие, возможность сохранения прежней микрофлоры.
Таким образом, своевременное выявление и лечение БВ может предупредить осложнения и возможные заболевания у женщин фертильного возраста.
Материал и методы исследования
Диагностика БВ основана на данных клинического обследования и специальных лабораторных методов исследования. Диагноз БВ можно поставить при наличии следующих скрининговых критериев:
Согласно данным литературы [8, 9, 10], перечисленные скрининговые методы бывают положительными в 75–85% случаев.
J. I. Thomason, S. M. Gelbart [11] при расширенной бактериоскопии мазков установили дополнительные признаки БВ:
- преобладание эпителиальных клеток над лейкоцитами;
- обнаружение при увеличении с иммерсией менее 5 лактобацилл в поле зрения.
Точность диагностики БВ с учетом расширенной микроскопии возрастает до 95–100%.
В обследуемой группе проводилось исследование показателей крови с подсчетом лейкоцитов, нейтрофилов и лейкоцитарного индекса интоксикации (ЛИИ).
Результаты исследования
Возраст обратившихся составил от 20 до 30 лет. Отмечена еще одна причина обращения за специализированной помощью — желание планировать беременность, причем 14 пациенток ранее не имели беременность.
Достаточно большую группу среди обследованных, имевших в прошлом беременности (75 женщин из 111 — 67,5%), составили пациентки с осложненным акушерско-гинекологическим анамнезом. Структура репродуктивных осложнений и гинекологической патологии выглядела следующим образом:
- преждевременные роды — 7 (6,3%);
- преждевременный разрыв плодовых оболочек в родах — 65 (58,5%)
- послеродовой эндометрит — 25 (22,5%);
- самопроизвольный аборт — 12 (10,8%);
- воспалительный процесс в области придатков, возникший вследствие родов и оперативных вмешательств (артифициальный аборт, вакуум-регуляция менструального цикла) — 27 (24,3%).
Обращает на себя внимание и большая частота патологии шейки матки, выявленная у всей группы обследованных; цервициты, эктопия цилиндрического эпителия и дисплазии диагностированы у 71 из 125 женщин, что составляет 56,8%.
При индивидуальном анализе значений ЛИИ установлено его достоверное увеличение при количественном содержании лейкоцитов на уровне нижней или средней границы нормы (5,86 ± 1,05 х 109/л), что свидетельствовало о том, что у женщин с БВ имеет место нейтрофилез при слабой ответной воспалительной реакции лейкоцитов, а это в свою очередь является косвенным показателем, указывающим на неполноценность фагоцитарного звена.
Следуя поставленным задачам поддержания репродукции, что послужило поводом для обращения наших пациенток за помощью в женскую консультацию, нами было проведено лечение бактериального вагиноза у супружеских пар. Методом лечения был избран комплекс, который включал в себя:
- антимикробный препарат системного действия — Клиндамицин;
- применение эубиотиков — Бифиформ, Бифидум-бактерин;
- иммунокоррекция проводилась фитоадаптогенами (настойка элеутерококка, лимонника, женьшеня) и тимическим иммуномодулятором (Вилозен);
- биокоррекция вагинальной флоры — Вагилак (биопрепарат живых лиофилизированных лактобактерий).
Клиндамицин представляет собой полусинтетическое производное линкомицина. Химическая модификация исходной молекулы природного соединения, синтезируемого актиномицетом Streptomyces lincolnensis, привела к появлению у производного ряда преимуществ: клиндамицин лучше абсорбируется из желудочно-кишечного тракта, на его всасывание не влияет прием пищи. Спектр его антимикробной активности включает анаэробы и грамположительные аэробы [1]. В случае развития кандидоза влагалища лечение проводилось при помощи флуконазола — 150 мг однократно внутрь.
Таким образом, комплексное лечение состояло из 2-х этапов:
- Клиндамицин по 150 мг через 6 часов в течение 7 дней;
- фитоадаптагены — по 20–25 капель 3 раза в день на протяжении 14 дней;
- эубиотики — в обычной дозировке на протяжении 10–14 дней.
- Вагилак — 1 раз в сутки в течение 10 дней в виде вагинальных суппозиториев при условии отсутствия во влагалищных выделениях дрожжеподобных грибков;
- иммуномодулятор Вилозен — 20–40 мг/сутки в виде капель под язык в течение 7–10 дней.
Данная схема лечения проводилась за 3–6 месяцев до планируемой беременности.
Клиническое и микробиологическое излечение наблюдалось после применения такого комплексного лечения у 115 пациенток (92%). У 6 женщин лечение осложнилось вагинальным кандидозом, несмотря на применение эубиотиков. При плановом микробиологическом обследовании пациенток через 3 месяца беременность констатирована у 8 пролеченных при отсутствии данных о наличии БВ. Необходимость проведения повторного курса лечения, в связи с обнаружением при плановом обследовании через 3 месяца микробиологических данных БВ, возникла у 2 больных (1,6%).
Выводы
Результаты проведенных исследований свидетельствуют, что предложенный комплексный метод лечения бактериального вагиноза с применением клиндамицина (пероральный прием по 150 мг через 6 часов на протяжении 7 дней) позволяет достичь стойкого клинико-микробиологического эффекта, необходимость лечения не требует доказательств целесообразности на этапе планируемой беременности и при наличии осложненного акушерско-гинекологического анамнеза.

1. Методические рекомендации по микробиологической диагностике раневых инфекций в лечебно-диагностических учреждениях армии и флота / В.М. Добрынин, И.А. Добрынина, В.В. Кацалуха и др. – СПб. НИИ эпидемиологии и микробиологии им. Пастера, 1999. – С. 4–62.
2. Об унификации микробиологических (бактериологических) методов исследования, применяемых в клиникодиагностических лабораториях лечебно-профилактических учреждений: Приказ № 535 МЗ СССР. – М., 1985. – 126 с.
3. Определение чувствительности микроорганизмов к антибактериальным препаратам: Методические указания МУК 4. 2. 1890 – 04 // Клиническая микробиология и антимикробная химиотерапия – 2004. – Т. 6, № 4. – С. 306–359.
4. Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам // Успехи биологической химии. – 2004. – Т. 44. – С. 263–306.
5. Clinical and laboratory standards institute. Performance standards for antimicrobial susceptibility testing; seventeenth informational supplement // Clinical Laboratory Standards Institute. – 2007. – Vol. 2, № 1.
6. Delialioglu N. Inducible clindamycin resistance in staphylococci isolated from clinical samples / Delialioglu N., Aslan G., Ozturk C., Baki V., Sen S., Emekdas G. // Jpn J. Infect Dis. – 2005. – Vol. 58. – Р. 104–106.
7. Deotale V. Inducible clindamycin resistance in Staphylococcus aureus isolated from clinical samples / Deotale V., Mendiratta D.K., Raut U., Narang P. // Indian J. Med. Microbiol. – 2010. – Vol. 28. – Р. 124–126.
8. Drinkovic D. Clindamycin treatment of Staphylococcus aureus expressing inducible clindamycin resistance / Drinkovic D., Fuller E.R., Shore K.P., Holland D.J., Ellis-Pegler R. // J. Antimicrob Chemother. – 2001. – Vol. 48, № 2. – Р. 315–316.
9. Feibelcorn K.R., Crawford S.A., McElmeel M.L., Jorgensen J.H. Practical disk diffusion method for detection of inducible clindamycin resistance in Staphylococcus aureus and coagulase‐negative staphylococci / Feibelcorn K.R., Crawford S.A., McElmeel M.L., Jorgensen J.H. // J. Clin. Microbiol. – 2003. – Vol. 41, № 10. – Р. 4740–4744.
10. Sedighi I. D-Test method for detection of inducible clindamycin resistance in Staphylococcus aureus / Sedighi I., Mashouf R.Y., Pak N., Rabiee M.A.S. // Iran J. Pediatr. – 2009. – Vol. 19, № 3. – Р. 293–297.
Стафилококк признан одним из наиболее распространенных возбудителей различных инфекций человека. Устойчивость к антимикробным препаратам среди стафилококков является растущей проблемой. Это привело к возобновлению интереса к использованию макролидов, линкозамидов и стрептограминов [6, 7]. Макролиды, линкозамиды и стрептограмины были объединены в одну группу (МЛС), это связано с общностью их механизмов действия и резистентности к ним микроорганизмов. Устойчивость к препаратам группы МЛС может быть связана с модификацией мишени действия, их активным выведением и быстрой инактивацией [4].
Наиболее распространенным и клинически важным механизмом резистентности стафилококков является метилирование. Известны два основных типа экспрессии устойчивости, связанной с метилированием: конститутивный и индуцибельный. При конститутивном типе синтез фермента метилазы (соответственно модификация мишени) происходит постоянно и не зависит от внешних условий, и бактерии проявляют перекрестную устойчивость ко всем макролидам, линкозамидам и стрептограминам. При индуцибельном – фермент синтезируется только в ответ на появление в окружающей среде антибиотиков. Штаммы с индуцибельным характером экспрессии метилаз, устойчивые к 14- и 15-членным макролидам, сохраняют чувствительность к 16 -членным макролидам и стрептограминам [4].
В последнее время, клиндамицин из-за его активного проникновения в ткани, является одним из наиболее эффективных антибиотиков в лечении инфекций, вызванных Staphylococcus aureus, особенно кожи и мягких тканей и остеомиелита [8].
Тем не менее выявленные чувствительные к клиндамицину стафилококки могут проявить индуцибельную резистентность во время проводимого лечения. На основании проведенных исследований было сделано заключение, что резистентные к эритромицину и чувствительные к клиндамицину стафилококки в ходе антибиотикотерапии могут приобретать резистентность, что и приводит к неэффективности проводимого лечения. Исходя из этого, возникает необходимость определения индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста, для выявления антагонизма между клиндамицином и эритромицином [9, 10].
Материалы и методы исследования
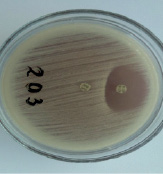
Рис. 1. Д-зона ингибирования вокруг диска с клиндамицином указывает на индуцибельный тип резистентности
Методика постановки D-теста и интерпритация результатов осуществлялась следующим образом: суспензию Staphylococcus spp. мутностью 0,5 McFarland наносили на поверхность Мюллера-Хинтон агара в чашке Петри, затем помещали диски с эритромицином (15 мкг) и клиндамицином (2 мкг) на расстоянии между ними 15 мм. После инкубации при 37°C в течение 18–24 часов уплощение зоны (D-образные) вокруг клиндамицина указывало на индуцибельный тип резистентности к клиндамицину (рис. 1). Если D-тест положительный (D+), то изолят следует считать устойчивым к клиндамицину, если отрицательный (D-), то чувствительным.
Результаты исследования и их обсуждение
По результатам идентификации установлено, что видовой состав выявленных стафилококков включал: коагулазоположительный вид S. aureus – 174 шамма и ряд коагулазонегативных видов (S. epidermidis, S. hyicus, S. auricularis, S. haemolyticus, S. hominis, S. capitis, S. saprophyticus) – 56 штаммов. Среди выявленных стафилококков S. aureus встречался в три раза чаще (рис. 2).
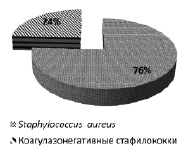
Рис. 2. Частота выявления Staphylococcus aureus и коагулазонегативных стафилококков из ран и свищей у больных хроническим остеомиелитом
Проведена сравнительная характеристика восприимчивости стафилококков к эритромицину и клиндамицину (рис. 3). Было установлено, что чаще встречаются штаммы, резистентные к эритромицину, причем у метициллинрезистентных коагулазонегативных стафилококков (MRCNS) эта разница составляла 36,4 %.
Среди метициллинрезистентных штаммов устойчивых к клиндамицину и эритромицину лидирующее положение занимает S. aureus, среди метициллинчувствительных – коагулазонегативные стафилококки (CNS).
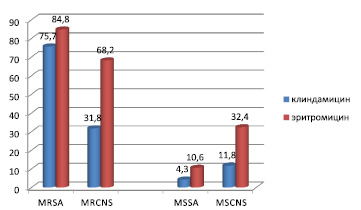
Рис. 3. Сравнительная характеристика резистентности эритромицина и клиндамицина к стафилококкам. Примечание. MRSA – метициллинрезистентные Staphylococcus aureus, MRCNS – метициллинрезистентные коагулазонегативные стафилококки, MSSA – метициллинчувствительные Staphylococcus aureus, MSCNS – метициллинчувствительные коагулазонегативные стафилококки
Сравнение различных типов восприимчивости стафилококка к клиндамицину и эритромицину
Антибиотик группы линкозамидов. В терапевтических дозах оказывает бактериостатическое действие, в высоких дозах оказывает бактерицидное действие на чувствительные штаммы. Нарушает внутриклеточный синтез белка на ранних стадиях путем связывания с 50S субъединицей рибосом бактерий.
Клиндамицин активен в отношении большинства аэробных грамположительных бактерий, включая Staphylococcus spp. (в т.ч. штаммы, продуцирующие пенициллиназу); Streptococcus spp., Bacillus anthracis, Corynebacterium diphtheriae.
Клиндамицин также активен в отношении анаэробных грамположительных бактерий, включая Eubacterium, Propionibacterium, Peptococcus, Peptostreptococcus spp., многих штаммов Clostrtidium perfringens и Clostrtidium tetani.
Среди грамотрицательных анаэробов к клиндамицину чувствительны Fusobacterium spp. (исключая F.varium, который обычно устойчив), Veillonella, Bacteroides spp. (включая B. fragilis).
В отношении Mycoplasma spp. клиндамицин обычно менее активен, чем эритромицин.
К клиндамицину чувствительны некоторые штаммы Actinomyces spp. и Nocardia asteroides.
Сообщается о некоторой противопротозойной активности в отношении Toxoplasma gondii и Plasmodium spp.
К клиндамицину устойчивы Enterococcus spp., метициллин-резистентные штаммы Staphylococcus aureus, большинство грамотрицательных аэробных бактерий (включая Enterobacteriaceae spp.), Neisseria gonorrhoeae, Neisseria meningitidis и Haemophilus influenzae, а также грибы (в т.ч. дрожжи) и вирусы.
Фармакокинетика
После приема внутрь около 90% дозы клиндамицина абсорбируется из ЖКТ. После приема в дозе 150 мг через 1 ч концентрация клиндамицина в плазме крови составляет 2-3 мкг/мл, через 6 ч – около 0.7 мкг/мл. После приема в дозе 300 мг и 600 мг C max в плазме составляет соответственно 4 мкг/мл и 8 мкг/мл. При одновременном приеме пищи уменьшается скорость абсорбции, при этом степень абсорбции изменяется незначительно.
После в/м введения в дозе 300 мг C max в плазме в среднем составляет 6 мкг/мл и достигается в течение 3 ч, при дозе 600 мкг – 9 мкг/мл.
У детей C max в плазме достигается в течение 1 ч. Когда такие же дозы вводят в/в C max в плазме составляет 7-10 мкг/мл и достигается в конце инфузии.
В небольших количествах клиндамицин абсорбируется с поверхности кожи.
При интравагинальном введении системная абсорбция может составлять около 5%.
Клиндамицин широко распределяется в тканях и жидкостях организма, включая кости, но в ЦНС не достигает значимых концентраций. Высокие концентрации клиндамицина определяются в желчи. Клиндамицин накапливается в лейкоцитах и макрофагах.
Около 90% клиндамицина связывается с белками плазмы.
Клиндамицин подвергается метаболизму, преимущественно в печени, с образованием N-деметилированного и сульфоксидного метаболитов, а также неактивных метаболитов.
T 1/2 составляет 2-3 ч, увеличивается у пациентов с тяжелыми заболеваниями почек и у недоношенных новорожденных.
Около 10% дозы выводится с мочой в виде неизмененных препаратов и метаболитов и около 4% с калом. Оставшаяся часть выводится в виде неактивных метаболитов. Экскреция медленная, в течение 7 дней.
Не удаляется из крови путем диализа.
Показания активного вещества КЛИНДАМИЦИН
Для системного применения: инфекционно-воспалительные заболевания тяжелого течения, вызванные чувствительными к клиндамицину микроорганизмами: пневмония, абсцесс легкого, эмпиема плевры, остеомиелит, эндометрит, аднексит, гнойные инфекции кожи, мягких тканей, ран, перитонит. Профилактика перитонита и внутрибрюшных абсцессов после перфорации или травмы кишечника (в комбинации с аминогликозидами). Как антибиотик резерва при инфекциях, вызванных штаммами стафилококка и других грамположительных микроорганизмов, резистентных к пенициллину. Как средство профилактики при экстракции зубов.
Для наружного применения: угри обыкновенные.
Для местного применения: вагинозы, вызванные чувствительными микроорганизмами.
Открыть список кодов МКБ-10| Код МКБ-10 | Показание |
| J15 | Бактериальная пневмония, не классифицированная в других рубриках |
| J85 | Абсцесс легкого и средостения |
| J86 | Пиоторакс (эмпиема плевры) |
| K65.0 | Острый перитонит (в т.ч. абсцесс) |
| L01 | Импетиго |
| L02 | Абсцесс кожи, фурункул и карбункул |
| L03 | Флегмона |
| L08.0 | Пиодермия |
| L08.8 | Другие уточненные местные инфекции кожи и подкожной клетчатки |
| L70 | Угри |
| M86 | Остеомиелит |
| N70 | Сальпингит и оофорит |
| N71 | Воспалительная болезнь матки, кроме шейки матки (в т.ч. эндометрит, миометрит, метрит, пиометра, абсцесс матки) |
| N72 | Воспалительная болезнь шейки матки (в т.ч. цервицит, эндоцервицит, экзоцервицит) |
| N73.0 | Острый параметрит и тазовый целлюлит |
| N76 | Другие воспалительные болезни влагалища и вульвы |
| T79.3 | Посттравматическая раневая инфекция, не классифицированная в других рубриках |
| Z29.2 | Другой вид профилактической химиотерапии (введение антибиотиков с профилактической целью) |
Режим дозирования
Внутрь взрослым - по 150-450 мг каждые 6 ч. При экстракции зубов с целью профилактики однократная доза составляет 600 мг в 1-2 приема по схеме.
Внутрь детям - по 3-6 мг/кг каждые 6 ч.
При в/м или в/в введении взрослым - 0.6-2.7 г/сут в разделенных дозах. При очень тяжелых инфекциях в/в можно вводить до 4.8 г/сут. Максимальные дозы: при в/м введении разовая доза - 600 мг, при в/в инфузии длительностью 1 ч - 1.2 г.
При в/м или в/в введении детям в возрасте старше 1 мес - 15-40 мг/кг/сут в разделенных дозах. При тяжелых инфекциях следует вводить суммарную дозу не менее 300 мг/сут.
Наружно - наносят на область поражения 2-3 раза/сут.
Интравагинально - 100 мг на ночь в течение 3-7 дней.
Побочное действие
Со стороны пищеварительной системы: тошнота, рвота, боли в животе, диарея, после в/в введения в высоких дозах - неприятный металлический привкус; после приема внутрь - явления эзофагита; транзиторное повышение активности печеночных трансаминаз и билирубина в плазме крови; в единичных случаях - желтуха и заболевания печени.
Со стороны системы кроветворения: редко - обратимая лейкопения, нейтропения, тромбоцитопения, агранулоцитоз.
Аллергические реакции: крапивница; редко - многоформная эритема; в отдельных случаях - отек Квинке, лихорадка, анафилактический шок.
Со стороны сердечно-сосудистой системы: при быстром в/в введении - понижение АД, головокружение, слабость.
Местные реакции: при в/в введении в высоких дозах - флебит; при в/м введении редко - раздражение в месте введения, развитие инфильтрата, абсцесса.
При наружном применении: раздражение в месте нанесения, контактный дерматит. Вследствие небольшой системной абсорбции имеется вероятность развития системных побочных эффектов.
При местном применении: цервицит, вагинит или вульвовагинальное раздражение.
Эффекты, обусловленные химиотерапевтическим действием: псевдомембранозный колит, кандидоз.
Противопоказания к применению
Повышенная чувствительность к клиндамицину или линкомицину.
Для системного применения: тяжелые нарушения функции печени или почек, миастения, бронхиальная астма, язвенный колит (в анамнезе), беременность, лактация, детский возраст до 1 месяца, пожилой возраст.
Применение при беременности и кормлении грудью
Клиндамицин проникает через плацентарный барьер в кровеносную систему плода. Выделяется с грудным молоком.
Клиндамицин для введения внутрь и парентерально противопоказан к применению при беременности и в период лактации.
Интравагинальное применение клиндамицина при беременности возможно в случае, если предполагаемая польза для матери превосходит потенциальный риск для плода; в период лактации - только по строгим показаниям.

Клиндамицин (англ. clindamycin) — полусинтетический антибиотик группы линкозамидов.
Клиндамицин — химическое соединение

Химически клиндамицин представляет собой (2S,4R)-N-<2-хлор-1-[(2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-(метилсульфанил)оксан-2-ил]пропил>-1-метил-4-пропилпирролидин-2-карбоксамид. Эмпирическая формула клиндамицина: C18H33ClN2O5S. Молекулярная масса — 425 г/моль.
Клиндамицин — лекарственный препарат
Активность клиндамицина в отношении микроорганизмов

Клиндамицин активен в отношении возбудителя акне (угревой сыпи) Propionibacterium acnes.
Клиндамицин активен в отношении бактерий, вызывающих вагинозы и другие заболевания урогенитального тракта человека: Gardnerella vaginalis, Bacteroides spp., Peptostreptococcus spp., Mobiluncus spp., Mycoplasma hominis,
Устойчивы к действию клиндамицина или терапия клиндамицином неэффективна: Clostridium sporogenes, Clostridium tertium, Trichomonas vaginalis, Chlamydia trachomatis, Neisseria gonorrhoeae, Candida albicans, Herpes simplex. Относительно устойчивы: [Clostridium] clostridioforme.
Показания к применению клиндамицина
- акне (угревая сыпь обыкновенная)
- вагинозов и других заболеваний урогенитального тракта, вызванных чувствительными к клиндамицину микроорганизмами
- пневмонии, абсцесса легкого, эмпиемы плевры, остеомиелита, эндометрита, аднексита, гнойных инфекции кожи и мягких тканей, ран , вызванного чувствительными к клиндамицину микроорганизмами
- инфекций, вызванных стафилококком и другими грамположительными бактериями, резистентными к пенициллину — как резервное антимикробное средство
Противопоказания и ограничения к применению клиндамицина

-
и подозрениях на язвенный колит
- бронхиальной астме
- миастении
- дефиците лактазы
- непереносимость галактозы
- глюкозо-галактозная мальабсорбции
- повышенной чувствительности к компонентам препарата
Применение клиндамицина для лечения беременных, кормящих матерей и детей
Терапия беременных женщин клиндамицином допускается, если ожидаемый эффект от лечения превышает потенциальный риск для плода и ребенка. Категория риска для плода при приёме беременной клиндамицина по FDA — B (исследования на животных не выявили риски отрицательного воздействия клиндамицин а на плод, надлежащих исследований у беременных женщин не было).
Клиндамицин после перорального или парентерального введения экскретируется в грудное молоко. В отношении проникновения в грудное молоко клиндамицина при интравагинальном или наружном использовании информация отсутствует. Имеются данные, что концентрация клиндамицина в грудном молоке достигает значений от 0,7 до 3,8 мкг/мл. Поэтому при терапии кормящих матерей клиндамицином следует проявлять осторожность.
Гель клиндамицина не рекомендуется детям до 12 лет. Клиндамицин в капсулах не следует давать детям до 8 лет и весом менее 25 кг. Не рекомендуется применять детям до трёх лет внутривенное или внутримышечно раствор клиндамицина, содержащий бензиловый спирт. Клиндамицин в любой форме не применяют у грудных детей до одного месяца.
Антибиотикоассоциированная диарея, геморрагический и псевдомембранозный колит, вызванные приёмом клиндамицина
Антибиотикоассоциированную диарею особенно часто вызывают широко применяемые препараты в поликлинической и стационарной практике, такие, как клиндамицин, линкомицин, ампициллин, пенициллин, цефалоспорины, тетрациклин, эритромицин. При этом способ назначения антибиотика особой роли не играет. Симптомы антибиотикоассоциированной диареи у большинства больных обычно появляются во время лечения, а у 30% спустя 110 дней после его прекращения. Непосредственным этиологическим фактором антибиотикоассоциированной диареи большинство исследователей считают, в частности, Clostridium difficile (Щербаков П.Л.).
По разным данным, антибиотикоассоциированная диарея наблюдается у 20–30% пациентов, принимавших клиндамицин. Антибиотикоассоциированная диарея может протекать в нескольких клинических формах. Наиболее легкой и распространенной формой является умеренное недомогание — комплекс любых симптомов диареи, которые не укладываются в классическое определение антибиотикоассоциированной диареи. Основным признаком собственно антибиотикоассоциированной диареи является диарейный синдром при отсутствии боли, интоксикации и дегидратации. Наиболее тяжелыми формами патологии являются антибиотико ассоциированный колит, сегментарный геморрагический колит и псевдомембранозный колит. В патогенезе этих заболеваний важную роль играет инфекционный фактор, в частности, Clostridiun difficile, Staphylococcus aureus, Salmonella spp., Clostridium perfringens (тип А), грибы рода Candida, Klebsiella oxytoca (Добровольский О.В., Сереброва С.Ю.).
У пациентов старше 60 лет антибиотикоассоциированный колит и диарея, вызванные Clostridium difficile, встречаются чаще и могут быть более тяжелыми, поэтому необходимо внимательно следить следить за состоянием пациентов и частотой стула, во избежание развития диареи.
В качестве профилактики развития антибиотикоассоциированных заболеваний кишечника можно рассматривать различные пробиотики (Ацилакт, Аципол, Бифиформ, Бифидумбактерин, Лактобактерин, Линекс, Энтерол и др.).
Клиндамицин — причина эзофагита, язв пищевода, желудка и двенадцатиперстной кишки
К настоящему времени четко обозначились препараты, вызывающие образование гастродуоденальных язв, и число их постоянно растет: нестероидные противовоспалительные средства (НПВС) и их производные, антикоагулянты, некоторые антибиотики, в частности, клиндамицин и др. Некоторые из перечисленных препаратов способны вызывать образование язв пищевода, например клиндамицин (рис. 1).
У пациентов, принимающих клиндамицин или другие ульцерогенные лекарственные средства, риск развития желудочно-кишечных кровотечений очень высок (Агапова Н.Г.).
Клиндамицин может быть причиной эзофагита, чему способствует: горизонтальное положение тела в первый час после приёма препарата, запивание таблеток малым количеством воды, анатомические факторы, в частности, расширение левого предсердия или эктазированная аорта, соприкасающаяся с пищеводом (Справочник Харрисона).
Профессиональные медицинские публикации, затрагивающие вопросы ассоциированных с приёмом клиндамицина состояний и заболеваний желудочно-кишечного тракта
Другие побочные эффекты клиндамицина
Боли в животе, тошнота, рвота, диарея, дисбиоз, желтуха, нарушения функции печени, гипербилирубинемия, лейкопения, нейтропения, агранулоцитоз, тромбоцитопения, нарушение нервно-мышечной проводимости, крапивница, зуд, эозинофилия, анафилактоидные реакции, суперинфекция.
При быстром внутривенном введении клиндамицина — критическое понижение артериального давления, головокружение, слабость.
В месте введения инъекции: раздражение, болезненность, тромбофлебит.
Порядок применения клиндамицина и дозы
Торговые наименования препаратов с действующим веществом клиндамицином
Читайте также:

